Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Pull-down von Calmodulin-bindende Proteine
In diesem Artikel
Zusammenfassung
Calmodulin (CaM) Pull-Down-Assay ist ein effektiver Weg, um die Interaktion von CaM mit verschiedenen Proteinen zu untersuchen. Diese Methode verwendet CaM-Sepharose-Kügelchen für eine effiziente und spezifische Analyse von CaM-bindenden Proteinen. Dies stellt ein wichtiges Instrument zur CaM-Signalisierung in zelluläre Funktion zu erforschen.
Zusammenfassung
Calcium (Ca 2 +) ist ein Ion wichtig bei der Regulation zellulärer Funktionen durch eine Vielzahl von Mechanismen. Ein Großteil der Ca 2 +-Signalisierung wird durch die Calcium-bindende Protein als Calmodulin (CaM) 1,2 bekannt vermittelt. CaM ist auf mehreren Ebenen in fast allen zellulären Prozessen, einschließlich Apoptose, Metabolismus, Kontraktion der glatten Muskulatur, die synaptische Plastizität, nerve growth, Entzündungen und der Immunantwort beteiligt. Eine Reihe von Proteinen zu regulieren diese Wege durch ihre Interaktion mit CaM. Viele dieser Wechselwirkungen hängen von der Konformation des CaM, die deutlich anders ist als an Ca 2 + (Ca 2 +-CaM) an seiner Ca 2 +-freien Zustand (ApoCaM) 3 gegenüber gebunden.
Während die meisten Zielproteine binden Ca 2 +-CaM, bestimmte Proteine binden nur an ApoCaM. Einige binden CaM durch ihre IQ-Domäne, einschließlich neuromodulin 4, neurogranin (Ng) 5, und bestimmte Myosin 7, postsynaptische Funktion 8 und Muskelkontraktion 9 Spielen jeweils. Ihre Fähigkeit zur Bindung und Freisetzung CaM in der Abwesenheit oder Anwesenheit von Ca 2 + ist von zentraler Bedeutung in ihrer Funktion. Im Gegensatz dazu viele Proteine binden nur Ca 2 +-CaM und benötigen diese Bindung für ihre Aktivierung. Beispiele hierfür sind Myosin Light Chain Kinase 10, Ca 2 + / CaM-abhängigen Kinasen (CaMKs) 11 und Phosphatasen (zB Calcineurin) 12, und Spektrin Kinase 13, die eine Vielzahl von direkten und nachgelagerten Auswirkungen 14 aufweisen.
Die Auswirkungen dieser Proteine auf die zelluläre Funktion sind oft abhängig von ihrer Fähigkeit, an CaM in einem Ca 2 +-abhängigen Weise zu binden. Zum Beispiel haben wir getestet, die Relevanz der Ng-CaM Bindung in synaptische Funktion und wie verschiedene Mutationen dieser Bindung beeinflussen. Wir erzielten ein GFP-markierten Ng construct mit spezifischen Mutationen in den IQ-Domäne, die die Fähigkeit des Ng zu CaM in einem Ca 2 +-abhängigen Weise zu binden verändern würde. Die Untersuchung dieser verschiedenen Mutationen gab uns einen großartigen Einblick in wichtige Prozesse der synaptischen Funktion 8,15 beteiligt. Doch in solchen Studien ist es wichtig zu zeigen, dass die mutierten Proteine der erwarteten veränderten Bindung an CaM haben.
Hier stellen wir ein Verfahren zur Prüfung der Fähigkeit von Proteinen an CaM in der Anwesenheit oder Abwesenheit von Ca 2 + binden, mit CaMKII und Ng als Beispiele. Diese Methode ist eine Form der Affinitätschromatographie bezeichnet als CaM Pull-Down-Assay. Es nutzt CaM-Sepharose Perlen Proteine, die an CaM und den Einfluss der Ca 2 + auf diese Bindung binden zu testen. Es ist wesentlich mehr Zeit effizienter und erfordert weniger Protein relativ zur Säulenchromatographie und andere Assays. Insgesamt bietet diese zu einem wertvollen Werkzeug zur Ca 2 + / CaM-Signalisierung und Proteine, die in erkundenteract mit CaM.
Protokoll
Siehe Abbildung 1 für eine Prinzipskizze des Verfahrens, beginnend mit dem Homogenat Abbildung. Geschätzte Zeit von der Vorbereitung der zellulären Extrakte Elution von CaM-Proteine ist ca. 6-7 Stunden.
1. Tissue Vorbereitung
- Inject organotypischen Schnitten des Hippocampus mit einem Virus mit einem Plasmid, das rekombinante Protein von Interesse (in diesem Beispiel grün fluoreszierende Protein (GFP)-markierten Ng) und erlauben Gewebe Protein Nachtexpress.
- Etwa 12 bis 18 Stunden nach der viralen Injektion (in Abhängigkeit von der viralen Ausdruck der Zeit), vorzubereiten, um das Gewebe zu sammeln. 1ml dissection-Puffer (10 mM Glukose, 4mm KCl, 26mm NaHCO3, 233mm Saccharose, 5 mM MgCl 2, 1 mM CaCl 2 und 0,1% Phenol-rot, vergast mit 5% CO 2 95% O 2) in eine Petrischale. Transfer gezüchtetes Gewebe / einfügen, um Petrischale und fügen 2mL Dissektion Puffer, um den Einsatz zu versenken das Gewebe.
- Collectiont organotypischen hippokampalen Gewebe (zwischen 5 und 10 Scheiben) durch vorsichtiges Schaben das Gewebe frei von dem Einsatz Membran mit einem Skalpell. Insbesondere das Entfernen einer bestimmten Region von Interesse (zB CA1) ist auch eine Option. Übertragen Sie die suspendierten Gewebes auf eine 1,5 ml Mikrozentrifugenröhrchen mit einem umgekehrten Pasteur-Pipette.
- Centrifuge Proben bei 1.500 rcf für 1 min, um Gewebe aus der Zerlegung Puffer zu trennen. Entfernen Sie vorsichtig den Überstand durch Absaugen. Achten Sie darauf, das Pellet zu stören.
- Für jede Scheibe verwendet, fügen Sie 30 bis 60 ul Homogenisationspuffer (150 mM NaCl, 20 mM Tris pH 7,5, 1 mM DTT, 1μg/mL Leupeptin 1μg/mL chemostatin, 1μg/mL Antipain, 1μg/mL Pepstatin und 1% Triton X -100), um das Gewebe und gründlich homogenisieren mit Pistill.
- Um Zelltrümmer zu entfernen, Zentrifuge die restlichen Homogenat bei 1.100 rcf für 10 min und entfernen Sie vorsichtig den Überstand durch Absaugen, während Vermeidung von Kontaminationen aus dem Pellet.
- Nehmen Sie sich 10% der Überstand als Probe des Eingangs (Probe 1). Bewahren Sie die verbleibende Überstand auf Eis bei der Herstellung der CaM-Sepharose-Kügelchen für den Einsatz in Schritt 3 fort.
Hinweis: Das Gewebe hier verwendeten organotypischen Schnitten des Hippocampus. Allerdings könnte man dissoziierten Neuronen oder anderen Zellkultur-System. In einem solchen Fall bei Schritt 1.4 beginnen, nachdem der Erhebung Ihrer Gewebe in geeigneter Weise.
2. Vorbereitung von Perlen für Pull-Down-
Im Umgang mit den Perlen ist es wichtig, die Perlen zu bergen und zu maximieren die Effizienz der Reaktionen durch die Verhinderung der Perlen aus dem Trocknen auf den Seiten des Rohres. Dazu ist es am besten zu Ihrem Rohre auf ihrer Seite drehen, sodass Lösung für die Perlen an den Wänden der Röhre nass, unmittelbar vor dem Zentrifugieren.
- Für jeden Pull-Down-, Pipette 400 ul ausgesetzt Calmodulin-Sepharose Kügelchen in ein 2 ml Reaktionsgefäß mit einem relativ flat-bottom, um die Oberfläche und die Interaktion Ihrer Lösungen mit den Kügelchen während Inkubationen maximieren.
- Centrifuge Perlen mit 21.000 rcf für 30 Sekunden und entfernen Sie vorsichtig den Überstand durch Absaugen. Achten Sie darauf, die Perlen zu stören.
- Zum Waschen der Kügelchen, 100 l der jeweiligen Homogenisierungspuffer mit entweder 2 mM CaCl 2 zu denen, die verwendet werden, um Pull-Down-Ca 2 +-CaM bindende Proteine und 2 mM EDTA (ein bekannter Ca 2 +-Chelator) für Perlen Herunterziehen ApoCaM bindenden Proteinen. Klopfen Sie leicht das Rohr wieder auszusetzen Perlen und Zentrifuge bei 1.500 rcf für 1 min. Entfernen Sie vorsichtig den Überstand durch Absaugen, was sicher nicht zu den Perlen zu stören.
Hinweis: Für alle die Sehnsucht Stufen, empfiehlt es sich, eine Pipettenspitze, dass eine feine Öffnung (z. B. Gel-loading Tips), um das Entfernen der Lösung ohne Entfernen Perlen ermöglichen verfügt.
3. CaM-Sepharose Bindung von Proteinen
- Teilen Sie Ihre Überstand in zwei Bedingungen, die ein gleiches Volumen. Abhängig von Ihrem Zustand, fügen Sie die entsprechende Menge an CaCl 2 oder EDTA Ihre Überstand bis zu 2 mM Konzentration für jeden.
- Add Überstand aus Schritt 1,7 bis Perlen in entsprechende Homogenisierung Puffer gewaschen. Klopfen Sie leicht das Rohr zu mischen.
- Inkubieren Proben bei 4 ° C für 3 Stunden auf einem Schüttler. Re-suspend Perlen alle 30 min oder so, um die Effizienz der Bindung zu erhöhen.
- Zentrifugenröhrchen mit Proben und Perlen bei 1.500 rcf für 3 min.
- Nehmen Sie 50 ul Überstand als Probe des ungebundenen Protein (Probe 2) und entfernen Sie vorsichtig die restlichen Überstände durch Absaugen entfernen und entsorgen.
- Wash Perlen drei Mal so in Schritt 2.3 mit 100 &mgr; l der jeweiligen Homogenisierungspuffer beschrieben.
4. Elution
- Add 50 ul Elutionspuffer (50 mM Tris-HCl pH 7,5 und 150 mM NaCl) mit den entgegengesetzten Zustand (10 mM CACL 2 oder 10mm EDTA), um die Perlen. Zum Beispiel, Proben, homogenisiert und in einem Puffer mit Ca 2 + gebunden waren in Elutionspuffer mit EDTA und umgekehrt eluiert.
Optional: Warming der Elutionspuffer auf 37 ° C vor der Zugabe zu Kügelchen können die Ausbeute zu erhöhen.
- Inkubieren Lösung mit Perlen bei Raumtemperatur für 30 min auf einem Schüttler. Mischen Sie die Perlen durch leichtes Antippen des Röhrchens etwa alle 5 min.
- Centrifuge Perlen bei 1.500 rcf für 3 min und entfernen Sie vorsichtig das 50 ul Überstand für das gebundene Protein (Probe 3) durch Aspiration. Achten Sie darauf, die Perlen zu stören.
- Add-Protein-Ladepuffer für alle Proben (dh Homogenat, ungebundenen und gebundenen Proteins sowie diejenigen, die noch an die Kügelchen gebunden).
Hinweis: Um Elution (besonders im Fall von ineffizienten Elution) zu maximieren, fügen Sie 50 ul der entsprechenden Elutionspuffer (zB Zugabe von EDTA mit buffer, um die Kügelchen in CaCl 2 gebunden), um die Perlen vor der Erwärmung Proben zu helfen eluieren alle verbleibenden gebundenen Proteins und wiederholen Sie die Schritte in 4.3 beschrieben, um die verbleibenden Proteine zu entfernen.
5. SDS-PAGE und Western-Blot
Conduct SDS-PAGE und analysieren mit Western-Blot durch Sondierung für Ihr Protein von Interesse und Sonde für ein Protein bekannt, CaM in die entgegengesetzte Zustand als eine positive Kontrolle zu binden.
6. Repräsentative Ergebnisse
2B zeigt ein Beispiel einer CaM-pull-down-Assay Test des CaM Bindung von GFP-markierten Ng gegenüber endogenen Ng. Dazu wurde GFP-Ng in unserem organotypischen Schnitten des Hippocampus über Nacht und überexprimiert wurde das Gewebe homogenisiert. Das Homogenat wurde mit CaM-Sepharose-Kügelchen in Anwesenheit von entweder Ca 2 + oder EDTA inkubiert. Homogenat Eingang zeigt, dass die GFP-Ng neben endogenen Ng und Ca 2 + / CaM-abhängige Kinase II exprimiert wurde(CaMKII). Als Basis der bekannten Bindung des endogenen Ng (dargestellt in Abb.. 2A) erwartet, GFP-markierten Ng in der Abwesenheit von Ca 2 + (EDTA gebundenen Proteins) und ungebundenen in Gegenwart von Ca 2 + (Abb. 2B) eluiert . Im Gegensatz dazu war die Kontrolle, CaMKII, nur in Gegenwart von Ca 2 + (gebundene Protein) eluiert und ungebunden in seiner Abwesenheit (EDTA). Dies zeigt, dass die CAM-Perlen wurden ordnungsgemäß funktioniert und die Elutionen waren effizient. Vor allem, was darauf hindeutet dies zeigt, dass GFP-Ng bindet in ähnlicher Weise wie die endogene Form ApoCaM, dass die GFP-Tag hatte keinen Einfluss auf die Funktion unserer rekombinanten Proteins.
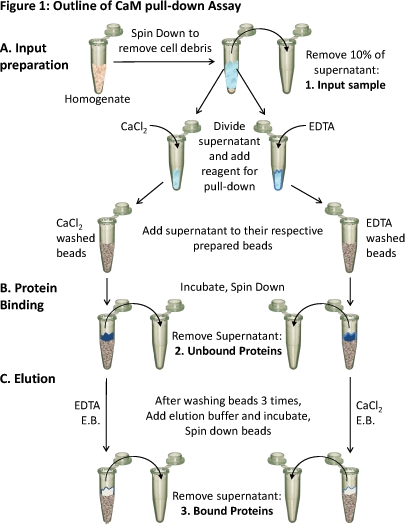
Abbildung 1. Überblick über die CaM Pull-Down-Assay
(A) Gewebehomogenat wird auf Zelltrümmer zu entfernen gesponnen. Über 10% der Überstand wird als ein Beispiel für die Eingabe (1) übernommen. Der verbleibende Überstand wird ebenso für die verschiedenen geteiltBedingungen und die entsprechenden Reagenzien (CaCl 2 oder EDTA) zugegeben, um Tests in diesen Bedingungen verbindlich. Jeder Überstand (enthält entweder CaCl 2 oder EDTA) wird auf den jeweils vorbereitet CaM-Sepharose-Kügelchen geladen und (B) inkubiert, damit verbindlich. Ungebundene Proteine entfernt werden (2) und (C) die gebundenen Proteine (3) sind aus der Perlen mit Elutionspuffer (EB) mit dem entgegengesetzten Zustand, wie die Bindung eluiert. Die Protein-Zusammensetzung dieser drei Protein-Proben können analysiert mit SDS-PAGE und Western-Blot-Analyse.
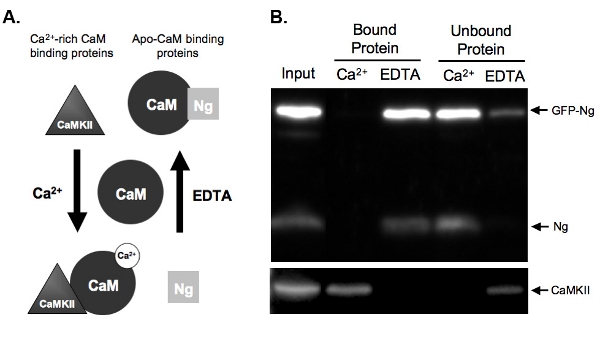
Abbildung 2. A.) Schematische Darstellung der Ca 2 +-abhängige CaM Bindung und Elution in Pull-Down-Assay Beispiele sind zwei Arten von Protein binden CaM in einem Ca 2 +-abhängigen Weise gegeben. Neurogranin (Ng) stellt Proteine binden apo-Cam und CaMKII Proteine, die Ca 2 +-reiche binden stelltCaM. CaM ist in seiner dissoziierten Zustand vor der Inkubation mit dem Homogenat Proteine gezeigt. Einmal unter den Bedingungen hoher Ca 2 +-Konzentrationen (2 mM) oder in Gegenwart eines Ca 2 +-Chelator inkubiert, EDTA (2 mM), die Proteine werden CaM entsprechend zu binden. Ng bindet CaM in der EDTA-Zustand, da es wenig bis gar keine Ca 2 + vorhanden ist, und würde ausgeschaltet werden die CaM-Sepharose-Kügelchen in Anwesenheit von Ca 2 + eluiert. CaMKII, würde jedoch zu CaM in Gegenwart von hohen Mengen an Ca 2 + binden und würde distanzieren, wenn die Ca 2 + wurde Chelat.
B.) Die Ergebnisse aus Beispiel CaM Pull-Down-Assay. Diese Abbildung zeigt die erwartete Endergebnis einer CaM-Sepharose-Pulldown mit den Proben untersucht, um Ng und CaMKII. Sowohl die endogene Ng und GFP-Ng sind in den Gassen von Proteinen gebunden CaM in Gegenwart von EDTA. Keine Ng gebunden ist, wenn die Proben mit CaM in Gegenwart von Ca 2 + inkubiert werden, die zeigen, dass Ng bindet nur apo-Cam. Unsere positive Kontrolle, CaMKII, auf der anderen Seite, bindet an CaM nur in Gegenwart von Ca 2 +.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die zur Verfügung gestellten Protokoll verwendet CaM-Sepharose-Kügelchen, die Ca 2 +-Abhängigkeit der CaM-bindenden Proteinen zu untersuchen. Viele Proteine binden CaM in einem Ca 2 +-abhängigen Weise. Diese Wechselwirkungen sind von großer Bedeutung angesichts der Zahl der CaM-bindende Proteine und ihre entscheidende Rolle in vielen Signalwegen. In diesem Protokoll werden CaM-Sepharose-Kügelchen verwendet, um CaM-bindenden Proteinen aus Gewebehomogenat separaten in die Gegenwart ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Tiffany Cherry in ihre Hilfe bei der Optimierung dieses Protokoll. Diese Arbeit wurde vom National Institute of Aging (AG032320) sowie Weiterentwicklung einer gesünderen Wisconsin finanziert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Produkt | Firma | Katalog-Nummer | Hinweise |
| Calmodulin-Sepharose beads | GE Healthcare | 17-0529-01 | |
| Anti-CaMKII alpha | Sigma-Aldrich | C6974 | |
| Anti-neurogranin | Millipore | 07-425 | |
| Gel Loading Pipettenspitzen | Fischer | 02-707-138 | Verwenden Sie zum Absaugen der Überstände |
| Reaktionsgefäße (2,0 ml) | Fischer | 05-408-146 | Verwenden Sie für alle Schritte mit Calmodulin-Sepharose-Kügelchen |
Referenzen
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten