Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gepaart Nanoinjection und Elektrophysiologie-Test zum Screening auf Bioaktivität der Verbindungen unter Verwendung des Drosophila melanogaster Riesen-Fiber System
In diesem Artikel
Zusammenfassung
Ein schneller In-vivo- Test für neuromodulatorische Verbindungen mit dem Riesen-Fiber System (GFS) von Test Drosophila melanogaster Beschrieben. Nanoinjections im Kopf des Tieres zusammen mit elektrophysiologischen Ableitungen der GFS offenbaren kann Bioaktivität von Verbindungen auf Neuronen oder Muskeln.
Zusammenfassung
Screening von Verbindungen für die in vivo-Aktivität kann in einem ersten Schritt die Kandidaten, die in pharmakologischen Mitteln 1,2 entwickelt werden kann, zu identifizieren verwendet werden. Wir haben ein neues nanoinjection / Elektrophysiologie Assay, der die Detektion der bioaktiven modulatorische Wirkungen von Verbindungen auf die Funktion eines neuronalen Schaltung, vermittelt die Fluchtreaktion in Drosophila melanogaster 3,4 ermöglicht. Unsere in vivo Assay, der die Drosophila Riesenfaser System (GFS, Abbildung 1) können Screening von verschiedenen Arten von Verbindungen, wie kleine Moleküle oder Peptide verwendet, und erfordert nur sehr geringe Mengen, um eine Wirkung hervorrufen. Darüber hinaus bietet das Drosophila GFS eine große Vielfalt an mögliche molekulare Zielstrukturen auf Neuronen oder Muskeln. Die Riesen-Fibers (GF) elektrisch Synapse (Gap Junctions) sowie chemisch (cholinergen) auf eine periphere Synapsing Interneuron (PSI) und der Tergo Trochanteral Muscle Neuron (TTMn) 5 6. Schließlich sind die neuromuskulären Endplatten (NMJ) des TTMn und der DLMn mit dem Sprung (TTM) und Flugmuskeln (DLM) glutamatergen 12.07. Hier zeigen wir, wie man Nanolitermengen einer Verbindung zu injizieren, die trotzdem eine elektrophysiologische intrazelluläre Ableitungen aus dem Riesen-Fiber System 13 und wie man die Wirkungen der Verbindung auf die Funktion dieser Schaltung zu überwachen. Wir zeigen Spezifität des Tests mit Methyllycaconitine Citrat (MLA), ein nAChR-Antagonist, der die Verbindung zum PSI DLMn aber nicht die Verbindung zu GF oder die Funktion des NMJ am Sprung oder Flug Muskeln TTMn stört.
Vor Beginn dieses Video ist es wichtig, dass Sie genau beobachten und sich mit dem JoVE Video mit dem Titel "elektrophysiologischen Ableitungen aus dem Riesen-Fiber Pathway von D. Melanogaster "von Augustin et al 7, da das Video hier vorgestellt wird als Erweiterung dieser herkömmlichen Technik bestimmt. Hier haben wir die elektrophysiologischen Verfahren und Fokus verwenden im Detail nur für die Aufnahme eines der gepaarten nanoinjections und Überwachungstechnik.
Protokoll
1. Elektrophysiologie Rig Set-up
- Die erforderliche Ausrüstung für die Elektrophysiologie Rig Set-up wird im Detail von Augustin et al. in diesem Journal 14. Bitte beachten Sie in diesem Artikel für eine detaillierte Erklärung der elektrophysiologischen Geräte benötigt.
- Ändern Sie den zuvor beschriebenen Elektrophysiologie Rig Set-up 14 durch das Hinzufügen eines sechsten Mikromanipulator, der die nanoinjector hält. Für einen einfachen Zugriff auf den Kopf des Tieres sie zwischen den beiden Stimulationselektrode Mikromanipulatoren platziert werden soll, wie in 2 gezeigt.
- Vor dem Versuch, sicherzustellen, dass Sie einen komfortablen Bereich auf allen Drehachsen mit allen Mikromanipulatoren haben, und dass alle Elektroden sowie die Injektion Mikropipette (siehe Schritt 2) kann das Tier zu erreichen.
2. Nanoinjection Set-up
- Die nanoinjection Set-up erfordert ein Nanoliter2000 (World Präzisiauf Instruments, Sarasota, FL, USA) oder eine ähnliche Art von Injektor, der kontrollierte Injektionen können in Nanolitermengen.
- Planen Injektionsnadel mit den Glas-Mikropipetten mit dem Injektor, indem man sie auf einen Widerstand von 80-100 MOhm mit einer Elektrode Abzieher zugeführt.
- Für einen reibungslosen Injektionen ist es erforderlich, die Fase Mikropipetten zu einer Öffnung am 17.11 um einem 45 Grad Winkel (Abbildung 3).
- Langsam verfüllen die Injektion Mikropipette mit synthetischem Öl mit einer Hamilton-Spritze, wie durch die manuelle Nanoliter2000 angewiesen, sicherzustellen, dass keine Luftblasen vorhanden sind.
- Sorgfältig sichern die Mikropipette auf dem nanoinjector und bereiten Sie es, die Verbindung durch das Entleeren überschüssiges Öl als durch die manuelle Nanoliter2000 angewiesen zu laden.
- Setzen Sie den Injektor auf dem Mikromanipulator und laden Sie die Verbindung wie in der Anleitung beschrieben Nanoliter2000. Stellen Sie sicher, dass die Spitze der Mikropipette nicht während dieser brechenVerfahren.
- Die gewünschte Menge von in Nanoliter des Injektors Steuergerät injiziert werden, durch die Nanoliter2000 Handbuch beschrieben. Bitte beachten Sie, dass der Gesamtbetrag injizierten sollte nicht mehr als 100 nl. Wir fanden, dass größere Mengen an Kochsalz-Control-Lösungen kann die Funktion des GFS-Schaltung auswirken.
- Es ist wichtig, damit der Injektor von der Steuereinheit während der Aufnahme Übernahme unplugged mit Ausnahme der Injektion selbst, da die Stromversorgung des nanoinjector stört die Aufnahmen, die sichtbar als Hintergrundrauschen (4) ist. Jedoch nicht die Stromversorgung unterbrechen, um die Steuereinheit wie es neu eingestellt wird.
3. Drosophila melanogaster Vorbereitung
- Anesthetize 2 bis 6 Tage alten Fliegen mit CO 2 oder auf Eis, wie vorher beschrieben 14,15.
- Sobald unbeweglich, verwenden Sie eine Pinzette, um das Tier zu einer kleinen Platte übertragen with weichen Dentalwachs, indem man es von seinen Beinen. Bitte beachten Sie, dass ein männlicher Fruchtfliegen etwa 1,0 mg wiegt und eine weibliche Fruchtfliege wiegt etwa 1,2 mg, also Verbindung-zu-Körpergewicht-Verhältnis ist anders im Vergleich zu männlichen weibliche Fliegen. Daher ist es empfehlenswert, nur ein Geschlecht für die Experimente verwendet.
- Wie bereits beschrieben, 14,15, vorsichtig montieren die Fliege Rückenseite nach oben und sicherzustellen, dass der Brustkorb und Kopf mit weichen Dentalwachs um den Körper gelegt werden immobilisiert. Sorgfältig breitete die Flügel aus, so dass sie senkrecht zu legen, um den Thorax (Abb. 2, C). Die Fliege sollte mit so wenig Schaden wie möglich montiert werden.
4. Gepaart Nanoinjection / Elektrophysiologie
- Stellen Sie das montierte Fliege an der Elektrophysiologie Rigg mit seinem Kopf in Richtung der stimulierenden Elektroden.
- Aufspießen, das Tier mit dem entsprechenden anregende, Boden-und Aufzeichnungs-Elektroden wie zuvor 14,15 (F beschriebenbbildung 2, C). Wenn nicht anders gewünscht, erfolgt eine Aufnahme Elektrode in die DLM und die andere in die TTM Muskel. Das DLM-Muskel im Brustkorb zwischen den vorderen Dorso-Central Haare und der Mittellinie des Fliege befindet. Die TTM Muskel wird in der Nähe der Flügel-Anhänge, zwischen den hinteren und vorderen Supra-Alar Haare der Fliege 7.
- Richten der Injektion Mikropipette, die die Verbindung mit dem Zentrum der drei Augenflecken auf der medialen hinteren Teil des Kopfes liegt, aber noch nicht zu injizieren (Abb. 2, C).
- Vor der Verbindung Injektion erhalten eine Grundlinie Aufzeichnung des GF zu TTM und GF, Wege des Riesen Fiber System (GFS, Abbildung 1) über Hirnstimulation DLM. Dazu aktivieren Sie die Riesen-Fibers (GF) mit 10 Zügen von 10 Stimuli (40-50 mV) jeweils für eine Dauer von 0,03 ms bei 100 Hz gegeben mit einem 1-Sekunden-Verzögerung zwischen den Zügen 14,15 (Abbildung 4). Wildtyp fliegt shOuld der Lage sein, eins-zu-eins in diesem Tempo folgen der Anregung sowohl für DLM und TTM Wege. Entsorgen Sie die Fliege, wenn der GF zu DLM und GF zu TTM Wege nicht folgen, die 100-Hz-Stimulation im Verhältnis 1:1.
- Wechseln zu kontinuierliche Stimulation des GF mit einzelnen Pulsen bei 1 Hz (Abbildung 4).
- Schnell stecken Sie den Injektor in das Steuergerät. Auch wenn Hintergrundgeräusche werden mit den 1-Hz-Stimulation Aufnahmen stören, nicht abbrechen.
- Vorsichtig die Injektion Mikropipette in die Kopfkapsel der Fliege direkt unter der Kutikula und injiziert die gewünschte Menge der Verbindung in die Hämolymphe der Fliege, während die 1 Hz Stimulation (Abbildung 4). Aufgrund der offenen Kreislaufsystem der Fliege, wird das gesamte Nervensystem zu der Verbindung innerhalb weniger Sekunden belichtet werden. Obwohl ein bestimmter Injektionsstelle ist nicht kritisch für Verbindungen in die Hämolymphe liefern, finden wir in den Bereich der Augenflecken, die sich lokalisierend medialen am meisten dorsalen Seite des Kopfes Kapsel, eine geeignete Stellen, die für eine einfache Injektion, die eine schnelle und gleichmäßige Verteilung der Verbindung führt ermöglicht werden.
- Unverzüglich entfernen Injektion Mikropipette aus der Injektionsstelle und ziehen Sie den Injektor aus dem Schaltkasten während der Fortsetzung des 1 Hz GF Stimulation bis zu 1 Min. nach der Injektion (Abb. 4).
- Um subtilere Effekte von Verbindungen auf der GFS zeigen, betonen die Giant Fibers (GF) mit 10 Zügen von 10 Stimuli bei 100 Hz mit einer Verzögerung von 1 Sekunde zwischen den Zügen. Fortfahren, um die Funktion der GF Wege zu diesem Paradigma alle 5 Minuten bis zu 15 Minuten (4) zu testen. Allerdings sind kürzere Intervalle oder längere Überwachungszeiträume ebenfalls möglich.
- Um zu testen, ob die Verbindung eine Wirkung an der neuromuskulären Endplatten (NMJ) der GFS hat, und möglicherweise verengen die Wirkungen der Verbindung, fahren Sie mit den Motoneuronen Richtungen aktivierenTLY von Brust-Stimulation. Dazu entfernen Sie die stimulierenden Elektroden aus den Augen und ersetzen Sie sie auf den vorderen Seiten des Thorax, um die motorischen Neuronen mit 10 von 10 Zügen Reize stimulieren bei 100 Hz.
Hinweis: Die Elektrophysiologie Spuren in dem Video gezeigt werden, sind nicht auf die Wirkungen von reinem Farbstoffinjektion entsprechen.
5. Repräsentative Ergebnisse
Wirkung eines Antagonisten am PSI zur Synapse des Riesen Fiber System DLM
Methyllycaconitine Citrat (MLA) ist ein nAChR-Antagonisten, die spezifisch für α7 nAChR-Subtypen ist. Die PSI zu Synapse in der GF-DLM Weg DLMn ist abhängig von der Dα7 nAChR-Subtyp für die ordnungsgemäße Funktion, während die genetische Entfernung von Dα7 nAChR-Subtyp hat keine Auswirkung auf die GF-Weg TTM 5,6. Um die Spezifität und Sensitivität unserer Test zeigen wir, injiziert MLA in unterschiedlichen Konzentrationen (0, 0,02, 0,04, 0.08, injiziert 0,12 ng / mg, 46 nl) in den Kopf des Tieres (n = 10 pro Verbindung Behandlung, n = 15 für Kochsalzlösung Behandlung). Nur männlichen Fliegen (des Wildtyp-Genotyp Wildtyp 10E) verwendet wurden, und die Wirkung der Verbindung wurde für insgesamt 15 Minuten nach der Injektion überwacht.
Abbildung 5 zeigt den Unterschied zwischen Baseline-Aufnahmen vor der Injektion erhalten und diese nach der Injektion in Reaktion auf MLA und Kochsalzlösung Control-Lösung erhalten. Wir fanden, dass die Injektion von MLA resultierte in der Unfähigkeit der GF-DLM Weg zum Eins-zu-eins bei 100 Hz folgen durch Reize der GfS im Gehirn während der GF-TTM Weg unbeeinflusst blieb. (Abbildung 5, Top-und mittleren Spur, t-Test zwischen Kochsalzlösung bei den Kontrollen [0 ng / mg] und den verschiedenen Konzentrationen von MLA zu jedem Zeitpunkt durchgeführt werden, es sei denn die Daten sind nicht-parametrische [Normalität und gleiche Varianzen getestet], da wir sonst verwenden ein Mann-Whitney-Rangsummentest. * p <0,001). Jedoch eine Eins-zu-Eins-response des DLM wurde beobachtet, wenn die motorischen Neurone wurden direkt (Abbildung 5, untere Kurve) stimuliert, die belegen, dass die NMJ Funktion des DLM und TTM nicht durch MLA betroffen. MLA erschien auf seine maximale Wirkung 1 Minute nach der Injektion zu erreichen für 0,04, 0,08 und 0,12 ng / mg MLA injiziert, da keine weiteren signifikanten Veränderungen während der folgenden 15 Minuten der Testphase festgestellt wurden. Darüber hinaus erreicht die Verbindung eine maximale Wirkung bei 0,08 ng / mg seit stärkere Reaktionen wurden nicht mit der höheren Dosierung von 0,12 ng / mg beobachtet.
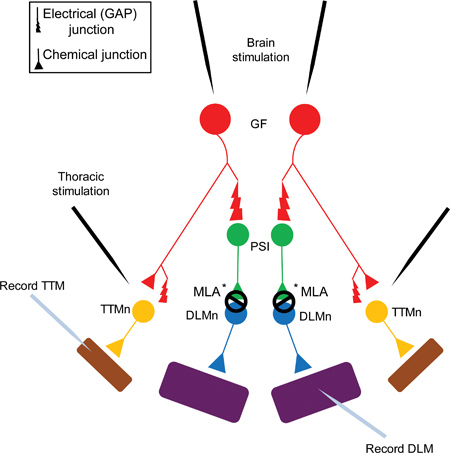
Abbildung 1. Der Riese Fiber System Diagram of the Giant Fiber System (GFS). The Giant Fibers (GFS, in rot dargestellt) elektrisch Synapse (Gap Junctions) sowie chemisch (cholinergen) auf eine periphere Synapsing Interneuron (PSI, in grün dargestellt) und die Tergo Trochanteral Muscle Neuron (TTMn, gelb dargestellt) 5. Die PSIch DLMn (Dorsal Längsmuskulatur Neuron, in blau dargestellt) Verbindung ist abhängig von Dα7 nAChR-Subtyp 6. Schließlich wird der neuromuskulären Synapse (NMJ) des TTMn und der DLMn auf dem Sprung (TTM, dargestellt in lila) und Flugmuskeln (DLM, dargestellt in lila) ist Glutamat.
Hinweis: Die GF zu PSI-Verbindung ist sowohl elektrische und chemische. In shakB Mutanten (die Gap Junctions fehlt), kann keine Antwort von der DLM bei der Stimulation des GF im Gehirn aufgenommen werden, zeigt, daß die chemische Komponente in Abwesenheit von elektrischen Verbindungen nicht ausreicht, um ein Aktionspotential in der hervorzurufen PSI 5,16-18. Weil der GF zu PSI-Verbindung ist abhängig von Gap Junction zeigt diese Figur nur den Gap Junction an der Synapse der Einfachheit halber.

Abbildung 2.
Mikromanipulatoren set-up.
- Eine modifizierte Set-up eines zuvor veröffentlichten Protokoll 14 wird verwendet, um die Injektion Mikromanipulator für gepaarte GFS-Aufnahmen mit gleichzeitiger nanoinjections passen. Die Zubereitung ist montiert Fliege mit dem Kopf der Fliege auf den Experimentator orientiert. Die Injektion Mikromanipulator (# 1) wird vor dem Experimentator zwischen den beiden Manipulatoren für die Wolfram-stimulierenden Elektroden (2 # und # 3) angeordnet ist. Die beiden Mikromanipulatoren für die Glas-Aufzeichnungselektroden (# 4 und # 5) auf der linken und rechten Seite angeordnet ist, jeweils. Der Mikromanipulator der Wolfram-Masseelektrode (# 6) angeordnet weitesten entweder auf der linken Seite (hier gezeigt) oder auf der rechten Seite in den Rücken.
- Eine Nahaufnahme von der Spitze der Regelungen der verschiedenen Elektroden und Injektion Mikropipette.
- Ein richtig montiert D. melanogaster aufgespießt mit Elektroden und Injektion Mikropipette bereit zur Injektion. Beachten Sie, dass der Körper des Tieresist mit seinen Brustkorb horizontal und mit den Flügeln montiert ausbreiten. Das Wachs wird fest um seinen Körper gewickelt zu verhindern, das Tier bewegt. Zusätzlich kann die Masseelektrode (Nr. 6, im Abdomen), die Glas Aufzeichnungselektroden (# 4 und # 5, des Thorax, durch dunkle Linien markiert), und die Stimulationselektroden (# 2 und # 3, einem für jedes Auge ) an ihrem Platz aufgespießt, wie zuvor 14 beschrieben. Die Injektion Mikropipette (# 1) ordnungsgemäß mit der Mitte der drei Ocellen (eingekreist) ausgerichtet ist. Angabe der Injektion Mikropipette sollte in diesem Bereich gespeichert.
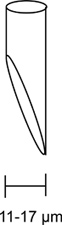
Abbildung 3. Abgeschrägte Injektion Mikropipette. Ein Diagramm eines ordnungsgemäß abgeschrägt Mikropipette wird hier gezeigt. Die Elektrode Öffnung sollte in einem 45 Grad-Winkel abgeschrägt sein und eine Öffnung zwischen 11 und 17 um. Ein richtiges abgeschrägte Injektion Mikropipette ist von entscheidender Bedeutung für einen reibungslosen Injektion mit minimalem dAmage zur Fliege.
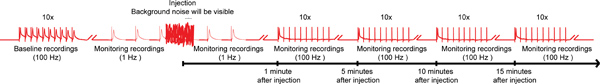
Abbildung 4. Allgemeine Systematik des nanoinjection / Elektrophysiologie-Protokoll. Eine repräsentative Darstellung des Gesamtkonzepts für die nanoinjection / Elektrophysiologie-Protokoll. Beginnen Sie mit dem Erhalt einer Grundlinie Aufnahme durch die Stimulierung der Riesen-Fibers (GF) bei 100 Hz mit 10 von 10 Zügen je Reize (nur ein Zug hier abgebildet). Vor der Injektion beginnen die 1-Hz-Stimulation eine Sekunde auseinander. Während der Injektion (während Injektor angeschlossen wird beim Control Box), werden Sie feststellen, erhebliche Geräuschkulisse, jedoch nicht beenden die Aufnahmen. Nach der Injektion (und Injektor wird vom Steuergerät unplugged), weiterhin die 1-Hz-Stimulation für etwa 1 Minute. Schließlich gehen Sie auf das GVS mit 10 Züge von 10 Stimuli Spannung bei 100 Hz und weiterhin die Funktion der GF Wege mit diesem Paradigma alle 5 Minuten bis zu 15 Minuten zu testen. Hinweis: Aufnahmen were manipuliert werden, um die allgemeine Systematik zu schaffen und repräsentieren nicht ein bestimmtes Ergebnis zu erhalten. Nicht maßstabsgetreu sind nicht alle Spuren gezeigt. Klicken Sie hier für ein größeres Bild .
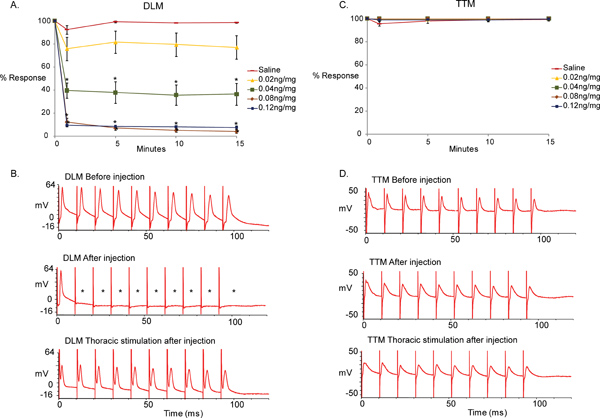
Abbildung 5. Die Auswirkungen der MLA in der GFS.
- Eine grafische Darstellung der Auswirkungen der α7 nAChR-Antagonist Methyllycaconitine Citrat (MLA) auf der GF-DLM Weg der Taufliege in verschiedenen Konzentrationen (0, 0,02, 0,04, 0,08, 0,12 ng / mg n = 10 pro Verbindung Behandlung. n = 15 für Kochsalzlösung Behandlung). Nur eine Minute nach der Injektion wurde eine deutliche und unmittelbare Wirkung mit 0,04 ng / mg MLA gesehen. Ein signifikanter Effekt wurde auch mit 0.8ng/mg und 0.12ng/mg von MLA bei 100Hz Stimulation der GfS gesehen. Wurde kein signifikanter Unterschied zwischen Kochsalzlösung bei den Kontrollen und 0,02 ng / mg MLA zur Kenntnis genommen. Außerdem, keine Veränderung in Effekt wurde nach 1 Minute nach der Injektion in der Zeit getestet (15 Minuten) zu sehen. Ein t-Test wurde zwischen Kochsalzkontrollen (0 ng / mg) und verschiedenen Konzentrationen von MLA zu jedem Zeitpunkt durchgeführt. SEM, * p <0,001 - Levels werden als Mittelwert + / berichtet.
- Probe Spuren der DLM-Reaktionen bei 100 Hz Stimulation. Obere Kurve zeigt die Antworten der Muskel vor der Injektion zu MLA GF Stimulation im Gehirn. Beachten Sie, dass der Muskel in der Lage, auf jeden Reiz eins-zu-eins bei 100 Hz zu reagieren. Mittlere Spur zeigt die Antworten der DLM nach MLA Injektion (0,12 ng / mg). Beachten Sie, dass der Muskel nicht in der Lage ist auf jeden Reiz eins-zu-eins bei 100 Hz zu reagieren. (Sternchen). Untere Spur zeigt die Antworten der DLM aus dem gleichen Präparat (0,12 ng / mg) auf direkte Stimulation der motorischen Neuronen im Thorax. Da DLM reagiert eins-zu-eins bei 100 Hz mit thorakalen Stimulation, kann der Ausfall der Antworten mit Gehirn Stimulationen an das cholinerge PSI-Verbindung zugeschrieben werden DLMn.
- Eine grafische Darstellung der Auswirkungen mit verschiedenen MLA Konzentrationen (0, 0,02, 0,04, 0,08, 0,12 ng / mg) auf dem GF-TTM Weg. Keine signifikanten Effekte wurden zwischen Saline (0 ng / mg) und Verbindung Injektionen jederzeit Punkt gesehen. Ein t-Test wurde zwischen Kochsalzlösung bei den Kontrollen (0 ng / mg) und den verschiedenen Konzentrationen von MLA zu jedem Zeitpunkt durchgeführt, * p <0,001.
- Probe Spuren der TTM Reaktionen bei 100 Hz Stimulation. Obere Kurve zeigt die Antworten der Muskel vor der Injektion zu MLA GF Aktivierung mit Stimulation des Gehirns. Beachten Sie, dass der Muskel in der Lage, auf alle Reize reagieren bei 100 Hz liegt. Mittlere Spur zeigt die Antworten der DLM nach MLA Injektion (0,12 ng / mg). Antworten von der TTM Muskel auf die Stimulation des GF im Gehirn verbleiben eins-zu-eins. Untere Spur zeigt die Antworten der TTM der gleichen Vorbereitung bis 100 Hz Stimulation der motorischen Neuronen im Thorax (0,12 ng / mg).
Diskussion
Die nanoinjection / Elektrophysiologie Bioassay hier vorgestellten ermöglicht eine schnelle Screening von Verbindungen im Nervensystem der Fruchtfliege. Dies ist ein neues in vivo-Technik, die kleine Mengen einer Verbindung benötigt, um einen Effekt auf einer Vielzahl von molekularen Zielstrukturen in einer gut charakterisierten neuronalen Schaltung auszulösen. Dieses Verfahren kann verwendet werden, um die Bioaktivität von verschiedenen Verbindungen zu testen, von unbekannten Toxine im Handel erhältlich p...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir möchten die Mitglieder des Mari-Labor und das Labor Godenschwege, insbesondere Aline Yonezawa anerkennen, für Kommentare und helfen mit diesem Protokoll. Diese Arbeit wurde vom National Institute for Neurological Disorders and Stroke Zuschuss R21NS06637 von UKW-und TAG finanziert werden; AB wurde von der National Science Foundation Award Nummer 082925, URM finanziert: Integrative Biologie für zukünftige Forscher.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Recording Glaselektroden: Borosilikatglas Kapillaren | World Precision Instruments | 1B100F-4 | 1,0 mm Außendurchmesser, 0,58 mm ID |
| Stimulator | Grass Instruments | Modell S48 | |
| Verstärker | Erste Instruments Inc. | Modell 5A | |
| Datenerfassungs-Software: Digidata | Molecular Devices | Modell 1440A | |
| Software zur Datenerfassung: pCLAMP | Molecular Devices | Version 10 | |
| Stereomikroskop wit LWL-Mikroskop Ringlicht | AmScope | SM-4T Modell HL250-AR | |
| Binokular für die Montage | AmScope | SM-2TZ | |
| Kite & Manuelle Mikromanipulator Schwenkfuß | World Precision Instruments | Model # M3301 Kite: Model # KITE-M3-L | |
| Drosophila melanogaster Wilde 10E-Genotyp (Wildtyp) | Bloomington Stock Center | Stock # 3892 | |
| Vertikale Pipette Abzieher | David Kopf Instruments | Modell 700C | |
| Injection Glasmikropipetten: Borosilikatglas Kapillaren | World Precision Instruments | Katalog # 4878 | OD 1,14 mm, 0,5 mm ID |
| Silikonöl | Fischer | Katalog # S159-500 | |
| Beveler | Sutter Instrument Co. | KT Braun Typ Model # BV-10 | |
| Nanoliter2000 | World Precision Instruments | Katalog # B203XVY | |
| Blaue Lebensmittelfarbe | McCormick | N / A | Zutaten: Wasser, Propylenglykol, FD & C Blue 1, und 0,1% Propylparaben (Konservierungsmittel). |
| Methyllycaconitine Citrat (MLA) | Tocris Bioscience | Katalog # 1029 | |
| Kunststoff-Wachs-Sticks | Hygenic Corporation (Akron Ohio USA) |
Referenzen
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten