Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Reproduzierbare Maus Ischiasnerv Crush und anschließende Bewertung der Regeneration von Whole mount Muskelanalyse
In diesem Artikel
Zusammenfassung
In diesem Bericht beschreiben wir eine Methode zur Maus Ischiasnerv zu zerschlagen. Diese Methode verwendet leicht verfügbar Arterienklemmen und einfach und reproduzierbar produziert komplette Ischiasnerv verknallt. Darüber hinaus beschreiben wir eine Methode, um Muskeln ganzen Halterungen für die Analyse der Nervenregeneration nach Ischiasnerv verknallt vorzubereiten.
Zusammenfassung
Regeneration im peripheren Nervensystem (PNS) ist weit verbreitet sowohl für seine Relevanz für die menschliche Krankheit und die robuste regenerative Reaktion von PNS Neuronen damit möglicherweise die Beleuchtung der Ausfälle von ZNS-Regeneration 1 montiert verstehen, intensiv untersucht. Ischiasnerv Crush (Axonotmesis) ist eine der gängigsten Modelle von peripheren Nervenverletzungen bei Nagern 2. Crushing unterbricht alle Axone aber Schwann-Zell Basallaminae bleiben erhalten, so dass eine optimale Regeneration ist 3,4. Dies ermöglicht es dem Prüfer, um genau zu studieren: die Fähigkeit eines wachsenden Axons sowohl mit der Schwann-Zellen und Basallaminae 4 interagieren. Ratten waren im Allgemeinen die bevorzugten Tiermodellen für experimentelle Nervenquetschungs. Sie sind weit verbreitet und ihre lädierten Ischiasnerv bietet eine angemessene Annäherung an die menschliche Nervenläsionen 5,4. Obwohl in der Größe kleiner als Ratte Nerven, die Maus N. viele ähnliche Eigenschaften. Am wichtigsten ist jedoch, mousE-Modelle sind immer wertvoll, weil von der breiten Verfügbarkeit von transgenen Linien erlaubt nun eine detaillierte Analyse der einzelnen Moleküle von entscheidender Bedeutung für die Regeneration von Nerven 6, 7. Vor Ermittler haben mehrere Methoden verwendet, um eine Nervenquetschungs oder Verletzungen, einschließlich einfacher abgewinkelte Pinzetten, Zangen gekühlt, Arterienklemmen, Gefäßklemmen und Forschern entwickelt Klammern 8,9,10,11,12 produzieren. Die Ermittler haben auch verschiedene Methoden zur Markierung der verletzten Stelle mit Naht, Kohlenstoff-Teilchen und fluoreszierende Kügelchen 13,14,1 verwendet. Wir beschreiben unsere Methode, um eine komplette reproduzierbar Ischiasnerv verknallt genaue und anhaltende Kennzeichnung des Crush-Website mit einer feinen Pinzette hämostatischen und anschließender Kohlenstoff Crush-Ort-Kennzeichnung zu erhalten. Als Teil unserer Beschreibung der Ischiasnerv verknallt Verfahren haben wir auch eine relativ einfache Methode des Muskels enthalten ganze montieren wir nutzen, um anschließend zu quantifizieren Regeneration.
Protokoll
1. Tierische Themen
1.1. Behandlung
- Alle Tier-Verfahren sollten mit Zustimmung der lokalen Einrichtung des Animal Care und Ethik-Kommission und im Einklang mit der Nutzung und Ausschuss und National Institutes of Health Leitlinien durchgeführt werden, mit Maßnahmen ergriffen, um Schmerzen und Beschwerden zu minimieren.
- Unsere Mäuse wurden unter temperierten Bedingungen auf einem 12-Stunden-Reverse-Dunkel-Zyklus untergebracht, während die Fed Mäusefutter und Wasser ad libitum.
- Für Studien mit erwachsenen Regeneration, sollten Mäuse mindestens 6 Wochen alt sein, wenn der Ischiasnerv verknallt durchgeführt wird. Dieses Zeitalter ist über den Zeitpunkt, an dem Beschneiden von polyneural neuromuskulären Endplatten stattfinden.
- In diesen Experimenten wurden 6-8 Wochen alte C57BL / 6 Mäuse von Charles River erworben. Beim Vergleich der Regeneration nach dem Ischiasnerv Crush (dh: von Axonwachstum) Mausstämmen sollten die gleichen sein, wie Unterschiede in der axonalen Regeneration nicht gewesen seined zwischen verschiedenen Inzuchtstämme 15,16. Wenn genetisch manipulierten Mäusen verwendet werden sollen, sind Wurfgeschwister Steuerelemente am besten geeignet.
1.2. OP-Vorbereitung
- Die Tiere sind tief narkotisiert für Chirurgie mit einem Cocktail von Ketamin (100 mg / kg) und Xylazin (10 mg / kg) durch intraperitoneale Injektion. Jedes Tier erhält außerdem eine subkutane Injektion von Meloxicam (10 mg / kg) zur post-operativen Schmerzen zu minimieren.
- Beide Hinterläufe sind sorgfältig rasiert mit einem chirurgischen Clippers (Roboz, RC-5903) und Enthaarung mit Nair Enthaarungscreme (gefunden auf der lokalen Apotheke) fertig gestellt.
- Haut wird gereinigt mit sterilen Wattestäbchen Applikatoren und Betadin chirurgische Macchia (Fisher Scientific, 19066452).
- Augensalbe (Fisher Scientific, 19082795) ist für die Augen mit sterilen Wattestäbchen Applikatoren aufgebracht.
- Die Maus wird auf eine saubere Platte aus rostfreiem Stahl platziert, unter denen wurde eine vorgewärmte homeot platzierthermic Decke-System (Harvard Apparatus, 507222F). Tierische Temperatur bei 37 ° C
- Alle Gliedmaßen sind nach unten, wobei darauf geachtet wird, um die hinteren Gliedmaßen symmetrisch so zu positionieren, dass das Kniegelenk einen rechten Winkel mit dem Körper (Bild 1, Bild A) macht abgeklebt.
- Das chirurgische Feld ist mit einem sterilen Tuch bedeckt. Alle Instrumente werden von Autoklaven oder heiße Perle Sterilisation (Fine Science Tools, 18000-45) und der Chirurg trägt eine Maske, Kittel, sterile Handschuhe und sterilisiert.
2. Reproduzierbare Ischiasnerv Crush
- Nach der Herstellung wird ein halbkreisförmigen Einschnitt über die Mittellinie (1) in die Haut. Die Haut wird sanft von der darunter liegenden Muskulatur seziert, und umgeschlagen zu bleiben aus dem Weg während des Verfahrens. Es feucht gehalten wird unter Verwendung von 0,1-Anwendungen ml steriler Kochsalzlösung (Hospira 0409-4888-20) während des Verfahrens.
- Das Öffnen der Faszien-Ebene zwischen den Gesäßmuskel und dem vorderen Kopf des Bizeps femoris zeigt den Ischiasnerv (Bild 1, Bild A). Für eine chirurgische Kontrolle sollte die kontralaterale Ischiasnerv freigelegt und mobilisiert werden, aber intakt gelassen. Die Gesäßmuskulatur wird dann wieder dagegen und vernäht mit 6-0 Seide geflochten, nicht-resorbierbaren Fäden (Roboz, SUT-1073-11).
- Die experimentelle Ischiasnerv wird dann in der gleichen Weise ausgesetzt ist, mit Retraktoren an Ort und Stelle um die Visualisierung (1, Feld B) zu erleichtern. Die Retraktoren sind vor dem Gebrauch sterilisiert.
Hinweis: Obwohl Spreizer-Systeme im Handel erhältlich sind, sind sie oft ziemlich teuer. Wir konnten eine zufriedenstellende Retraktor-System mit preiswerter Hardware liefert und Insekten Pins (siehe Abschnitt Materialien) zu machen. - Der Ischiasnerv wird dann vorsichtig aus dem umgebenden Bindegewebe mit Iridektomie Schere befreit.
- Mit einem feinen 5/45 (Fine Science Tools, 11251-35) Pinzette wird der Nerv auf der unteren Kiefer eines superfeinen Arterienklemmen (Fine Science Too platziertls, 13020-12). Die drei Faszikel werden sequenziell ausgerichtet, nicht auf der jeweils anderen (Abbildung 1, Einschub B). Die Arterienklemmen haben mit einer Markierung wurde bei 1,5 mm aus ihrer Spitze eingraviert. Der äußerste Teil des Ischias wird im Einklang mit dieser Marke vor dem Gedränge gebracht. Dies gewährleistet eine einheitliche Breite von Crush, und dass der Nerv nicht über die Backen der Zange hämostatischen verlängern, wenn abgeflacht aufgrund der Brechkraft. Wenn der Nerv erstreckt sich über die Zange Spitze der Nerv wird nur teilweise zerdrückt werden.
- Der Andrang ist senkrecht zu der Nerv bei 45 mm von der dritten Zehe gemacht, wie an einem Faden, der den Pfad des Ischiasnervs annähernd gemessen. Der Nerv wird einmal für 15 Sekunden bei 3 Klicks der Arterienklemmen zerquetscht. Es wird darauf geachtet nicht, um den Nerv zu dehnen. Wenn die Hämostaten sind wieder geöffnet, sollte der gesamte Nerv an der Stelle verknallt durchscheinend.
- Ein zweites Paar von hämostatischen Zange (identisch mit dem ersten), die zuvor in getauchterKohlepulver (Fisher Scientific, C272-500) wird verwendet, um das Gedränge vor Ort zu markieren. Der Nerv wird an der gleichen Stelle verknallt für 15 Sekunden bei 3 Klicks zerquetscht. Kein Kohlenstoff-Kennzeichnung sollte über die Grenze des ursprünglichen verknallt zu verlängern. Dies ist besonders wichtig, wenn genaue Kennzeichnung des Crush-Website erforderlich. Vor der Verwendung wird Kohlenstoffpulver durch Bestrahlung mit UV-Licht für zwei Stunden sterilisiert, und danach erfolgt unter Verwendung steriler Technik.
- Um Vortauche die Zange in Carbon, sondern schließt verbreitet Kohlenstoff an der Operationsstelle, die Zange in pulverisierter Kohle geöffnet sind, dann sanft geschlossen (aber nicht geklickt) geschlossen, und der Kohlenstoff an der Außenseite der Hämostaten wird mit steriler Gaze abgewischt . Die Zange werden unter mindestens 3-fache Vergrößerung, um sicherzustellen, dass die Brech-Oberflächen gleichmäßig in Kohlepulver beschichtet überprüft. Wenn nötig, werden sie wieder getaucht und abgewischt.
- Die Gesäßmuskulatur wird erneut abgelehnt und genäht in der gleichen Weise wie die Gegenseite.
- Schließlich wird die Haut Einschnitt geschlossen mit 9 mm-Reflex Clips (World Precision Instruments, 500.346; Applikator: 500.345). Wenn 9 mm Reflex Clips vorhanden sind, um eine Bewegung, kleiner Reflex Clips oder 6-0 Nähte (Roboz, SUT-1073-11) zu beschränken kann stattdessen verwendet werden.
3. Post-operative Betreuung
- Nach dem Eingriff werden die Tiere auf einem Heizkissen bei 37 ° C, bis sie Anzeichen für eine Bewegung zeigen.
- Sie werden dann zurück zu ihrem eigenen Käfig, wo Wasser und Nahrung sind leicht zugänglich auf dem Boden in Form von Hydrogel und benetzten Lebensmittel bewegt.
4. Semi-Thin Vorbereitung
- Nach einer Überdosis Pentobarbital (300 mg / kg) der Beinmuskulatur wird entfernt, um den Ischiasnerv * freizulegen. Mit den Nerv restlichen in situ, das Hinterviertel in 2% Paraformaldehyd und 2% Glutaraldehyd in 0,1 M Phosphatpuffer auf Eis für 30 Minuten eingetaucht.
* Wenn das Durchgehen whole mount Muskel-Präparat, sind die Muskeln Ernteed vor dem Freilegen der Ischiasnerv. - Der Nerv wird vorsichtig entfernt, mit darauf geachtet werden, nur dann transportieren, das proximale Ende. Dann wird der Nerv ist post-fixed im gleichen Fixativ für drei zusätzliche Stunden.
- Nach der Fixierung der Nerv wird dreimal in 0,1 M Phosphatpuffer gespült.
- Der Nerv wird in 2% Osmiumtetroxid in 0,1 M Phosphat-Puffer für eine Stunde eingetaucht.
- Der Nerv wird dann dehydratisiert durch sequentielle Eintauchen in zunehmend konzentrierten Ethanol (50%, 70%, 80%, 95%, 100%, 100%, 100%). Jedes Eintauchen beträgt 15 Minuten.
- Die entwässerte Nerv wird zweimal in Propylenoxid für je drei Minuten inkubiert.
- Dann wird der Nerv in einer 1:1-Mischung aus Propylenoxid eingetaucht und Einbetten 812 für mindestens 6 Stunden (in der Regel über Nacht).
- Dann wird der Nerv in einem 2:1-Gemisch aus Propylenoxid eingetaucht und über Nacht Integrieren 812.
- Schließlich wird der Nerv in reiner Einbinden 812 ist sechs Stunden lang eingetaucht, dann in der entsprechenden Form und ba eingebettetenked bei 60 ° C für 48 Stunden.
- 1,0 um Abschnitte werden von der distalen Nervenstumpf zu einem festgelegten Abstand von der Crush-Website mit einem Ultracut UCT Ultramikrotom (Leica) mit einem Glas Messer und mit Toluidinblau gefärbt geschnitten. Dünne Schnitte können auch zur Untersuchung der Ultrastruktur durch Elektronenmikroskopie hergestellt werden.
5. Whole mount Muskel-Präparat
- Erste Mäuse werden mit einer Überdosis Pentobarbital (300 mg / kg) getötet und die Hinterbeine sind an den Knien entfernt.
- Vier Muskeln in der hinteren Gliedmaßen sind zur Analyse entnommen: die tibialis anterior (TA), M. extensor digitorum longus (EDL), soleus und peroneus longus.
- Alle Muskeln werden über sorgfältig seziert und entfernt, und merken sich durch ihr Bindegewebe zu einem schwarzen Sylgard (Fisher Scientific, NC9492579) Schale mit Beschichtung. Sie werden in PBS gespült und dann in 4% Paraformaldehyd für 30 Minuten.
- Der TA wird dann in PBS gespült, in OCT (Fisher Scientific, 14-373-65), und schnell in ein Bad aus Aceton und Trockeneis eingefroren.
- Es wird bei -80 ° C für dünne Schnitte im Falle whole mount Präparat nicht gespeichert. Im Allgemeinen ist die TA zu dick für eine angemessene gesamte Halterungen.
- Die EDL, soleus und peroneus longus sind für 3 x 10 Minuten in PBS, in 0,1 M Glycin * (Fisher Scientific, AC12007-0010; verdünnt in PBS) gelegt für 30 Minuten gespült, gespült und 3 x 10 Minuten in PBS erneut. Sie werden dann in eiskaltem 100% Methanol genau 5 Minuten bei -20 ° C abgeschreckt, gespült 3 x 10 Minuten in PBS, und eingetaucht in fluoreszent konjugierten alpha-Bungarotoxin (1:200 verdünnt in PBS) für 30 Minuten. Die Muskeln wurden 3 × 10 Minuten in PBS, durch einen 1-Stunden-Block in 2% BSA (KPL, 50-61-00) und 0,2% Triton X-100 (Punkt Scientific GmbH, 9002-93-1) gespült in PBS * und über Nacht inkubiert, während Schütteln bei 4 ° C in einer Mischung aus primären Antikörper in der gleichen 2% BSA/0.2% Triton Block verdünnt.
* GLycine und Blockieren Lösungen basieren auf dem gleichen Tag wie Muskel Ernte auf, rührt 30-60 Minuten bei Raumtemperatur vor der Verwendung.- Um Axone und neuromuskuläre Synapsen zu markieren, verwenden wir eine Kombination aus einem monoklonalen Maus-Neurofilament Marker (Covance, SMI-312R; 1:1000 verdünnt), einem monoklonalen Maus-synaptischen Vesikel Marker (SV2 DSHB, verdünnt 1:1000) und Rhodamin konjugiert alpha -Bungarotoxin (Sigma-Aldrich, verdünnt 1:200). Um reaktive Schwann-Zellen markieren, verwenden wir Kaninchen-anti-GAP-43 (Novus Biologicals, NB300-143, verdünnt 1/500). Die primären Antikörper sichtbar gemacht mit einem IgG1 Subtyp-spezifischen Fluorescein-konjugiertem Ziege-anti-Maus-sekundären Antikörper und DyLight 649 konjugiertem Esel-anti-Kaninchen (Jackson ImmunoResearch, verdünnt 1:200).
- Am folgenden Tag werden die Muskeln in PBS für 3 × 10 Minuten lang gespült, gewaschen und in Sekundärantikörper 1:200 verdünnt (in 2% BSA/0.2% Triton Blockierungslösung). Sie werden dann 2 × 10 Minuten in PBS, fo gespültllowed von einem 5-minütigen Eintauchen in DAPI (Invitrogen, D3571, verdünnt auf 300 nM in VE-Wasser), und einem weiteren 10-Minuten in PBS spülen.
- Jeder Muskel wird dann auf einem schwarzen Sylgard (Fisher Scientific, NC9492579) beschichteten Petrischale präpariert. Zunächst werden die Sehnen an ihren Einbauplätzen in den Muskel entfernt, und dann werden die Muskeln verdünnt durch Abziehen Inneren Muskelfasern (3, Platten AC). Es wird darauf Außenfläche des Muskels, einschließlich der Endplatte Bänder (3, Platten DF) zu erhalten. Die daraus resultierenden Muskeln werden auf plus-Objektträger (Fisher Scientific, 12-550-15) mit Vectashield (Vector Laboratories, H-1000) und 22 x 40 mm montiert Deckgläsern (Fisher Scientific, 12 bis 548-5C) durch klaren Nagellack versiegelt auf beiden Seiten. Wenn sie richtig auf der Folie der Endplatte Band kontaktiert das Deckglas montiert.
6. Regeneration gemessen
- Die Regeneration kann in allen drei Muskeln (M. peroneus, EDL und Soleus) geschätzt werden. Wir haben oft abAmin Regeneration 14 Tage nach Nervenquetschungs, ein Zeitpunkt, an dem ein wesentlicher Prozentsatz der NMJ werden neu innerviert. Beide früheren und späteren Zeitpunkten sind auch geeignet, abhängig von der wissenschaftlichen Frage gebeten. In jedem Muskel, wird Re-Innervation des gesamten Endplatte Band untersucht. Nur en face Oberfläche NMJ werden ausgewertet. Auf diese Weise kann mindestens 200 NMJ pro Muskel schnell geprüft werden.
- Um Muskeln punkten Re-Innervation ermitteln wir einen "Re-Innervation ratio". Der Nenner ist die Anzahl der denervierten neuromuskulären Verbindungen wie von α-Bungarotoxin verbindlich und Schwann-Zell-GAP-43-Immunreaktivität beschriftet. Der Zähler ist die Zahl der Re-innervierten NMJ wie von neurofilament/SV2 Immunreaktivität beschriftet. Bei Bedarf kann NMJ als entweder teilweise (nicht vollständige Erfassung der α-Bungarotoxin von SV2) oder vollständig (eine vollständige Abdeckung von α-Bungarotoxin von SV2) re-innerviert klassifiziert werden. Beispiele für die re-innervierten und denervierten NMJ siehe Abbildung 3, Platten G und H.
7. Repräsentative Ergebnisse
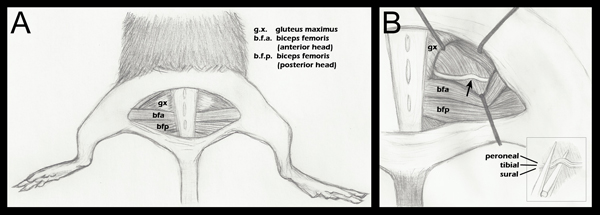
Abbildung 1. Schematische Darstellung der hinteren Extremität Anatomie wichtig, Nervenquetschungs. A. Eine halbkreisförmige Hautinzision gemacht worden Freilegung der darunterliegenden Muskulatur. B. Die Gesäßmuskulatur getrennt worden ist, und der Ischiasnerv offenbarte (Schritt 2.4). Ein Pfeil kennzeichnet den ungefähren Standort verknallt. Retractor Platzierung ist als allgemeine Richtlinie gezeigt, und wird während jeder Operation zur Visualisierung des Ischias-und Herangehensweise der Arterienklemmen für crush Leichtigkeit eingestellt B (kleines Bild):. Platzierung des Ischias am Unterkiefer der Arterienklemmen kurz vor verknallt (Schritt 2.5). Separate Faszikel sind beschriftet zu demonstrieren, dass sie benachbart sind horizontal, aber nicht vertikal, während das Gedränge. Obwohl drei fascicles in diesem Diagramm markiert sind, kann man auch sehen, einen vierten Faszikel, der Gelenkknorpel Zweig der fibularis. Für eine genauere anatomische Zeichnung der Verzweigung Muster des Ischiasnervs Faszikel distal der Crush-Punkt finden Sie in Greenes Anatomie der Ratte, 188 Abb. 17.
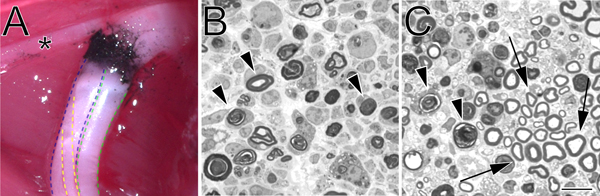
Abbildung 2. Ein Kohlenstoff-markierten Stelle verknallt in situ und Toluidinblau-gefärbten, Semidünnschnitten von zerkleinertem Ischiasnerv. A. Ein Beispiel für ein Gedränge vor Ort in situ (links hinteren Gliedmaßen). Schwarzer Kohlenstoff bezeichnet den Ort verliebt. Der Stern markiert einen Zweig des N. tibialis innerviert, die Oberschenkelmuskulatur und dient als nützlicher Orientierungspunkt während verknallt Chirurgie. Die tibiale Teilung der Ischiasnerv ist blau, die peronaeus in grün dargestellt, und die suralis in gelb. B. Semidünnschnitte demonstriert eine vollständige crush mit blutstillende Kraft durchgeführtps. C. Semidünnschnitte zeigt eine unvollständige crush mit abgewinkelten Pinzette durchgeführt. In beiden Bildern degenerierenden Myelin-Profile werden mit Pfeilspitzen markiert. In Panel C Pfeile markieren Beispiele erhalten Myelin-Profile und eine Gruppe von Axonen verschont. Scale-Bar ist 10 um.
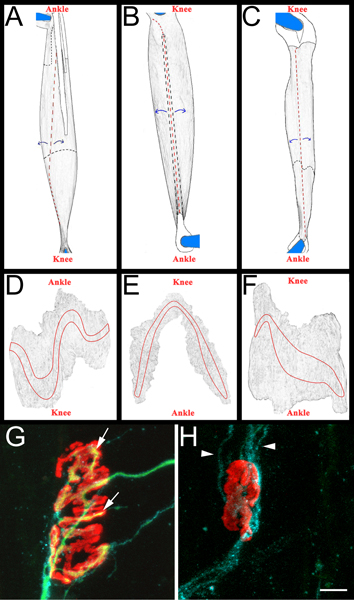
Abbildung 3 Whole mount Muskel schematische und Vertreter NMJ AC:.. Übertragen von Bildern EDL (A), Peronaeus longus (B) und soleus (C) Muskeln nach der Entnahme aus Hinterbein. Muskeln gezeigt, sind von rechts Hinterbein. Knie-und Sprunggelenk anatomische Orientierung sind auch als Referenz enthalten. Sehnen sind weiß und skizzierte in einem festen schwarzen Linie, wenn auf der Oberseite des Muskels positioniert. Sie sind in einer schwarzen gestrichelte Linie dargestellt, wenn sie unter dem Muskel erstrecken. Cuts sind rot gestrichelt dargestellt.Muskel wird vom Schnitt Stätten, wie durch blaue Pfeile gekennzeichnet geschält und anschließend ausgedünnt. Nach Durchforstung wird der Muskel von den Stiften, indem um das, was bleibt von den Sehnen merken sich getrennt DF:. Übertragen von Bildern whole mount Muskeln nach der Entfernung des Bindegewebes und die anschließende Verdünnung. Die Endplatte Bands werden an jedem Muskel skizziert GH:. Soleus whole mount Muskel 14 Tage nach dem Ischiasnerv Andrang demonstriert erneut innervierten (G) und denervierten (H) neuromuskulären Endplatten. In diesen Gremien sind NMJ, Axonen und Schwann-Zellen visualisiert werden, wie oben beschrieben im Abschnitt 5.5.1. Acetylcholin-Rezeptoren sind rot, grün Axone und Schwann-Zellen verarbeitet blau. In Feld G zeigen die Pfeile Bereichen der NMJ, die durch ein Axon wieder innerviert. Im Panel H Pfeilspitzen zeigen GAP-43 positive Schwann-Zell-Prozesse. Beachten Sie das Fehlen von Axonen. Scale-Bar ist 10 um.
Diskussion
Wir haben eine Methode, um eine komplette zuverlässig Ischiasnerv crush mit genauen Kennzeichnung des Crush-Site zu erhalten präsentiert. Wie bereits erwähnt, ist Ischiasnerv crush ein gemeinsames Modell der peripheren Nervenverletzungen bei Mäusen und Ratten. Obwohl jede Methode der Andrang hat seine Vorteile und Nachteile, fanden wir dieses Verfahren hergestellt werden eine komplette verknallt, die leicht mit einem Minimum an speziellen Geräten (zB spezielle Klemmen, etc.) gekennzeichnet war.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde vom NIH K08NS065157 Zuschüsse (bis TAF) Außerdem unterstützt wurde, das Penn Center für Erkrankungen des Bewegungsapparats, Auszeichnung Anzahl P30AR050950 vom National Institute of Arthritis, Muskel-Skelett unterstützt und Hautkrankheiten diese Arbeit (TAF und Steven S. Scherer). Schließlich unterstützt Shriners Pediatric Research Center Seed-Finanzierung (TAF) diese Arbeit. Wir danken Herrn Dr. Young-Jin Sohn für zunächst zeigen, daß der ganze Berg Verfahren und Amy A. Kim für ihre Unterstützung bei der Erstellung der Skizzen von Abbildung 1 zu bestätigen.
Materialien
| Name | Company | Catalog Number | Comments |
| Name (Beschreibung / Quantität) | Lieferant | Katalog-Nummer | |
| Mini Clipper mit Nr. 0000 Klinge | Roboz | RC-5903 | |
| Nair Haarentferner (9 oz.) | Kirche und Dwight Co., Inc. | N / A | |
| Betadine Surgical Scrub (1 Gallone) | Fisher Scientific | 19066452 | |
| Augensalbe (1 Unze) | Fisher Scientific | 19082795 |
Chirurgische Werkzeuge:
| Name (Beschreibung / Quantität) | Lieferant | Katalog-Nummer |
| FST 250 Hot Wulst Sterilisator | Fine Science Tools | 18000-45 |
| Iris Schere (11 cm lang) | World Precision Instruments | 500216 |
| Potts-Smith Pinzetten (Straight; 18cm; 1x2 Zähne) | Fine Science Tools | 11024-18 |
| McPherson-Vannas Schere (5 mm Klingen) | World Precision Instruments | 14.124-G |
| Dumont Nr. 5 Pinzetten - Dumoxel Standard Spitze | Fine Science Tools | 11252-30 |
| Dumont # 5/45 Pinzetten - Dumoxel Standard Spitze | Fine Science Tools | 11251-35 |
| Ultra Fine Hämostyptika (Straight, glatten Innenflächen) | Fine Science Tools | 13020-12 |
| Pulver-Aktivkohle (500 g) | Fisher Scientific | C272-500 |
| Größe 6-0 Nahtmaterial mit C-1 Nadel (steril, Seide, schwarz, geflochten,Nicht-resorbierbare, 18 "Länge, Box of 36) | Roboz | SUT-1073-1011 |
| Reflex Clip-Applikator (für 9 mm-Clips) | World Precision Instruments | 500345 |
| 9mm Edelstahl Reflex Clips (100/Schachtel) | World Precision Instruments | 500346 |
Animal Care:
| Name (Beschreibung / Quantität) | Lieferant | Katalog-Nummer |
| 0,9% Natriumchlorid-Injektion (ohne Konservierungsmittel, 20 mL) | Hospira | 0409-4888-20 |
| Komplette homöothermen Blanket-System mit flexibler Sonde (Medium, 115 VAC, 60 Hz) | Harvard Apparatus | 507222F |
Chirurgische Platform und Retraktoren:
(Gekauft bei örtlichen Baumarkt)
| Name (Beschreibung /) | Menge |
| Edelstahl-Plattform (gefräst; ~ 12 "x12" x1 / 8 ") | 1 |
| Button-Magnete (Beispiel: Eclipse E825) | 3 |
| Edelstahlschrauben (3 "Long; Durchmesser von Knopfmagnete Entschlossen) | 3 |
| Edelstahlmuttern (Sized zu Bolts Fit) | 9 |
| Gummibänder (Light Tension) | 3 |
| Insekten-Pins (beide Enden gebogen, um Haken zu bilden) | 3 |
Semi-Hauchdünn:
| Name (Beschreibung / Quantität) | Lieferant </ Strong> | Katalog-Nummer |
| Paraformaldehyd (1 kg) | Sigma-Aldrich | P6148-1KG |
| Wasserfreies Dinatriumhydrogenphosphat (500 g; verwendet, um Phosphatpuffer vorbereiten) | Fisher Scientific | S375-500 |
| Mononatriumphosphat wasserfrei (1 kg; verwendet, um Phosphatpuffer vorbereiten) | Fisher Scientific | AC38987-0010 |
| Glutaraldehyd (50%, 10 × 10 ml) | Ted Pella, Inc. | 18431 |
| Osmiumtetroxid (4% igen wässrigen, 10 x 10 ml) | Ted Pella, Inc. | 18465 |
| Propylenoxid (450 ml) | Ted Pella, Inc. | 18601 |
| Embed 812 (Kit, für harte Blöcke / hohen Bildkontrast) | Electron Microscopy Sciences | 14120 |
| Toluidine Blau (25 g) | Ted Pella, Inc. | 19451 |
Whole mount Muskel-Präparat und Immunhistochemie:
| Name (Beschreibung / Quantität) | Lieferant | Katalog-Nummer |
| Paraformaldehyd (1 kg) | Sigma-Aldrich | P6148-1KG |
| Wasserfreies Dinatriumhydrogenphosphat (500 g; verwendet, um Phosphatpuffer vorbereiten) | Fisher Scientific | S375-500 |
| Mononatriumphosphat wasserfrei (1 kg; verwendet, um Phosphatpuffer vorbereiten) | Fisher Scientific | AC38987-0010 |
| 10% BSA Diluent / Blocking Solution (200 ml) | Kirkegaard & Perry Laboratories, Inc. | 50-61-00 |
| Triton X-100 (100 ml) | Dot Scientific Incorporated | 9002-93-1 |
| Glycin, 98% (1 kg) | Fisher Scientific | AC12007-0010 |
| Tissue-Tek Cryo-OCT-Verbindung (Urteil vom 12, 4 Unzen-Flaschen) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (£ 2 Kit) | Fisher Scientific | NC9492579 |
| Edelstahl Insektennadeln, Größe 1 (100 St.) | Fine Science Tools | 26001-40 |
| Tetramethylrhodamin-A-Bungarotoxin (0,5 mg) | Sigma-Aldrich | T0195-.5MG |
| Maus monoklonaler Antikörper gegen SMI-312 (0,1 ml) | Covance | SMI-312R |
| Maus monoklonaler Antikörper gegen SV2 (0,1 ml) | Developmental Studies Hybridoma Bank (DSHB) | SV2 |
| Kaninchen Polyklonale Antikörper gegen GAP-43 | Novus Biologicals | NB300-143 |
| Fluorescein konjugierten Ziege anti-Maus IgG, Fc &ggr; Unterklasse 1. Spezifisches | Jackson ImmunoResearch | 11 5-095-205 |
| DyLight 649 konjugiertem Esel-anti-Rabbit IgG | Jackson ImmunoResearch | 711-495-152 |
| 4 ',6-Diamidino-2-phenylindol (DAPI, dilactate, 10 mg) | Invitrogen | D3571 |
| Vectashield Eindeckmedium (10 ml) | Vector Laboratories | H-1000 |
| Superfrost Plus Mikropräparate (Weiß, Größe: 75 x 25 mm; Packung mit 144) | Fisher Scientific | 12-550-15 |
| Fisherfinest Premium-Deckgläser (Größe: 40 x 22 mm; Packung mit 1 Unze) | Fisher Scientific | 12 bis 548-5C |
Referenzen
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten