Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Immunhistologische Markierung von Mikrotubuli in Sensory Neuron Dendriten, Tracheen und Muskeln in der Drosophila Larva Körperwand
In diesem Artikel
Zusammenfassung
Um zu verstehen, wie komplex Zelle Formen, wie neuronalen Dendriten, während der Entwicklung erreicht werden, ist es wichtig, in der Lage sein, genau Assay Mikrotubuli Organisation. Hier beschreiben wir eine robuste immunhistologische Markierung Methode, um Mikrotubuli Organisation von dendritischen Verzweigung Neuron sensorischen Dendriten, Luftröhre, Muskeln zu untersuchen, und andere Drosophila Larve Körperwand Gewebe.
Zusammenfassung
Um zu verstehen, wie sich Unterschiede in komplexen Zelle Formen erreicht werden, ist es wichtig, genau zu verfolgen Mikrotubuli Organisation. Die Drosophila Larve Körper Wand enthält verschiedene Zelltypen, die Modelle, um Zellen und Gewebe Morphogenese Studie sind. Zum Beispiel Tracheen werden verwendet, um Rohr Morphogenese 1, und die dendritische Verzweigung (DA) sensorischen Neuronen der Drosophila Larve zu einem primären System für die Aufklärung der allgemeinen und Neuron-Klasse-spezifische Mechanismen der dendritischen Differenzierung 2-5 und Degeneration 6 prüfen .
Die Form der Dendriten Niederlassungen erheblich variieren kann zwischen Neuron Klassen und sogar zwischen verschiedenen Niederlassungen eines einzelnen Neurons 7,8. Genetische Studien in DA Neuronen lassen vermuten, dass Differential Zytoskelett-Organisation kann morphologischen Unterschiede in dendritische Verzweigung Form 4,9-11 zugrunde liegen. Wir bieten eine robuste immunologische Kennzeichnung Methode, um einessay in vivo Mikrotubuli Organisation in DA sensorischen Neurons Dendriten Laube (Abbildungen 1, 2, Movie 1). Dieses Protokoll zeigt die Zerlegung und Immunfärbung des ersten Stadiums Larve, eine Bühne, wenn sie aktiv sensorischen Neurons Dendriten Auswuchs und Verzweigung Organisation auftritt 12,13.
Neben Färbung sensorischen Neuronen erreicht diese Methode robust Kennzeichnung von Mikrotubuli Organisation in den Muskeln (Filme 2, 3), Luftröhre (Abbildung 3, Movie 3), und andere Körperteile Wand Gewebe. Es ist für die Ermittler wollen Mikrotubuli Organisation in situ Analyse in die Wand des Körpers bei der Untersuchung von Mechanismen, die wertvolle Kontrolle von Geweben und Zellen zu gestalten.
Protokoll
1. Vorbereitung der Reagenzien
Hinweise vor Beginn: Dissection und immunhistochemische Färbung sind in einem magnetischen Kammer durchgeführt und die Larve sich mit speziell geformten Insektennadeln merken. Detaillierte Anweisungen für den Bau eines magnetischen Kammer und Vorbereitung dieser Stifte können in Zusammenhang mit Verweisen 14,15 gefunden werden. Kurz gesagt, ist ein 1x1cm quadratisches Loch in ein magnetisches Blatt und einem Deckglas angebracht auf der Rückseite des Blattes in eine kleine Kammer zu schneiden. Die Seiten der Kammer sind mit Epoxy-Kleber versiegelt; nach dieser Leim abgebunden hat die Kammer mehrmals mit 70% Ethanol vor Gebrauch gewaschen werden. Dissection Insekten Pins sind durch Biegen in die gewünschte Form hergestellt und anschließend verklebt auf eine Metall-Reiter 14,15. Alternativ zu einem Metall-Reiter haben wir ein umgekehrtes Flat-Head Stahl Reißzwecke mit einem Handgriff von einem cut-off gelben Spitze gemacht werden. Die Nutzung dieser magnetische Kammer Anordnung ermöglicht genaue Kontrolle over pin Positionierung und Gewebe Stretching beim Präparieren.
Zum Antrieb der Reportergen-Expression in den verschiedenen Untergruppen der DA Neuronen Ermittler können mit mehreren verschiedenen Gal4-Linien (zusammengefasst von Shimono und Kollegen 16). Viele dieser Linien sind aus dem öffentlichen Lager-Zentren zur Verfügung. In dieser repräsentativen Protokoll führen wir Immunfärbung einer Zeile, in der zwei gegensätzliche Klassen von DA Neuronen sind Co-markierten: die einfachste Klasse I und komplexeste Klasse IV (P10-Gal4 17,18, UAS-mCD8: Kusabira-Orange (KO)).
- Bereiten Ca + +-freien HL3.1 Kochsalzlösung
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 Saccharose und 5 Trehalose; pH 7.2 19. Filter-sterilisiert und bei 4 ° C. Hinweis: Ca + +-freier Lösung verhindert Muskelkontraktion beim Präparieren.
- Bereiten Sie 2x PHEM Puffer
- In mM: 130 PIPES, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filter-sterilisiert und bei 4 ° C.
Hinweis: Diese Materialien werden nicht auflösen, bis der pH-Wert nähert 7,0.
- In mM: 130 PIPES, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filter-sterilisiert und bei 4 ° C.
- Bereiten Sie das Fixativ frisch unmittelbar vor der Fixierung.
- Um eine 25ml Lösung, erste Mix 2g Paraformaldehyd, 100 &mgr; l 1M NaOH und 10 ml Wasser in einem 50 ml-Falcon-Röhrchen vorbereiten.
- Schütteln Sie in einem 55 ° C Wasserbad mit Schüttler Fixativ, bis die Lösung klar ist. (Gesamtvolumen wird bei etwa 11,5 ml sein.)
- Coole Fixativ auf Eis.
- Add 12.5ml 2x PHEM Puffer.
- Der pH-Wert auf 7,0 mit 1 M HCl.
- Füllen Sie die Lösung mit Wasser, bis das Volumen ist 25ml.
- Filtern Sie die Lösung mit Whatman-Papier.
2. Larven Dissektion
Beachten Sie vor Beginn: Mikrotubuli-Netzwerke und insbesondere in sensorischen Dendriten, werden Zusammenbruch rasch nach Beginn der Dissektion. Achieving schnelle Zerlegung in weniger als fünf Minuten durch eine sofortige Fixierung gefolgt sind Schlüsselfaktoren für den Erfolg dieses Protokolls.
- Waschen Sie die Larve im Wasser schnell und verschieben Sie sie in dieser Rückgang mit einer Schleife des Haares.
- Orient die Larve dorsal und ventral auf dem Glas. Hinweis: Diese Orientierung ist die ventrale Cluster Neuronen zu untersuchen. Um zu untersuchen, dorsalen Cluster Neuronen, invertieren die Orientierung.
- Verwenden Sie das Zentrum Insekten-polig auf dem vorderen Ende in der Nähe der Mündung Haken pin. Legen Sie den Stift kurz vor dem Ende für die besten Ergebnisse.
- Geben Sie einen Tropfen Kochsalzlösung HL3.1 in der Sektion Kammer.
- Schneiden Sie das sehr hinteren Spitze der Larve off mit Mikroschere. Hinweis: Dieser Schritt eröffnet eine Öffnung am hinteren Ende der Larve, die den Zugang für die Mikroschere (Schritt 2,7) ermöglichen wird.
- Schnappen Sie mit der Zange der Region gut, dass jetzt Stossen ist aus der Öffnung am hinteren Ende der Larve. Ziehen Sie die gesamte Darm.
- Legen Sie dieSpitze von einem Blatt der Mikroschere durch die Öffnung und entlang der ventralen Mittellinie in Richtung der vorderen.
- Mit der Ecke Stifte, Bolzen der nun freien Ecken, posterior, dann anterior. Gleichzeitig sanft dehnen öffnen Sie die Larven Filet.
3. Fixation, Sperrung, Färbung und Montage von Larven Filets
Hinweise vor Beginn: Alle Fixierung und Färbung Schritte werden in der Sektion Kammer durchgeführt. Während dieses Prozesses darauf achten, nicht das Insekt Stifte halten die Larve, da dies zu Gewebeschäden führen kann klopfen. Um zu verhindern, das Experiment vor dem Austrocknen, das tut alles Färbeschritte in eine kleine Tupperware Behälter befeuchtet Gewebe umgeben.
- Saugen Sie das Ca + +-freien HL3.1 Puffer unter Verwendung eines gelben Spitze. Unmittelbar fügen Sie die Fixiermittel mit einem anderen pipetteman.
- Gently Pipette auf und ab, um das Fixiermittel mit den restlichen Spuren von Ca + +-freien HL3.1 Puffer-Mixin der Kammer. Unmittelbar absaugen und dann fügen Sie frisches Fixativ in die Kammer.
- Inkubieren bei Raumtemperatur für 20 Minuten.
- Wash 6x 10 Minuten in PBST (0,1% Triton X-100 in PBS).
- Block mit 5% Ziegenserum in PBST für 20 min bei RT.
- Ersetzen Sie die Blocking-Lösung mit primärem Antikörper in 5% Ziegenserum in PBST verdünnt. Die primären Antikörper verwendet werden Maus-anti-α-Tubulin (DM1A) und Ratte anti-CD8 (5h10), beide verdünnt 1 / 1000.
Hinweis: Der Prüfer kann wollen Maus-anti-α-Tubulin (DM1A) mit Maus-Anti-futsch (22C10) 20,21 verdünnt 1 / 1000 unter bestimmten Umständen ersetzt (siehe Diskussion).
- Inkubieren über Nacht (mindestens 16h) bei 4 ° C.
- Wash 6x 10 Minuten in PBST.
- Add sekundären Antikörper-Lösung in 5% Ziegenserum in PBST verdünnt. Die sekundären Antikörper verwendet werden, Alexa Fluor 488 Ziege anti-Maus IgG und Cy3 donkey anti-Ratte-IgG. Halten Sie die Probe abgedeckt, um zu verhindern FluorophorFoto-Bleiche 22.
- Inkubieren entweder bei RT für 2 Stunden oder über Nacht bei 4 ° C eine Stunde bei Raumtemperatur.
- Wash 6x 10 Minuten in PBST.
- Setzen Sie den Larven Filet auf der Folie Nagelhaut-Seite nach unten, in 80% Glycerin montieren und Dichtung den Seiten des Deckglases mit Nagellack für einen "schnellen" zu montieren.
Hinweis: Für eine verbesserte Gewebe Lichtung, und eine dauerhafte stabile Probe, mount in DPX wie bisher 23 beschrieben.
4. Repräsentative Ergebnisse:
Fluoreszenzfärbung wurde unter einem konfokalen Mikroskop untersucht. In den Abbildungen 1-2, verschiedene Zweige innerhalb eines Dendriten Laube haben verschiedene Zytoskelett-Organisation. Abbildung 1 zeigt einen Bereich der Laube einer Klasse IV DA Neuron bei der 1. Larvenstadium Larvenstadium. Die ganze Laube ist mit mCD8 markiert:: KO erkannt und mit einem Anti-CD8-Antikörper und fluoreszierende sekundäre (Cy3). Tubulin wird unter Verwendung anti α-Tubulin-Antikörper und Fluorescent sekundären (Alexa Fluor 488). Die wichtigsten Branchen sind für Tubulin positiv, einige dünne Seitenäste Tubulin-negativ. Movie 1 ist eine Reihe von seriellen Schnitten durch eine ähnliche Färbung einer Klasse-I-DA Neurons. Abbildung 2 zeigt einen Bereich der Laube einer Klasse IV DA Neuronen mit Antikörpern gegen futsch und CD8 an der 1. Larvenstadium Larvenstadium gefärbt. Die wichtigsten Branchen sind futsch-positiv, einige dünne Seitenäste futsch-negativ. Abbildung 3. Tracheen in der larvalen Körper Wand zeigen eine komplexe Mikrotubuli Organisation. Filme 2 und 3 zeigen Schnittserien der Färbung durch Körperwand Muskeln und Luftröhre.
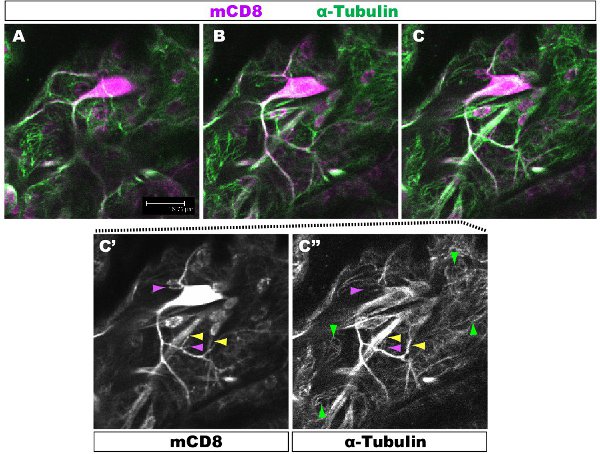
Abbildung 1. Abb.. 1 zeigt eine Region von der Laube einer Klasse IV DA Neuron bei der 1. Larvenstadium Larvenstadium. : Die ganze Laube ist mit mCD8 gekennzeichnet: KO erkannt und mit anti-CD8-Antikörper und fluoreszierende sekundäre (Cy3). Tubulin wird unter Verwendung anti-&-Tubulin Antikörper und fluoreszierende sekundäre (Alexa 488). Panels AC sequentielle konfokalen z-Abschnitte (0,5 um), C'-C ", single Antikörper-Färbung von Feld C Beispiel von Ästen mit einem (gelbe Pfeilspitze) oder ohne (lila Pfeil) Mikrotubuli sind hervorgehoben. Roten Pfeile markieren Mikrotubuli in der zugrunde liegenden Epithelzellen.
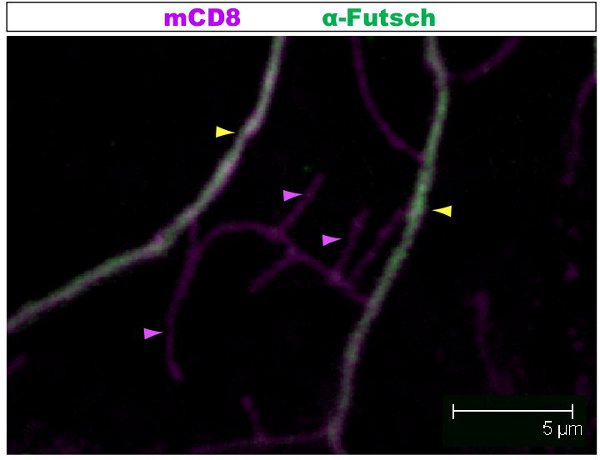
Abbildung 2. Abb.. 2 zeigt eine ähnliche Region von der Laube einer Klasse IV da Neuron mit Antikörpern gegen futsch und CD8 an der 1. Larvenstadium Larvenstadium gefärbt. : Die ganze Laube ist mit mCD8 gekennzeichnet: KO erkannt und mit anti-CD8-Antikörper und fluoreszierende sekundäre (Cy3). Futsch erkannt wird mit anti-futsch-Antikörper und fluoreszierende sekundäre (Alexa 488). Die wichtigsten Branchen sind futsch-positiv, einige dünne Seitenäste futsch-negativ. Beispiel für Branchen mit (gelbe Pfeilspitze) oder ohne (lila Pfeil) futsch sind hervorgehoben.
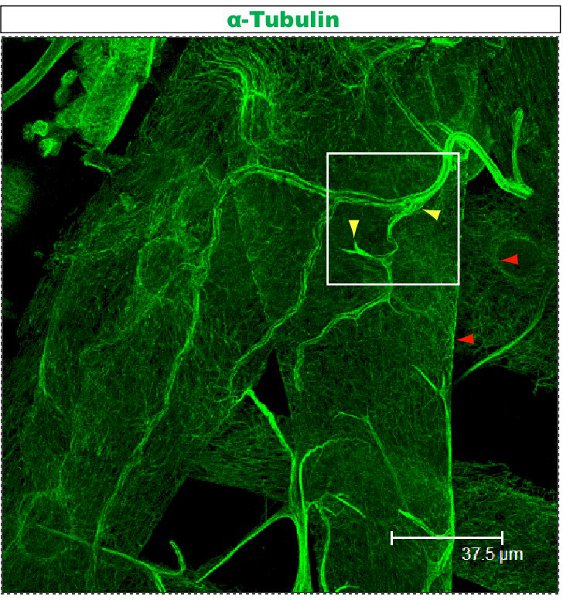
Abbildung 3. Trachea befleckt mit dem anti-Tubulin-Protokoll beschrieben. Diese Larve ist der dritte Larvenstadium und seziert wie zuvor 23,24 beschrieben. Movie 3 zeigt vergrößert Schnittserien aus dem Bereich von einem Quadrat markiert.
Movie 1. Serienschnitte Tracing Tubulin-Färbung in der dendritischen Dorn einer Klasse I Neuron. Die ganze Laube ist mit mCD8 markiert:: KO (Magenta) erkannt und mit anti-CD8-Antikörper und fluoreszierende sekundäre (Cy3). Tubulin (grün) wird unter Verwendung eines Anti-α-Tubulin-Antikörper und fluoreszierende sekundäre (Alexa Fluor 488). Maßstab: die eine Seite des Videobildes entspricht 46.88μm im Abschnitt. Klicken Sie hier, um sich den Film anzusehen.
Movie 2. Serienschnitte Tracing Tubulin-Färbung in body Wand Muskeln eines dritten Larvenstadium Larve. Tubulin wird unter Verwendung anti-α-Tubulin-Antikörper und fluoreszierende sekundäre (Alexa Fluor 488). Maßstab: die eine Seite des Videobildes entspricht 46.88μm im Abschnitt. Klicken Sie hier, um sich den Film anzusehen.
Movie 3. Serienschnitte Tracing Tubulin-Färbung in einer Körperwand Luftröhre eines dritten Larvenstadium Larve, mit einem quadratischen in Abbildung 3 markiert. Tubulin wird unter Verwendung anti-α-Tubulin-Antikörper und fluoreszierende sekundäre (Alexa Fluor 488). Maßstab: die eine Seite des Videobildes entspricht 46.88μm im Abschnitt. Klicken Sie hier, um sich den Film anzusehen.
Diskussion
Um zu verstehen, wie komplex Zellformen sind es erreicht ist wichtig in der Lage sein, genau Assay Mikrotubuli Organisation. Hier beschreiben wir eine robuste immunhistologische Markierung Methode Assay Mikrotubuli Organisation von dendritischen Verzweigung Neuron sensorischen Dendriten. Neben Färbung sensorischen Neuronen erreicht diese Methode robust immunhistologische Färbung der Luftröhre, Muskeln und andere Körperteile Wand Gewebe.
Wir verwenden dieses Protokoll, um Mikrotubuli Orga...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir bedanken uns bei RIKEN für die Finanzierung. P10-Gal4 war eine Art Geschenk Alain Vincent (Université Paul Sabatier, Toulouse, Frankreich).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog Anzahl | Kommentare (Optional) |
|---|---|---|---|
| Zange | Dumont | 11251-20 | |
| Mikroschere | FST | 15000-08 | |
| Maus anti-α-Tubulin (Clone: DM1A) | Sigma | T9026 | Verdünnung 1 / 1000 |
| Maus anti-futsch (Clone: 22C10), Überstand | Entwicklungsbiologie Studium Hybridoma der Bank | 22C10 | Verdünnung 1 / 1000 |
| Rat anti-CD8 (Klon: 5h10) | Caltag | MCD0800 | Verdünnung 1 / 1000 |
| Alexa Fluor 488 Anti-Maus-IgG | Invitrogen | A-11001 | Verdünnung 1 / 500 |
| Cy3 anti-Rat IgG | Jackson Immunoresearch | 712-166-150 | Verdünnung 1 / 200 |
Referenzen
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten