Method Article
Der Ausarbeitung der einzelnen Drosophila Ei Chambers für Live-Imaging
In diesem Artikel
Zusammenfassung
Die Drosophila Ei Kammer ist ein ausgezeichnetes Modell für die Erforschung der Mechanismen der mRNA-Lokalisierung. Um die dynamische Ereignisse, die die Prozesse der Lokalisierung untermauern zu erfassen, ist eine schnelle hochauflösende Bildgebung von lebendem Gewebe erforderlich. Hier präsentieren wir ein Protokoll für die Präparation und Bildgebung von Live-Proben mit minimalen Unterbrechungen.
Zusammenfassung
Live Cell Imaging ist eine wichtige Technik angewendet, um eine Reihe von Drosophila Gewebe als Modelle verwendet, um Themen wie Achsen-Spezifikation, die Zelldifferenzierung und Organogenese 1 zu untersuchen. Richtige Vorbereitung der experimentellen Proben ist ein wichtiger, jedoch oft vernachlässigte Schritt. Das Ziel der Vorbereitung ist es, physiologische Relevanz zu gewährleisten und optimale Aufnahmebedingungen zu schaffen. Um die Lebensfähigkeit des Gewebes zu erhalten, ist es entscheidend zu Dehydratation, Hypoxie, Überhitzung oder Verschlechterung Medium 2 zu vermeiden.
Die Drosophila-Ei Kammer ist ein gut etabliertes System zur Prüfung von Fragen im Zusammenhang, aber nicht beschränkt, um Körper Musterung, mRNA Lokalisation und Organisation des Zytoskeletts 3,4. Für Early-und Mid-Stage Ei Kammern, die Montage in Halocarbonöl ist gut für das Überleben, dass es freie Diffusion von Sauerstoff ermöglicht, verhindert das Austrocknen und Hypoxie und verfügt über hervorragende optische Eigenschaften für die Mikroskopie. ImAlterung der fluoreszierenden Proteinen besteht in der Einführung von Transgenen in das Ei Kammer oder physikalische Injektion von markierten RNA-, Protein oder Antikörper 5-7 möglich. Zum Beispiel erlaubt die Aufnahme MS2 Konstrukte in das Genom von Tieren Echtzeit-Beobachtung von mRNAs in der Eizelle 8. Diese Konstrukte können für in vivo-Markierung von mRNA durch Nutzung des MS2-Bakteriophagen-RNA-Stammschleife Interaktion mit dem Hüllprotein 9.
Hier präsentieren wir ein Protokoll für die Extraktion von Eierstöcken sowie Isolierung einzelner Ovariolen und Ei Kammern aus der weiblichen Drosophila. Für eine detaillierte Beschreibung von Drosophila Oogenese siehe Allan C. Spradling (1993, neu aufgelegt 2009) 10.
Protokoll
1. Drosophila Vorbereitung vor für die Dissektion (nach E. Gavis, Princeton University)
- Entsorgen Sie die Erwachsenen von einer spärlich gesät Flasche und übertragen Sie die Flasche bis 25 ° C im Vorfeld des Experiments. Sobald neue Erwachsenen begonnen haben, zu entstehen, zwei Tage warten.
- Nehmen Sie ein Fläschchen mit Fliege ca. 10ml von fester Nahrung und fügen 0,5-0,7 Gramm Trockenhefe (siehe Tabelle) auf einem 45 Grad Winkel. Bedecken Sie nicht die ganze Oberfläche der Fliege Essen mit Hefe.
- Fügen Sie einige Tropfen von Wasser auf die Hefe, die ausreicht, um Hydrat (Abbildung 1A). Stellen Sie die Durchstechflasche bei 45 Grad und lassen Sie ca. 3 Minuten für die Hefe, um das Wasser aufzusaugen (Abbildung 1B).
Hinweis: Alternativ Vormischung eine Hefe in einem separaten Behälter Paste zermahlen und die Paste in das Fläschchen mit einem Spatel.
- Betäuben die Fliegen in der Ampulle durch Injizieren von CO 2-Gas. Wenn sie aufhören zu bewegen, kippen die unbewussten Fliegen auf den CO 2 Fly-Pad für die Sortierung (Abbildung 1C).
- Isolieren 10-15 Frauen und 5 Männer des gewünschten Genotyps unter einem Binokular mit einer feinen Spitze Pinsel (Abbildung 1D). Männer sind offensichtlich durch die Anwesenheit von claspers, eine dunkle hervorstehenden Struktur, an ihren hinteren.
- Fügen Sie ausgewählt fliegt in die Hefekuchen mit Fläschchen (1E). Platz bei 25 ° C für 24-60 Stunden. Inkubieren Sie für kürzere Zeiträume für eine größere Prozent der jungen bis mittleren Stadium Ei Kammern und längere Zeiträume für Spätstadium Eikammern.
2. Drosophila Ovar Dissektion
- Setzen Sie einen kleinen Tropfen auf einem Halocarbonöl Nr. 1.5, 22 x 50 mm Deckglas (Abbildung 2A). Stellen Sie die vorbereitete Deckglas der Seite, wo es nicht im Weg sein.
- Betäuben die Fliegen in der Hefekuchen mit abscheulichen durch Injektion von CO 2-Gas und Spitze auf eine CO 2-Pad.
- Scharfe feine Nase Zange zu greifen eine individuelle gemästet am Vorderrand des Bauches weiblich (nicht zwischen the Abdomen und Thorax) (2B-C).
- Halten Sie das Weibchen mit der Zange und sehen unter einem Binokular, etwa 2-3 cm oberhalb der vorbereitete Deckglas.
- Noch Halten auf der vorderen, mit einem zweiten Satz von Zangen, um das Gewebe am äußersten hinteren Ende des weiblichen (2D) zu entfernen. Hinweis: Darmgewebe wird in der Regel ziehen Sie mit dem hinteren Ende. Wischen Sie die entnommene Gewebe aus der Zange.
- Während Sie noch die der weiblichen an der vorderen, verwenden Sie die Zange abgewischt, um sanft drücken oder massieren den Bauch, arbeitet vom vorderen zum hinteren. Massieren das Abdomen in der gleichen Weise wie das Entfernen Zahnpasta aus dem Ende einer Röhre.
- Zwei große opake Strukturen aus dem Bauch und Stick auf dem Ende der Zange (2E-F) geschoben werden kann. Dies sind die gepaarten Eierstöcke.
- Tippen Sie auf die Eierstöcke auf die Halocarbonöl auf der Folie unten.
- Wiederholen Sie die Dissektion 1-2 Mal um insgesamt 6.4 Eierstöcke im Öl auf dem Deckglas geben (Figure 2G).
3. Isolating Ovariolen
Hinweis: Jeder Eierstock enthält ca. 16 bis Ovariolen mit 6 bis 10 Eikammern der verschiedenen Stufen, wie Perlen auf einer Schnur 10 angeordnet hat.
Hinweis: Vor der Isolierung der Ovariolen, passen Sie die Lichtquelle auf der Seziermikroskop so dass das Licht angestrahlt in einem flachen Winkel auf die Probe. Man erhält Gegensatz zu der Probe und erlaubt die Visualisierung der jungen Stadium Eikammern.
- In der Öl-, trennen Sie die beiden Eierstöcke durch Entfernen des Bindegewebes am hinteren Ende (alte Stufen) mit geschlossener Zange (Abbildung 3A).
- Orient eine individuelle Eierstock mit der ältesten Bühnen zur linken und jüngste Stufe nach rechts. Die junge Bühne Eikammern im Eierstock sind transparent und bilden die mehr spitze Ende des Eierstocks.
- Mit einer Pinzette in der dominanten Hand, sanft fassen Sie den hinteren eines Eierstocks, vorzugsweise durch den Überresten the Bindegewebe. Halten Sie den Eierstock an Ort und Stelle mit der Zange, verwenden Sie ein Sezieren Sonde (oder Wolfram-Nadel), um herauszuarbeiten, individuelle Ovariolen (3B-D).
Hinweis: Einzelne Ovariolen wird zwischen den jungen Stadien (Germarium bis 10-Stadium) zu brechen, wie die älteren Stadien zu groß, um aus der vollständigen Eierstock getrennt werden sollen.
Hinweis: Punktieren einer späten Phase Eizelle mit dem Sezieren Sonde wird im Zytoplasma in das auslaufende Öl führen und das Herauslösen einzelner Ovariolen sehr anspruchsvoll. Wenn ein Spätstadium Eizelle punktiert wird, zu einem frischen Eierstock bewegen.
- Sobald die Ovariole ist frei von dem Eierstock, verwenden Sie die Sonde sezieren, um es im Zentrum der Öltropfen und Orient in der gewünschten Orientierung für das Experiment ziehen. Hinweis: Ovariolen in Öl absetzen und sich an das Glas.
- Wiederholen Sie diesen Vorgang (3,3-3,4), bis es 15 bis 25 einzelnen Ovariolen sind. Hinweis: Dies kann die Dissektion der MULTIP erfordernle Eierstöcke. Der ganze Vorgang sollte weniger als 15 Minuten.
Hinweis: Es ist ratsam, einen Eierstock jeweils aus mehreren Fliegen anstatt Sezieren beide Eierstöcke von weniger Fliegen, um die n Anzahl der Fliegen für das Experiment zu erhöhen sezieren.
Hinweis: Durch eine grobe Behandlung der Ovariole wird in ungesunden Eizellen führen und kann zu Artefakten im Experiment führen.
Hinweis: Die Oocyten beginnt phänotypische Veränderungen aufgrund bis 40 Minuten nach dem aus dem Eierstock (vergleiche 7E bis F) seziert betonen anzuzeigen.
- Sobald Ovariolen in einer angemessenen Orientierung (Abbildung 3E) sind, verwenden Sie das Sezieren Sonde und geschlossenen Pinzette, um überschüssige Eierstockgewebe um aus dem Öl. Dieses Material kann von der Zange auf ein Papiertuch abgewischt werden.
4. Isolierung einzelner späten Stadium Ei Kammern (Nach E. Gavis, Princeton University)
- Mit einer Pinzette in der Dominant der Hand, fassen Sie die hinteren eines isolierten Eierstock, vorzugsweise von den Resten des Bindegewebes. Halten Sie den Eierstock an Ort und Stelle mit der Zange, führen das Sezieren Sonde in das hintere Ende des Eierstocks in der Nähe der Zange (Abbildung 4A). Vermeiden Sie jegliche Punktierung Ei Kammern, die durch Einführen der Sonde zwischen späten Stadium Ei Kammern.
- Ziehen Sie die Nadel durch das Sezieren Eierstock bis zum Austritt in einem frühen Stadium Ei Kammern (Abbildung 4B). Wenn es richtig gemacht, wird die Sonde entfernen Sie das Bindegewebe hält die Ovariolen und Spätstadium Eikammern an Ort und Stelle.
- Wiederholen Sie Schritt 4,2, bis die Ovariolen auf dem Deckglas verteilt sind. Hinweis: Bei der Ei-Kammern nicht mehr auf übereinander gestapelt werden, ist dieser Schritt abgeschlossen.
- Mit dem Sezieren Sonde, trennen Sie die Eizellen zu spät für eine einfache Bildgebung (4C) zu ermöglichen.
Hinweis: Eine Punktion eine Eizelle während Sezieren späten Stadium Ei Kammern ist nicht so verurteilen, wie ich mit SezierenNDIVIDUELLE Ovariolen für jüngere Stadien.
Hinweis: Bei Stufe 14 Eikammern, verwenden Sie die Zange, um die dorsalen Anhänge zur Orientierung zu erfassen.
5. Injektionspräparat
Hinweis: Für die Injektion von Oozyten Mitte der Bühne, orientieren die Ovariolen senkrecht zur Längsachse des Deckglases.
- Schalten Sie den Imaging-Mikroskop [in unserem Fall eine DeltaVision Core von Applied Precision] und laden Sie die entsprechenden Einstellungen Bildgebung (5A-B).
- Schalten des Injektionsgeräts (5C).
- Laden Sie die Injektionsnadel mit Ladetipp (5D-E). Lösungen, die injiziert werden sollte kurz bei hoher Geschwindigkeit zentrifugiert werden, um Ablagerungen, die die Injektionsnadel blockieren könnten zu vermeiden.
- Bringen Sie den geladenen Injektionsnadel in den Injektor. Achten Sie darauf, um nicht zu unterbrechen Sie die Nadel (5F).
- Um mit dem Mähwerk Nadeln zu unterstützen, setzen Sie ein kleines Stück Glas aus einem 2x10 mm geschnitten oder gebrochen Deckglas einert eine Seite der Öltropfen mit den Ovariolen. Stellen Sie sicher, dieses Glas-Fragment in Öl bedeckt ist. Dieses Glas wird zu rammen die Nadelspitze gegen dienen zum Brechen von dem Mähwerk oder die Nadel.
6. Die Injektion von fluoreszierenden RNA
Bevor Sie beginnen: Stellen Sie die Einspritzvorrichtung und Mikro-Manipulator Kontrollen, so dass die Injektionsnadel über der Mitte des Sichtfeldes positioniert ist.
- Montieren Sie die Probe, um auf dem Mikroskoptisch injiziert werden.
- Wählen Sie das 20x-Objektiv. Höhere oder niedrigere Vergrößerung Ziele können ebenfalls verwendet werden.
Hinweis: Bei Verwendung eines automatisierten Bühne mit Punkt Besuch Fähigkeit ist es ratsam, alle von der Bühne 8-9 Oozyten für die Injektion vor Beginn markieren. Dies ermöglicht eine einfache und besuchen Injektion von ausgewählten Oozyten.
- Senken Sie die Injektionsnadel bis sie das Öl berührt. Zentrieren Sie die Nadelspitze über dem Objektiv.
- Drehenabseits der Raumbeleuchtung und schalten Sie das Hellfeld-Licht für das Mikroskop. Wählen Sie den ersten Punkt (Eizelle) auf der Liste markierten Punkten. Beim Blick durch die Okulare, auf die Eizelle (Abbildung 6A) zu konzentrieren.
- Senken Sie die Nadel manuell, bis sie in der gleichen Ebene wie der Fokus der Eizelle und sichtbar neben der Eizelle ist.
- Mit den Manipulator, bewegen Sie den Punkt der Injektionsnadel, bis es im Inneren der Eizelle ist. Eine schnelle stechende Bewegung ist oft erfolgreicher als einen langsamen Fortschritt. Einmal drinnen, Auswerfen eines kleinen Volumens von der Nadel und visuell beurteilen die Auswirkungen, je nach Bedarf wiederholen. Wenn die Injektion erfolgreich ist, wird das Zytoplasma der Eizelle im Inneren verdrängt werden, wenn dies nicht offensichtlich, wiederholen. Es ist nicht notwendig, um Bild der Fluoreszenz um festzustellen, ob Material eingespritzt wurde. Nach der Injektion entfernen Sie die Nadel aus dem Inneren der Eizelle (6B-G).
- Die genaue Menge an Flüssigkeit eingespritzt wird, schwierig zu quantifizieren. Um das injizierte Volumen, einstellbar erhöhenst der Druck-oder Zeitpunkt der Injektion Puls, brechen Sie die Nadelspitze, um die Öffnung leicht erhöhen oder benutzen Sie wiederholte Injektion Impulse.
Hinweis: Der gesamte Prozess sollte Injektion weniger als 10 Sekunden dauern, wenn richtig ausgeführt. Umfangreiche stechender oder Verweilen mit der Nadel im Inneren zu Eizelle führt zu schweren Schäden an der Ei Kammer führen.
- Vor der Auswahl des nächsten markierten Oozyte, erhöhen die Injektionsnadel hoch genug in dem Öl, um nicht anderen Oozyten in dem Transportweg zu kontaktieren.
- Am neuen Eizelle, wiederholen Sie Schritt 6.6. Fahren Sie auf diese Weise, bis alle benötigten Eizellen injiziert werden.
Hinweis: Wenn ein Fehler gemacht wird während der Injektion mit dem nächsten markiert Eizelle zu bewegen. Verschwenden Sie keine Zeit auf beschädigten Eizellen.
Hinweis: Die Nadel kann verstopft werden während einer Injektion Sitzung. In diesem Fall verschieben Sie die Nadel neben dem zerbrochenen Stück Glas in der Öl-auf dem Deckglas. Witzh das Glas und die Nadel in der gleichen Bildebene, sanft rammen die Nadel in das Glas (Abb. 6H). Testen Sie, dass die Nadel, indem Sie den Injektionsknopf und zu sehen, wenn eine Flüssigkeit verlässt die Spitze der Nadel ist verstopft.
- Wenn alle Eizellen injiziert wurden, manuell verschieben Sie die Nadel auf, aus dem Öl und richten Sie ihn aus dem Strahlengang für das Mikroskop. Stellen Sie sicher, dass es an einem sicheren Orientierung ist, um Augenschäden zu vermeiden.
Hinweis: Wenn eine erweiterte Zeitspanne zwischen Eikammer Isolierung und Oocyteninjektion verstrichen ist, wird es schwierig Oozyten zu injizieren und phänotypischen Veränderungen aufweisen mit Stress verbunden. Ähnliche Probleme können bei grober Handhabung der Eizelle oder Injektion von überschüssigen Mengen (vergleiche die Abbildungen 6I, J, K) ergeben.
7. Live-Imaging-experimentelles Design
- Wählen Sie das erste Eizelle injiziert aus der Liste. Testen Sie, ob die Injektion in die Eizelle war durch bildgebende einem Frame in der Fluoreszenz (eins in 6G).
- Konfigurieren Sie die experimentellen Parameter, unter anderem: Anregungswellenlänge, Emissions-Weg, Zeit Anregung, Z-Stapel und die Zeit zwischen den Sammlungen. Hinweis: Weitere Informationen hierzu finden Sie Parton R., et al. (2010) 2.
- Sammeln Sie die Datenmenge.
8. Repräsentative Ergebnisse
In vitro synthetisiert Alexa-546 GRK-RNA in einer Me31B :: GFP Eikammer (7A) injiziert. Die RNA lokalisiert an der dorsalen vorderen der Eizelle und bildet eine Kappe um den Kern (7B). Weitere Beispiele für RNA Lokalisation siehe MacDougall N., et al. (2003) 11.
Mitte und Ende der Etappe exprimierenden Oozyten fluoreszenzmarkierte Protein (Tau-GFP, 7C) oder RNA-Tagging-Systeme (GRK * mCherry, 7D) können ohne Injektion abgebildet werden.

Abbildung 1.

Abbildung 2.
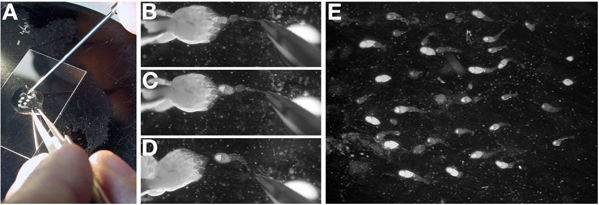
Abbildung 3.
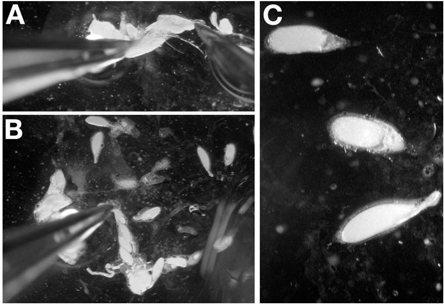
Abbildung 4.

Abbildung 5.
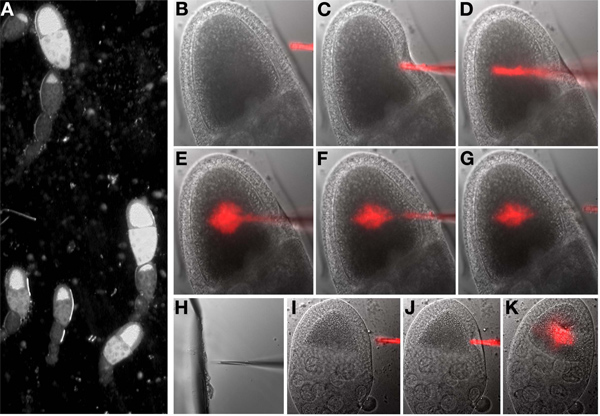
Abbildung 6.
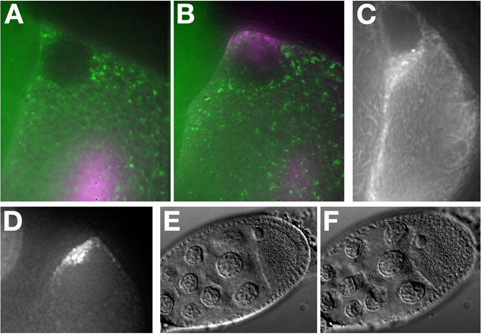
Abbildung 7.
Diskussion
Live Cell Imaging ist ein leistungsfähiges Assay zur Untersuchung zellulärer Prozesse in Echtzeit. Neben der einfachen Hellfeld-Beobachtung hat der Zusatz von fluoreszierenden Markierungen an Proteine und RNAs von Interesse führen zu vielen Durchbrüchen. Hier haben wir ein Protokoll für die Bildgebung individuelles Wohnen Eizellen, die in Kombination mit genetischen und biochemischen Assays genutzt werden können umrissen.
In diesem Protokoll auch erklären, wie experimentell zu manipulieren lebenden Oozyten durch Injektion. Es gibt viele Möglichkeiten für das Material zu injizieren, einschließlich In-vitro synthetisiert fluoreszenzmarkierten RNA-Assay die Fähigkeit einer sekundären Struktur, um direkte RNA Körperregion (Ball und Davis, unveröffentlicht) und Antikörper, die die Funktion von Proteinen 6 inhibieren. Zukünftige Arbeiten werden wahrscheinlich sehen die Einführung anderer Etikettierung Komponenten und zelluläre Maschinerie zur lebenden Eizellen ermöglichen molekularen Mechanismen zu testen.
t "> Die Erhaltung der Rentabilität und Lebensfähigkeit des Gewebes ist von wesentlicher Bedeutung bei der Arbeit mit lebenden Zellen. In diesem Protokoll, weisen wir darauf hin eine Reihe von Schritten, die auf Stress des Eies Kammer führen kann. Zum Beispiel, trotz Öl überlegen for Imaging, erweiterte Kulturbegriff in der Öl kann dazu führen, auf dem Ei Kammer zu betonen. Dies kann leicht unter Hellfeld Belichtung werden durch Untersuchung des Zellkerns und Position, Membran, die Eizelle zu verzerren und wird bleb unter Stress (vgl. Abbildung 7E (unbelasteten) zu Figure7F überwacht werden ( betonte)). Stage 9 Eikammern zeigen RNA Lokalisation und Grenze Zellmigration 12 über mehrere Stunden. jedoch ein Stadium 8.7 Eikammer beginnt zu negativen Auswirkungen in Halo Kohlenstoff Öl nach etwa 40 Minuten von den Eierstöcken entfernt von dem weisen weiblich. Spätstadium Eikammern, Stufe 11 bis 14, kann sich normal entwickeln entweder in Öl oder wässrigen Medien wegen der Sekretion der Eischale von den Follikelzellen in diesen Phasen 13. Es war Reported, dass die Zugabe von Insulin zu wässrigen Medium Insekten-Stufe 9 Oozyten bis zu 6 Stunden 14 und germaria bis zu 14 Stunden 15 aufrechtzuerhalten. In allen Fällen sollten aggressive Manöver des Eies Kammer vermieden werden, da sie die Eizellen betont und reduziert seine Lebensfähigkeit. Imaging weniger Ei Kammern und darauf achten, dass jeder vorsichtig zu behandeln ist der beste Weg, um eine optimale Rentabilität zu gewährleisten.Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch eine Wellcome Trust Senior Research Fellowship an I. Davis unterstützt.
Materialien
Werkzeuge in Dissektion verwendet sollte sauber sein, aber müssen nicht autoklaviert werden. Wischen Sie Werkzeuge mit EtOH und es ihnen ermöglichen, vor Beginn trocknen.
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Feine Spitzen Pinsel (Künstler Sable, rund, Größe 00 oder 0) | Von den meisten Verkaufsstellen Malutensilien | Eine gute Qualität ist wichtig, Pinsel | |
| Halocarbon Products Corporation, Baureihe 95 | Halocarbon Products Corporation, 887 Kinderkamack Road, River Edge NJ 07661 | Europäische Händler: Solvadis (GMBH) Achten Sie darauf, Oxygenat durch Einblasen von Luft durch das Öl. | |
| Deckglas-Nr. 1.5, 22 x 50mm | International-No1-VWR Cat = 631-0137-22-50mm | Menzel-Glaser-22-40mm-MNJ 400-070T | |
| Dumont No.5 - Dumostar | Fine Science Tools | 11253-20 | "Biologie" Spitze ist auch gut, aber zerbrechlicher |
| Dissecting Sonde | Fine Science Tools | 10140-01 | |
| Seziermikroskop | Olymp | SZ61 | |
| CO2-Pad | Erhältlich über http://www.flystuff.com / (Ein Geschäftsbereich der Genesee Scientific) | 59-114 (789060 Dutscher) | Europäische Händler: Dutscher www. dutscherscientific. com / Es ist auch relativ einfach benutzerdefinierte bauen eine eigene Fliege Pads |
| Kimcare | Kimbery Clark-Kimcare-Medizinische Reinigungstücher | KLEW3020 | |
| Mikroskop-DeltaVision | Applied Precision | DC-CORE | |
| Mikromanipulator | Burleigh Mikromanipulatoren von Lumen Dynamics Group Inc. 2260 Argentia Road, Mississauga, Ontario, Kanada L5N 6H7 | Burleigh PCS-5000-Serie, TS-5000 bis 300 | http://www.ldgi-burleigh.com / (Formerly Exfo) |
| Injektionsvorrichtung | Tritech Research, Inc. 2961 Veteran Ave Los Angeles, CA 90064 | MINJ-1 | Geändert mit einer Halterung zu nehmen Eppendorf Femptotips |
| Injektionsnadel | Eppendorf Sterile Femtotips I und II | 930000043 | Verschiedene Tipps sind besser für unterschiedliche Anwendungen |
| Tipps zum Einlegen von 20 &mgr; l | Eppendorf | 5242956.003 | |
| Trockene aktive Hefe | Fleischmann Yeast | # 2192 |
Referenzen
- Arias, A. M. Drosophila melanogaster and the development of biology in the 20th century. Methods Mol. Biol. 420, 1-25 (2008).
- Parton, R. M., Valles, A. -M., Dobbie, I. D., Davis, I. Pushing the Limits of Live Cell Imaging in Drosophila. Live Cell Imaging: A Laboratory. Goldman, R. D., Swedlow, J. R., Spector, D. L. , Cold Spring Harbor Laboratory Press. 387-418 (2010).
- Johnston, D. Moving messages: the intracellular localization of mRNAs. Nat. Rev. Mol. Cell Biol. 6 (5), 363-375 (2005).
- Jansen, R. mRNA Localization: Message on the Move. Nat. Rev. Mol. Cell Biol. 2, 247-256 (2001).
- Van De Bor, V., Hartswood, E., Jones, C., Finnegan, D., Davis, I. gurken and the I factor retrotransposon RNAs share common localization signals and machinery. Dev. Cell. 9 (1), 51-62 (2005).
- Delanoue, R., Herpers, B., Soetaert, J., Davis, I., Rabouille, C. Drosophila Squid/hnRNP helps Dynein switch from a gurken mRNA transport motor to an ultrastructural static anchor in sponge bodies. Dev. Cell. 13 (4), 523-538 (2007).
- Jaramillo, A. M., Weil, T. T., Goodhouse, J., Gavis, E. R., Schupbach, T. The dynamics of fluorescently labeled endogenous gurken mRNA in Drosophila. J. Cell. Sci. 121 (Pt. 6), 887-894 (2008).
- Forrest, K. M., Gavis, E. R. Live imaging of endogenous mRNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159-1168 (2003).
- Bertrand, E. Localization of ASH1 mRNA particles in living yeast. Mol. Cell. 2 (4), 437-445 (1998).
- Spradling, A. C. Developmental genetics of oogenesis. The Development of Drosophila melanogaster. Bate, M., Martinez-Arias, A. 1, Cold Spring Harbor Press. Cold Spring Harbor. 1-70 (1993).
- MacDougall, N., Clark, A., MacDougall, E., Davis, I. Drosophila gurken (TGFalpha) mRNA localizes as particles that move within the oocyte in two dynein-dependent steps. Dev. Cell. 4 (3), 307-319 (2003).
- Tekotte, H., Tollervey, D., Davis, I. Imaging the migrating border cell cluster in living Drosophila egg chambers. Dev. Dyn. 236 (10), 2818-2824 (2007).
- Weil, T. T., Parton, R., Davis, I., Gavis, E. R. Changes in bicoid mRNA anchoring highlight conserved mechanisms during the oocyte-to-embryo transition. Curr. Biol. 18, 1055-1061 (2008).
- Prasad, M., Jang, A. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nat. Protoc. 2 (10), 2467-2473 (2007).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten