Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mausmodell von Allergen-induzierte Asthma
In diesem Artikel
Zusammenfassung
Experimentelle Mausmodellen von allergischem Asthma bieten neue Möglichkeiten zur Untersuchung von Krankheitsentstehung und die Entwicklung neuer Therapeutika. Diese Modelle sind gut, um Mess-Faktoren, die die allergische Immunantwort, Entzündung der Atemwege, Lungen-und Pathophysiologie geeignet.
Zusammenfassung
Asthma ist eine der Hauptursachen für Morbidität und Mortalität und betrifft rund 300 Millionen Menschen auf der ganzen Welt. 1 Mehr als 8% der US-Bevölkerung an Asthma erkrankt ist, mit der Prävalenz nimmt zu. 2 Wie bei anderen Erkrankungen, Tiermodellen der allergischen Atemwegserkrankung erheblich erleichtern Verständnis der zugrunde liegenden Pathophysiologie, zu identifizieren potentielle therapeutische Targets und lassen präklinische Testung von neuen Therapien möglich. Modelle der allergischen Atemwegserkrankung haben in mehreren Tierarten entwickelt worden, aber Mausmodellen sind besonders attraktiv aufgrund der geringen Kosten, die sofortige Verfügbarkeit, und gut charakterisierte Immunsystem dieser Tiere. 3 Verfügbarkeit einer Vielzahl von transgenen Linien weiter steigert die Attraktivität dieser Modelle. 4 Hier beschreiben wir zwei Mausmodellen der allergischen Atemwegserkrankungen, beide beschäftigen Ovalbumin als Antigen. Nach anfänglichen Sensibilisierung durch intraperitoneale Injektion, ein Modell Lief.ERS, die das Antigen Herausforderung durch Vernebelung, die andere durch intratracheale Lieferung. Diese beiden Modelle bieten komplementäre Vorteile, mit jeder imitiert die wichtigsten Funktionen des menschlichen Asthma. 5
Die wichtigsten Features von akuten Asthma zählen eine übertriebene Reaktion der Atemwege auf Reize wie Methacholin (Atemwegshyperreaktivität; AHR) und Eosinophilen-reiche Entzündung der Atemwege. Diese sind auch prominente Auswirkungen der Allergen-Provokation in unserem Mausmodell, 5,6, und wir beschreiben Techniken zur Messung und ihnen somit die Bewertung der Auswirkungen der experimentellen Manipulation. Insbesondere beschreiben wir sowohl invasive 7 und 8 nicht-invasive Techniken zur Messung Atemwegshyperreaktivität sowie Verfahren für die Beurteilung Infiltration von Entzündungszellen in die Atemwege und der Lunge. Airway Entzündungszellen werden von BAL gesammelt, während Lunge Histopathologie wird verwendet, um Marker für Entzündungen im ganzen Organ zu beurteilen. DieseTechniken bieten leistungsstarke Tools für die Untersuchung von Asthma bei einer Weise, die nicht beim Menschen möglich wäre.
Protokoll
I. Sensibilisierung und Allergen-Challenge (siehe Abbildung 1)
A. Für Intratracheale Herausforderung
- Für die anfängliche Sensibilisierung, injizieren männliche oder weibliche C57BL / 6 oder BALB / c Mäuse (6-8 Wochen alt) intraperitoneal an Tag 0 und wieder am Tag 7 mit 20 ug Ovalbumin (OVA, Sigma-Aldrich, St. Louis, MO) emulgiert in 0,2 ml steriler Phosphat-gepufferter Salzlösung (PBS), enthaltend 2 mg Aluminiumhydroxid (Sigma-Aldrich) oder mit 2 mg Aluminiumhydroxid in 0,2 ml steriler PBS als Kontrolle.
- Herausforderung mit Antigen gegebenenfalls (z. B. an den Tagen 14, 16, 18 und 20). Challenge-Verfahren folgt.
- Anesthetize Maus mit einer intraperitonealen (ip) Injektion einer Mischung aus Ketamin (90 mg / kg) und Xylazin (10 mg / kg). Stellen Sie sicher, die Maus ist voll narkotisiert für mindestens 10 min.
- Betätigungsfläche Winkel von 45 Grad oder mehr. Bewegen Sie die Maus auf dieser Oberfläche zu halten Bauchseite nach oben und den Kopf oben.
- Haken thread unter vorderen Schneidezähnen an den Kopf nach hinten halten. Stufe die Pfoten miteinander, um sicherzustellen, der Luftröhre ist gerade und verwenden Etikettenband zu den Beinen halten. Weichen Sie Operationsstelle mit 70% EtOH und Tupfer.
- Anwenden Bupivacain (0,1 bis 0,2 ml 0,25% ige Lösung) topisch an der Einschnittstelle.
- Nip Haut an der Kehle mit einer Pinzette und ziehen Sie vorsichtig nach außen. Machen Sie einen kleinen vertikalen Schnitt mit Scheren. Minimieren Größe des Einschnitts.
- Bereiten Sie eine 1 ml Spritze mit 50 ul PBS oder 0,1% OVA in PBS und legen Sie sie in einem sich wiederholenden Pipette (Tridak Stepper, Torrington, CT). Nehmen Sie die Pipette in der einen Hand und mit der anderen, um das Gewebe zurückhalten mit der Pinzette und setzen die Luftröhre.
- Halten Sie die Spritze als parallel zur Luftröhre wie möglich, legen Nadel durch Tracheawand und injizieren Sie die Lösung.
- Pflegen Maus in einer vertikalen Ausrichtung nach der Injektion zu Zeit zur Herstellung einer in der Lunge absetzen können.
- Sanft und steril nahe Wundgebiet mitPinzette und Dichtung mit Naht.
- Bewegen Sie die Maus Brustbein-down auf einem Heizkissen und lassen Sie es bis zur vollständigen ambulanten erholen. Nach der Erholung, kehren die Maus in die Tierstation und überwachen sie täglich auf Anzeichen von Serom, Entzündung oder Infektion, und Wunddehiszenz, bis die Wunde vollständig verheilt ist.
B. Für die Herausforderung durch Vernebelung
- Sensibilisieren Mäusen am Tag 0 durch intraperitoneale Injektion von 20 ug OVA (Sigma-Aldrich) in 0,2 ml steriler PBS, enthaltend 2 mg Aluminiumhydroxid (Sigma-Aldrich) oder mit 2 mg Aluminiumhydroxid in 0,2 ml steriler PBS emulgiert als Kontrolle .
- Am Tag 14 zu erhöhen Sensibilisierung durch ip-Injektion, wie oben beschrieben.
- Am 21., 22., 23., 24. und 25. Tag nach der anfänglichen Sensibilisierung, Mäuse Herausforderung durch die Exposition für 30 min bis 1% vernebelten OVA oder PBS allein über einen Ultraschall-Vernebler (Buxco Research Systems, Wilmi geliefertngton, NC).
- Ort Mäuse in der Hauptkammer des WBP, akklimatisieren sie innerhalb der Plethysmographie Kammer für mindestens 10 min.
- Platz 1 ml 0,1% OVA in sterilem PBS oder sterilem PBS allein, wie in den Schritten 4-6 beschrieben, über einen Vernebler Tasse. Inhalationsgerät für 30 min.
- Entfernen und entsorgen Verneblerbecher verbleibende Lösung.
- Vernebelung kann bei den Mäusen gleichzeitig unter Verwendung eines Zerstäubungs Kammer durchgeführt werden.
II. Bestimmung der Atemwegshyperreaktivität zu Methacholin
A. Nicht invasive Messung der Überempfindlichkeit der Atemwege durch Ganzkörper-Plethysmographie (WBP; Buxco Research Systems, Wilmington, NC)
- Lassen Sie das pulverisierte Methacholin Flasche auf Raumtemperatur aufwärmen vor dem Öffnen (Methacholin ist sehr hygroskopisch und wird nutzlos, Klumpen zu bilden, wenn erlaubt, Wasser zu absorbieren). Bereiten Sie eine 200 mg / ml Stammlösung in sterilem PBS, dann machen serielle 2-fache Verdünnungen (zB 100, 50, 25, 12,5 und 60,25 mg / ml). Halten Lösungen kalt.
- Richten Sie Geräte wie folgt: connect Haupteinlass der WBP zu Vernebler, Bias-Flow Einlass zum Luftpumpe, und WBP Steckdose zu Gasfalle mit eng anliegenden Gummischlauch. Bringen Sie Druckaufnehmer, um die Ausgänge der Haupt-und Referenz-Kammern des WBP zu überbrücken. Schließen Sie Druckwandler Vorverstärker mit den mitgelieferten Kabel, und verbinden Vorverstärker an den PC unter Verwendung spezifischer Daten-Übernahme-Karte.
- Kalibrieren Sie den Vorverstärker mit Hilfe der Software gemäß den Empfehlungen des Herstellers.
- Ort Mäuse in der Hauptkammer des WBP, akklimatisieren sie innerhalb der Plethysmographie Kammer für mindestens 10 min, dann Rekord Grundlinie Lesungen (Penhbase) für 3 min.
- Platz 1 ml steriler PBS in der Verneblerbecher. Vernebeln für 2 min und dann überwachen respiratorischen Variablen für einen zusätzlichen 6 min während der Trocknungsphase. Entfernen und entsorgen Verneblerbecher alle verbleibenden PBS.
- Platz 1 ml 6,25 mg / ml in der Methacholin Verneblerbecher und rEPEAT Vernebelung für 2 Minuten plus einer 6-Minuten-Monitoring-Zyklus.
- Wiederholen Sie die Messung mit 12,5, 25, 50 und 100 mg / ml Methacholin, mit dem gleichen 2-min-Periode Vernebelung und 6-Minuten-Monitoring-Zyklus.
- Entfernen Sie die Mäuse aus den Kammern auf und schickt sie in ihre Käfige.
- Refill Verneblerbecher mit 1 ml sterilem PBS und führen Sie eine weitere Sequenz, um den Schlauch zu spülen.
- Beenden Sie die Luftströme, zerlegen, reinigen und wischen alle Kammern, bevor Sie einen zweiten Satz von Tieren.
B. invasive Messung der Atemwegsempfindlichkeit durch Computer-gesteuerte Ventilator (flexiVent; SCIREQ Inc., Montreal, Kanada)
- Wiegen Sie die Maus und betäuben durch intraperitoneale (ip) Injektion von 60 mg pro kg Körpergewicht Pentobarbital-Natrium.
- Im Anschluss an eine adäquate Anästhesie, Position die Mäuse ventro-dorsal zur Tracheotomie.
- Desinfizieren Sie die Haut des Halses mit 70% Ethanol. Anwenden Bupivacain (0,1 bis 0,2 ml 0,25% ige Lösung) topisch an der incision Website. Einschneiden und öffnen Sie die Haut des Halses. Trennen Sie die Nackenmuskulatur und setzen die Luftröhre.
- Machen Sie eine 1 - bis 2-mm-Schnitt in der Luftröhre mit einer feinen Schere (nicht sicher sein, um die Luftröhre zu durchtrennen) und stecken Sie den Trachealtubus vorsichtig. Binden Sie eine Naht um die Luftröhre, um eine Undichtigkeit zu verhindern.
- Legen Sie die Maus in die Bodyplethysmographen Kammer und schließen Sie das eingefügt Trachealtubus mit dem Beatmungsgerät.
- Starten mechanischen Beatmung. Festlegen geeigneter Atemfrequenz und Gezeiten / Hubvolumen (150 Hübe / min und 200 ul bzw. für eine 20-g-Maus). Achten Sie darauf, dass der Brustkorb wird synchron bewegt sich mit dem Beatmungsgerät. Wenn die Maus "kämpfen" wird mit dem Ventilator (Selbst-Atmung), injizieren mehr Betäubung und warten Sie für die Synchronisation.
- Nach Baseline-Messungen, halten Mäuse unter Baseline-Belüftung für eine weitere 3 min, und von dort aus 2 nd der Impedanzmessungen gesetzt. Diese 2 nd der Baseline-Messungen eingestellt ist, dass Calc verwendetulate Der durchschnittliche Ausgangswert Werte.
- Deliver PBS oder Methacholin (MCH) Herausforderungen (6,25, 12,5, 25, 50 und 100 mg / ml) durch die Kanalisierung inspiratorischen Flow aus dem Ventilator durch einen Ultraschall-Vernebler.
- Im Anschluss an jede Herausforderung mit MCH (6,25, 12,5, 25, 50 und 100 mg / ml), Rückkehr in den Kolben, um die Bereitstellung einer VT von 10 ml / kg bei 120 Atemzüge / min und nehmen Impedanzmessungen.
III. Die Messung der zellulären Infiltration in den Luftraum
A. Führen Sie bronchoalveolären Lavage (BAL)
- Nach der Messung der AHR, einschläfern Mäuse mit CO 2, und positionieren Sie jede Maus auf dem Rücken auf dem OP-Pad.
- Weichen Sie den Bereich mit 70% EtOH.
- Beginnend am unteren Abdomen, schnitt den Bauchraum und zu entfernen Haut / obere Muskel, hangaufwärts in Richtung der Rippen.
- Sobald die Rippen sichtbar sind, mit einer Schere vorsichtig die Membran durchstechen. Lungen sollte verdecken von der Membran weg. Seien Sie besonders ca.umsichtig nicht auf nick die Lunge oder Herz.
- Schneiden Sie den Brustkorb, um die Lunge vollständig freizulegen / Herz (Schneiden zu vermeiden, keine größeren Blutgefäße, um Blut aus Füllen der Stelle zu halten).
- Mit einer 1 ml Spritze mit einer 27 Gauge-Nadel (BD Spritzen, Franklin Lakes, NJ), durchstechen die Herzkammern und langsam und vorsichtig nach hinten ziehen Sie die Spritze, um das Blut zu sammeln. Darauf achten, dass das Herz kollabiert.
- Sammeln Sie das Serum aus diesem Blut unter Verwendung von Standard-Protokoll. Lagerung bei -70 ° C bis zur Verwendung.
- Schneiden Sie Haut und Gewebe aus der Kehle, bis die Luftröhre wird enthüllt. Räumen Sie ausreichend Gewebe zu leicht arbeiten innerhalb des Feldes (wieder, vermeiden Schneiden keine größeren Blutgefäße).
- Mit einer gebogenen Schere, unter der Luftröhre geschnitten, um einen Pfad zu löschen.
- Führen Sie die Spitze einer gebogenen Pinzette unter der Luftröhre und fassen Sie das Ende von einem Stück Faden. Zeichnen Sie den Faden unter der Luftröhre.
- Binden Sie einen lockeren halben Knoten über der Luftröhre, geringer in der Kehle.
- CarefUlly schnitt eine Kerbe, in ausreichender Größe für die Kanüle, über dem Faden.
- Setzen Sie vorsichtig die Kanüle in das Loch hinunter und die Luftröhre über den Punkt der Faden. Leicht nach vorne drücken, bis die Kanüle entsteht gerade am Eingang zu den Lungen (zu weit: Punktion Lungen; zu kurz: Zusammenbruch Luftröhre beim Versuch sich zu erholen BAL).
- Ziehen Faden und Knoten, um komplette Luftröhre herum Kanüle zu versiegeln.
- Lock-Spritze (1 ml PBS) an der Kanüle und vorsichtig auf die Flüssigkeit in der Lunge. Lungenlappen sollte individuell langsam aufzublasen. Nicht über-Füllung. Für einen ausgewachsenen Maus 0,9-1,0 ml ist das absolute Maximum. 0,8 ml sicherer sein kann. Lock Spritze lose an der Kanüle, sonst ist die Wahrscheinlichkeit eines Schadens bei dem Versuch, zu lösen.
- Ziehen Flüssigkeit aus den Lungen. Wird ein Widerstand angetroffen (Gewebe in Kanüle gesaugt), drücken Kanüle langsam weiter in die Lunge und wieder entfernen. Ebenfalls um die Kanüle an Ort und Stelle. Wenn alle ELSe ausfällt, ziehen Sie die Kanüle einen Teil des Weges, der Luftröhre ist viel wahrscheinlicher, in diesem Fall zusammenbrechen.
- Trennen Sie Spritze von der Kanüle, Kaution BAL-Flüssigkeit in Behälter, und wiederholen Sie 2 mal mit frischem PBS-Lösung.
- Halten Sie die BAL-Lösung auf Eis, bis abzentrifugiert.
- Verwenden Sie die BAL-Flüssigkeit und Serum, die OVA-spezifischen IgE mit kommerziell erhältlichen ELISA-Kits Maus-IgE (MD Bioproducts, St. Paul, MN) zu messen.
B. Zählen von Zellen und Bestimmen Differenziale
- Zentrifugieren Sie die BAL-Flüssigkeit 5 min bei ~ 600 × g, 4 ° C
- Das Zellpellet sanft in PBS und halten Sie auf dem Eis.
- Legen Sie eine Standard-Neubauer Hämazytometer mit der verdünnten Zellsuspension und zählen die Zellen.
- Entfernen Sie Aliquots von 2 × 10 4 Zellen in 10 bis 40 ul Volumen für Zytospins. Verdünnen Sie Zellen, wenn nötig.
- Für Zytospins, mischen Sie 2 x 10 4 Zellen, 130 ul PBS und 10 ul FBS. Fügen gesamte Zelle Mischung zu double Zytospin Trichter und Zentrifuge 10 min bei 700 rpm, mit doppelseitigem cytoslides für Doppelproben.
- Die Objektträger bei Raumtemperatur für 1 h vor dem Färben trocknen.
- Stain Den Objektträger mit Hilfe Diff-Quick-Färbung (Siemens, Newark, DE).
IV. Repräsentative Ergebnisse
Übermäßige Verengung der Atemwege nach provokativen Reizen ist ein hervorstechendes Merkmal der klinischen Asthma. Wir beschreiben zwei Methoden zur Messung solcher Atemwegshyperreaktivität zu Methacholin in OVA-sensibilisierten und provozierten Mäusen: Ganzkörper-Plethysmographie (Abbildung 2) und erzwungenen Schwingung mit der flexiVent System (Abbildung 3). Beide Methoden zeigen, dass OVA Sensibilisierung und Herausforderung Atemwegshyperreaktivität in Mäusen erzeugt.
Eosinophilen-reiche Entzündung der Atemwege ist ein weiteres hervorstechendes Merkmal der sowohl klinisch als Asthma und allergische Atemwegserkrankungen bei Mäusen. Wie in 4 gezeigt , OVA Sensibilisierung und Herausforderung erhöht die Gesamtzahl der Zellen, die aus den Atemwegen von BAL wiederhergestellt werden können. Die Zahl der Eosinophilen und, in geringerem Umfang, sind insbesondere Neutrophilen erhöht.
Es gibt Anzeichen dafür, dass allergische Atemwegserkrankung Ergebnisse aus Überproduktion von IgE-Antikörpern gegen sensibilisierende Antigene. Sensibilisierung und Herausforderung mit OVA unter Verwendung der Protokolle beschreiben wir IgE-Spiegel erhöht im Serum und BAL-Flüssigkeit der behandelten Mäuse (5).
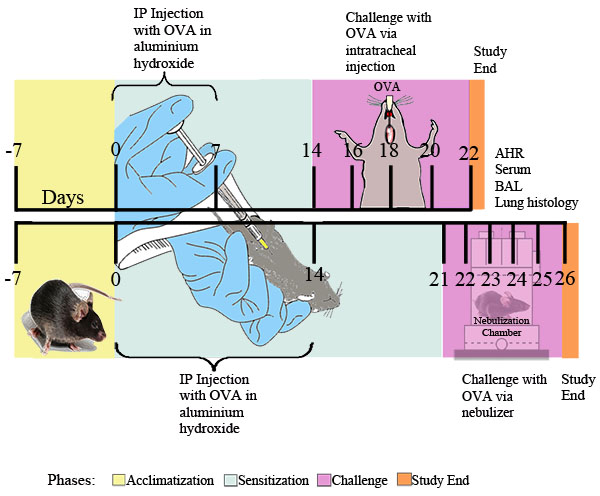
Abbildung 1. Experimentelle Schema für OVA-induzierten allergischem Asthma. Die Mäuse wurden zweimal sensibilisiert ip mit 20 ug OVA in 2 mg Aluminiumhydroxid in 0,2 ml steriler PBS oder 2 mg Aluminiumhydroxid in 0,2 ml steriler PBS allein emulgiert, an der gefolgt angegebenen Zeitpunkten durch ihn herauszufordern mit 0,1% OVA oder sterile PBS-Lösung oder durch den täglichen Ex Posure für 30 Minuten bis 1% zerstäubt OVA in PBS oder PBS alleine geliefert mittels eines Ultraschall-Vernebler (Buxco). Vierundzwanzig Stunden nach der letzten OVA Belichtung wurde Atemwegsempfindlichkeit bestimmt. Anschließend wurden BAL-Flüssigkeit, Blut-Proben, Lungenzellen, und Geweben zur weiteren Analyse gesammelt.
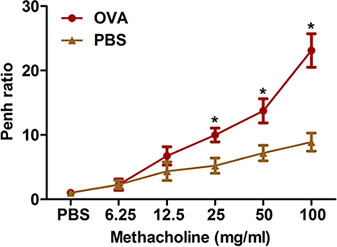
Abbildung 2. Bewertung der Allergen-induzierte Atemwegshyperreaktivität durch eine nicht-invasives Verfahren. Mäuse (n = 4/group) sensibilisiert wurden und herausgefordert mit OVA. Vierundzwanzig Stunden nach der letzten Herausforderung, wurde Atemwegshyperreaktivität zu inhalativen Methacholin bestimmt mittels Ganzkörper-Plethysmographie wie im Protokoll beschrieben. Penh wurde bestimmt und als Penh Verhältnis (durchschnittliche Penh über den 8-min Zeitintervall mit Methacholin durch die durchschnittliche Penh über den 8-Minuten-Intervall mit PBS unterteilt). *, P <0,05 vs PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Abbildung 3. Beurteilung der Allergen-induzierte Atemwegshyperreaktivität durch ein invasives Verfahren (erzwungene Schwingung). Mäuse (n = 4/group) waren sensibilisierten und provozierten mit OVA. Vierundzwanzig Stunden nach der letzten Belastung wurde Atemwegshyperreaktivität steigenden Konzentrationen von inhaliertem Methacholin durch die erzwungene Schwingung (flexiVent) Verfahren wie im Protokoll beschrieben ist. A, B) Atemwegswiderstand, C) Lung Elastanz. *, P <0,05 vs PBS.
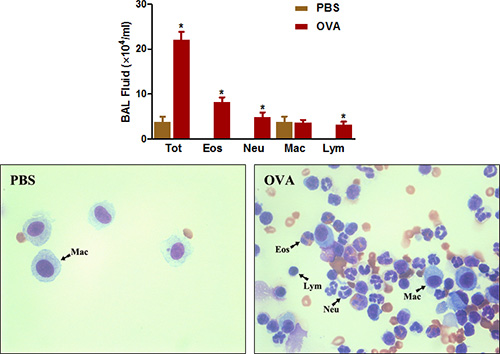
Abbildung 4. BAL-Flüssigkeit-Zellzahl. Mäuse (n = 4/group) waren sensibilisierten und provozierten mit OVA. Vierundzwanzig Stunden nach der letzten Herausforderung, (nach oben) BAL Zellen wurden gesammelt und insgesamt Zellen wurden gezählt, wie in der beschriebenen Protokoll. (Unten) Cytospin Folien waren prepariert und gefärbt mit Diff-Quick. TOT = Arbeitskosten insgesamt Zellen; Eos = Eosinophile; Neu = Neutrophile; Mac = Makrophagen, Lym = Lymphozyten. *, P <0,05 vs PBS.
Abbildung 5. OVA-spezifische IgE. Mäuse (n = 4/group) waren sensibilisierten und provozierten mit OVA. Vierundzwanzig Stunden nach der letzten Belastung wurde IgE in der BAL und in Serum aus dem Blut durch Herzpunktion gesammelt, wie im Protokoll beschrieben, gemessen. *, P <0,05 vs PBS.
Diskussion
Tiermodelle der allergischen Atemwegserkrankungen stellen wichtige Werkzeuge für die klinische Studien relevant Asthma. Eine Reihe von verschiedenen Modellen, leicht variierenden Arten und Antigenen, entwickelt worden. Die Maus, eine attraktive und häufig genutzte Labor Arten, bietet auch eine Reihe von Vorteilen für die Modelle der allergischen Erkrankung der Atemwege. 9,10 Obwohl solche Modelle nicht nachahmen Asthma in jeder Hinsicht, 11 mit Aspekten der chronischen Erkrankung besonders schwe...
Offenlegungen
Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her durch den Atlanta VAMC IACUC Ausschuss gemäß Protokoll # V010-10 gesetzt durchgeführt.
Danksagungen
Diese Arbeit wurde vom NIH Grant HL093196 (RCR) und den Atlanta Research and Education Foundation (AREF) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Material Name | Firma | Katalog-Nummer | Kommentare |
| Ovalbumin | Sigma-Aldrich St. Louis, MO | A5503 | |
| Aluminiumhydroxid | Sigma-Aldrich | 239186 | |
| Acetyl-β-Methylcholin Chlorid | Sigma-Aldrich | A2251 | |
| Pentobarbital-Natrium-Salz | Sigma-Aldrich | P3761 | |
| Die Ganzkörper-Plethysmographie (WBP) System | Buxco Research Systems Wilmington, NC | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc. Montreal, Kanada | http://www.scireq.com | |
| Lichtmikroskop | Leica Microsystems, Inc. Buffalo Grove, Illinois | ||
| Cytospin 4 | Thermo Scientific Asheville, NC | ||
| Diff-Quick Fleck | Siemens Newark, DE | B4132-1A | |
| Mehrfachdispenser | Tridak Torrington, CT | STP4001-0025 |
Referenzen
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten