Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Wachstum von Mycobacterium tuberculosis Biofilme
In diesem Artikel
Zusammenfassung
Mycobacterium tuberculosis bildet Wirkstoff toleranten Biofilme, wenn unter bestimmten Bedingungen kultiviert. Hier beschreiben wir Verfahren zur Kultivierung von M. Tuberkulose Biofilmen und die Bestimmung der Häufigkeit des Drogenkonsums tolerant persisters. Diese Protokolle werden für weitere Studien sinnvoll in die Mechanismen der Verträglichkeit der Medikamente in M. Tuberkulose.
Zusammenfassung
Mycobacterium tuberculosis, dem Erreger der menschlichen Tuberkulose, hat eine außerordentliche Fähigkeit, gegen Umweltbelastungen einschließlich Antibiotika überleben. Obwohl Stresstoleranz von M. Tuberkulose ist eine der wahrscheinlich Mitwirkenden an den 6-monatigen Chemotherapie der Tuberkulose ein, bleiben die molekularen Mechanismen dieser charakteristischen Phänotyp des Erregers unklar. Viele mikrobielle Spezies entwickelt haben, um in stark beanspruchenden Umgebungen von sich selbst organisierenden überleben in hoch organisierten, Oberfläche angebracht und Matrix eingekapselt Strukturen, so genannte Biofilme 2-4. Das Wachstum in den Gemeinden scheint eine bevorzugte Überlebensstrategie von Mikroben sein, und wird durch genetische Komponenten, die Oberfläche Befestigung, interzelluläre Kommunikation, und die Synthese von extrazellulären polymeren Substanzen (EPS) 5,6 Regulierung erreicht. Die Toleranz gegenüber widrigen Umweltbedingungen wird wahrscheinlich durch EPS erleichtert, und vielleicht durch die physiogische Anpassung einzelner Bazillen auf heterogene Mikroumgebung innerhalb der komplexen Architektur von Biofilmen 7.
In einer Reihe von neueren Arbeiten haben wir festgestellt, dass M. tuberculosis und Mycobacterium smegmatis haben eine starke Neigung, in organisierten vielzelligen Strukturen wachsen genannten Biofilmen, die vertragen mehr als 50 Mal können die minimalen Hemmkonzentrationen der Anti-Tuberkulose-Medikamente Isoniazid und Rifampicin 10.08. M. Tuberkulose, aber faszinierend erfordert spezielle Bedingungen, um reife Biofilme, insbesondere 9:1-Verhältnis von Headspace bilden: Medien sowie eingeschränkte Luftaustausch mit der Atmosphäre 9. Bedarf an spezialisierten Umweltbedingungen könnte möglicherweise auf die Tatsache, dass M. verknüpft werden Tuberkulose ist ein obligat humanpathogene und damit hat sich um Gewebe-Umgebungen angepasst. In dieser Veröffentlichung zeigen wir Methoden zur Kultivierung von M. TuberkuloseBiofilme in einer Flasche und einer 12-Well-Platte-Format, die bequem für bakteriologische sowie genetische Studien ist. Wir haben das Protokoll eines abgeschwächten Stamm von M. beschriebenen Tuberkulose, mc 2 7000, mit einer Deletion in den zwei Loci, panCD und RD1, die kritisch für die in vivo das Wachstum des Erregers 9 sind. Dieser Stamm kann sicher in einer BSL-2 Containment werden für das Verständnis der biologischen Grundlagen der Tuberkulose-Erreger wodurch die Anforderung eines teuren BSL-3-Anlage verwendet. Die Methode kann erweitert werden, mit entsprechenden Modifikationen in den Medien, um Biofilm von anderen kultivierbaren Mykobakterien wachsen.
Insgesamt wird ein einheitliches Protokoll zur Kultivierung von Mykobakterien Biofilmen helfen den Ermittlern bei der Untersuchung der grundlegenden elastischen Eigenschaften von Mykobakterien interessiert. Darüber hinaus wird eine klare und präzise Verfahren zur Züchtung von Mykobakterien Biofilme auch helfen, die klinische und pharmazeutische investigators zur Prüfung der Wirksamkeit eines potentiellen Arzneimittels.
Protokoll
1. Wachsende Biofilmen von M. Tuberkulose in einer 250ml-Flasche mit Schraubverschluss gelagert
- Medien-Herstellung: 0,5 g KH 2 PO 4, 0,5 g MgSO 4, 4g L-Asparagin, 2 g Zitronensäure, 0,05 g Eisenammoniumcitrat, 60ml von Glycerin in 900 ml Wasser. Der pH-Wert mit NaOH auf 7,0. Autoklav, abgekühlt und unmittelbar vor dem Beginn des Versuchs, fügen sterilen ZnSO 4 bis zu einer Endkonzentration von 0,1% w / v. Seit 7000 mc 2 ist ein Pantothenat auxotroph dieser Stamm erfordert auch Pantothensäure bei 10μg/mL der Endkonzentration.
Hinweis: Dies ist ein Standard Zusammensetzung Sauton Medien für M. tuberculosis verwendet. Falls erforderlich, wird andere spezielle Vorlagen können auch nach anderen mykobakteriellen Arten verwendet werden.
- Zuchtansätze Zubereitung: Grow M. Tuberkulose in 7H9OADC mit 0,05% Tween-80 für eine Woche, oder OD 600 von 0,7 bis 1,0. Die culture können direkt als Inokulum werden bei einer Verdünnung von 1:100 verwendet.
- Dispense 25ml Sauton die Medien zu einer 250ml-Flasche mit Schraubverschluss gelagert Polystyrol (Corning). Fügen Sie 250μl des Inokulums auf das Medium, Kappe der Flasche sehr fest und legen Sie sie ungestört in einem befeuchteten Inkubator bei 37 ° C für 3 Wochen. Beachten Sie die Flasche einmal täglich, um sicherzustellen, dass es keine Verschmutzung.
- Am Ende der dritten Woche, lösen Sie den Verschluss der Flasche, um das weitere Wachstum von M. erlauben Tuberkulose an der Grenzfläche. Wenn die Kappe wird in diesem Stadium nicht gelockert dann die unzureichende Sauerstoffkonzentration im Behälter wird weiter verzögern das Wachstum von Bakterien.
2. Wachstum von M. Tuberkulose Biofilmen in 12-Well-Platten
- Bereiten Sie die Medien und Inokulum von mc 2 7000, wie in A1 und A2 beschrieben.
- Mischen Sie 60 ml Medium mit 600μl des Inokulums. Dispense 4.5mL des Gemisches in jede Vertiefung der Platte. Die Platte mit Deckel. Wickeln Sie die Platte mehrmals mit Parafilm. Die Platte ungestört in befeuchteten Inkubator bei 37 ° C für 5 Wochen.
3. Um die Frequenz des Arzneimittels toleranten persisters in M. Tuberkulose Biofilmen
- Grow M. Tuberkulose Biofilmen in einer 12-Well Format, wie in Abschnitt B dieser beschriebenen dauert insgesamt ca. 5-Wochen.
- Sobald die Biofilme gereift sind (nach 5 Wochen Inkubation) injizieren Ihre Wahl des Antibiotikums in der gewünschten Konzentration in den Medien unter den Biofilmen mit einer Mikrospitze in einer Pipette.
Hinweis: Die Lautstärke der Medien unter den Häutchen reduziert sich auf etwa 3,0 ml. So Ermittler sollte entsprechend berechnen die Menge der Droge.
- Strudel die Platte vorsichtig, so dass das Antibiotikum gründlich in dem Medium diffundiert. Für statistisch signifikante Ergebnisse, injizieren die Antibiotiotic in vier Brunnen. Parallel dazu spritzen die gleiche Menge an Lösungsmittel, in dem das Antibiotikum in den anderen vier Brunnen aufgelöst wurde, und lassen Sie die letzten vier Vertiefungen der Platte unberührt. Die Platte mit Deckel und stellte neue Schichten von Parafilm um die Platte herum. Legen Sie sie zurück in den Inkubator für gewünschten Zeitraum.
- Am Ende der Inkubation zu öffnen und die Platte hinzuzufügen Tween-80 bis zu einer Endkonzentration von 0,1% (Volumen / Volumen) in jeder der Vertiefungen. Schwenken Sie die ganze Platte für eine gleichmäßige Verteilung sanft des Waschmittels. Anschließend wird die Platte bei Raumtemperatur für 15 Minuten. Mischen Sie den Inhalt jedes Wells mit Pipette mehrmals, so dass gesamte Inhalt gleichmäßig auf eine 15 ml konische Röhrchen übertragen werden können.
- Anzentrifugieren den Inhalt des Rohrs bei 4000rpm für 10 Minuten bei Raumtemperatur. Das Pellet in 5 ml frischem Waschpuffer (PBS mit 10% Glycerin und 0,05% Tween-80). Wiederholen Sie die dreimaligem Waschen. Das Pellet in 5 ml Waschpuffer. Halten Sie es auf der Wippe für overnight bei 4 ° C
Hinweis: Obwohl niedrige Temperatur wurde ursprünglich für M. smegmatis (um sein Wachstum während der Dispersion zu minimieren) entwickelt und verwendet für M. tuberculosis als auch die langsam wachsenden Arten können am ehesten bei Raumtemperatur ohne Einfluss auf Ergebnis geschaukelt zu werden. Rocking bei Raumtemperatur könnte notwendig sein, wenn Arbeiten im BSL-3-Anlage.
- Bereiten Sie eine sterile Spritze mit Mikrospitze (2-200 ul) durch Abschneiden seiner breiten Ende auf die entsprechende Größe, passend sie auf die Spritze und wickelte sie mit Parafilm versehen. Führen Sie den gesamten Inhalt des Rohres durch die Spitze montierten Spritze und sammeln sich in einem frischen 15 ml Tuben. Wiederholen Sie diesen Schritt 5 bis 6 mal, bis du eine ziemlich homogene Suspension zu beobachten.
- Verdünnungsreihe der Suspension und die Platte Verdünnungen auf 7H11OADC Platte, um die Anzahl der lebensfähigen Kolonien in jeder Vertiefung zu bestimmen. Die Inkubation erfolgt für drei Wochen in 37 ° C Inkubator. Bestimmen Sie die Frequenzcy der persisters im Biofilm Bevölkerung durch Berechnen des Verhältnisses der Anzahl der Kolonien in der Antibiotika behandelt, um die auf Lösungsmittel behandelt Platten erhalten werden.
4. Repräsentative Ergebnisse
Wenn in einer Flasche kultiviert, das Wachstum von M. Tuberkulose kann an der Basis der Flasche bis zum Ende der ersten Woche zu sehen. Am Ende der zweiten Woche, kann lückenhaft Wachstum von Bakterien auf der Luft-Media-Schnittstelle erkannt, obwohl das Wachstum an der Luft-Medium-Schnittstelle ist konsistent sichtbar am Ende der dritten Woche (1A). Zu diesem Zeitpunkt die Anlagerung der Bakterien an der Wand des Behälters beobachtet. Von diesem Punkt an das Wachstum der Kultur tritt vor allem auf die Luft-media-Schnittstelle. Die Flüssigkeit unter der Oberfläche Wachstum ist klar. Typischerweise reift der Struktur am Ende der fünften Woche (1B). Wenn Inkubation verlängert wird, werden die Strukturen beginnen, auf den Boden des Behälters sinken. InteressanterweiseAnziehen der Kappe bis zum Ende der dritten Woche ist ein wichtiger Schritt in diesem Prozess, und aus unbekannten Gründen eine lose-verschlossenen Flasche erheblich verzögert Initiierung des Wachstums auf die Schnittstelle 9.
In der 12-Well-Format wird ein robuster Biofilm an der Luft-Media-Schnittstelle in jeder der Vertiefungen am Ende von fünf Wochen (2A) gesehen. Wenn die Platten nicht vollständig eingewickelt dann Differential Biofilmwachstum beobachtet wird. Im schlimmsten Fall kann bedeutende Medien Verdampfen Strömungsabriss das Wachstum der Bakterien (Fig. 2B). So Einwickeln der Platte ist notwendig, sowohl um die Verdunstung zu verhindern sowie zu Umwelt für die Biofilmbildung (siehe vorigen Absatz) zu schaffen.
Die Zahl der lebensfähigen Bazillen in Biofilmen mit dieser Technik bestimmt ist ziemlich reproduzierbar. Antwort von M. Tuberkulose Biofilme hängt von der Art der Antibiotika. Für eine bakterizide Antibiotika wie Rifampicin, folgt ein Verlust der Lebensfähigkeit bipha sic Trend 9. Ein rascher Rückgang der Rentabilität in den ersten drei bis vier Tagen durch eine anhaltende Phase, in der ein kleiner Prozentsatz der Bevölkerung bleiben völlig widerspenstig gegen Antibiotika unabhängig von der Konzentration des Antibiotikums oder der Zeitpunkt der Exposition gefolgt. Abbildung 3 zeigt die Anzahl der lebensfähigen Bazillen in reife Biofilme nach einer 7-tägigen Exposition gegenüber 50μg/mL (50 mal höher als die MHK) von Rifampicin.

1A. Frühe Auftreten von M. Tuberkelbazillen auf dem Luft-Media-Interface von Bakterien nach 3 Wochen Inkubationszeit.

Abbildung 1B. Gereift Biofilmen von M. Tuberkulose auf dem Luft-Media-Schnittstelle nach fünf Wochen der Inkubation.
820/3820fig2A.jpg "/>
2A. 5-Wochen alte Biofilme von M. Tuberkulose in 12-Well-Format entwickelt.
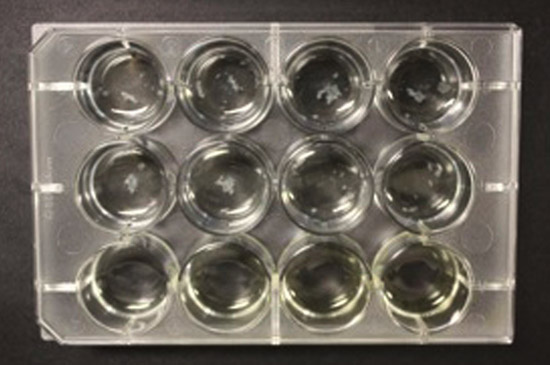
2B. Ein gescheiterter Versuch, M. tuberculosis Biofilmen in 12-Well-Platte wachsen, ohne Parafilm.
Abbildung 3. Ein Vertreter Diagramm, das die Häufigkeit des Drogenkonsums tolerant persisters in M. Tuberkulose Biofilme wachsen in 12-Well-Format und ausgesetzte von Rifampicin für sieben Tage 50μg/mL.
Diskussion
Tuberkulose (TB), durch die Infektion von Mycobacterium tuberculosis verursacht wird, bleibt eine große Bedrohung für die globale öffentliche Gesundheit. Fast ein Drittel der Weltbevölkerung schätzungsweise asymptomatisch durch den Erreger infiziert werden, zeigen etwa 9 Millionen neue Fälle in Klinik jedes Jahr mit den Symptomen einer aktiven TB und rund 1,7 Millionen sterben an der Infektion jedes Jahr 11. Die enorme Belastung der Krankheit ist in erster Linie durch einen Mangel an einem Impf...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Arbeit wurde mit finanzieller Unterstützung durch die National Institutes of Health und American Lung Association durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
Referenzen
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten