Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Experimentelle Endokarditis Modell von Methicillin-resistenten
In diesem Artikel
Zusammenfassung
Experimentelle Ratte Endokarditis Modell durch Methicillin-resistente S. aureus.
Zusammenfassung
Endovaskuläre Infektionen, einschließlich Endokarditis, sind lebensbedrohliche Infektionskrankheiten Syndrome 3.1. Staphylococcus aureus ist der häufigste weltweit Ursache solcher Syndrome mit inakzeptabel hohen Morbidität und Mortalität sogar mit geeigneten antimikrobiellen Wirkstoff Behandlungen 4-6. Der Anstieg der Infektionen durch Methicillin-resistente S. aureus (MRSA), haben die hohen Raten von Vancomycin klinischen Therapieversagen und wachsenden Probleme von Linezolid und Daptomycin Widerstand alle weiter kompliziert die Behandlung von Patienten mit solchen Infektionen, und führte zu hohen Kosten im Gesundheitswesen 7, 8. Darüber hinaus ist zu betonen, dass die meisten bisherigen Studien mit Antibiotika Ergebnisse in klinischen Umgebungen zugrunde gelegt wurden, so dass sie möglicherweise auch durch den Host Faktoren variiert von Patient zu Patient beeinflusst werden. Daher ist ein Tiermodell der endovaskulären Infektion in dem Host-Faktoren sind ähnlich von Tier zu Tier mehrentscheidend für mikrobielle Pathogenese als auch die Wirksamkeit neuer antimikrobieller Substanzen zu erforschen. Endokarditis bei Ratte ist ein etabliertes Tiermodell, der nahe menschlichen nativen Klappe Endokarditis. Dieses Modell wurde genutzt, um die Rolle von bestimmten Staphylokokken-Virulenzfaktoren und die Wirksamkeit von Antibiotika-Behandlungsregime für Staphylokokken-Endokarditis zu untersuchen. In diesem Bericht beschreiben wir die experimentellen Modell Endokarditis durch MRSA, die verwendet werden, um bakterielle Pathogenese und Reaktion auf Antibiotika-Behandlung untersucht werden konnte.
Protokoll
1. Vorbereiten der MRSA-Stämme für Infektionsforschung
- Impfen eine Öse MRSA Kultur aus einem Vorrat Rohr bei -80 ° C zu einer Schafblut Trypticase Soy Agar (TSA) Platte (siehe Tabelle der spezifischen Reagenzien und Ausrüstung), und inkubieren Sie bei 37 ° C über Nacht.
- Überprüfen Sie die Reinheit der Kultur auf das Blut-Agar-Platte (ähnlich Kolonie Phänotypen), um sicherzustellen, gibt es keine Kontamination.
- Wählen Sie eine Kolonie aus dem Schafblut TSA-Platte und beimpfen die Kolonie in 5 ml Trypton-Soja-Bouillon (TSB) in einem 15 ml-Snap-Röhrchen.
- Bei 37 ° C über Nacht unter Schütteln bei 200 UpM.
2. Vorbereiten Chirurgie Katheter
Schneiden Sie Polyethylenschlauch (PE10;. Becton Dickinson, Best.-Nr. 427401) bis 10 cm Länge, und schmelzen Sie ein Ende, indem Sie die Spitze mit einer sterilen Pinzette. Der Zweck Abdichten eines Endes des Katheters ist, um eine Blutung während der Katheterisierung zu vermeiden.
3. Pre-enurgery Vorbereitung und Anästhesie
- Ort Sprague-Dawley Ratten (Harlan, Indianapolis, Ind. weiblich, 250-300 Gramm) in einer Kammer mit Isofluran-Sauerstoff-Gasgemisch (50%: 50%), bis die Betäubung wirksam wird (z. B. Muskeln sind entspannt und Pedal Reflexe fehlen ) und verwalten Tiere in einer anästhesierten Zustand während der Operation mit dem Gasgemisch.
- Reinigen Sie die Hals-Bereich von Kinn bis knapp unterhalb des Brustbeins mit Betadin und 70% Ethanol.
4. Chirurgisches Vorgehen
- Verwenden steriler Technik in der Chirurgie. Einen Einschnitt (1-1,5 cm) vertikal nur durch die Hautschicht des Halses über dem Brustbein.
- Mit einem stumpfen Instrument trennen die Faszie an der rechten Halsschlagader mit 2 Paar gebogene Hakenpinzette aussetzen.
- Ziehen Sie die Arterie nach oben aus Hals Hohlraum, und Platz zwei 10 cm Länge der Seidenfaden unter der Arterie und bindet von der Arterie an der exponierten Kopfende, platzieren Sie einen Clip auf der artery, um eine Blutung zu verhindern.
- Machen Sie ein kleines Loch in der Spitze der Arterie mit einem Katheter Einführhilfe (Becton Dickinson, Bestell-Nr. 406999), legen Sie einen Katheter mit einer Pinzette durch das Loch in der Arterie, entfernen Sie den Clip und drücken Sie den Katheter zum Herzen hin, bis ein Widerstand erfüllt ist.
- Binden Sie die losen Fäden rund um den kaudalen Ende der Arterie und sichern Sie den Katheter an Ort und Stelle mit dem seidenen Faden, wenn der Katheter ist an Ort und Stelle, wie bestimmt durch: i) die Länge der Katheter eingeführt (4-5 cm), ii) Widerstand gegen eine weitere Förderung und iii) Pulsation des Katheters mit dem Herzschlag. Lassen Sie den Katheter an Ort für den Rest des Experiments.
- Schneiden Sie überschüssige Faden und Katheter Enden, und stellen Sie sicher, dass es keine Blutung aus dem Katheter. Stecken Sie die losen Enden unter die Haut des Halses und schließen Sie die Haut mit Haut-Clips.
- Legen Sie die Ratte im Käfig an einem warmen Ort, bis von der Narkose erholt und bieten Nahrung und Wasser. Überprüfen Sie die Ratte häufig während undnach dem Erwachen aus der Narkose.
- Diese Operation ist eine "Kategorie E"-Verfahren. Die Verfahren produziert Schmerz ist unrelieved von Analgetika seit MRSA-Infektionen begleitende Leiden für die Tiere.
5. MRSA-Infektion
- Eine Infektion kann zwischen 1 und 7 Tagen nach der Operation durchgeführt werden, aber halten Sie innerhalb von Experimenten konsistent.
- Sauberkeit Rattenschwanz mit 70% Ethanol und 0,5 ml Injektion MRSA an einer gewünschten Zellen (Oktober 4 - Oktober 6 cfu / Tier für den S.-aureus-Stämme). Mit 27 G 1/2 Zoll Nadel intravenös aus der Schwanzvene Achtung : MRSA-Kultur gehört zu Biosicherheitsstufe 2 (BSL2) und hat eine mäßige potenzielle Gefahr für Mensch und Umwelt.
- Halten Sie Druck auf der Baustelle, bis eine Blutstillung vor der Rückkehr der Ratte in den Käfig.
6. Sacrifice Ratten und Kultur Zielgewebe
- Opfer Ratten durch ip-Injektion von Natriumpentobarbital (200 mg/ Kg) nach 1 bis 6 Tage nach der Infektion.
- Legen Sie die Ratte auf den Rücken und wischen Sie die Brust mit 70% Ethanol.
- Machen Sie einen V-förmigen Schnitt im Brustkorb unterhalb Brustbein, und schneiden Sie die Knorpel der Rippen auf beiden Seiten des Brustbeins, um das Herz freizulegen.
- Ziehen Sie das Herz sanft und Clip durch das Herzgewebe nahe an der Aorta und sezieren bis das Herz zu befreien.
- Legen Sie die Innenstadt, in einer sterilen Petrischale mit 4x4 Zoll Gaze innen, machen Sie einen Schnitt durch die linksventrikuläre Innenwand und öffnen Sie den linksseitigen Kammer.
- Überprüfen Sie visuell auf Katheterplatzierung. Untersuchen und entfernen Vegetationen aus dem Ventil mit Schere und Pinzette.
- Wiegen und Homogenisierung der Vegetation und machen serielle Verdünnungen mit PBS für quantitative Kultur.
7. Repräsentative Ergebnisse
Unmittelbar nach dem Einsetzen des Katheters in die Arterie und schiebt den Katheter etwa 4-5 cm in Richtung des Herzens, wird ein Widerstand sein ErfahCED. Wenn kein Widerstand gemessen wird, kann der Katheter nicht erfolgreich in die linke Seite des Herzens Kammer eingeführt worden sind, wozu auch der Platzierung des Katheters zu beeinträchtigen. Eine korrekte Platzierung des Katheters zuvor veröffentlicht 9 ist in Abbildung 1 dargestellt.
Ein Teil der MRSA-Infektion Proben müssen quantitative kultivierten die sicherstellen, dass die genaue lebensfähige Keimzahl für die Infektion und die Reinheit der Probe Infektion. Darüber hinaus sollten die Organismen gewonnen aus Vegetationen die gleichen wie die in dem Inokulum verwendet werden.
Tabelle 1 zeigt ein Beispiel für die Virulenz eines S. aureus-Stamm in der Ratte Endokarditis-Modell die bisher 9 veröffentlicht wurde. Alle Tiere mit Inokula von 10 5 und 10 6 cfu herausgefordert und geopfert zwischen 3 bis 6 Tage nach der Infektion entwickelt endocardits mit hoher S. aureus Dichten der kardialen Vegetationen sowie Niere und Milz ( Tabelle 1). Ratten, die mit sterilen Ventil Kulturen gelten als nicht infizierte.
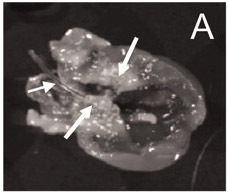
Abbildung 1. Der Katheter ist in einem richtigen Stelle (linke Seite der Herzkammer), und zahlreiche Vegetationen sichtbar sind rund um die Aortenklappen 9.
| Inokulum (Anzahl der Animas) | Mittleren log 10 KBE / g Gewebe ± SD ein in: | ||
| Vegetation | Niere | Milz | |
| 10 6 KBE / Tier (9) | 10,36 ± 0,85 | 7,30 ± 0,64 | 6,70 ± 0,57 |
| 10 5 CFU / Tier (8) | 9,93 ± 0,53 | 7,14 ± 0,53 | 6,44 ± 0,63 |
| 10 4 KBE / Tier (7) | 3,46 ± 0,50 * | 1,81 ± 0,74 * | 1,58 ± 0,59 * |
eine SD, Standardabweichung. P <0,001 in Bezug auf 10 5 oder 10 6 CFU-Challenge Tieren.
Tabelle 1. S. aureus Dichte der kardialen Vegetationen mit verschiedenen Inokula in der Ratte Endokarditis Modell 9.
Diskussion
Die Ratte Endokarditis ist eine wichtige und gut charakterisierten Tiermodell für in vivo-Studien in der Pathogenese und Antibiotika in der Behandlung von bakteriellen Infektionen 9-11. Darüber hinaus stellt Ratte Endokarditis Modell eines Verbundes von akuter und sub-akute Infektionen, und ahmt menschlichen Gegenüber und menschlichen nativen Klappe Endokarditis. Darüber hinaus begleitet von einer in Dauerkatheter, stellt sie eine klassische Biofilm-assoziierte Infektionen, eine gemeinsame und sc...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der US National Institutes of Health [Zuschuss R01AI-39108 zu ASB] und der American Heart Association [Zuschüsse SDG 0630219N und AID 09GRNT2180065 zu YQX].
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Blutagarplatte, 5% Schafblut in Trypticase Soy Agar (TSA) | Hardy Diagnostics | A10BX | |
| Trypticase Soy Broth (TSB) | Becton Dickinson | 211825 | |
| Schüttelinkubator | Labnet | I5311-DS | |
| Polyethylen-Rohr | Becton Dickinson | 427401 | |
| Kathetereinführvorrichtung | Becton Dickinson | 6999 | |
| Isofluorance | Western Medical Suppy, Inc. | 2147 | Folgen Sie Sicherheit und Handhabung Informationen |
| Chirurgische Instrumente | Fine Science Tools und Biomedical Research Instruments, Inc. | Finden Sie die Instrumente aus den beiden Unternehmen für Ihre Bedürfnisse |
Referenzen
- Petti, C. A., Fowler, V. G. Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin. 21, 219-233 (2003).
- Bashore, T. M., Cabell, C., Fowler, V. Update on infective endocarditis. Curr. Probl. Cardiol. 31, 274-352 (2006).
- Fowler, V. G., Justice, A., Moore, C. Risk factors for hematogenous complications of intravascular catheter-associated Staphylococcus aureus bacteremia. Clin. Infect. Dis. 17, 313-320 (1993).
- Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis. 39, 309-317 (2004).
- Hoen, B. Special issues in the management of infective endocarditis caused by gram-positive cocci. Infect Dis. Clin. North Am. 16, 437-452 (2002).
- Moise, P. A., Hershberger, E., Amodio-Groton, M. I., Lamp, K. C. Safety and clinical outcomes when utilizing high-dose (> or =8 mg/kg) daptomycin therapy. Ann. Pharmacother. 43, 1211-1219 (2009).
- Sakoulas, G., Brown, J., Lamp, K. C., Friedrich, L. V., Lindfield, K. C. Clinical outcomes of patients receiving daptomycin for the treatment of Staphylococcus aureus infections and assessment of clinical factors for daptomycin failure: a retrospective cohort study utilizing the Cubicin Outcomes Registry and Experience. Clin. Ther. 31, 1936-1945 (2009).
- Xiong, Y. Q., Willard, J., Kadurugamuwa, J. L., Yu, J., Francis, K. P., Bayer, A. S. Real-time in vivo bioluminescent imaging for evaluating the efficacy of antibiotics in a rat Staphylococcus aureus endocarditis model. Antimicrob. Agents Chemother. 49, 380-387 (2005).
- Peerschke, E. I., Bayer, A. S., Ghebrehiwet, B., Xiong, Y. Q. gC1qR/p33 blockade reduces Staphylococcus aureus colonization of target tissues in an animal model of infective endocarditis. Infect. Immun. 74, 4418-4423 (2006).
- Ganesh, V. K., Rivera, J. J., Smeds, E. A structural model of the Staphylococcus aureus ClfA-fibrinogen interaction opens new avenues for the design of anti-staphylococcal therapeutics. PLoS Pathog. 4, e1000226 (2008).
- Boles, B. R., Horswill, A. R. Staphylococcal biofilm disassembly. Trends Microbiol. , (2011).
- Tseng, C. W., Sanchez-Martinez, M., Arruda, A., Liu, G. Y. Subcutaneous Infection of Methicillin Resistant Staphylococcus Aureus (MRSA). J. Vis. Exp. (48), e2528 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten