Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vitro-Assay Mesothelzellen Ausverkauf, dass die Modelle der frühen Schritte der Metastasierung Eierstockkrebs
In diesem Artikel
Zusammenfassung
Die Mesothelzellen-Clearance-Test hier beschriebenen nutzt die Vorteile der fluoreszenzmarkierten Zellen und Zeitraffer-Video-Mikroskopie zu visualisieren und quantitativ zu messen die Wechselwirkungen von Eierstockkrebs mehrzelligen Sphäroiden und Mesothelzelle Monoschichten. Dieser Test modelliert die frühen Schritte der Metastasierung Eierstockkrebs.
Zusammenfassung
Eierstockkrebs ist die fünfte führende Ursache von Krebs verursachten Todesfälle in den Vereinigten Staaten ein. Trotz eines positiven ersten Reaktion auf Therapien, entwickeln 70 bis 90 Prozent der Frauen mit Eierstockkrebs neue Metastasen, und die Rezidivrate ist oft tödlich 2. Es ist daher notwendig, zu verstehen, wie sekundäre Metastasen entstehen, um bessere Behandlungen für Zwischen-und Spätstadium Eierstockkrebs entwickeln. Ovarialkarzinom Metastasen tritt auf, wenn bösartige Zellen aus dem Primärtumor Ort lösen und zu verbreiten, in der gesamten Bauchhöhle. Die disseminierten Zellen können vielzelligen Cluster oder Sphäroide, die entweder ungebunden bleiben wird, oder das Implantat auf Organe in der Bauchhöhle 3 (Abbildung 1, Movie 1) zu bilden.
Alle Organe in der Bauchhöhle mit einem einzigen, kontinuierlichen, Schicht von Mesothelzellen 4-6 (2) ausgekleidet ist. Allerdings sind Mesothelzellen abwesend von untenPeritoneal Tumormassen, wie durch eine elektronenmikroskopische Aufnahme von Studien ausgeschnitten humanem Tumorgewebe Abschnitten 3,5-7 (2) offenbart. Dies deutet darauf hin, dass Mesothelzellen von der Unterseite der Tumormasse sind von einem unbekannten Prozess ausgeschlossen.
Zurück in vitro Experimente zeigten, dass primäre Ovarialkarzinom Zellen effizienter zu befestigen extrazellulären Matrix, als Mesothelzellen 8, und neuere Studien zeigten, dass die primäre peritoneale Mesothelzellen tatsächlich eine Barriere für Eierstockkrebs Zelladhäsion und Invasion (im Gegensatz zu Adhäsion und Invasion im Vergleich auf Substraten, die nicht mit Mesothelzellen bedeckt waren) 9,10. Dies würde darauf hindeuten, dass Mesothelzellen als Barriere gegen Eierstock-Krebs Metastasen handeln. Die zellulären und molekularen Mechanismen, durch die Eierstockkrebszellen diese Barriere zu durchbrechen, und schließt die Mesothel haben bis vor kurzem unbekannt geblieben.
Hier beschreiben wir the-Methodik für ein in-vitro-Test, dass die Modelle der Wechselwirkung zwischen Eierstockkrebszelllinien Sphäroide und Mesothelzellen in vivo (Abbildung 3, Movie 2). Unser Protokoll wurde von bisher beschriebenen Methoden zur Analyse Eierstocktumorzelllinien Interaktionen mit Mesothelzellen Monoschichten 16.8 angepasst, und wurde zum ersten Mal in einem Bericht zeigt, dass Eierstocktumorzellen verwenden einen Integrin-abhängige Aktivierung von Myosin und Zugkraft auf den Ausschluss von der Förderung beschrieben Mesothelzellen von unter einem Tumor Sphäroid 17. Dieses Modell nutzt die Vorteile der Zeitraffer-Fluoreszenz-Mikroskopie, die beiden Zellpopulationen in Echtzeit zu überwachen und bietet räumliche und zeitliche Informationen über die Wechselwirkung. Die Eierstockkrebs exprimieren rot fluoreszierendes Protein (RFP), während die Mesothelzellen grün fluoreszierendes Protein (GFP). RFP-exprimierenden Eierstockkrebszelllinien Sphäroiden auf die GFP-exprimierenden Mesothelzellen Monoschicht zu befestigen. Die Sphäroide Verbreitung, einzudringen, undzwingen die Mesothelzellen beiseite schaffen ein Loch in der Monoschicht. Dieses Loch wird visualisiert als der negative Raum (schwarz) in der GFP-Bild. Die Fläche des Loches kann dann gemessen werden, um quantitativ die Unterschiede hinsichtlich des Clearance-Aktivität zwischen der Kontrolle und Populationen von Eierstockkrebs und / oder Mesothelzellen werden. Dieser Assay erfordert nur eine kleine Anzahl von Eierstockkrebszellen (100 Zellen pro Sphäroid x 20-30 Sphäroide pro Bedingung), so ist es möglich, diesen Assay unter Verwendung von wertvollen primären Tumorzelle Proben. Ferner kann dieser Assay einfach für Hochdurchsatz-Screening angepasst werden.
Protokoll
1. Eierstockkrebszelllinien Spheroid Formation
- RFP-exprimierenden Eierstockkrebs Zellen werden in 10% Base-Medium (ein benutzerdefiniertes Zellkulturmedium, das ein 50:50-Gemisch von 199 und MCDB105, 10% fötales Rinderserum und 1% Pen-Strep) kultiviert. Um RFP in unmarkierten Eierstockkrebs zu exprimieren, zu transfizieren der Zellen mit einem Plasmid, das RFP und wählen für Zellen RFP. Alternativ können virale Vektoren verwendet werden, um transient exprimieren fluoreszierende Proteine, oder Zellen können vor inkubieren mit einem roten Fluoreszenzfarbstoff Zelle Tracker-Farbstoff (Invitrogen).
- Vor der Bildung von Eierstockkrebs Sphäroide, ist es notwendig, mit geringer Haftung 96 Well Rundboden Kulturschalen vorbereitet. Um die geringer Haftung Kultur Herstellung von Platten und 30μl Poly-HEMA (6 mg Polyhydroxyethylmethacrylat in 1 ml 95% EtOH)-Lösung in jede Vertiefung einer 96-Well Corning Zellkulturschale zugegeben. Die 96-Well-Platten werden in einem 37 ° C nicht-befeuchteten Inkubator, um das Ethanol, l verdunsten inkubierteaving eine Folie aus Poly-HEMA auf jeder Vertiefung. Diese Poly-HEMA-Film verhindert, dass Zellen Befestigung am Boden der Vertiefung und zwingt die Zellen in Suspension 18 wachsen. [Alternativ kann Ultra-Low Befestigung Kultur-Platten (Corning) anstelle von Poly-HEMA beschichteten Schalen verwendet werden.]
- Nach dem niedrigen Kraftschlußbeiwert Kultur-Platten hergestellt werden, trypsinieren einen Teller mit Eierstockkrebs Zellen, Pellet die Zellen in einer Tischzentrifuge (Heraeus) bei 900 RCF für 3 Minuten, den Überstand aspirieren und in 10% Basismedium erneut zu suspendieren.
- Zählen Sie die Zellen mit einer Zählkammer.
- Die Konzentration der Zellen, so dass es 100 Zellen pro 50 ul von 10% Base-Medium.
- In 50 ul der gleichmäßig suspendiert verdünnten Zellsuspension in jede Vertiefung der 96-Well Poly-HEMA beschichteten Kulturschale.
- Inkubieren der Platte mit 96 Vertiefungen bei 37 ° C Zellkulturbrutschrank für 16 Stunden (der Betrag der Zeit zu erhöhen oder abhängig von der Menge an Zeit, die verringert werdeneine bestimmte Zelllinie zu mehrzelligen Sphäroiden oder gewünschten experimentellen Bedingungen) bilden, um die Eierstockkrebszellen zu Cluster zusammen zu ermöglichen, wobei ein einzelner vielzelligen Sphäroid in jede Vertiefung. Einige Tumorzellen Apoptose während dieser Zeit unterziehen, so ist es wichtig, eine Zeit vor der Induktion der Apoptose zu wählen.
2. Mesothelzelle Monoschichtbildung
- In einer Zellkultur Haube vor die Vertiefungen von einer 6-Well-Glasboden MatTek Schale mit Fibronectin durch Zugabe von 2 ml einer 5μg Fibronectin / ml PBS-Lösung in jede Vertiefung der Schale und Inkubieren bei Raumtemperatur für 30 Minuten. Die optische Qualität der Glas-Böden in MatTek Gerichte erlauben hochauflösende mikroskopische Bildgebung.
- GFP-exprimierende Mesothelzellen werden in 10% Base-Medium kultiviert. Trypsinieren eine Platte von Mesothelzellen, Spin-down in einer Tischzentrifuge (Heraeus) bei 900 UPM für 3 Minuten, den Überstand aspirieren, und in 10% Basismedium erneut zu suspendieren. DieMesothelzellen welche hier bereits die GFP exprimieren, wenn sie stammen, aber nicht markiertem Mesothelzellen können durch Transfektion mit einem Plasmid, das GFP-cDNA oder Vorinkubation der Zellen in einem grün fluoreszierenden Zellen-Tracker-Farbstoff (Invitrogen) hergestellt werden.
- Nach dem 30-minütigen Inkubation Fibronektin (in Schritt 2.1), waschen Sie die Vertiefungen der MatTek Schüssel mit 2 ml PBS.
- Absaugen des PBS und Platte 6 x 10 5 Mesothelzelle pro Vertiefung in jede Vertiefung der 6-Well-MatTek Schale. Inkubieren MatTek Schale in einem 37 ° C Zellkultur Inkubator über Nacht, damit die Mesothelzellen auf der Schale an und bilden eine Monoschicht.
3. Mesothelzelle Abstand Assay
- Verwenden Sie eine Pipette, die Eierstockkrebs Sphäroiden aus dem 96-Loch-Poly-HEMA beschichteten Platte zu sammeln.
- Saugen Sie das Medium aus einem Brunnen der 6 gut MatTek Schale mit Mesothelzellen Zellmonolayer. Waschen Sie einmal mit 2 ml PBS. In all der Sphäroide aus dem 96-Loch-pspät, um eine Vertiefung der MatTek Schale (~ 3x die Anzahl von Kugeln, die er zu machen Sphäroide Landung ist für den Teil der Schale, die nicht abgebildet werden kann abgebildet werden).
- Setzen Sie den MatTek Schüssel auf der Bühne eines umgekehrten Weitfeld-Fluoreszenzmikroskop ausführen kann Zeitraffer-Bildgebung für die Dauer von mindestens 8 Stunden. Verwenden Sie einen motorisierten Tisch zu Bild mehrere Positionen in der Schale, mit mehreren Sphäroid Interkalation Veranstaltungen, in einem einzigen Experiment. Wir verwenden eine Nikon Ti-E umgekehrt Motorisierte Weitfeld-Fluoreszenz Zeitraffer-Mikroskop mit integriertem Perfect Focus System und Low [20x-0.75 numerischen Apertur (NA)] Vergrößerung / NA Differential Interferenz Kontrast (DIC)-Optik, eine Nikon Halogen-Transilluminator mit 0,52 NA großem Arbeitsabstand (LWD) Kondensator, Nikon schnelle (<100-Millisekunden Schaltzeit) Anregungs-und Emissions-Filter (GFP Ex 480/40, Em 525/50, RFP-mCherry Ex 575/50 Em 640/50), Sutter schnell übertragen und Epifluoreszenz Lichtweg Smart-Absperrter, eine Nikon linear-kodierte motorisiertem Tisch, ein Hamamatsu ORCA-AG gekühlt Charge-Coupled Device (CCD)-Kamera, ein custom-built Mikroskop Inkubationskammer mit Temperatur und CO 2-Steuerung, Nikon NIS-Elements AR-Software Version 3, und ein TMC Schwingungsisolation Tisch.
- Die Eierstockkrebszelllinien Sphäroide wird an der Unterseite der Schale absetzen und heften sich an die Mesothelzellen Zellmonolayer. Sammle GFP, RFP und Bilder von Phase 20 + Sphäroid / Monoschicht Interaktionen, alle 10 Minuten, für 8 Stunden.
- Die RFP-exprimierenden Ovarialkarzinomzellen Sphäroide wird in die GFP-exprimierenden Mesothelzelle Monoschicht ein Loch in der Monoschicht einzudringen. Nach 8 Stunden Messung der Größe der Löcher, indem es die schwarzen Löcher in den GFP-Bild mit Elements Software (oder eine andere geeignete Software wie Bild J). Normalisieren der Lochgröße auf die ursprüngliche Größe Sphäroid durch Dividieren der Lochgröße zu 8 Stunden nach der Größe des Sphäroids in der entsprechenden RFP Bild zum Zeitpunkt Null. In diesem ehemaligenreichlich, wurde das Loch Größe nur einmal gemessen, sondern es kann mehrere Male während der 8 Stunden Experiment gemessen werden zum besseren Verständnis der Dynamik der Einlagerung.
4. Repräsentative Ergebnisse
In diesem Beispiel, verglichen wir die Fähigkeit von Mesothelzellen Abstand OVCA433 Ovarialkarzinomzellen Sphäroide, die gedämpft Expression von Talin-1 bis OVCA433 Sphäroide zu kontrollieren. OVCA433 Sphäroide aus jeder Gruppe wurden in einen MatTek Schale mit ZT Mesothelzelle Monoschichten zugegeben. Sechs Sphäroide aus jeder Gruppe wurden alle 10 Minuten für 8 Stunden (Abbildung 4, Movie 3, Movie 4) abgebildet. Die Löcher in der Monoschicht durch den sich ausbreitenden kugeln wurden gemessen und sechs Positionen aus jeder Gruppe wurden gemittelt. 4 zeigt, dass die durchschnittliche Fläche der lichten Weite von Talin 1 Zuschlag Sphäroide erzeugt wesentlich kleiner als die durchschnittliche Fläche durch Steuerung Sphäroide geschaffen wurde, was darauf hindeutet, dass Talin für Mesothelzellen Clearance durch O erforderlichVCA433 Eierstockkrebs Sphäroide.
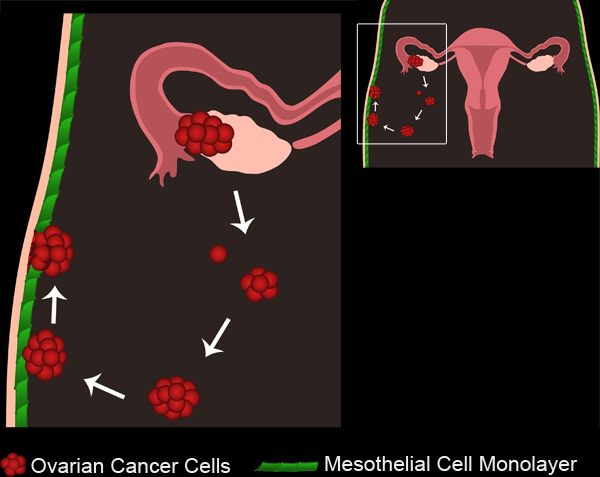
Abbildung 1. Eierstockkrebs Metastasen. Primäre Tumoren der Eierstöcke entwickeln sich entweder aus dem Eierstock Oberflächenepithel oder Eileiter. Tumorzellen / Cluster brechen aus dem Primärtumor und sammeln sich in der Bauchhöhle. Tumorzellen können dann aggregieren, um mehrzellige Sphäroide zu bilden. Sphäroide dann auf die Mesothelzellen Zellmonolayern Auskleidung der Bauchhöhle zu befestigen. Die Mesothelzellen von unterhalb des beigefügten Eierstockkrebs Sphäroids ausgeschlossen, so dass die Kügelchen den Zugriff auf die zugrunde liegende Basalmembran zu gewinnen.
Movie 1. Eierstockkrebs Metastasen. Hier klicken, um Film anzusehen .
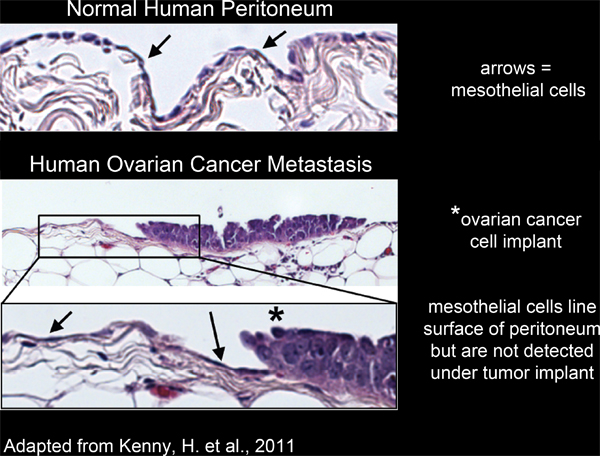
Abbildung 2. Mesothelzellen Linie die Oberfläche der menschlichen Peritoneum und von unterhalb Ovarialkarzinomzellen Implantate ausgeschlossen.
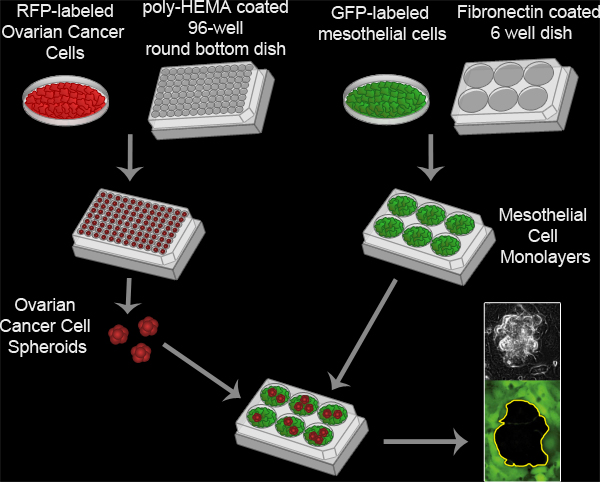
Abbildung 3. Mesothelzellen Abstand Assay. Eierstockkrebs Sphäroide durch Inkubation von 100 ausgebildet RFP-exprimierenden Eierstockkrebs Zellen pro Vertiefung in einem Poly-HEMA beschichteten 96-Well-Rundboden Kulturschale bei 37 ° C für 16 Stunden. Poly-HEMA verhindert, dass die Zellen aus Befestigung an der Kulturschale, so dass die Zellen in Suspension verbleiben und aneinander haften, um einen Cluster pro Vertiefung zu bilden. Mesothelzellen Zellmonoschichten werden durch Beschichten 6x10 5 Mesothelzellen pro Well in einer 6-Well-Fibronectin beschichteten MatTek Schale und Inkubation der Platte bei 37 ° C für 16 Stunden hergestellt. Die Sphäroide werden dann an den MatTek Schale mit Mesothelzellen Monoschicht übertragen und die beiden Zellpopulationen werden alle 10 Minuten für 8 Stunden unter Verwendung eines Nikon Ti-E I abgebildetnverted Motorisierte Weitfeld-Fluoreszenz Zeitraffer-Mikroskop und Software-Elemente.
Movie 2. Mesothelzellen Abstand Assay. Hier klicken, um Film anzusehen .
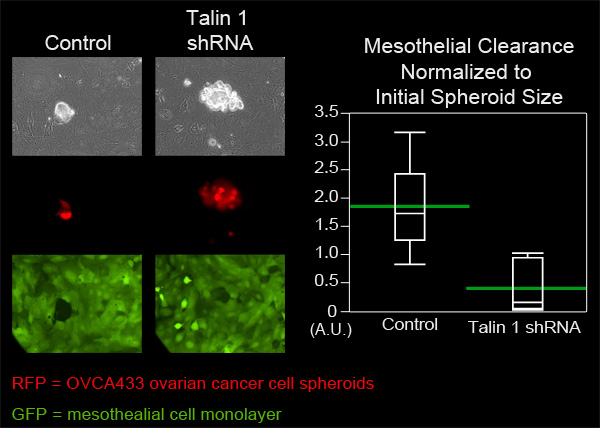
Abbildung 4. Dämpfung von Talin-1-Expression in OVCA433 Sphäroide sinkt Mesothelzellen Clearance Fähigkeit. OVCA433 Sphäroide (rot) mit und ohne abgeschwächte Expression von Talin-1 durften zu befestigen und dringen in eine ZT Mesothelzellen Monolayer (grün). Die beiden Zellpopulationen wurden alle 10 Minuten für 8 Stunden mit einer Nikon Ti-E umgekehrt Motorisierte Weitfeld-Fluoreszenz Zeitraffer-Mikroskop und Software-Elemente abgebildet. Die Grafik zeigt, dass Talin 1 Dämpfungsignifikant abnimmt Mesothelzelle Clearance (Quantil-Plot mit grünen Balken an der Mittel).
Movie 3. Kontrolle OVCA433 Sphäroide (rot) in eine Invasion Mesothelzellen Monolayer (grün). Hier klicken, um Film anzusehen .
Movie 4. Dämpfung von Talin-1-Expression in OVCA433 Sphäroide (rot) nimmt Mesothelzellen (grün)-Clearance Fähigkeit. Klicken Sie hier, um Film anzusehen .
Diskussion
Der "Ausverkauf Mesothelzellen Assay" präsentiert hier verwendet Zeitraffer-Mikroskopie, um die Wechselwirkungen von Eierstockkrebs mehrzelligen Sphäroiden und Mesothelzellen Zellmonolayern überwachen, in der großen räumlichen und zeitlichen Detail. Zuvor hatten mehrere Gruppen 8-14 Endpunkt-Assays verwendet werden, um zu zeigen, dass Eierstock-Krebszellen zu befestigen und dringen in Mesothelzelle Monoschichten. Dieser Assay ist einzigartig, da sie verwendet fluoreszenzmarkierten Zellen Tumorz...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir möchten das Nikon Imaging Center an der Harvard Medical School, speziell Jennifer Waters, Lara und Wendy Petrak Lachs, für die Ausbildung und den Einsatz ihrer Zeitraffer Mikroskope danken. Wir möchten auch an Rosa Ng und Achim Besser für wertvolle Diskussionen danken. Diese Arbeit wurde vom NIH Grant 5695837 (an M. Iwanicki) und GM064346 zu GKI unterstützt; durch einen Zuschuss von Dr. Miriam und Sheldon G. Adelson Medical Research Foundation (bis GKI).
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog-Zahl | Kommentare |
| OVCA433 Eierstockkrebszellen | Geschenk von Dr. Dennis Slamon | ||
| ZT Mesothelzellen | Geschenk von Dr. Tan Ince | ||
| Medium 199 | Gibco | 19950 | |
| MCDB105 | Cell-Anwendungen Inc. | 117-500 | |
| FBS-hitzeinaktiviertem | Gibco | 10082 | |
| Pen-Strep | Gibco | 15070 | |
| Platten mit 96 Vertiefungen | Corning Costar | 3799 | |
| Polyhydroxyethylmethacrylat (Poly-HEMA) | Sigma Aldrich | 192066-25G | Für Poly-HEMA-Lösung aufzulösen 6 mg Poly-HEMA-Pulver in 1 ml 95% EtOH |
| EtOH | Pharmco-Aaper | 111ACS200 | Verdünnen Sie bis 95% in dH 2 0 |
| Zellkultur Haube | NuAire | NU-425-300 | |
| Zellkultur-Inkubator | Thermo Scientific | 3110 | |
| Inkubator für Poly-HEMA-Platten | Labline Instruments | Kaiserliche III 305 | |
| Tischzentrifuge | Heraeus | 75003429/01 | |
| 6 gut Glasboden-Schüssel | MatTek corp. | P06G-1.5-20-F | |
| Fibronektin | Sigma | F1141-1MG | |
| PBS | Cellgro | 21 bis 040-CV | |
| Zeitraffer-Mikroskop: | |||
| Mikroskop | Nikon | Ti-E Inverted Motorisierte Fluoreszenz-Zeitraffer-Mikroskop mit integriertem Perfect Focus System | |
| Objektiv | Nikon | 20X-0.75 numerische apeture | |
| Halogen-Transilluminator | Nikon | 0,52 NA Kondensor für langen Arbeitsabstand | |
| Anregungs-und Emissionsfilter | Chroma Single-Pass-Filter in Nikon-Gehäuse | GFP-Ex 480/40, Em 525/50 RFP-mCherry Ex 575/50 Em 640/50 | |
| Übertragen und Epifluoresce Lichtweg | Sutter | Smart-Fensterläden | |
| Linear-kodierte Motortisch | Nikon | ||
| Gekühlte Charged-Coupled Device-Kamera | Hamamatsu | ORCA-AG | |
| Mikroskop Inkubationskammer mit Temperatur und CO 2-Steuerung | custom-built | ||
| Schwingungsisolierung Tisch | TMC | ||
| NIS-Elements-Software | Nikon | Version 3 |
Referenzen
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten