Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung und Kultivierung von embryonalen Ratten-Nervenzellen: ein Quick-Protokoll
In diesem Artikel
Zusammenfassung
Wir beschreiben eine schnelle Methode zur Isolierung und Kultur hippokampalen und kortikalen Neuronen aus Nagetier Embryonen. Dieses Protokoll erlaubt es uns, Experimente, in denen nahezu reinen neuronalen Kulturen sind erforderlich, durchzuführen.
Zusammenfassung
Wir beschreiben eine schnelle Methode zur Dissoziation und Kultur oder kortikalen Neuronen des Hippocampus von E15-17 Rattenembryonen. Das Verfahren kann erfolgreich zur Isolierung von Maus und Mensch primären Neuronen und neuralen Vorläuferzellen angewendet werden. Dissoziierte Neuronen in serumfreiem Medium bis zu mehreren Wochen aufrechterhalten. Diese Kulturen können Nukleofektion, Immunzytochemie, Nukleinsäuren Herstellung sowie Elektrophysiologie verwendet werden. Ältere neuronalen Kulturen können auch mit einem guten Wirkungsgrad von lentiviralen Transduktion und, weniger effizient, mit Calciumphosphat oder Lipid-basierte Methoden wie Lipofectamin transfiziert werden.
Protokoll
1. Poly-D-Lysin (PDL): Herstellung
- 5 ml sterilem ddH 2 O bis 5 mg PDL um eine Stammlösung von 1 mg / ml zu erhalten.
- Mischen Sie Stammlösung durch mehrmaliges Pipettieren.
- Sofort verwenden oder speichern Poly-D-Lysin-Lösung bei 2-8 ° C.
2. Poly-D-Lysin (PDL): Beschichtung Zellkulturschalen
- Verdünnen Sie die PDL-Stammlösung mit sterilem ddH 2 O auf die Endkonzentration von 10 ug / ml.
- Pipette genug Lösung in eine 60 mm-Schale zur Kultur-Oberfläche (3 ml für eine 60 mm-Schale) zu decken.
- Schaukeln sanft auf gleichmäßige Beschichtung der Oberfläche Kultur zu gewährleisten.
- Inkubieren beschichtete Platten bei Raumtemperatur (RT) über Nacht.
- Am nächsten Tag, in der Regel der Tag der Dissektion, entfernen Sie das Poly-D-Lysin-Lösung durch Absaugen und waschen kurz mit 3 ml sterilem ddH 2 O. Wiederholen Sie diesen Schritt. Nach dem zweiten Waschen, Wasser vollständig zu entfernen durch Absaugen.
- Die Platten können bei 4 ° C für bis zu drei Wochen gelagert werden.
3. Poly-D-Lysin (PDL) und Laminin: Vorbereitung und Beschichtung von Glas Zwei-Kammer-Objektträgern
- Mix PDL (1 mg / ml) und Laminin (1 mg / ml) Stammlösungen in sterilem ddH 2 O bis zu einer Endkonzentration von 10 und 5 g / ml.
- Pipette genug Lösung in die Vertiefungen einer Glas Zwei-Kammer-Objektträger, die Kultur Oberfläche (1 ml pro Vertiefung einer 2 gut Glas Zwei-Kammer-Objektträger) bestimmt.
- Schaukeln sanft auf gleichmäßige Beschichtung der Oberfläche Kultur zu gewährleisten.
- Inkubieren beschichteten Platten über Nacht bei RT.
- Am nächsten Tag, entfernen Sie das Poly-D-Lysin-Beschichtung Laminin-Lösung durch Absaugen und waschen Sie kurz zweimal mit 1 ml sterilem ddH 2 O. Nach dem zweiten Waschen, Wasser vollständig zu entfernen durch Absaugen.
- Chamber Slides können bei 4 ° C für bis zu drei Wochen gelagert werden.
Hinweis: Jeder Glas Chamber Slide können beschichtet werden following dieses Protokoll. Wir verwenden oft die Zwei-Kammer-Objektträgern, weil jede Folie ermöglicht die Steuerung-Test experimentellen Setting (z. B. im Vergleich zu unbehandelten behandelt, im Vergleich zu untransfizierte transfiziert).
4. Neuronale Dissection und Kultur
- Wärmen Sie die folgenden Reagenzien in einem 37 ° C warmes Wasserbad:
- TrypLE Express auf seiner ursprünglichen 100 ml Flasche.
- Neurobasal/B27 Vollmedium (siehe Tabelle I). Das Volumen erwärmt hängt von der Anzahl der Gänge zu plattierenden (zB 30 ml für zehn 60 mm beschichtet Geschirr).
- 3 ml kaltem Ruhezustand E-Lösung, um vier 60 mm-Kulturschalen und 13 ml einer 15 ml Falcon BD hohe Klarheit Polypropylen konische Röhre.
- In 25-30 ml kaltem Dissektion Medium (siehe Tabelle II, Dr. Olimpia Meucci, persönliche Mitteilung) zu jeder der drei 100 mm-Kulturschalen. Diese Platten, die eine große Volumen des Mediums, wird verwendet, um die Embryonen unmittelbar nach ihrer waschenEntnahme aus den Fruchtblasen (Schritte 4.7 und 4.8).
- Euthanize einen E17 timed trächtigen Ratten durch CO 2 in Übereinstimmung mit Public Health Services Policy über humane Pflege und Verwendung von Labortieren und unter einer institutionell genehmigt Tierpflege und nutzen Protokoll.
- Sprühen Sie Unterbauch mit 70% EtOH und schneiden medial durch die Haut und Muskeln mit einer Schere Aussetzen der Gebärmutter und Embryonen.
- Entfernen Sie alle Föten und legen Sie sie in einem sterilen 100-mm-Schale mit einem Überschuß von kaltem Medium Dissektion (25-30 ml, siehe Schritt 4.3).
- Schneiden Embryonen mit Hilfe eines kleinen Schere aus Fruchtblase und legen Sie sie in der zweiten 100-mm-Schale mit kaltem Medium Dissektion.
- Waschen der Embryonen bei Raumtemperatur durch leichtes Kippen des 100-mm-Schale für 5-10 Sekunden. Dann übertragen Sie die gespülten Embryonen in die dritte Schale mit 100 mm Sezieren Medium. Zwei Waschungen in überschüssige Medium sind in der Regel aus, um alle Spuren von Blut zu entfernen. Jedoch, wenn notwendig,Essary, waschen Sie ein weiteres Mal mit einer frischen 100-mm-Schale mit 25-30 ml kaltem Medium Dissektion.
- Mit einem Stereomikroskop und einer gebogenen Pinzette, extrahieren jeder Ratte Embryo das Gehirn durch Herausziehen der Haut und Schädel. Zeigen gesamte Gehirn in einem der 60-mm-Schalen (in der Regel mit nicht mehr als 5 Gehirne pro Schale) mit kaltem Hibernate E. Bewahren Sie diese Platten auf Eis.
- Nehmen Sie eine Schüssel zu einer Zeit und unter einem Binokular, trennen Sie die Hemisphären und isolieren die zerebralen Kortex Entfernen des Mittelhirns und der Hirnhäute.
- Optional: Schnitt Gehirne auf die Mittellinie, extrahieren hippocampi, und gehen Sie folgendermaßen vor, um Hippocampus-Neuronen zu isolieren.
- Sammeln Sie alle seziert Kortex in einem 15-ml klare konischen Rohr mit 13 ml kaltem Hibernate E. Lassen Sie die zerebralen Kortex auf Eis, bis alle Sektionen abgeschlossen sind. Aufgrund ihrer geringen Größe kann präpariert hippocampi in einem 1,5-ml-Eppendorf-Röhrchen anstelle einer 15-ml-Röhrchen gesammelt werden. Falls gewünscht, in diesem Schritt Kortex oderhippocampi in einem Kryoröhrchen Fläschchen mit 1 ml gebracht werden Ruhezustand E + B27 + 2% Gentamicin (50 ug / ml) + Fungizone (250 ng / ml) im Verhältnis von 2-4 oder 2-4 Kortex hippocampi pro Röhrchen. Hirngewebe bei 4 ° C im Dunkeln bis zu einer Woche (späteren Zeiten nicht noch nicht getestet) gespeichert werden. Bei Bedarf nutzen, um die feinen Pinzette Hirngewebe in ein 15 ml Röhrchen mit Hibernate E übertragen und folgen Sie dann das Protokoll unten, um Neuronen zu isolieren.
- Übertragen der Röhre eine Gewebekulturabzug. Lassen Sie die Rinden auf dem Boden des Röhrchens absetzen und dann vorsichtig den Überstand.
- In 13 ml frisch Hibernate E an den 15-ml konischen Röhrchen, erlauben Kortex am Boden des Röhrchens absetzen und entfernen Sie vorsichtig den Überstand. Wiederholen Sie diesen Schritt 2 weitere Male und nach dem letzten Waschen, sorgfältig entfernen Sie alle Medien.
- Enzymatisch verdauen zerebralen Kortex mit indem 1-2 ml (abhängig von der Anzahl Rindenanzahl; verbrauchen weniger für hippocampi Trennung) von warmem TrypLE Express. Verschließen Sie den Deckel des Röhrchens mit Parafilm und schweben Sie den Schlauch in einem 37 ° C warmen Wasserbad für 10 Minuten.
- Sprühen Sie das Rohr mit 70% Ethanol vor dem Öffnen der Kappe und 10 ml Hibernate E. Lassen Sie die Rinden am Boden des Röhrchens absetzen und den Überstand entfernen. Wiederholen Sie diesen Schritt dreimal zu waschen TrypLE Express. Im letzten Schritt entfernen Sie vorsichtig alle Medien.
- Sanft verreiben (4-5 mal) die Rinden in 2 ml Neurobasal/B27 Vollmedium mit einem Feuer-poliertem Glas Pasteur (ca. 1 mm im Durchmesser). Seien Sie vorsichtig, um Blasen zu vermeiden.
- Wiederholen weitere 4-5 Mal mit einer sterilen Pasteurpipette aus Glas kleineren Durchmesser (dh eine Pipette zu 1/2-3/4 mm im Durchmesser). Verwenden Sie nicht einer Pasteurpipette kleiner als diese, oder es wird die Zellen zu zerstören.
- Erlauben restlichen Stücke von Gewebe (in der Regel nur sehr wenige, wenn überhaupt) zu begleichen.
- Übertragen der oberen Einzelzell-Suspension auf ein neues 15-ml-Röhrchen, hinterlässt ständiger Gewebestücke. Pelzther verdünnen die Zellsuspension bis zu 10-12 ml mit Neurobasal/B27 Vollmedium.
- Gut mischen und verdünnen Zellen zum Zählen durch Zugabe von 10 ul Zellsuspension zu 490 ul 50x Counting Lösung (siehe Tabelle III) in einem 1,5 ml Eppendorf-Röhrchen.
- Tafel Zellen auf PDL-beschichteten Platten mit einer Dichte von 5,0 x 10 4 / cm 2. Wenn Nukleofektion durchgeführt werden soll, empfehlen wir Ausplattieren der Zellen in einer höheren Konzentration (8-10 x 10 4 / cm 2).
- Normalerweise sezieren wir 9-10 Feten pro Experiment, wie etwa 13 x 10 6 Neuronen aus jedem E17 Fötus stammen. Wenn mehr Embryonen benötigt werden, um sicherzustellen, dass die ganze Prozedur dauert nicht länger als zwei Stunden.
- Falls gewünscht, 24 Stunden nach der Isolierung können 10 uM Cytosin-β-D-arabinofuranosid (AraC) jeder Schale zugegeben werden, um Gliawucherung verhindern. Jedoch ist dieser Schritt nicht erforderlich, da Neurobasal/B27 Medium inhibiert Gliawucherung, Gemäß den Empfehlungen des Herstellers (Invitrogen / Gibco).
- Neuronen können für Experimente nach 4-5 Tagen in vitro verwendet werden, obwohl genaue Zeit hängt von der gewünschten Differenzierung der Bühne. Wir haben kultivierten Neuronen für bis zu 4 Wochen ohne eine signifikante Abnahme der Überlebensrate (Abbildung 1).
- Für längere Kultivierung, ersetzen Kulturmedium jede Woche mit frisch zubereiteten Neurobasal/B27 Vollmedium.
5. Repräsentative Ergebnisse
Neuronen auf Glas Chamber Slides kultiviert werden können, um Immunzytochemie unterzogen werden. 1 zeigt ein typisches Bild einer kortikalen Neuronen nach fünf Tagen in Kultur fixiert und immunmarkiert mit anti-MAP-2-Antikörper auf neuronale Prozesse zeigen.
2 zeigt ein repräsentatives Bild einer Ratte Hippocampus nach 3 Wochen in Kultur. Die neuronale Morphologie einer ausdifferenzierten Zelle wird durch MAP-2 hervorgehoben immunolabeling (MAP-2 neuronalen Marker, monoklonalen Maus-Antikörper Klon AP-20, Gene Tex, Irvine, CA) nach einem Standard-Verfahren wie zuvor 1 beschrieben. Die Bilder wurden sichtbar gemacht mit der Nikon Eclipse E400 aufrecht Fluoreszenz-Mikroskop mit Kamera EXI aqua (Qimaging), motorisierte Z-Achse, und SlideBook5 Akquisition / Dekonvolution Software (Intelligent Imaging Innovations, Inc., Denver, CO) ausgestattet. Eine Reihe von dreidimensionalen Bildern der einzelnen Bild wurden zu einem zweidimensionalen Bild zerlegt und aufgelöst durch Anpassung der Signal Cut-off in der Nähe von maximaler Intensität, um die Auflösung zu erhöhen.
Abbildung 3 zeigt Reinheit der neuronalen Kulturen. Protein wurden Lysate DIV7 Ratte neuronalen Kulturen (CTX) und von einem Fall von humanen Glioblastomen (GBM) erhalten. Wie erwartet, ist die neuronale Lysat stark positiv für die neuronale Protein MAP-2 und negativ für den Astrozyten-Marker GFAP, während der GBM Proteinlysatpräparation negativ ist foder MAP-2 und positiv für GFAP.
Obwohl in unserem Protokoll wir verwendet haben Hibernate E für mehrere Jahre als sezieren und Spülmedium, vor kurzem haben wir ein zusätzliches und sehr praktischen Gebrauch davon, um Hirngewebe zur weiteren Verwendung zu erhalten erforscht. Abbildung 4 zeigt einen Tag in-vitro-5 (DIV5) Kultur von Ratten-kortikalen Neuronen aus Kortex bei 4 ° C für eine Woche lang in den Ruhezustand E + B27 ihres ursprünglichen Präparation von den Embryonen isoliert. Neuronen wurden auf einer Glasbasis Zwei-Kammer-Objektträger mit PDL und Laminin beschichtet, wie zuvor beschrieben ausplattiert. Das aufgenommene Bild wurde mit Hilfe entfaltet SlideBook5 Akquisition / Dekonvolution Software wie oben beschrieben (Abb. 2).

Abbildung 1. Repräsentatives Bild einer kortikalen Neuronen mit pmaxGFP (Amaxa, Lonza, Walkersville, MD) und nucleofected immunmarkiert mit MAP-2 Antikörper, in rot. Original-Vergrößerung 100x.
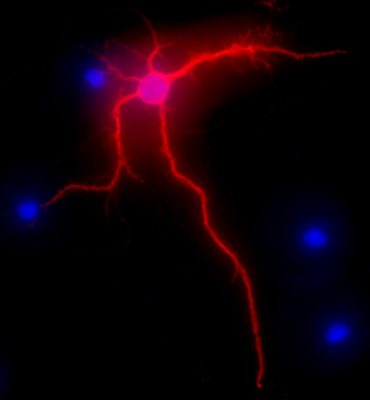
Abbildung 2. Vertreter Bild zeigt MAP-2 Immunomarkierung, in rot, von Neuronen im Hippocampus nach 3 Wochen in der Kultur. DAPI-Färbung, in blau, zeigt Zellkernen. Original-Vergrößerung 40x.

3. Western-Blot, Reinheit von neuronalen Zellkulturen. 30 ug neuronalen Ratten und menschlichen GBM Protein-Lysate wurden durch Elektrophorese aufgetrennt und einer Western-Blot-Analyse nach Standardverfahren ein. Anti-MAP-2 war ein polyklonaler Hasen von Cell Signaling (Danvers, MA), wurde Anti-GFAP-Antikörper ein monoklonaler Maus von Chemicon (Millipore, Billerica, MA), und die monoklonalen anti-GRB2 Antikörper wurde von Transduction Laboratories BD ( Sparks, MD). GRB2 wurde als Kontrolle verwendet Belastung.

Abbildung 4. Vertreter Bilder der Tage in vitro 5 (DIV5) kortikale Neuronen der Ratte aus Kortex links in Hibernate erhaltenen E + B27 bei 4 ° C für eine Woche nach ihrer Präparation. A) Phasenkontrast von Neuronen auf einem Glas-Zwei-Kammer-Objektträger kultiviert. Original-Vergrößerung 20x. B) Immunfluoreszenz, der die Expression von MAP-2 bei der neuronalen Prozessen, grünen, die Kultur wurde für die Astrozyten-Marker GFAP negativ. DAPI-Färbung, in blau, zeigt Zellkernen. Original-Vergrößerung 40x.
Diskussion
Die Methode der Präparation und Kultur von Ratten-Hippocampus und kortikalen Neuronen hier beschriebenen ermöglicht die Durchführung von Experimenten unter Verwendung nahezu reinen neuronalen Kulturen in einem chemisch definierten Medium (Abbildung 3) gewachsen. Obwohl Protokolle für die Kultivierung nahezu reinem Neuronen in serumfreiem Medium wurden zuvor 2,3,4 beschrieben, gibt es wesentliche Änderungen in unserer Methode. Anders als bei traditionellen Protokollen (zB Banker et al.) <...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir bedanken uns bei Jonna Ellis für die redaktionelle Unterstützung. Vom National Institute of Mental Health: Das Projekt beschrieben wurde von Verleihungsnummer R01MH079751 (F. Peruzzi PI) unterstützt. Der Inhalt ist ausschließlich der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung des National Institute of Mental Health oder des National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Konzentration | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 mM |
Tabelle I Neurobasal/B27 Vollmedium.
| Reagens | Konzentration |
| Glucose | 16 mM |
| Saccharose | 22 mM |
| HEPES | 10 mM |
| NaCl | 160 mM |
| KCl | 5 mM |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0,22 mM |
| Gentamicin | 50 ug / ml |
| Fungizone | 250 ng / ml |
| pH-Wert | 7,4 |
| Osmolarität | 320-330 mOsm |
Tabelle II. Dissection Medium.
| Reagens | Volume (ul) |
| Neurobasal/B27 Vollmedium | 240 |
| Trypanblau Stain 0,4% | 250 |
| Gesamt | 490 |
Tabelle III. 50x Counting Lösung.
| Reagens | Firma | Cat. Anzahl |
| Hibernate E | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| Gentamicinsulfat | Sigma Aldrich | G1264 |
| 200 mM Glutamax | Gibco, Invitrogen | 35050 |
| TrypLE Express w / o Phenolrot | Gibco, Invitrogen | 12604 |
| Cytosin-β-D-Hydrochlorid arabinofuranosid | Sigma Aldrich | C6645 |
| Poly-D-Lysin | Sigma Aldrich | P6407 |
| Laminin 1 mg / ml | Millipore | CC095 |
| HEPES | Sigma Aldrich | H3375 |
| Trypanblau Stain 0,4% | Gibco, Invitrogen | 15250 |
Tabelle IV. Spezifische Reagenzien.
| Ausrüstung | Firma | Cat. Anzahl |
| Stereo-Mikroskop | Olymp | SZ61 |
| Große Zange | FST | 11022-14 |
| Fine-Pinzetten | Moria | MC40B |
| Micro Fine-Pinzetten | Moria | MC31 |
| Gestochen scharfe Schere | Roboz | RS-6820 |
| Micro Präparierschere | FST | 91460-11 |
| Micro Dissecting gebogenen Schere | FST | 14067-11 |
| Glas 2-Kammer-Objektträgern | Lab-Tek | 154461 |
| 60 mm Platten | BD Falcon | 353002 |
| 100 mm-Schalen | Corning | 430167 |
| 15 ml Röhrchen | BD Falcon | 352099 |
| 1,5 ml Kryo-Röhrchen Fläschchen | Nunc | 375353 |
Tabelle V. Ausstattung.
Referenzen
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten