Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Produktion von lentiviralen Vektoren für die Transduktion von Zellen aus dem Zentralen Nervensystems
In diesem Artikel
Zusammenfassung
In diesem Protokoll beschreiben wir Produktion, Reinigung und Titration von lentiviralen Vektoren. Wir bieten ein Beispiel für lentiviralen Vektor-vermittelte Gentransfer in primär kultivierten Neuronen und Astrozyten. Unsere Verfahren können auch auf andere Bauarten gelten In-vitro- Und In-vivo-.
Zusammenfassung
Effizienter Gentransfer in das zentrale Nervensystem (ZNS) ist bei der Untersuchung von Genfunktionen wichtig, Modellierung und Entwicklung von neurologischen Erkrankungen therapeutische Ansätze. Lentivirale Vektoren sind attraktive Kandidaten bei der Transduktion von Neuronen und anderen Zelltypen im ZNS, wie sie sowohl sich teilende als auch sich nicht teilende Zellen, Unterstützung anhaltende Expression von Transgenen transduzieren, und relativ große Verpackungen Kapazität und geringer Toxizität 1-3. Lentivirale Vektoren wurden erfolgreich in Transduzieren viele neuronale Zelltypen in vitro 4-6 und 7-10 bei Tieren verwendet.
Große Anstrengungen wurden unternommen, um lentiviralen Vektoren mit verbesserten biologischen Sicherheit und Effizienz für den Gentransfer zu entwickeln. Das aktuelle dritte Generation replikationsdefekt und selbst-inaktivierende (SIN) lentiviralen Vektoren sind in 1 dargestellt. Die erforderlichen Elemente für Vektor-Verpackungen sind in vier Plasmide aufgeteilt. In der lentiviralen transfer Plasmid wird der U3-Region in der 5'-Long Terminal Repeat (LTR) mit einem starken Promotor aus einem anderen Virus ersetzt. Diese Modifikation erlaubt die Transkription der Vektorsequenz unabhängig von HIV-1-Tat-Protein, das normalerweise für HIV-Genexpression 11 erforderlich ist. Das Verpackungssignal (Ψ) ist für die Verpackung und die Rev-reaktive Element (RRE) wesentlich zur Herstellung hoher Titer Vektoren benötigt. Die zentralen Polypurin-Trakt (cPPT) ist für den Kernimport der Vektor-DNA eine Funktion zum Umwandeln nicht teilende Zellen 12 erforderlich wichtig. In der 3 'LTR, werden die cis-regulatorische Sequenzen vollständig von der U3-Region entfernt. Diese Streichung ist auf 5 'LTR nach der reversen Transkription kopiert, was zu einer transkriptionellen Inaktivierung beider LTRs. Plasmide pMDLg / pRRE enthält HIV-1 gag / pol-Gene, die Strukturproteine und Reverse-Transkriptase bereitzustellen. pRSV-Rev Rev codiert, die zur RRE für eine effiziente RNA-Export aus dem Zellkern bindet. pCMV-G codiertdie vesikulären Stomatitis-Virus Glycoprotein (VSV-G), die HIV-1 Env ersetzt. VSV-G erweitert den Tropismus der Vektoren und ermöglicht Konzentration durch Ultrazentrifugation 13. Alle Gene, die für die akzessorischen Proteine, einschließlich vif, vpr, Vpu und Nef sind in der Verpackungs-System ausgeschlossen. Die Herstellung und Manipulation von lentiviralen Vektoren sollte nach den NIH-Richtlinien für die Forschung auf der Basis rekombinanter DNA (durchgeführt werden http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf ). Eine Genehmigung von einzelnen Institutionelle Biologische und Chemische Sicherheit Ausschuss kann vor der Verwendung lentiviralen Vektoren erforderlich sein. Lentivirale Vektoren werden häufig durch Kotransfektion von 293T-Zellen mit lentiviralen Transfer-Plasmid und den Helferplasmide die Proteine kodieren für Vektor-Verpackung erforderlich produziert. Viele lentiviralen Transferplasmide und Helferplasmide kann von Addgene, eine nicht erreicht werdenPlasmid-Profit-Repository ( http://www.addgene.org/~~V ). Einige stabile Verpackungs-Zelllinien entwickelt worden, aber diese Systeme bieten weniger Flexibilität und Effizienz ihrer Verpackung in der Regel lehnt im Laufe der Zeit 14, 15. Im Handel erhältliche Kits können Transfektion unterstützen hohe Effizienz der Transfektion 16, aber sie kann sehr teuer für große Vektorpräparationen. Calciumphosphatpräzipitation Methoden bieten hocheffiziente Transfektion von 293T-Zellen und somit eine zuverlässige und kostengünstige Methode für lentiviralen Vektor Produktion.
In diesem Protokoll, stellen wir lentiviralen Vektoren durch Co-Transfektion von 293T-Zellen mit vier Plasmide auf die Calciumphosphat-Präzipitation grundsätzlich durch Reinigung und Konzentration Ultrazentrifugation durch ein 20% Saccharose-Kissen nachgegangen wurde. Die Vektortiter durch Fluoreszenz-aktivierte Zellsortierung (FACS) Anallyse oder durch Echtzeit-qPCR. Die Herstellung und Titration von lentiviralen Vektoren in diesem Protokoll kann mit 9 Tagen abgeschlossen sein. Wir bieten ein Beispiel für diese Vektoren Transduktion in murine neokortikalen Kulturen, die sowohl Neuronen und Astrozyten. Wir zeigen, dass lentivirale Vektoren hohen Effizienz der Transduktion und Zelltyp-spezifische Genexpression in primär kultivierte Zellen von CNS unterstützen.
Protokoll
1. Die Verpackung der lentiviralen Vektoren
Lentivirale Vektoren sind durch Co-Transfektion eines lentiviralen Transfervektor und andere Plasmide für die Verpackung in 293T-Zellen durch Calciumphosphat-Transfektion Verfahren erforderlich hergestellt. Wir verwenden 10 100-mm Zellkulturschalen in diesem Protokoll. Es kann skaliert oder unten, je nach Anwendungen. Die 293T-Zelllinie wird in Dulbeccos modifiziertem Eagles-Medium (DMEM) mit hohem Glukosegehalt (4500 mg / L) gehalten wird, ergänzt mit 10% fötalem Rinderserum (FBS), 100 Einheiten / ml Penicillin, 100 ug / ml Streptomycin bei 37 ° C Inkubator mit 5% CO 2.
- Seed 293T-Zellen bei 30-40% Konfluenz bis 10 100-mm-Gewebekulturschalen (3 × 10 6 Zellen / Schale) in Kulturmedium. Senden Sie die Zellen, um Inkubator.
- Nach 20-24 h Kultur, überprüfen Sie die Zelldichte. Die Zellen sollten etwa 80% Konfluenz zum Zeitpunkt der Transfektion werden.
- Bereiten Sie eine 50-ml-Tube. In 4,4 ml TE79/10 (1 mM Tris-HCl, 0,1 mMEDTA, pH 7,9) abzüglich der Gesamtmenge der folgenden Plasmid-DNA. In 100 ug lentiviralen Transfer-Plasmid (Abbildung 1), 58 pg pMDLg / pRRE, 31 pg pCMV-G, 25 ug pRSV-Rev, 600 ul 2M CaCl 2. Vorsichtig mischen.
- Bereiten Sie einen anderen 50-ml-Tube. 5 ml 2x HBS (0,05 M HEPES, 0,28 M NaCl, 1,5 mM Na 2 HPO 4, pH 7,12).
- Nehmen Sie die DNA-CaCl 2-Gemisch von 10-ml-Pipette und fügen Sie das Röhrchen mit 2 x HBS, tropfenweise unter Vortexen die Röhre.
- Halten der Fällungsreaktion bei Raumtemperatur (RT) für 30 min.
- Entfernen Sie die Kulturschalen aus Inkubator. Mischen Sie die Fällungsreaktion, durch Vortexen mischen. 1 ml Suspension in jeden 100-mm-Schale enthaltenden Zellen. Die Suspension muss langsam zugegeben, tropfenweise unter leichtem Schwenken des Mediums in der Schale werden. Kehren diese Gerichte in den Inkubator verlassen und für 5 Stunden.
- Entfernen des Mediums aus der Kultur. 6 ml frisches Kulturmedium mit 6 mM Natrium-butyrate zu jedem Gericht. Zurück zu den Kulturen-Inkubator. Nach Übernacht-Kultur, wenn eine fluoreszierende Reporter in dem Konstrukt, überprüfen die Expression des Reportergens unter Fluoreszenzmikroskop. Normalerweise exprimieren über 80% der Zellen das Reportergen, wenn sie von einer allgegenwärtigen Promotor (zB CMV-Promotor) angetrieben wird.
- Zwei Tage (40-44 h) nach der Transfektion Überstand zu sammeln von 10 Geschirr in 2 50-ml-Röhrchen (etwa 30 ml Röhrchen). Frieren Sie den Überstand in -80 ° C Gefrierschrank oder gehen Sie zum nächsten Schritt.
2. Konzentration und Reinigung der Vektoren
- Zentrifuge die frisch gesammelten oder aufgetaut Überstand bei 900 g (etwa 2000 UpM) für 10 min auf eine beliebige Zelle Trümmern in dem Überstand zu entfernen.
- Bringen Sie einen 60-ml-Spritze auf eine 0,2-Spritze um SFCA Filter. Überstand von 50-ml-Tube mit der Spritze. Den Überstand in ein Zentrifugenröhrchen Polyallomer.
- Nimm 5 ml 20% Saccharose (hergestellt in PBS) in einer 5-ml-Pipette. Einfügendie Pipette auf den Boden der Zentrifugenröhrchen mit Überstand. Langsam die Saccharose-Lösung unter dem Vektor Überstand. Wiederholen Sie diese Schritte für Überstand aus einer anderen Röhre.
- Zentrifugieren Sie den Überstand bei 11000 rpm und 4 ° C für 4 h mit Beckman SW28 Rotor Schwung.
- Entfernen Sie den Überstand. Fügen Sie 150 ul 4% Laktose (hergestellt in PBS) zu jedem Zentrifugenröhrchen. Resuspendieren der Pellets.
- Übertragen des Vektors aus konzentrierter alle Zentrifugenröhrchen in ein 1,5 ml-Röhrchen. Lassen Sie die Röhrchen auf Eis für 15 min.
- Mischen Sie den Vektor Suspension durch Pipettieren. Spin mit Mikrozentrifuge bei voller Geschwindigkeit (ca. 16000 g) für 1 min.
- Überstand in ein neues 1,5-ml-Tube. Teilen Sie die letzte Probe in 20 ul Aliquots und lagerte sie in -80 ° C Gefrierschrank.
3. Titration der Vektoren
- Samen 5 x 10 4 / Vertiefung von HT1080-Zellen in 12-Well-Platte in 1 ml DMEM-Medium mit 10% FBS.
- Nach overnight Kultur, Zählen von Zellen aus einer gut punkten und die Zellzahl.
- Make 5-fache serielle Verdünnung (1:5, 1: 25; 1:125 und 1:625) der konzentrierten Vektor mit Kulturmedium. Fügen ich ul der verdünnten Vektor zu trennen Brunnen. Die Proben können dupliziert, um die Genauigkeit zu erhöhen.
- Fügen Sie 1 ul 4 mg / ml Polybren (Hexadimethrinbromid) in jede Vertiefung mit Vektor-und in einen Brunnen ohne Vektor. Mischen Sie durch leichtes Schütteln der Platte. Zurück zum Inkubator für 48 Stunden.
- Entfernen Medium aus den Vertiefungen Zellkultur. Waschen Sie die Vertiefungen mit PBS. In 250 ul 1x Trypsin-EDTA-Lösung zu den Zellen. Wenn die Zellen abgelöst werden (3-5 min), 1 ml Kulturmedium. Die Zellen durch Pipettieren. Übertragen Zellsuspension in 1,5 ml-Zentrifugenröhrchen.
- Zentrifugieren bei 900 g für 6 min. Für Vektoren mit einem fluoreszierenden Reporter-Gen (zB GFP), gehen Sie zu 3,7 für FACS-Analyse fort. Für Vektoren ohne einen Reporter, gehen bis 3,8 für die Echtzeit-qPCR fort.
- Für Vektoren, die eine fluostofflampen Reporter-Gen, der Überstand entfernt und das Pellet mit 300 ul 3,7% Formaldehyd in PBS. Bestimmen Sie den Prozentsatz der Reporter-positiven Zellen durch FACS-Analyse. Der Titer wird als Transduktion Einheiten pro Milliliter eingeengt Vektor (TU / ml) dargestellt werden.
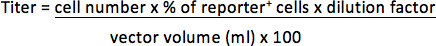
Wenn beispielsweise 1 × 10 5 Zellen wurde mit 1/25 ul (0,04 ul) Vektor und 30% transduzierte Zellen sind Reporter positiv ist, wird der Titer sein:
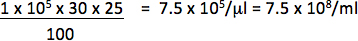
Verwenden Sie nur die Verdünnungen fallen in einem linearen Zusammenhang zwischen dem Anteil der positiven Zellen und der Menge der Vektor-Titer hinzugefügt, um zu berechnen. Die Endtiter sollte ein Mittelwert der Titer von Transduktionen von mindestens 2 unterschiedliche Mengen des Vektors erhalten wird.
- Für Vektoren, ohne dass einfluoreszierenden Reporter-Gen, Extrahieren genomischer DNA aus HT1080-Zellen unter Verwendung QIAamp DNA Mini Kit (Qiagen) gemäß den Hersteller-Protokoll. Verstärken Vektorsequenz in genomischer DNA unter Verwendung des ABI PRISM 7000 Sequence Detection System (Applied Biosystems) mit den Primern (HIV-1 in PBS / psi Bereich 17) 5'-CCGTTGTCAGGCAACGTG-3 'und 5'-AGCTGACAGGTGGTGGCAAT-3', und TaqMan-Sonde 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Albumin-Gen, das eine einzelne Kopie-Gen im Genom (2 Kopien / Zelle) ist, hat auch mit den Primern 5'-TGAAACATACGTTCCCAAAGAGTTT-3 'und 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3' amplifiziert und Sonde 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-TAMRA-3 'als interne Kontrolle. Bestimmen der Kopienzahl des Vektors und Albumin durch PCR in 96-Well-Platte nach der Bedienungsanleitung des Herstellers mit dem folgenden Programm: 50 ° C für 2 min, 95 ° C für 10 min und 35 Zyklen von 95 ° C für 15 Sekunden und 60 ° C für 2 min. Zehn-fache serielle Verdünnungen von Plasmiden bekannter Konzentration (dargestellt als Kopieangegeben wurde) mit der Template-Sequenzen sollten auch verstärkt, um eine Standardkurve für die Quantifizierung von unbekannten Proben zu erzeugen. Der Titer wird als Integration Einheiten pro Milliliter eingeengt Vektor (IU / ml) dargestellt werden.
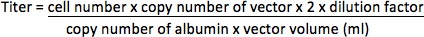
4. Transduktion neokortikaler Kulturen
Großhirnrinde Kulturen, die sowohl Neuronen und Glia aus Maus-Kortex unter Verwendung eines Zwei-Schritt-Beschichtungsverfahrens wie vorstehend 18 beschrieben hergestellt. Neocortices aus fötalem Mäusen 14-16 Tage der Schwangerschaft gewonnen werden auf einem vorher festgelegten glialen Monoschicht in MEM mit 10% FBS, 20 mM Glucose und 2 mM Glutamin in 24-Well Gewebekulturplatte ausplattiert.
- Nach 5 Tagen in vitro, fügen Sie 10 uM Cytosinarabinosid (Ara-C) im NAZortical Kultur zu hemmen, nicht-neuronalen Zellteilung. Weiter Kultur die Zellen für 2 Tage.
- Warm Kulturmedium bei 37 ° C Wasserbad für 5-10 min. Ersetzen Ara-C-haltigem Medium mit frischem Kulturmedium (500 ul / Vertiefung).
- In Vektor mit gewünschten MOI (Multiplizität der Infektion, wobei das Verhältnis der Anzahl von Vektor-Partikeln auf die Anzahl der Zielzellen) zu der Kultur. Die Kultur für 24 Stunden. Wir verwenden MOI von 1-10 (meist 5) in primären kortikalen Kulturen.
- Ersetzen Sie das Kulturmedium durch frisches Medium. Weiter Kultur. Wenn es ein Reporter-Gen im Vektor-Konstrukt, überprüfen Zellen unter fluoreszierenden Mikroskop 2 Tage nach Transduktion. Die Expression des Reportergens wird in Neuronen 2-7 sichtbar nach Transduktion, abhängig von der Vektor-Design, und die Dosis.
5. Repräsentative Ergebnisse
Die Titer der lentiviralen Vektoren mit diesem Protokoll hergestellt Bereich 10 8 -10 10 IU / ml, seit M.h geeignet sind für die Transduktion von einer Vielzahl von Zelltypen CNS sowohl in vitro und in vivo. Tabelle 1 und 2 zeigen ein repräsentatives Ergebnis unter Verwendung der Vektoren, die dieses Protokoll hergestellt. Wir transduzierten murinen Neocortex Kulturen mit lentiviralen Vektoren, die grün fluoreszierendes Protein (GFP), die durch Synapsin (SYN)-Promotor oder gliales fibrilläres saures Protein (GFAP)-Promotor. Sieben Tage nach der Transduktion, führten wir Immunfärbung zur Kennzeichnung von Neuronen und Astrocyten mit Anti-NeuN und Anti-GFAP Antikörper. Wie in Tabelle 1 und Abb. 2A, nach der Transduktion mit dem Vektor, der das Synapsin-Promotor, über 90% der Neuronen (NeuN +-Zellen) exprimieren GFP und keine Astrozyten (GFAP +-Zellen) exprimieren diese Reportergens. Wenn GFAP-Promotor in den Vektor-Konstrukt (2B) verwendet wird, etwa 80% der Astrozyten (GFAP +-Zellen) Ausdrucks GFP; alle GFP +-Zellen sind Astrozyten durch Kolokalisation mit GFAP und Abwesenheit von GFP-Expression in NeuN-markierten Zellen bestätigt. Diese Ergebnisse zeigen, dass lentivirale Vektoren sehr effizient Transgene Zellen aus ZNS und Zell-spezifischen Genexpression liefern können erreicht werden, wenn geeignete Promotoren verwendet werden.
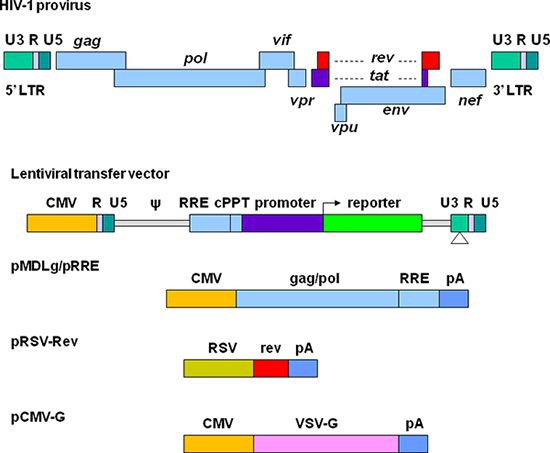
Abbildung 1. Schematische Darstellung der HIV-basierte lentivirale Vektoren und der Verpackungen Plasmide. Die HIV-1-Provirus ist an der Oberseite angezeigt. Die Elemente für Vektor-Produktion sind in vier verschiedenen Plasmiden getrennt. Lentivirales Übertragung Plasmid enthält ein Hybrid-5'-LTR, in dem die U3-Region mit dem Cytomegalovirus (CMV)-Promotor, der Verpackung Signal (ψ), der RRE-Sequenz, die zentralen Polypurin-Trakt (cPPT), einem Gen von Interesse (zB ersetzt eine fluoreszierende Reporter) zusammen mit einem Promotor der Wahl, und der 3 'LTR, in dem diecis-regulatorischen Sequenzen werden vollständig von der U3-Region entfernt. pMDLg / pRRE enthält die gag und pol-Gene und RRE-Sequenz von HIV-1 unter der Kontrolle des CMV-Promotors. pRSV-Rev enthält die codierende Sequenz des Rev vor der RSV-Promotor angetrieben wird. pCMV-G enthält das VSV-G-Protein-Gens unter der Kontrolle des CMV-Promotors. PA gibt die Polyadenylierungssignal aus humanen β-Globin-Gen.
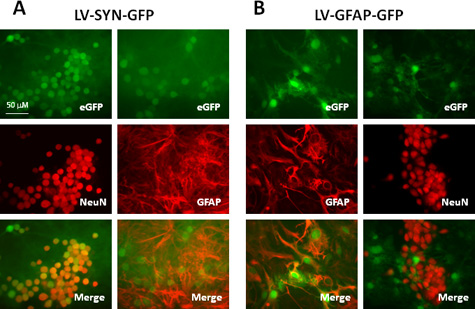
Abbildung 2. Die Expression von Reporter-Gene in der Maus neokortikalen Mischkultur transduziert mit lentiviralen Vektoren, die Zelltyp-spezifische Promotoren. Die Kulturen mit NS-SYN-GFP (A) oder LV-GFAP-GFP-Vektoren (B) bei einer MOI von 5 wurden transduziert. Sieben Tage nach der Transduktion wurden die Zellen mit anti-NeuN oder Anti-GFAP-Antikörper immungefärbt. Oberen Felder zeigen GFP-Fluoreszenz, zeigen mittleren und unteren Platten Immunfärbung Paneele sind Bilder fusioniert (GFP: grün; NeuN oder GFAP: rot).
| Vektor | GFP +-Zellen in Neuronen | GFP + in Astrozyten |
| LV-SYN-GFP | 92,2 ± 7,3 | 0 |
| LV-GFAP-GFP | 0 | 78,3 ± 11,5 |
Tabelle 1. Vergleich der GFP-Expression in murinen Neocortex Kulturen transduziert mit lentiviralen Vektoren, die verschiedenen Promotoren ein.
einem Maus-neokortikalen Kulturen (5 x 10 5 / Well in 24-Well-Platte) wurden mit LV-SYN-GFP-oder LV-GFAP-GFP-transduzierte bei einer MOI von 5. Sieben Tage nach der Transduktion wurden die Kulturen fixiert und immunhistochemisch für NeuN oder GFAP. Die Anzahl an GFP und NeuN / GFAP exprimierenden Zellen wurden in Bilder von 10 Feldern pro experimentellen Bedingungen gezählt. Die Werte stellen den Prozentsatz der Neuronen (NeuN +-Zellen) oderAstrozyten (GFAP + Zellen), die auch zum Ausdruck, die das GFP-Reportergen. Die angegebenen Werte sind Mittelwerte ± SD von drei unabhängigen Experimenten.
Diskussion
In diesem Protokoll haben wir die Herstellung von lentiviralen Vektoren und Anwendung dieser Vektoren in neokortikalen Kulturen gezeigt. Wir haben gezeigt, effiziente und Zelltyp-spezifische Transduktion mit den Vektoren durch diese Verfahren hergestellt. Wenn der Synapsin-Promotor verwendet wird, ist die GFP-Expression streng neuronenspezifische. Wenn der GFAP-Promotor verwendet wird, ist die GFP-Expression ausschliesslich in Astrozyten. Wenn kein Zelltyp-spezifische Expression erforderlich ist, kann eine ubiquitäre P...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von den NIH Neuroscience Blueprint Core-Zuschuss (P30 NS057105, BJS) nach Washington University, Program Project Grant NS032636 (BJS) und von der Hoffnung, Zentrum für Neurologische Störungen unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Fötales Rinderserum | Hyclone | SV3001403 | |
| PBS | Mediatech | 21 bis 040-CM | |
| Trypsin-EDTA | Sigma-Aldrich | T3924 | |
| Natriumbutyrat | Sigma-Aldrich | B5887 | |
| Hexadimethrinbromid (Polybren) | Sigma-Aldrich | H9268 | |
| 293T-Zellen | ATCC | CRL-11268 | |
| HT1080-Zellen | ATCC | CCL-121 | |
| Falcon 100 x 20 mm Gewebe-culturE Gericht | BD Biosciences | 353003 | |
| 1 x 3 ½ in polyallomoer Zentrifugenröhrchen | Beckman-Coulter | 326823 | |
| 0,2-Mikron-Spritzenfilter | Corning | 431219 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 |
Referenzen
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten