Method Article
Umbau eines Capture-ELISA zu einem Luminex xMAP Assay unter Verwendung eines Multiplex-Antikörper-Screening-Methode
In diesem Artikel
Zusammenfassung
Ein ELISA kann leicht zu einem Luminex xMAP Assay umgewandelt werden und durch die Vorteile der Multiplexen mehrere Antikörper gleichzeitig gescreent werden, um eine optimale Antikörperpaar zu identifizieren, was zu einer erhöhten Empfindlichkeit und den Dynamikbereich, während reduzierenden Assay einsehbar.
Zusammenfassung
Die Enzyme Linked Immuno Assay (ELISA) ist seit langem das wichtigste Werkzeug für den Nachweis von Analyten in biologischen Proben für die biowissenschaftliche Forschung und klinische Diagnostik. Jedoch hat ELISA Einschränkungen. Es wird typischerweise in einer 96-Well-Mikrotiterplatte durchgeführt, und die Vertiefungen werden mit Einfang-Antikörper beschichtet, die eine relativ große Menge an Probe, um ein Antigen von Interesse zu erfassen. Die große Oberfläche der Vertiefungen und die hydrophobe Bindung der Fänger-Antikörper können auch auf nicht-spezifische Bindung und erhöhten Hintergrund führen. Darüber hinaus verlassen sich die meisten ELISAs auf Enzym-vermittelte Verstärkung des Signals, um eine angemessene Empfindlichkeit zu erreichen. Eine solche Verstärkung ist nicht immer linear und kann somit die Ergebnisse verfälschen.
In den vergangenen 15 Jahren hat eine neue Technologie bietet sich heraus, dass die Vorteile des ELISA, sondern ermöglicht auch einen höheren Durchsatz, höhere Flexibilität, geringere Probenvolumen und niedrigeren Kosten, mit einer ähnlichen WOrkflow 1, 2. Luminex xMAP-Technologie ist eine Mikrosphären (Perle) Array-Plattform ermöglicht sowohl Monoplex und Multiplex-Assays, die sowohl für Protein-und Nukleinsäure-Anwendungen 5.3 angewendet werden können. Die Perlen haben den Capture-Antikörper kovalent an eine kleinere Oberfläche immobilisiert, die weniger Capture-Antikörper und kleiner Probenvolumina, verglichen mit ELISA und nicht-spezifische Bindung wird deutlich reduziert. Kleinere Probenmengen sind wichtig bei der Arbeit mit Grenzmuster wie Cerebrospinalflüssigkeit, Synovialflüssigkeit, etc. 6. Multiplexen der Test weiter reduziert Probenvolumen Anforderungen, so dass mehrere Ergebnisse aus einer einzigen Probe.
Die jüngsten Verbesserungen von Luminex enthalten: die neue MAGPIX System, ein kleiner, billiger, einfacher zu bedienende Analysator; niedriger Konzentration Magnetic MagPlex Mikrokugeln, die den Bedarf an teuren Filterplatten eliminieren und kommen in einer Konzentration arbeiten besser für Assay-Entwicklung geeignet undLow-Throughput-Anwendungen, und die xMAP-Antikörper-Kupplung (AbC) Kit, das ein Protokoll, Reagenzien und Verbrauchsmaterialien, die für Kupplung Perlen an den Fänger-Antikörper von Interesse enthält. (Siehe Abschnitt Materialien für eine detaillierte Liste der Inhalte der.)
In diesem Experiment, setzen wir eine voroptimierte ELISA-Assay für TNF-alpha Zytokine an der xMAP-Plattform und die Performance der beiden Methoden 7-11. TNF-alpha als ein Biomarker bei der Messung von entzündlichen Reaktionen bei Patienten mit Autoimmunkrankheiten verwendet.
Wir beginnen mit der Kupplung vier Kandidaten Fänger-Antikörper zu vier verschiedene Mikrosphären-Sets oder Regionen. Wenn sie miteinander vermischt, erlauben diese vier Sätze für die gleichzeitige Prüfung aller vier Kandidaten mit vier getrennten Nachweis von Antikörpern gegen die besten Antikörper Paar, spart Reagenzien, Probe und Zeit zu bestimmen. Zwei xMAP Assays werden dann mit den beiden optimale Antikörper-Paare ausgebildet und ihre Wirkung istim Vergleich zu der ursprünglichen ELISA-Test in Bezug auf Signalstärke, Dynamikbereich und Empfindlichkeit.
Protokoll
I. Vorbereitung der Reagenzien
- Antikörper Auswahl und Vorbereitung
- Identifizieren der Antikörper in dem Experiment verwendet werden.
- Vier Fänger-Antikörper: spezifisch für humanes TNF-alpha, entweder monoklonal oder polyklonal, alle dem gleichen Host Arten.
- Vier Nachweisantikörper: spezifisch für humanes TNF-alpha, entweder unverändert, biotinylierten oder PE-konjugiert.
- Eine Bestätigung Antikörper: PE-konjugierten und spezifisch für die Host-Spezies der Fänger-Antikörper.
- Lösen Sie alle Antikörper an die vom Hersteller empfohlene Konzentrationen arbeiten.
- Wählen Sie vier Phiolen mit niedriger Konzentration MagPlex Mikrosphäre (Perle) Sätze oder Regionen, zum Beispiel Luminex Teilenummern MC10012-ID, MC10013-ID, MC10014-ID und MC10015-ID.
- Identifizieren der Antikörper in dem Experiment verwendet werden.
- Kupplung Antikörper gegen MagPlex Microspheres, mit der xMAP-Antikörper (AbC) Coupling Kit
Refer zum ABC-Kit Benutzerhandbuch (Part # 89-00002-00-319) für die komplette Kupplung Prozedur. (Hinweis: Lichtempfindliche Mikrosphären sollten vor Licht geschützt werden, wenn möglich.)- Bringen Sie die Reagenzien in der ABC-Kit auf Raumtemperatur abgekühlt und Etikett vier Reagenzgläser mit den Wulstbereich Zahlen für die Kupplungsreaktion ausgewählt. Den Inhalt der vier Fläschchen MagPlex Perlen (je 1 ml oder 2,5 x 10 6 Perlen) in die vier markierten Reaktionsgefäße.
- Waschen Sie jede der Perlenset zweimal in 500 ul von Activation Buffer, wie in der ABC-Kit Handbuch beschrieben.
- Aktivieren Sie jede Kugel Set mit 480 ul von Activation-Puffer, 10 uL Sulfo-NHS und 10 ul des EDC-Reagenz, nach dem Verfahren in der ABC-Kit-Handbuch und 20 Minuten inkubieren. (Hinweis:. EDC Reagenz muss in 250 ul Activation Buffer unmittelbar vor diesem Schritt wieder hergestellt werden)
- Wiederholen Sie den vorherigen Waschschritt mit dem nun "aktiviert" Mikrosphären insgesamt thrEE Times mit 500 ul Activation Buffer, wie in der ABC-Kit Handbuch beschrieben.
- Planen vier getrennten Lösungen, die jeweils 7,5 ug (dh 3 g / Millionen Mikrosphären) der Fang-Antikörper in Aktivierungspuffer.
- Fügen Sie diese vier Capture-Antikörper Lösungen für ihre jeweiligen Reaktionsgefäße, Jedes Röhrchen sofort, und inkubieren für zwei Stunden auf einem Rotator.
- Wiederholen Sie den vorherigen Waschschritt mit dem nun "gekoppelt" Mikrosphären insgesamt dreimal mit 500 ul der Waschpuffer mit dem ABC-Kit enthalten.
- Nach dem letzten Waschschritt, 500 ul Waschpuffer zu jedem Reaktionsgefäß, um eine endgültige Lager Konzentration von 5 Millionen Antikörper-gekoppelten Kügelchen pro Milliliter bereitzustellen. Vortex und beschallen die Reaktionsrohre, um die Mikrosphären zu zerstreuen.
HINWEIS: teilweises Eintauchen des geschlossenen Mikrosphäre Fläschchen in einem Ultraschallbad mit DI-Wasser gefüllt bietet effektiven Beschallung für alle Waschschritte. (Siehe Tabelle Werkstoffe für equipment Details.) - Lagern Sie die gekoppelten Kügelchen bei 2-8 ° C und vor Licht geschützt, bis sie benötigt.
- Auszählung von Coupled Microspheres
- Zähle die Anzahl der Mikrosphären erholt nach der Kupplungsreaktion unter Verwendung einer Zelle Zähler oder Hämazytometer. Entnehmen Sie bitte dem Zählen Instruments Bedienungsanleitung für entsprechende Anweisungen dafür. Die Erholung von der Kupplung ist in der Regel über 90%.
- Kupplung Bestätigung
- Bestätigen Sie die Kupplung erfolgreich war durch die Vorbereitung Testlösungen der gekoppelten Kügelchen Aktien für jeden Satz, mit dem finalen Konzentration von 100 Perlen / ul in Assay-Puffer (PBS mit 1% BSA). Verdünnungen des Phycoerythrin-(PE-) markierten Anti-Spezies-IgG-Antikörper Bestätigung bei 4 ug / ml in Assay-Puffer.
- 50 ul Aliquot jeder Testlösung in vier Vertiefungen einer mit rundem Boden, 96-Well Platte, für insgesamt 16 Brunnen. Anschließend werden 50 μL Assaypuffer in acht der Brunnen, in den Hintergrund, und 50 ul verdünnte Antikörper Bestätigung in den acht verbleibenden Brunnen zu messen.
- Mischen Sie die Reaktionen vorsichtig durch Auf-und Abpipettieren mehrmals mit einem Multi-Kanal-Pipette. Die Platte, und inkubieren für 30 Minuten bei Raumtemperatur auf einem Schüttler.
- Legen Sie die Platte auf einer magnetischen Platte Separator für 1-2 Minuten, um die Perlen aus der Lösung ziehen. Entfernen Sie dann die Flüssigkeit durch Umdrehen der Platte kräftig, während auf der Separator, über einen Abfallbehälter.
- Waschen jeder Vertiefung zweimal durch Zugabe von 100 ul Assaypuffer und Entfernung des Überstandes von der Platte in einer ähnlichen Weise unter Verwendung der magnetischen Platte Abscheider.
- Resuspendieren der Beads in 100 ul Assay-Puffer durch vorsichtiges Auf-und Abpipettieren fünfmal mit einem Multi-Kanal-Pipette.
- Analysieren auf einem Luminex xMAP Instrument, wie die MAGPIX Instrument. Die Intensität des Fluoreszenzsignals dieser Reaktion ist directly proportional zur Menge des Proteins auf der Oberfläche der Kügelchen, um eine schnelle Bewertung der relativen Menge an Protein, die mit den Kügelchen.
- Kupplung Biotin zu unmodifizierten Antikörper zum Nachweis
- Bei Verwendung von unmodifizierten Detektions-Antikörper, biotinylieren diese Antikörper mit dem Thermo Fisher EZ-Link Sulfo-NHS-LC-Biotin-Reagenz (Best.-Nr. PI-21335) und das Verfahren in der Packungsbeilage beschrieben. Sobald biotinyliert, können die Nachweisantikörper später mit Streptavidin Phycoerythrin (SA-PE) in dem Assay (Schritt III.6.) Markiert werden, so dass sie mit der xMAP Analyse gefunden werden kann.
II. Assay-Setup
- Vorbereiten einer anfänglichen Mischung aus allen vier Perlenset durch Zugabe von 10 ul jeder auf 0,96 mL PBS mit 1% BSA (Assay-Puffer. Tabelle siehe Materialien) zu bestimmen, welche ist am effektivsten, mit der xMAP-Assay.
- Bereiten Sie die Detektions-Antikörper-Lösungen von diluting jeweils 1 pg / ml in Assay-Puffer.
- Bereiten Sie den R & D Systems TNF-α-Protein-Standard bei 2000 pg / ml in Assay-Puffer.
- Verdünnen Sie die Streptavidin-rPhycoerythrin (SA-PE) (vorausgesetzt @ 1 mg / ml) auf 8 ug / ml in Assay-Puffer.
III. Antikörper-Screening
- Dann werden 50 ul der Antikörper gebundene Mikrokügelchen Mischung zu jedem der 16 Wells einer Costar Rundkolben 96-Well-Platte für den Screening-Assay.
- Dann werden 50 ul Assay-Puffer auf 8 der 16 Brunnen, in den Hintergrund zu messen.
- Dann werden 50 ul der R & D Systems TNF-α-Standard (@ 2000 pg / ml) zu den anderen 8 Vertiefungen, um Reaktion zu messen.
- Inkubieren für eine Stunde bei Raumtemperatur, vor Licht geschützt, unter Schütteln auf einem Assay-Platten-Schüttler.
- Dann werden 50 ul jeder der vier Nachweis von Antikörpern gegen vier Brunnen (zwei und zwei Hintergrund-Antwort) und Inkubation für 30 Minuten bei Raumtemperatur, vor Licht geschützt, unter Schütteln auf einer Testplatte shaker.
- In 50 ul der SA-PE-Reagenz in alle Vertiefungen pipettieren und 15 Minuten bei Raumtemperatur, vor Licht geschützt, unter Schütteln auf einem Assay-Platten-Schüttler.
- Legen Sie die Platte auf einer magnetischen Platte Separator für eine Minute und entfernen Sie dann die Flüssigkeit durch kräftiges Umdrehen der Platte.
- Geben Sie 100 ul Assay-Puffer auf jede der 16 Vertiefungen, legen Sie die Platte auf der Magnetplatte Separator für eine Minute und entfernen Sie dann die Flüssigkeit durch gewaltsam umdrehen, die während auf dem Separator.
- Geben Sie 100 ul Assay-Puffer auf jede der 16 Vertiefungen und lesen Sie die Platte mit der Luminex MAGPIX Instrument, die sich auf das Benutzerhandbuch für den ordnungsgemäßen Betrieb.
- Wählen Sie einen Antikörper-Paar, das Sie die gewünschte Signalstärke entspricht.
IV. xMAP funktionellen Test
- Nach der Auswahl der besten Fänger-Antikörper, verdünnt 100 ul dieser Antikörper gebundene Perle Lager (aus Schritt IB8) auf 10 ml mit Assay-Puffer.
- In 50 uldas verwässerte Perlen bis 78 Vertiefungen von zwei Costar Rundboden-96-well Platten. (78 Vertiefungen x 2 = 156 Platten Vertiefungen) Jede Platte wird verwendet, um die Leistung einer anderen Detektions-Antikörper zu bewerten.
- Bereiten Sie eine 12-Punkt-Standard-Kurve, beginnend bei 8000 pg / ml und endend bei 4 pg / ml, mit dem R & D Systems TNF-α-Standard. In sechs 50 ul Wiederholungen jeder Verdünnung auf jede der Platten, plus sechs Bohrungen mit 50 ul Assaypuffer jeder, als Hintergrund, für insgesamt 78 Vertiefungen / Platte.
- Die Inkubation für eine Stunde bei Raumtemperatur, vor Licht geschützt, unter Schütteln auf einem Assay-Platten-Schüttler.
- Dann werden 50 ul des ersten Detektions-Antikörpers gegenüber allen 78 Bohrungen der ersten Platte. Wiederholen des zweiten Detektions-Antikörper auf der zweiten Platte.
- Die Inkubation erfolgt während 30 Minuten bei Raumtemperatur, vor Licht geschützt unter Schütteln auf einem Assay-Platten-Schüttler.
- Fügen Sie die 50 ul der SA-PE-Reagenz in alle Vertiefungen jeder Platte.
- Bebrütendie beiden Platten für 15 Minuten bei Raumtemperatur, vor Licht geschützt unter Schütteln auf einem Assay-Platten-Schüttler.
- Legen Sie die Platten auf Magnetplatte Separatoren für eine Minute, und entfernen Sie die Flüssigkeit durch gewaltsam umdrehen, die während auf dem Separator.
- Geben Sie 100 ul Assay-Puffer zu jedem der 78 Bohrlöcher auf den Platten, legen die Platten auf Magnetplatte Separatoren für eine Minute, und entfernen Sie die Flüssigkeit durch kräftiges Umdrehen der Platte.
- Geben Sie 100 ul Assay-Puffer zu jedem der 78 Bohrlöcher auf den Tellern und zu analysieren, auf der MAGPIX Instrument, die sich auf das Benutzerhandbuch für den ordnungsgemäßen Betrieb.
V. ELISA-Assay
- Befolgen Sie die Anweisungen mit dem R & D Systems Menschliche TNF-α/TNFSF1A DuoSet ELISA-Kits (R & D Part # DY210) enthalten sind, messen die Reaktion der serienmäßig mit dem R & D Kit enthaltene generiert. Wiederholen Sie den ELISA-Test drei weitere Male, wobei Sie den R & D Systems Erfassung und Erkennung Ameiseibodies mit den Antikörpern der anderen Anbieter. Der Einfachheit halber Paar die Antikörper durch Anbieter (zB Millipore Capture-Antikörper mit Millipore Detektionsantikörper, Abcam Capture-Antikörper mit Abcam Detektionsantikörper, etc.).
- Bewerten jedes Paar unabhängig, wie durch den ELISA-Format erforderlich ist, mit jedem der drei TNF-α Protein-Standards.
VI. Repräsentative Ergebnisse
Dieses Protokoll zeigt, wie ein typischer ELISA zur xMAP-Plattform umgewandelt werden kann, unter Ausnutzung des Multiplex-Fähigkeit der Technologie, um schnell optimieren den Assay. Der ELISA in diesem Beispiel verwendet wurde, war die menschlichen Tumornekrosefaktor-alpha (TNF-α) DuoSet ELISA-Kit von R & D Systems (R & D Part # DY210).
Zusätzlich zu dem Antikörper-Paar mit dem Kit mitgeliefert wurden drei anderen Antikörper-Paaren aus verschiedenen Quellen (siehe Tabelle Werkstoffe) gleichzeitig mit der xMAP-Plattform evaluiert. Four der Antikörper wurden als Capture-Antikörper bezeichnet und wurden MagPlex Niedrige Konzentration Mikrokügelchen gekoppelt ist. Die anderen vier Antikörper wurden als Detektions-Antikörper bezeichnet, von denen drei Größen und Biotin-gekoppelt und der vierte wurde biotinyliert wie im Protokoll beschrieben.
Die Antikörper für diese Studie wurden je nach Verfügbarkeit und Anbieter ausgewählt. Doch in der praktischen Einstellung sollten Antikörper basierend auf der individuellen Einstellung des Benutzers und Wertentwicklung in der Vergangenheit Erfahrungen mit diesem Antikörper ausgewählt werden. Obwohl dieses Experiment nicht getestet wird die Eignung eines Antikörpers als Einfang-Antikörper gegen Detektionsantikörper, ist dieses Protokoll für diesen Zweck einfach angepasst werden.
Die Luminex xMAP Assays wurden als Multiplex, um alle vier Fänger-Antikörper als eine Mischung bewerten durchgeführt, durch die Kombination von vier Gruppen von TNF-α-Antikörper gekoppelte MagPlex Mikrosphären. Die Capture-Antikörper wurden mit jedem der vier untersuchtenbiotinylierten Nachweis Antikörper einzeln, so dass die Wechselwirkung eines Detektions-Antikörper mit jedem der vier Capture-Antikörper gleichzeitig bestimmt werden. Vier solcher Tests, die parallel durchgeführt werden, bestimmt die Interaktionen aller vier Nachweisantikörper mit allen vier Fänger-Antikörper. Abbildung 1 zeigt die vergleichende Daten aus diesen Screening-Assays.
Die Ergebnisse zeigten, dass der Antikörper-Paar aus dem R & D Systems durchgeführt DuoSet besten mit einer daraus resultierenden Reaktion bei 6183 mittlere Fluoreszenzintensität (MFI) Einheiten. Es wurde auch beobachtet, dass die Detektions-Antikörper von Millipore (86% der F & E-Antikörper-Reaktion Paar) und Abcam (67%) eine angemessene Reaktion in der xMAP-Test zur Verfügung gestellt, wenn sie mit dem R & D Systems Fänger-Antikörper kombiniert. Die Fänger-Antikörper aus Abcam, Millipore und Novus produzierte eine weniger erwünschte Resonanz in der xMAP-Assay.
Es ist wichtig zu beachten, dass die PURPose dieser Studie ist es nicht unbedingt Unterschiede zwischen bestimmten Antikörpern oder Lieferanten, sondern lediglich zu illustrieren, dass es erkennbare Unterschiede in der Leistung, wenn die unter ähnlichen Bedingungen verwendet wird, und dass die xMAP-Plattform kann ein effizientes Mittel zur Bewertung dieser Unterschiede bieten zu markieren.
Die R & D Systems DuoSet-Protokoll verwendet wurde, um die vier Antikörper-Paare in einem ELISA-Format zu vergleichen. Die R & D Systems-Protokoll wurde mit allen Antikörper-Paaren verwendet, weil es von typischen reflektierenden ELISA-Protokolle heute weit verbreitet ist und es ist analog zu Protokollen mit xMAP-Technologie verwendet. Die ELISA-Tests zeigten, dass der Antikörper-Paar aus R & D Systems wieder die besten Ergebnisse (Abbildung 2). Der Antikörper-Paar aus Abcam produziert keine Antwort und die Antikörper-Paaren von Millipore und Novus produziert bescheidene Antworten.
Um eine Variation in der Antikörperreaktivität mit dem Standard zu bewerten, alle vier Antiköry-Paare wurden mit drei verschiedenen rekombinanten TNF-α-Protein-Standards getestet, von drei verschiedenen Herstellern (siehe Tabelle Werkstoffe). Die Daten in Abbildung 2 zeigen, dass die rekombinanten TNF-α-Protein-Standards aus den drei Herstellern gleichwertige Ergebnisse gab.
Die TNF-α-Protein von R & D Systems verwendet wurde, um Standard-Kurven mit dem ELISA (Tabelle 1) und den xMAP Assays (Tabellen 2 und 3) zu generieren. Während der ELISA-Test mit dem R & D Systems Antikörper Paar fertig war, nutzten die xMAP Assays die R & D Systems Fänger-Antikörper und entweder die Detektions-Antikörpers von R & D Systems oder Millipore. Die TNF-α-Protein von R & D Systems wurde verdünnt, um eine Reihe von Konzentrationen von 8000 bis 4 pg / ml zu produzieren. Nur die Antikörper-Paar aus R & D Systems produziert das erwartete Ergebnis in der xMAP-Assay, mit einer Antwort> 20.000 MFI, wie in Tabelle 2 dargestellt undAbbildung 3. Wenn die Detektions-Antikörpers von Millipore wurde mit der xMAP-Assay an Stelle des R & D Systems Detektions-Antikörper (Tabelle 3), die Antwort (6.000 MFI) betrug etwa 30% der Reaktion mit dem Detektions-Antikörper von R & D Systems erhalten werden, verwendet, wie in Abbildung 3.
Die Daten in Tabelle 1 für die Standardkurve für die ELISA, der ein vom Hersteller empfohlenen TNF-α von 16 bis 1000 pg / ml hatten. Dieser Bereich war sehr begrenzt, da die OD bei 1000 pg / ml war etwas größer als 2 OD-Einheiten und das Spektralphotometer kann nicht über 3 OD messen. Wegen der Grenze mit dem Spektrophotometer, war es nicht möglich, den Bereich des ELISA-Assays weiter zu erhöhen. Zusätzlich geben die Daten in Tabelle 1, dass die R & D Systems DuoSet ELISA ist nicht zum Aufspüren von TNF-α bei Konzentrationen deutlich weniger als 16 pg / ml. Auf der anderen Seite, ist der Test in der Lage xMAP MessTNF-α Ing. bei einer Konzentration von weniger als 7,8 pg / ml mit der Capture-Antikörper von R & D Systems mit der Detektions-Antikörper entweder von R & D Systems oder Millipore kombiniert.
Der dynamische Bereich und die Empfindlichkeit der beiden Methoden besser dargestellt, wenn in einer log-log-Skala aufgetragen (Abbildung 4). Eine klare Unterscheidung zwischen der Steigung der ELISA-Antworten und den Antworten der xMAP Assays ist ersichtlich, dass weitere deutet auf eine weitere Begrenzung der Fähigkeit zur Erkennung von TNF-α mit dem ELISA, an den beiden höheren und niedrigeren Konzentrationen werden.
Die Nachweisgrenzen (LOD) für die zwei funktionelle TNF-α xMAP Assays wurden durch Identifizieren der niedrigsten TNF-α-Konzentration mit einem Ansprechniveau beobachtet (MFI) größer als der Hintergrund, plus dreimal die Standardabweichung (SD) angenähert. Um die statistische Signifikanz zu erreichen, wurden sechs Wiederholungen verwendet, um die SD für sowohl die xMAP und ELISA-Verfahren zu bestimmen. These Schätzungen der LOD sind optimistisch und soll eine "best-case"-Szenario, mit dem Verständnis, dass unter normalen Betriebsbedingungen nur zwei oder drei Wiederholungen genutzt werden können. In Tabelle 2 ist zu beachten, dass bei Verwendung der R & D Systems Paar, die niedrigste TNF-α-Konzentration bei 3,91 pg / ml eine Antwort von 66 MFI, die größer sind als die Reaktion des Hintergrund + 3SD ist, hergestellt werden, die diese Kriterien erfüllen . Wenn der Millipore Detektionsantikörper mit dem R & D Systems Fänger-Antikörper (Tabelle 3) verwendet wurde, war die Nachweisgrenze von weniger als 7,81 pg / ml. In diesem Fall ergibt das 2. niedrigsten TNF-α-Konzentration eine akzeptable Antwort von 17 MFI, größer als die Reaktion des niedrigsten TNF-α-Konzentration plus dreimal die Standardabweichung. (10 MFI + 3 (2,4) = 16,29 MFI) In ähnlicher Weise wurde die Nachweisgrenze für den R & D Systems DuoSet ELISA schätzungsweise zwischen 63 pg / ml und 31 pg / ml (Tabelle 1) zu sein.
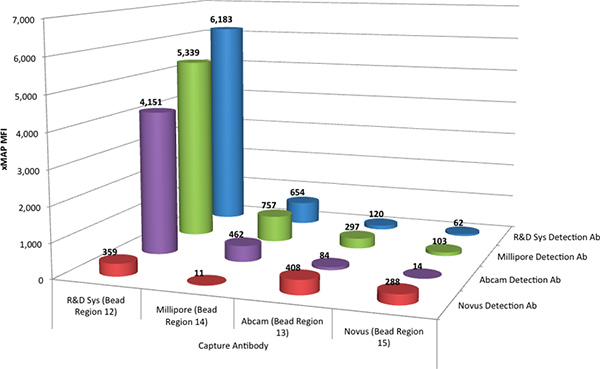
Abbildung 1. Die mittlere Fluoreszenzintensität (MFI) des R & D Systems Standard (@ 2000 pg / ml) für jede mögliche Kombination der vier Fänger-Antikörper (gekoppelt an vier verschiedenen Mikrosphären-Regionen) und den vier Nachweisantikörper. Klicken Sie hier, um zu vergrößern Abbildung .
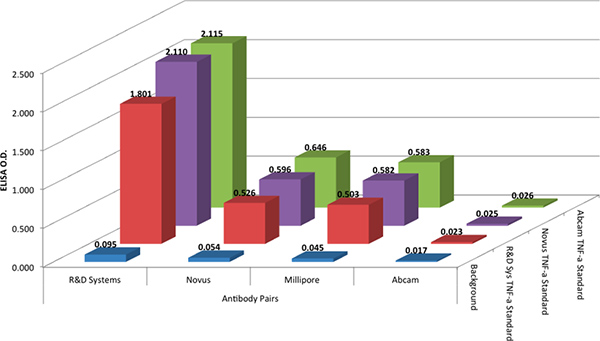
Abbildung 2. Die optische Dichte (OD) von drei verschiedenen rekombinanten Standards (@ 1000 pg / ml) für vier Capture-und Detektions-Antikörper, Paar-Kombinationen. Erfassung und Erkennung Antikörper wurden willkürlich durch Verkäufer gepaart, der Einfachheit halber. Klicken Sie hier für eine größere Abbildung anzuzeigen .
| pg / ml | OD | Std. Abweichung | 3 SD |
| 1000 | 2,084 | 0,035 | 2,187 |
| 500 | 1,328 | 0,038 | 1,441 |
| 250 | 0,787 | 0,025 | 0,863 |
| 125 | 0,476 | 0,026 | 0,554 |
| 63 | 0,304 | 0,023 | 0,374 |
| 31,3 | 0,212 | 0,025 | 0,287 |
| 15,6 | 0,167 | 0,026 | 0,244 |
| 0 | 0,118 | 0,021 | 0,182 |
Tabelle 1 Die optische Dichte (OD) des 2-fachen Verdünnungsreihe von der R & D Systems DuoSet Packungsbeilage, für die Verwendung als Standard-Kurve angegeben;. Einschließlich Standardabweichung (SD) und der geschätzten Nachweisgrenze (LOD), zwischen 31,3 pg / ml und 63 pg / ml.
| R & D Systems Capture-und Detektions-Antikörper | |||
| pg / ml | MFI | Std. Abweichung | 3 SD |
| 8000 | 20.320 | 463 | 21.707 |
| 4000 | 15.594 | 223 | 16.263 |
| 2000 | 11.098 | 79 | 11.336 |
| 1000 | 6985 | 160 | 7465 |
| 500 | 4149 | 80 | 4390 |
| 250 | 2233 | 30,0 | 2323 |
| 125 | 1199 | 43,8 | 1330 |
| 63 | 636 | 14,0 | 678 |
| 31,3 | 340 | 12,9 | 379 |
| 15,6 | 183 | 5,9 | 201 |
| 7,8 | 103 | 2,2 | 109 |
| 3,9 | 66 | 2,4 | 73 |
| 0 | 11 | 0,8 | 13,8 |
Tabelle 2 Die mittlere Fluoreszenzintensität (MFI) von einer Standard-Verdünnungsreihe von xMAP-Technologie gemessen, unter Verwendung des Antikörpers Paar mit dem R & D Systems DuoSet enthalten;. Einschließlich Standardabweichung (SD) und der geschätzten Nachweisgrenze (LOD), weniger als 3,91 pg / ml.
| R & D Systems Capture-Ab mit Millipore-Detection-Ak | |||
| pg / ml | MFI | Std. Abweichung | 3 SD |
| 8000 | 5800 | 143 | 6229 |
| 4000 | 3881 | 120 | 4242 |
| 2000 | 2176 | 73 | 2396 |
| 1000 | 1138 | 32,1 | 1234 |
| 500 | 578 | 31,3 | 671 |
| 250 | 289 | 6,2 | 307 |
| 125 | 142 | 3,1 | 151 |
| 63 | 75 | 5,3 | 91 |
| 31,3 | 44 | 3,3 | 54 |
| 15,6 | 28 | 2,6 | 35,5 |
| 7,8 | 17 | 1,5 | 21,2 |
| 3,9 | 10 | 2,0 | 16,3 |
| 0 | 7 | 1,4 | 11,4 |
Tabelle 3 Die mittlere Fluoreszenzintensität (MFI) von einer Standard-Verdünnungsreihe von xMAP-Technologie gemessen, mit dem R & D Systems Fänger-Antikörper und das EMD Millipore Detektions-Antikörper;. Einschließlich Standardabweichung (SD) und der geschätzten Nachweisgrenze (LOD), weniger als 7,81 pg / ml.
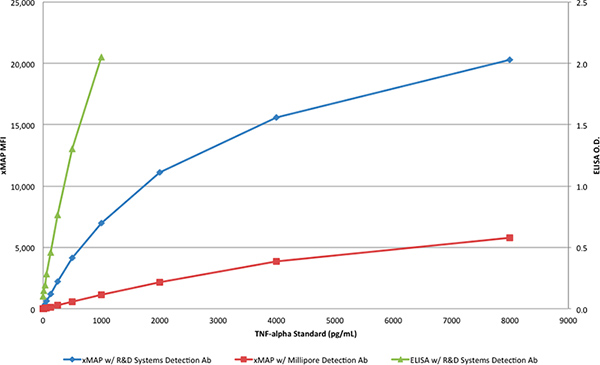
Abbildung 3. Die Standard-Kurven der beiden xMAP Assays und der R & D Systems DuoSet ELISA. Klicken Sie hier für eine größere Abbildung anzuzeigen .
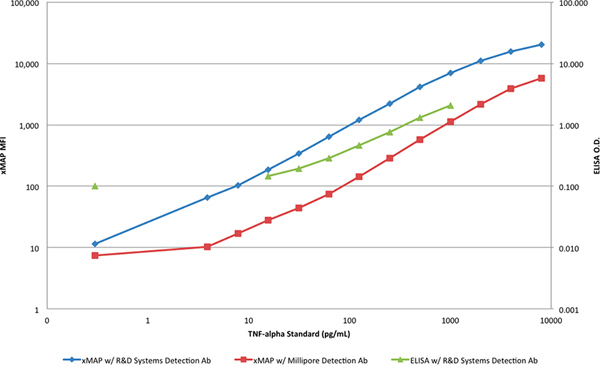
Abbildung 4. Ein Vergleich der xMAP Standardkurven und der ELISA-Standardkurve in einer log-log-Skala. Klicken Sie hier für eine größere Abbildung anzuzeigen .
Diskussion
Die Umwandlung eines ELISA-Assays auf Basis der Luminex xMAP-Plattform kann so einfach sein wie Substitution Streptavidin Meerrettichperoxidase (SA-HRP) in einer typischen ELISA-Kit mit Streptavidin Phycoerythrin (SA-PE), und die Optimierung für die Leistung. Für diejenigen, die eine xMAP Immunoassay von Grund auf neu erstellen möchten, können dies mit einem einfachen Protokoll, das ermöglicht auch die schnelle, Multiplex-Auswertung der Antikörper-Paaren durchgeführt werden. Die Reagenzien für die xMAP Assay wurden leicht unter Verwendung des xMAP Antikörper Kupplungssatz zum Koppeln der Fänger-Antikörper bezeichnet, um MagPlex niedriger Konzentration Mikrokügelchen. Die Verwendung einer niedrigen Konzentration Mikrokügelchen verringert die Kosten der Assay-Entwicklung bei gleicher Testleistung höherer Konzentration Mikrokügelchen. Die Zeit, die erforderlich ist, um Mikrosphären gekoppelt MagPlex vorzubereiten, ist ca. 3 Stunden, das ist viel schneller als die 22 bis 24 Stunden erforderlich, um das Fell gut einer ELISA-Platte, gefolgt von einer Behandlungder beschichteten Vertiefungen. Die Leistung der xMAP-Versuch ist auch besser als der ELISA in Bezug auf die Nachweisgrenze (<4 pg / ml vs> 31 pg / ml) und der dynamische Bereich (<4 pg / ml bis> 8000 pg / ml vs 16 pg / ml bis 1000 pg / ml). Tafel Software haben eine begrenzte OD Bereich, der entweder 3 oder 4, OD, beschränken die obere Grenze des dynamischen Bereichs für einen Assay.
Zweifellos wird nicht alle Antikörper in einem ELISA-Format zu arbeiten und nicht alle Antikörper, die gut funktionieren in einem ELISA sind leicht übertragbar auf die xMAP-Assay-Format. Da jedoch xMAP Assays können gemultiplext (dh, gleichzeitig ausgeführt werden), ist es möglich, mehrere Abscheidung und Nachweis-Antikörper-Kombinationen gleichzeitig zu evaluieren, das beste Paar zu identifizieren, für einen Assay zu verwenden. Dieses Verfahren spart erheblich Zeit und Reagenzien im Vergleich zu dem ELISA-Verfahren Entwicklung, die auf der Auswertung eines Paares in einer Zeit ist begrenzt. Wenn zwei oder mehr Antikörper-Paare ausführen äquivalent; andere Parameter des Assays könnenals Eignung des Paares (z. B. Verfügbarkeit, Kosten, usw.) zu bestimmen.
Neben der verbesserten Assay-Performance und Flexibilität mit der xMAP-Assay, gibt es auch erhebliche Kosteneinsparungen. Die empfohlene Menge des Antikörpers zur Beschichtung eines einzigen Vertiefung eine ELISA-Platte ist 400 ng erforderlich ist, während die Menge der Kügelchen in einer Vertiefung einer xMAP Assay verwendet liegt bei ca. 7,5 ng. Somit wird die Menge des Antikörpers für ein ELISA benötigt auch wird mehr als 50 Testergebnisse, wenn es in einer xMAP Assay verwendet. Für Anwendungen mit wertvollen Proben, xMAP hat auch einen erheblichen Vorteil. Das Volumen der Probe für den ELISA empfohlen ist 100 ul während das Volumen für die xMAP-Assay erforderlich, dass die Hälfte oder weniger sein können.
Zusammenfassend ist die Umwandlung eines ELISA-Assays auf Basis der Luminex xMAP-Plattform unkompliziert, effizient und Kosten sparend, während die Herstellung eines Assays mit überlegener Dynamik und Sensibilität.
Offenlegungen
Diese Arbeit wurde am Luminex Corporation mit Ausrüstung bei Luminex Corporation hergestellt getan.
R & D Systems & EMD Millipore sind strategische Partner von Luminex Corporation, lizenziert zur Entwicklung und Vermarktung xMAP Multiplex Assays.
Danksagungen
Diese Arbeit wurde von Luminex Corporation finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Beschreibung | Verkäufer | Katalog-Nummer | Kommentare |
| Menschliche TNF-α/TNFSF1A DuoSet ELISA-Kit | R & D Systems | DY210 | Enthält monoklonale und polyklonale Biotin-gekoppelten Antikörpern und rekombinanten TNF-α-Protein-Standard |
| Monoklonaler Antikörper gegen TNF-α | Abcam | Ab18696 | Fänger-Antikörper, Klon CH8820 |
| Monoklonaler Antikörper gegen TNF-α | Abcam | Ab16166 | Biotin-gekoppelten Detektions-Antikörper, Klon AS1 |
| TNF-alpha-Protein | Abcam | Ab9642 | Rekombinanten TNF-α-Protein-Standard |
| Monoklonaler Antikörper gegen TNF-α | NOVUS | NBP1-50115 | Fänger-Antikörper, Klon 4H31 |
| Monoklonaler Antikörper gegen TNF-α | Novus | NB100-78162 | Biotin-gekoppelten Detektions-Antikörper, Klon MAb11 |
| TNF-alpha-Protein | Novus | NBC1-18460 | Rekombinanten TNF-α-Protein-Standard |
| Monoklonaler Antikörper gegen TNF-α | EMD Millipore | MAB1141 | Fänger-Antikörper, klonen 3C7.2 |
| Polyklonalen Antikörper gegen TNF-α | EMD Millipore | 654250 | Kaninchen polyklonaler Antikörper-Erkennung |
| Streptavidin-Phycoerythrin | Moos | SAPE-001 | Fluoreszierenden Reporter-Reagenz für die Luminex xMAP-Test |
| MAGPIX w / Xponent Software | Luminex Corporation | MAGPIX-Xponent | Luminex-Gerät |
| xMAP Antikörper-Kupplung (AbC) Kit | Luminex Corporation | 40-50016 | Beinhaltet EDC-Reagenz, Sulfo-NHS-Reagenz, Aktivierung, Waschpuffer, 1,5 ml Reaktionsgefäße und Einwegpipetten |
| MagPlex Microspheres, geringe Konzentration | Luminex Corporation | MC10012-ID, MC10013-ID, MC10014-ID, MC10015-ID | Kügelchen mit niedriger Konzentration (bei 2,5 x 10 6 Kügelchen / ml) |
| EZ-Link Sulfo-NHS-LC-Biotin | Thermo Fisher | PI-21335 | Biotinylierungskit für unmodifizierte Detektionsantikörper |
| Tecan Infinite F200 Reader | Tecan | ELISA-Reader | |
| Phosphate Buffered Saline | Sigma-Aldrich | P-3688 | 1% PBS-BSA, Assay-Puffer |
| One-Pint Kompakte Ultraschall-Reiniger, 115 VAC | Cole-Parmer | WU-08849-00 | Produzieren Sie eine effektive Betriebsfrequenz von 55 kHz |
| Magnetische Rohr Separator | Luminex Corporation | CN-0288 bis 01 | Für einzelne 1,5 ml Röhrchen magnetische Trennung in Kopplung Waschschritte |
| Magnetische Plattenphasentrenner | Luminex Corporation | CN-0269 bis 01 | Für 96-Well-Platte magnetischen Trennung in Assay-Waschschritte |
Referenzen
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten