Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
High-Throughput-Einzel-Zell-und Multiple-Zelle Mikroverkapselung
In diesem Artikel
Zusammenfassung
Das Kombinieren der monodispersen Tropfenerzeugung mit Beschleunigungssensoren Anordnung von Zellen und Partikeln, beschreiben wir ein Verfahren, um eine gewünschte Anzahl von Zellen oder Teilchen in einem einzelnen Tropfen mit kHz Preise zu kapseln. Wir demonstrieren die Effizienz zweimal höher sind als die von ungeordneten Kapselung für Single-und Double-Teilchen-Tropfen.
Zusammenfassung
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protokoll
Die Protokolle in diesem Abschnitt beschreiben die Materialien und Ausrüstungen, die speziell auf die experimentellen Ergebnisse präsentiert bekommen genutzt. Beachten Sie, dass andere Anbieter für Chemikalien und Ausrüstung verwendet werden kann.
1. Bauelementherstellung und Softlithographie
Standard-Soft-Lithographie-Techniken, 21 von denen einige in früheren JOVE Artikel wurden oft vorgestellten wurden 22 für die Erstellung von Polydimethylsiloxan (PDMS) Mikrokanal Netzwerke gebunden an Glassubstraten verwendet. Abgesehen von Masterreproduktion Formenbau von SU-8 Photolithographie können die Prozesse außerhalb von einem Reinraum oder sauberen Abzug durchgeführt werden, jedoch Staub und Partikel sollten noch minimiert werden, um konsistente Ergebnisse zu erzielen.
- Entwerfen Sie ein Mikro-Kanal-Muster wie in Abbildung 1 in AutoCAD (Autodesk Inc.) gezeigt. Von einem Dritten Herstellers (Fineline Imaging Inc.), um eine hohe Auflösung (50.000 dpi) trans druckenTransparenz-Maske auf Mylar-Folie oder Quarz, wo Kanäle sind transparent auf einem dunklen Hintergrund.
- Erstellen Sie eine Silizium-und SU-8 Fotolack-Master für Replik Guß. Kurz gesagt, spinnen SU-8-2050 (MicroChem) negativer Photoresist mit vom Hersteller empfohlenen rpm auf einem Spin-Coater, eine 52 um dicke Schicht auf ein sauberes 7,5 cm oder 10 cm Silizium-Wafer zu erzeugen. Nach Weichbacken, Randentlackung, UV-Belichtung durch eine Maske Kontakt, Post-Exposure Bake, Entwicklung und Flutbelichtung, messen die tatsächliche Dicke des SU-8-Schicht mit Hilfe eines Dektak Profilometer (Veeco). Band der Master-Form auf den Boden eines 4 "oder 5" Petrischale für PDMS Replikat Formen herzustellen.
- Mix PDMS-Elastomer-Basis mit Elastomer Härtungsmittel (Dow Corning) in einem Verhältnis von 10:1 w / w Basis zu Härter. Gießen Sie gut gemischten PDMS-Vorläufer auf den Silizium-Master eine 2-3 mm endgültige Dicke Schicht schaffen. Eine Mischung aus 20 g Elastomer-Basis mit 2 g Härtungsmittel ausreichend ist, um ein 4 "Durchmesser bedecken.
- Legen Sie die Master Schimmel und PDMS im Vakuumexsikkator (Jencons) zu de-Gas nicht ausgehärteten PDMS. Verwendung eines Druckreglers (Cole Parmer), langsam abnehmen die Kammer Überdruck von 0 "Hg bis -27" Hg innerhalb von 20 Minuten, um ein übermäßiges Schäumen zu vermeiden. Lassen Vorrichtung in der Vakuumkammer bei -27 "Hg für 30 Minuten oder bis Luftblasen verschwinden.
- Lassen Vakuum bewegen und Master-Form und PDMS zu einem 65 ° C Ofen (Thermo Scientific) bei einem Mindestaufenthalt von vier Stunden. Die Vorrichtung kann in den Ofen über Nacht Härten zu verbessern gelassen werden.
- Entfernen Sie das Gerät aus dem Ofen nehmen und abkühlen lassen. Schneiden Sie vorsichtig PDMS um kreisförmige Scheibe mit einer Präzisions-Messer schälen und aus PDMS. Ausschneiden Vorrichtung Form wie in 1 gezeigt, mit einem Skalpell.
- Stanz fluidische Anschlüsse (drei pro Gerät) in den drei Regionen jähriger in 1 gezeigt unter Verwendung eines Biopsiestanze. Für dieses Gerät mit einem 0,75 mm Außendurchmesser Stempel (Harris).
- Beachten Tesafilm auf das strukturierte Seite des PDMS und einem Peeling entfernenStaub. Als kostengünstige, aber lebensfähige Alternative zu herkömmlichen Sauerstoff-Plasma-Geräte, Plasma-Behandlung 21,22 mit der strukturierten Seite des PDMS und einem sauberen 3 "x 1" Glas-Objektträger mit einem Handheld-Labor Corona Anlage (Electro-Technic Products Inc .). 23. Hinweis, dass dieses Gerät in einem Abzug oder gut belüfteten Raum durch Ozon Entladung verwendet werden sollte, und alle Uhren und Handys sollte mindestens drei Meter entfernt gehalten werden. Passen Sie die Corona-Entladung, um eine stabile Korona mit minimaler Funkenbildung zu erreichen. Langsam schwenken die Elektrode etwa 1/4 "über jeder Fläche für etwa 20 Sekunden und dann sofort bringen die behandelten Oberflächen in Kontakt, um eine starke dauerhafte Verbindung bilden, bevor die PDMS-Oberflächen in ihre Heimat zurückzukehren.
- Stellen Sie das Gerät auf einer Metallplatte, in einem kalten Ofen, stellen Sie den Backofen auf 120 ° C und über Nacht backen, um die Bindung zu vervollständigen und die PDMS zu seiner ursprünglichen hydrophoben Zustand. Zurück 24 Während dieser hohen Temperatur backen, ter Glasoberfläche des Kanals auch hydrophob aufgrund der Ablagerung von einer dünnen hydrophoben Schicht auf dem Glas werden. Alternativ kann hydrophoben Beschichtungen, wie Aquapel (PPG Industries) in die fluidischen Anschlüsse unter Verwendung einer 1 ml Spritze und einer Nadel Spritze injiziert werden. 12 sorgfältig aber fest injizieren Aquapel von Spülluft in die fluidischen Anschlüsse ohne die PDMS auf Glas-Bindung gefolgt . Aggressiv wiederholen Sie die Entlüftung auf allen Einlass-und Auslasskanäle, während Wischen Sie überschüssiges Aquapel, um eventuelle Ablagerungen, die die Kanäle verstopfen können nach dem Trocknen zu vermeiden.
2. Probenvorbereitung
- Bereiten Sie eine Zellkultur nach festgelegten Verfahren für Ihr ausgewähltes Zelltyp. Für das spezielle Gerät in dieser Studie verwendet wird, sollte 8-15 um Teilchen oder Zellen adäquat für die Verkapselung zu bestellen. Kleinere oder größere Zelltypen, die Änderung der Abmessungen der Fokussierung Kanal, um eine angemessene Re p erreichen. Für die mirThSB Demonstration Ergebnisse in dieser Arbeit gezeigt, werden um 9,9 Polystyrol-Mikrosphären (G1000, Thermo Scientific) als Surrogate Zelle genutzt.
- Bereiten Sie die wässrige Partikel-oder Zellsuspension durch vorsichtiges Mischen. Bei der Verwendung von Zellen oder Polystyrol-Teilchen, ist die Kontrolle, Konzentration (siehe Abbildung 4), um ideale bestellt Kapselung zu erzielen. Mit bisherigen Daten 12 als Leitfaden, berechnen Sie die gewünschte Zelle oder Partikelkonzentration von der bestellten Zug Abstand und Mikro-Kanal-Größe basiert wie: eine Zelle oder ein Teilchen pro erwarteten Längs-Zug mal Abstand die Fokussierung Kanal Querschnittsfläche. Wenn die Stoffkonzentration (1% w / w) nicht ausreichend ist, Erhöhung der Konzentration (hier 1,5% w / w) durch leichtes Zentrifugieren der Probe Lager, überstehende Flüssigkeit entfernt, und Resuspendieren der Teilchen durch Vortex-Mischen, Mischen oder sanfteren bei der Verwendung von Zellen. Vorbereitung eines angemessenen Volumens zu berücksichtigen gewünschte Sammelvolumen und für Laufzeit mit fl verbundenow-Tuning.
- Beide Zellen und Polystyrol-Partikel ein spezifisches Gewicht größer als eins. Obwohl es in diesem Protokoll gezeigt, für Langzeit-Experimenten Dauer in der Größenordnung von mehreren Minuten bis zu Stunden, einverstanden Auftrieb die Lösung durch Zugabe eines gelösten Stoffes wie CaCl 2 für Partikel oder Optiprep (Sigma-Aldrich) für Zellen.
- Eine 10 ml Probe des kontinuierlichen Fluorkohlenstoffphase Ölphase durch Mischen des Fluorkohlenstofföl FC-40 (3M) und PFPE-PEG-Block-Copolymer-Tensid 25 (2,5% w / w) (RainDance Technologies) in einem 15 ml-Zentrifugenröhrchen. Alternativ kann leichtes Mineralöl (PTI Verfahren Chemicals) mit ABIL-EM 90 Tensid (2,5% w / w) (Evonik Goldschmidt Corporation) verwendet werden.
3. Experimenteller Aufbau
- Schalten Sie den invertierten optischen Mikroskop (Axio Observer, Zeiss) und High-Speed-Kamera (Phantom V310, Vision Research). Konzentrieren Sie und prüfen Sie die Kanäle für Clogs und Schutt durch entweder manuell das Gerät bewegen odermit einem motorisierten Mikroskop Bühne. Einige kleine Trümmer heraus geschoben werden kann, wenn Flüssigkeit durchströmt. Für große Trümmer oder offensichtliche Clogs, wählen Sie einen anderen Kanal auf dem Gerät als Fremdkörper in der Fokussierung Kanal kann degradieren Bestellung Qualität erheblich. Beachten Sie, dass Clogs können oft unter Strom, indem Sie fest auf dem PDMS-Oberfläche über der betroffenen Region mit stumpfen Pinzette entfernt werden.
- Schneiden drei Längen von PVC-Schläuchen (0,01 "ID/0.03" OD, Tygon) für die wässrige Einlaß, Öleinlass und Auslaß Emulsion. Um Totvolumen zu minimieren, gerade genug, um Schläuche von den Spritzenpumpen auf dem Mikroskoptisch erreichen geschnitten. Schneiden Sie Rohrenden in einem 45 ° Winkel zum Einsetzen in fluidischen Anschlüsse zu erleichtern.
- Sie mit einer Pinzette drücken passen die Rohrenden in die fluidischen Anschlüsse in Schritt 1 gestanzt und drücken Sie dann passen zwei 30-Gauge-Blunt-Spitze aus Edelstahl Kanülen (Kleinteile) in die freien Enden der jeweiligen wässrigen und öligen Einlaßrohren (kein Klebstoff erforderlich) . Setzen Sie den Ablaufschlauch in einen Abfallbehälter reservoir. Dieser Schlauch wird später in einen Sammelbehälter bewegt werden.
- Bewegen Sie das Gerät und die angeschlossenen Schlauch mit dem Mikroskoptisch, ausrichten und konzentrieren sich auf die Düse mit einem Gerät zur Verfügung Objektiv (20x wurde für dieses Experiment verwendet wird). Passen Sie für K hler Beleuchtung und andere Einstellungen als Mikroskop für eine optimale Aufnahme erforderlich.
- In eine 1 ml-Spritze (BD) mit der gut gemischten wässrigen Phase und einer 3 ml Spritze (BD) mit der Ölphase Lösung in Schritt 2 hergestellt. Beachten Sie, dass alle Spritzen nach einem der Volumen verwendet werden können, sollten sorgfältig ausgewählt werden je nach den gewünschten Laufzeiten und Minimierung jeglicher Pulsatilität. Neigen Sie eine Spritze vertikal und Flick, um Luftblasen an die Spritzenauslaßstück bewegen. Drücken Sie langsam genug, um die Kolben Luft zu der Kanüle zu schieben. Halten der Spritze vertikal, verbinden die Spritzen mit der entsprechenden Spritze Nadel bereits auf das Gerät in Schritt 3.3 befestigt. Drücken Kolben, um die Luft durch die Spritzennadel Totvolumen zwingen, bis die Flüssigkeit pushed durch den Schlauch fast an das Gerät. Befestigen Sie die Spritze zu einer Spritzenpumpe (Nexus 3000, Chemyx) und den Kolben in Eingriff Block. Wiederholen Sie die Anschlüsse für die zweite Spritze und montieren Sie an einen zweiten Spritzenpumpe.
- Leistung auf jeder Spritzenpumpe und Programm unter Verwendung der Pumpe Herstellers Protokolle. Stellen Sie die ersten Flussraten bis Q = Öl 50 &mgr; l / min und Q AQ = 5 &mgr; l / min für die Öl-Phase und der wässrigen Phase, beziehungsweise. Starten Sie die Pumpen.
- Warten Sie für jede Flüssigkeit in das Gerät eindringen und füllen Sie die Kanäle, Ausschieben verbleibende tote Luft. Dies kann einige Minuten dauern. Wenn es eine große Menge an Luft in dem Einlassschlauch, vorübergehend zu erhöhen, jedes Strömungsrate, bis die Luft ausgestoßen wird. Erhöhen Sie nicht die Durchflussmengen so hoch, dass große Belastungen treten in den Kanal, was möglicherweise zu PDMS-Glas-Bindung Misserfolg.
- Mit den ersten Flussraten, beobachten die Bildung von Tropfen an der Düse (hier gezeigten Ergebnisse: 20x magnification, 21005 fps Bildrate, Belichtung 3 us). Reduzieren Sie die Kamera Sichtfeld nur die Düse, um die Frame-Rate zu maximieren und die Speicheranforderungen, wenn möglich. Nehmen Sie Videos und Probe bestätigen, dass die Abtastrate ausreichend, um Aliasing zu vermeiden ist.
- Zur Vermeidung von Strahlen (siehe Abbildung 2), mit niedrigen Flussraten wässrigen starten. Langsam erhöhen wäßrigen Strömungsrate zu beobachten Reihenfolge der Partikel in der wässrigen Lösung langen Kanal, wenn die Strömungsrate zunimmt.
- Ist die Partikelkonzentration ist zu niedrig, um Züge mit relativ wenigen "fehlenden" Partikel und die Probe wurde nicht abgestimmt Auftrieb geben, körperlich kippen Sie die Spritzenpumpe in Richtung der Spritzenauslaßstück zu bieten allmählichen Absetzen der Teilchen in Richtung der Spritze Steckdose. Dieses Verfahren ist in dem Video-Protokoll gezeigt. In regelmäßigen Abständen Drehen der Spritze entlang ihrer Achse kann auch reduzieren unerwünschte Besiedlung.
- Sobald eine angemessene Ordnung auftritt, stellen Sie die Ölmenge, die Generierung Frequenz abzustimmen undGröße der Tropfen. Die mittlere Tropfenvolumen kann mit Hilfe der wässrigen Durchfluss durch den Rückgang Generation Frequenz wie von Video-Capture gemessen aufgeteilt werden. Iterativ anpassen beide Volumenströme zu wünschen Kapselung Preise und Tropfenvolumen zu erreichen.
- Sobald stabile bestellt Kapselung bestätigt wird, bewegen Sie den Ablaufschlauch aus dem Abfall Reservoir in einen Sammelbehälter oder speisen ihn in ein anderes Gerät für die anschließende Prüfung.
- Bestimmen Sie die Sammlung auf Zeit gewünschte Anzahl von Tröpfchen und der berechneten Frequenz-Generation basiert.
- Datensatz der Anteil von Tropfen, die 0, 1, 2, ..., N Teilchen, um die Effizienz Quantifizierung unter Verwendung von entweder Tropfenerzeugung Video Ergebnisse oder durch Pipettieren einer Probe der gesammelten Emulsion zur Inspektion.
4. Repräsentative Ergebnisse
Die Ergebnisse werden präsentiert, die sowohl zu erreichen kontrollierte Ein-Teilchen und kontrollierten Doppelblind-Teilchen-Verkapselung (Abbildung 3). Durch das Schneidendie FC-40 Ölmenge in der Hälfte, wird Einteilchen-Verkapselung Zwei-Teilchen-Kapselung. Umgekehrt könnte man die wässrige Durchfluss, um Partikel zu der Düse schneller liefern erhöht haben, aber wir würden auch das Risiko von Strahlen von dem wässrigen Strom erhöht haben. Histogramme in Abbildung 3 präsentieren die gebrochene Zahl der Teilchen pro Tropfen für die beiden Fälle zusammen mit Vergleiche mit Poisson-Statistik. Die gelegentlichen Tropfen mit Null Teilchen sind in erster Linie die "fehlenden" Teilchen in den bestellten Züge, während die Fälle, in denen es mehr als gewünscht eingekapselten Teilchen Folge lokal hohen Partikelkonzentrationen und Partikel, die manchmal zu einem der zwei vertikalen Fokuspositionen zu migrieren. Beachten Sie, dass Auftrieb passend wie in Abschnitt 2 beschrieben wurde nicht genutzt. Stattdessen wurde die Spritzenpumpe physikalisch gekippt, damit Absetzen der Partikel in Richtung der Spritze Auslaß, was zu einer hohen Konzentration von Partikeln während des Laufs.
Ein experimenteller Sicht, welche die Notwendigkeit einer angemessenen Partikel-und Zell-Konzentrationen ist in Abbildung 4 dargestellt. Ohne vollständige Bestellung, werden lokalisierte Gruppen von Teilchen Ordnung und gekapselt, aber viele Tropfen sind ohne Partikel. Ein Histogramm zeigt die verminderte Verkapselungseffizienz für die gewünschte Partikelgröße zwei Kapselung.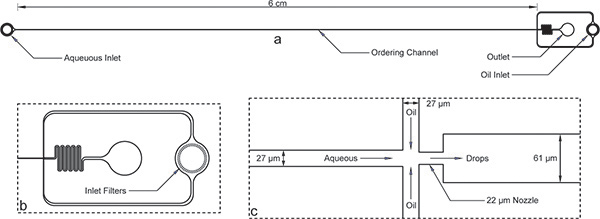
Abbildung 1. Encapsulation Gerät. a) Gesamt-Gerät mit Buchten, Steckdose und lange Bestellweg. Das Gerät beträgt 52 um und die Bestellung von Kanalbreite beträgt 27 um. b) Sowohl wässrigen und öligen Einlässe große Trümmer Filter mit Lücken in der Größenordnung von der Bestellung Kanalbreite für die vergrößerte Ansicht des Öleinlasses. c) Die vergrößerte Ansicht zeigt Düse gleich Kanalweiten 27 um den wässrigen und öligen Kanälen, durch die Kontraktion der Düse 22 um und plötzliche Ausdehnung einer breiteren Kanal 61 um folgt.Beachten Sie, dass die Abmessungen der hier gezeigten Vorrichtung überprüft wurden mit einem Profilometer nach Mikrofabrikation und unterscheiden sich geringfügig von den Nennweiten auf der Maske. Ein wahres Bild des Bestellers Kanal und Düse sind online verfügbar als Supplemental Abbildung 1 . Die AutoCAD-Datei Maske wurde ebenfalls eingeschlossen Online als Ergänzung zu diesem Manuskript.

Abbildung 2. Hysterese eines tropfenden zu Jetting Übergang mit einem größeren Gerät (80 x 22 um breit um hoch). a) Bei konstanten FC-40 Durchfluss (Q Öl = 45 ul / min), tritt stetigen Tropfenbildung bei 10 kHz mit einer wässrigen Volumenstrom Q AQ = 8 ul / min. Als die wässrige Strömungsrate wird langsam auf 10 m erhöht undu, L / min, Ausstoßen der wässrigen Fluidstrom ausgelöst wird. b) Wenn die Durchflussrate ist auf 8 ul / min Jetting weiter zurück. Beachten Sie, dass stetige Tropfenbildung kann durch kurzes Anhalten der wässrigen Strömungspumpe (a 1 Sekunde Pause ist typisch) wieder hergestellt werden.
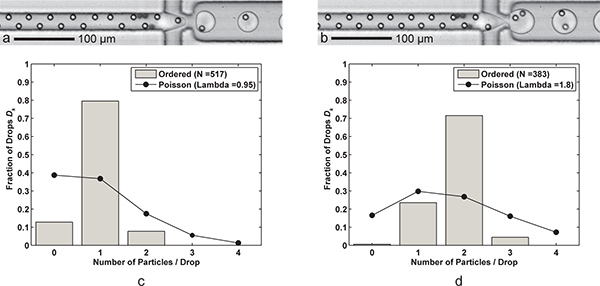
Abbildung 3. Einzel-und Doppel-Teilchen-Kapselung. A) Tropfenbildung mit einer Zelle pro Tropfen (Öl Q = 60 ul / min, Q aq = 9 ul / min) mit einem Tropfen Generation von 6,1 kHz, mittlere Tropfengröße von 24,4 pL, und ein Single-Cell-Abscheidung Wirkungsgrade D k = 79,5% und P k = 83,7% (λ = 0,95) für eine Stichprobengröße von n d = 517 Tropfen und n p = 491 Teilchen. b) Drop-Formation mit zwei Zellen pro Tropfen wird einfach durch eine Verringerung der FC-40 Öl-Fördermenge Q bis 30 μ erreichtL / min. Die größere (39,8 pL) Tropfen werden mit einer Rate von 3,8 kHz mit einer Zwei-Zell-Capture-Effizienz ausgebildet D k = 71,5% und P k = 79,5% (λ = 1,80) für eine Probe von n d = 383 und n Tropfen p = 689 Teilchen. cd) Zwei Histogramme vergleichen Sie die Drop-Kapselung Partikel Wirkungsgrade D k der bestellten Single-und Double-Teilchen-Verkapselung mit Poisson-Statistik (random Kapselung). Beachten Sie, dass in beiden Fällen, Partikel Abstand in Strömungsrichtung um etwa 17-18 für vollständig geordneten abwechselnd Teilchen ist. Zusätzliche Videos zeigen sowohl Single-und Double-Teilchen-Kapselung sind online verfügbar. Klicken Sie hier um Supplemental Film 3a anzuzeigen . Klicken Sie hier um Supplemental Film 3b sehen .

Abbildung 4. Konzentration stark beeinflusst Verkapselungseffizienz. A) Als die Konzentration nimmt ab, voller Ordnung findet nicht statt, und damit "Löcher" in den Zügen entstehen, so dass einige Tropfen mit weniger als erwarteten Partikel. B) Das Histogramm zeigt die verringerte Effizienz ( D k = 55,9%, P k = 70,9%) für Zwei-Teilchen durch Einkapselung auf einen niedrigeren Wert von λ = 1,57, wo es annähernd so viele Einzelpartikel-abfällt, da Doppel-Teilchen Tropfen. Dieser Angabe liegt Q Öl = 30 ul / min und Q AQ = 9 ul / min, die gleichen Bedingungen wie für die Flow Abbildung 3b. Ein Vertreter ergänzende Video ist online verfügbar. Klicken Sie hier um Supplemental Movie 4 sehen .
Diskussion
Trotz der relativ hohen Grad der Bestellung werden nicht alle Tropfen enthalten die richtige Anzahl von Partikeln oder Zellen. Verkapselungseffizienz kann als die Anzahl von Zellen oder Partikeln, die in Tropfen mit der gewünschten Belegung durch die Gesamtzahl unterteilt eingekapselt geworden berechnet werden. Diese Rohdaten können entweder von einem automatisierten High-Speed-Video-Algorithmus oder aus einer Stichprobe von Imaging gesammelt Emulsion erhalten werden. Dies kann zu der Fraktion von Teilchen P ...
Offenlegungen
JE ist ein Erfinder auf einen anhängigen Patent auf die Technologie in diesem Manuskript verwendet basiert.
Danksagungen
Wir danken RainDance Technologies für die Probe von PFPE-PEG-Tensid in dieser Studie verwendeten, und wir danken den BioMEMS Resource Center (Mehmet Toner, Regisseur) für die Silizium-Wafer verwendet werden, um Schimmel PDMS-Kanal Repliken zu erstellen.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| AutoCAD | AutoDesk | ||
| Transparenz-Maske | Fineline Imaging Inc. | ||
| SU-8 Fotolack | MicroChem | 2050 | |
| Dektak Profilometer | Veeco | ||
| Petrischale | BD Falcon | 351058 | |
| PDMS-Silikon-Elastomer-Kit | Dow Corning Corp | Sylgard 184, Werkstoff-Nummer (240) 4019862 | |
| Vakuumexsikkator | Jencons | 250-030 | |
| Vakuumpumpe | Alcatel Vacuum Technology | 2010 C2 | |
| Vakuumregler | Cole-Parmer | EW-00910-10 | |
| Backofen | Thermo Scientific | Lindberg Blue M, OV800F | |
| Biopsiestanze, 0,75 mm | Harris | Uni-Core-15072 | |
| Labor Corona Anlage | Electro-Technic Products Inc. | BD-20AC, SKU 12051A | |
| Glas-Folien | Gold Seal | 3010 | |
| Aquapel | PPG Industries | Alternative Strategie | |
| Polystyrol-Mikrokügelchen, um 9,9 | Thermo | G1000 | |
| Optiprep | Sigma-Aldrich | D1556 | Nicht nachgewiesen |
| Luer-Lok Spritzen | BD | 1 ml: 309628 3 ml: 309585 | |
| FC-40 Fluorkohlenstofföl | 3M Inc. | Sigma Aldrich, F9755 | |
| PFPE-PEG Fluortensid | RainDance Technologies | ||
| Leichtes Mineralöl | PTI Process Chemicals | 08042-47-5 | Alternative Strategie |
| Mineral-Öl-Tensid | Evonik Goldschmidt GmbH | Abil EM 90 | Alternative Strategie |
| Tygon Schlauch aus PVC | Kleinteile | TGY-010 | |
| 30-Gauge-Luer-Lok Spritzennadel, 1/2 " | Kleinteile | NE-301PL-C | |
| Inverses Mikroskop | Carl Zeiss Imaging | Axio Observer.Z1 | |
| High Speed Kamera | Vision Research | Phantom V310 | |
| Spritzenpumpen (2) | Chemyx Inc. | Nexus 3000 | |
| Silikonöl | Dow Corning | 200 Fluid, 10 cSt | Optional für Storage-Emulsion |
Referenzen
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten