Method Article
Small-scale Kernextrakten für funktionelle Assays von Gen-Expression Machineries
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Vorbereitung der robuste, kleine HeLa Kernextrakten beschrieben wird. Dieses Protokoll ist wertvoll für Tests, die Verwendung von kleinen Populationen von Zellen, wie Zellen mit Medikamenten oder RNAi behandelt erfordern. Verfahren sollte für eine Vielzahl von Genexpressions und anderen Zelltypen, einschließlich Zellen des Patienten.
Zusammenfassung
Ein großer Teil der Fortschritte im Verständnis der Genexpression wurde unter Verwendung von in vitro Systemen. Für die meisten Studien werden funktionelle Assays unter Verwendung von Extrakten, die in loser Schüttung von 10 bis 50 oder mehr Liter Zellen in Suspension gewachsen sind bereit, durchgeführt. Jedoch sind diese in größerem Maßstab durchgeführt nicht zugänglich schnell Test in vitro Wirkungen, die aus einer Vielzahl von in vivo zellulären Behandlungen oder Bedingungen. Die Zeitschrift Video Artikel zeigt ein Verfahren zur Herstellung funktioneller kleinen nukleären Extrakten mit HeLa-Zellen als ein Beispiel. Dieses Verfahren wird unter Verwendung von nur drei 150 mm-Platten von Zellen als adhärente Monoschichten gewachsenen durchgeführt. Um die Effizienz der Klein-Extrakten zu veranschaulichen, zeigen wir, dass sie so aktiv wie lose gekoppelte Kernextrakten für RNA Polymerase II Transkription / Spleißen Reaktionen sind. Um das Dienstprogramm des Extraktes Protokoll zu demonstrieren, zeigen wir, dass Spleißen in Extrakten aus HeLa-Zelle vorbereitet wird abgeschaffts behandelt mit dem Spleißen Hemmer Medikament E7107. Die kleinräumige Protokoll sollte allgemein für jeden Prozess oder Zelltyp, der in vitro untersucht werden können, mit Zellextrakten. Dazu gehören Zellen des Patienten, die nur in begrenzten Mengen oder Zellen, die zahlreiche Mittel, wie Arzneimittel, DNA-schädigende Mittel, RNAi oder Transfektion, die die Verwendung von kleinen Zellpopulationen erfordern. Darüber hinaus sind kleine Mengen frisch gezüchtete Zellen bequem und / oder die für einige Anwendungen.
Protokoll
1. Wachsenden HeLa Zellen für Nuclear Extraction
- Tafel HeLa-Zellen auf drei 150 mm-Platten mit DMEM-Medium, ergänzt mit 10% FBS und 1% Penicillin / Streptomycin. Wachsen in einem 37 ° C Inkubator mit 5% CO 2, bis die Zellen 90% konfluent sind.
Tip-Split-Zellen 1.10 von einer konfluenten Platte und Ernte 3 Tage nach der Trennung.
Tipp-Eine zusätzliche Platte kann bei gezüchtet werden nicht genügend Zellen mit drei Platten (zum Beispiel, wenn die Zellen weniger als 90% konfluent sind).
2. Bereiten Sie und Chill Nuclear Extract Solutions
- Bereiten Sie frische Lösungen, wie in Tabelle 2 dargestellt.
- Aliquot von 10 ml hypotonischen Puffer in ein 15 ml Falcon-Röhrchen. Aliquot von 1 ml Puffer mit hohem Salzgehalt und 1 ml Puffer mit niedrigem Salzgehalt in 1,5 ml Eppendorf-Röhrchen. Kühlen Sie die Puffer auf Eis. Fügen Sie die entsprechenden Volumina von PMSF und DTT auf jeden Puffer unmittelbar vor der Verwendung (siehe Tabelle 1).
3. Ernte HeLa-Zellen für Nuclear Extraction
- Saugen Sie Medien aus den Zellen und waschen Sie die Zellen einmal mit 13 ml Raumtemperatur 1X PBS pro Platte.
- Saugen Sie das PBS-Waschung.
Tip-Saugen so viel von der PBS wie möglich, indem zunächst aspirierenden, dann steht die Platte auf seiner Seite, einige Sekunden warten, und Absaugen der Ruhe.
- Wenn eine Zelle Heber, kratzen Zellen bis zum unteren Rand der Platten, und anschließend die Zellen in ein Eppendorf-Röhrchen. Vermeiden Sie Blasen. Die 3 Platten abgekratzt Zellen sollten in ein 1,5 ml Eppendorf-Röhrchen passen.
Tipp-Es ist einfacher, das Volumen der Zellen abzuschätzen, ob ein Eppendorf-Röhrchen verwendet wird. Für Scale-up, Falcon-Röhrchen verwenden.
- Zentrifugieren bei 4 ° C in einer Mikrozentrifuge für 5 min bei 100 xg die Zellen zu pelletieren.
4. Swell HeLa-Zellen in hypotonischen Puffer
- Vorsichtig absaugen PBS vom Zellpellet und schätzen Sie die gepackten Zellvolumens (PCV), indem Sie die Gradation auf dem Schlauch. Drei konfluenten Platten von HeLa-Zellen liefern etwa 500 ul von PCV.
- Hinzufügen weiterer 2X die PCV von hypotonischen Puffer zu dem Zellpellet. Vorsichtig schütteln, um die Zellen zu resuspendieren. Verwenden Sie einen P1000 Pipetman zu Erythrozyten vorsichtig resuspendieren durch Auf-und Abpipettieren, wenn nötig.
- Zentrifugieren bei 4 ° C in einer Mikrozentrifuge für 5 min bei 100 xg die Zellen zu pelletieren. * Die Zellen werden begonnen, zu diesem Zeitpunkt quellen haben, und das Zellvolumen sollte nun etwa 750 ul-1000 pl ist.
- Vorsichtig absaugen hypotonischen Puffer und fügen Sie neue hypotonischen Puffer auf ein Endvolumen von 1,5 ml. Die Zellen.
- Inkubieren der resuspendierten gequollenen Zellen auf Eis für 10 min.
5. Lyse Zellen unter Verwendung eines Dounce Homogenisator
- Verwenden Sie hypotonischen Puffer, um die Dounce spülen und dann entspannen sie auf Eis. Wischen Sie den Stößel mit einem trockenen heikle Aufgabe wiper (zB Kimwipe). Entfernen Sie die restlichen Puffer von der Dounce mit einem 1000 ul erweiterten Mikropipettenspitze.
- Übertragen geschwollenen Zellen in die Dounce. Bewegen Sie den engen Pistill der Dounce auf und ab 5 Mal, um die Zellen zu lysieren, wobei darauf zu Blasen zu vermeiden.
- Assay zur Zelllyse unter Verwendung eines 5 ul Aliquot von Zellen aus dem Dounce. Setzen Sie den aliquoten in ein Eppendorf-Röhrchen und ein gleiches Volumen von Trypanblau. Den Teig auf einem Objektträger und untersuchen Sie die Zellen mit einem Lichtmikroskop. Die Kerne der lysierten Zellen erscheinen blau. Etwa 90% Lyse ist ideal.
Tipp-Die Anzahl der die Zellen dounced werden sollen, werden in Abhängigkeit von der Dichtheit des Dounce. Bei der Durchführung dieses Protokoll zum ersten Mal, bestimmen die Anzahl der Male, die von der Durchführung von Schritt 5,3 nach jedem Schlag mit dem Dounce Dounce. Nicht über-Dounce, wird übermäßige Douncing zerstören die Kerne.
- Übertragen der lysierten Zellen zu einem vorher chilled Eppendorf-Röhrchen und Spin in einem 4 ° C Mikrozentrifuge 5 min bei 1500 × g. Das Pellet enthält die Kerne. Vorsichtig den Überstand in ein neues Röhrchen ohne Unterbrechung der Kerne. Der Überstand enthält das Zytoplasma.
Tipp-Das Zytoplasma kann als solches verwendet werden oder weiter zu einem S100 verarbeitet mit dem gleichen High-Speed-Spin für Bulk-Extrakte (siehe 1 zur Herstellung eines aktiven S100 von Schüttgut auszugsweise) verwendet.
6. Salz-Extrahieren Sie die Kerne
- Schätzen Sie die Packed Kernvolumen (PNV), indem Sie die Gradation auf dem Schlauch. Ein PCV von 500 ul der Regel ergibt sich eine PNV von 400 ul.
- In ½ X PNV der Puffer mit niedrigem Salzgehalt zu den Kernen durch Einsetzen eines Mikropipettenspitze dem Boden des Röhrchens und langsam Spritzen die Puffer in die Kerne unter vorsichtigem Mischen. Nicht Pipette auf und ab. Sanft Flick die Rohre, um sicherzustellen, dass das Pellet vollständig im Puffer mit niedrigem Salzgehalt, bevor Sie fortfahren resuspendiert.
- Add ½ X PNV von Puffer mit hohem Salzgehalt und schnell mischen 1 Mal durch Invertieren des Röhrchens. Nicht schütteln. Drehen bei 4 ° C für 30 min.
Tip-Seien Sie sanft mit den Kernen, wenn sie in Puffer mit hoher Salzkonzentration zu vermeiden, sind sie Lyse.
- Drehen bei 4 ° C in einer Mikrozentrifuge für 15 min bei 18.000 × g. Der Überstand ist der hohe Salz Kernextrakt (HS-NE). Drei Platten von Zellen liefern typischerweise 500-600 ul der HS-NE.
7. Konzentrieren Sie sich und Dialysieren des Kernextrakt
- Übertragen Sie 500 ul des HS-NE in gekühlte Mini-centricons (Amicon) und Spin für 50 min bei 4 ° C in einer Mikrozentrifuge bei 14000 x g. Kehren Sie die Mini-Centricon (Amicon) und legen Sie sie in einem neuen Eppendorf-Röhrchen. Spin für 2 min bei 4 ° C 1000 × g, um den HS-NE erholen. Das HS-NE wird auf ca. 115 ul konzentriert werden.
- Mit einem P200 Pipetman, übertragen 45 ul Aliquots der HS-NE in Mini-Dialyse-Slide-a-lysatoren, und legen Sie sie in 500 ml gekühltes Dialysepuffer. Die Unterseite der Slide-A-Lyzer mit dem Boden des Schwimmers ausgerichtet ist. Rühren für 1-2 Stunden bei 4 ° C Die NE erscheint nach der Dialyse bewölkt.
Tipp-nicht zentrifugieren, um die trübe Niederschlag, der nach der Dialyse beobachtet wird, zu entfernen, da dies Zentrifugation reduziert die Aktivität des Extrakts.
- Die NE kann sofort verwendet werden oder aliquotiert. Aliquots sollten in flüssigem Stickstoff eingefroren und bei -80 ° C. Der NE können gespeichert werden und durchlaufen mindestens zwei Gefrier-Auftau-Zyklen ohne Aktivität.
8. Repräsentative Ergebnisse
Vor kurzem wurden effizient in vitro Systeme zur Kopplung RNAP II die Transkription zu Spleißen 5.2 entwickelt. Diese Systeme eingesetzt HeLa-Zellen in der Masse geworden und sind daher nicht geeignet, um schnell Testen der Wirkungen von spezifischen zellulären Behandlungen mit mehreren Proben. Basierend auf diese Notwendigkeit einnd der allgemeine Nutzen eines kleinen Auszug Protokoll (siehe Diskussion), haben wir eine robuste kleine Kernextrakt Methode. Repräsentative Daten einen Vergleich der RNAP II Transkription / Spleißreaktion im kleinen Maßstab Kernextrakt mit dem Bulk-nuklearen Extrakt wird in Abbildung 2 dargestellt. Ein CMV-DNA-Konstrukts, welches den CMV-Promotor enthält und kodiert für ein Standard-Spleißen Substrat (Ftz 3, 2A) für die Analyse verwendet. Wenn dieses Konstrukt in der Masse (Spuren 1-3) oder im kleinen Maßstab (Bahnen 4-6)-Extrakt inkubiert wurde, wurden ähnliche Niveaus der entstehenden prä-mRNA durch die 5 Minuten-Zeitpunkt (2, Spuren 1 und 4 synthetisiert ). Nach Zugabe von α-Amanitin, um weitere Transkription zu blockieren, die Spleißzwischenprodukte und gespleißte Produkte im Laufe der Zeit mit ähnlichen Kinetiken in beiden Arten von Extrakten (2, Spuren 2, 3, 5, 6) akkumuliert. Diese repräsentativen Ergebnisse zeigen, dass die Effizienz des Putsches LED RNAP II Transkription / Spleißen System ähnelt in den Bulk-und kleinräumige Kernextrakten.
Um die Nützlichkeit der kleinen Extrakt Methode zu veranschaulichen, wurden Extrakte aus HeLa-Zellen mit dem Spleißen Inhibitor, E7107 oder der negativen Kontrolle Verbindung pladienolide F 6,7 und dann die gekoppelten Transkription RNAP II / Spleißen Assay wurde durchgeführt behandelt hergestellt. Wie in 3, die Transkription durch RNAP II aufgetreten effizient in Extrakten aus sowohl der Pladienolide F E7107 und behandelten Zellen (10 min Zeitpunkten) ausgearbeitet wurde. Im Gegensatz dazu traten Spleißen in der Regel in dem Extrakt aus den Pladienolide F-behandelten Zellen hergestellt, jedoch wurde in den E7107-behandelten Zellen abgeschafft (Abbildung 3, 20-60 min Zeit Punkte). Diese Daten liefern Proof of Concept für die Nutzung der kleinräumigen Kernextrakten zur speziellen Behandlung der Zellen im kleinen Maßstab.
jpg "/>
Abbildung 1. Schematische Darstellung der Small-scale-Extrakt-Protokoll. Schritt P1. Die Zellen werden als Monolayer gewachsen ist, geerntet von den Platten unter Verwendung einer Zelle Hebevorrichtung und geschwollen durch die Zugabe von hypotonischen Puffer. Schritt P2. Zellen werden lysiert unter Verwendung eines Dounce-Homogenisator und zentrifugiert, um die Kerne Pellet. Schritt P3. Zellkerne werden aus dem Zytoplasma getrennt und Salzgewinnung unterzogen. Schritt P4. Die nukleare Extrakt konzentriert und dialysiert. Schritt P5. Ergebnisse sind, dass zeigen, dass Kernextrakten funktionsfähig sind (siehe Abbildung 2 für näher) erhalten.
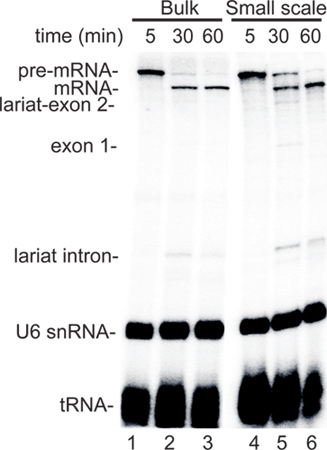
Abbildung 2. Small-scale Kernextrakten sind in einem gekoppelten RNAP II Transkription / Spleißen Assay robust. A. Schematische Darstellung des CMV-DNA-Matrize für Ftz gekoppelten RNAP II Transkription / Spleißen verwendet. Der CMV-Promotor und die Größen der Exons und Introns sind angegeben. B. Vergleich der gekoppelten RNAPII Transkription / Splicing-Assay unter Verwendung von entweder lose Kernextrakt oder kleinräumige Kernextrakt. α-Amanitin zugegeben nach 5 min der Transkription und Spleißen wurde für 30 und 60 min auf. RNA wurde extrahiert und fraktioniert und auf einem 5% igen denaturierenden Polyacrylamidgel detektiert durch Phosphoimager. Die Spleißzwischenprodukte und Produkte angegeben. Die endogene U6 snRNA und tRNA im Extrakt und die 32 während der Inkubation P-markierten angegeben sind. Siehe 3 für ein detailliertes Protokoll über die gekoppelte Transkription RNAP II / Spleißsystem.
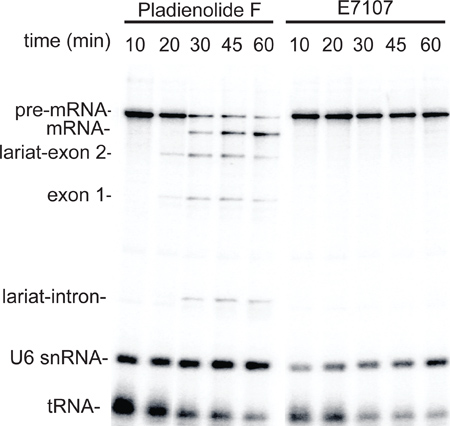
Abbildung 3. Small-scale nuklearen Extrakten aus HeLa-Zellen mit dem Inhibitor Splicing Medikament behandelt E7107 vorbereitet sind defekt beim Spleißen. Zellen mit 3 uM Pladienolide behandelt wurden als F oder E71076 beschrieben, und dann verwendet, um kleine Kernextrakten herzustellen. Ein Zeitverlauf wurde unter Verwendung des gleichen Transkription / Spleißen Assay, wie in 2 durchgeführt. Die Spleißzwischenprodukte und Produkte, und U6 snRNA und tRNA sind angegeben.
Diskussion
Wir haben eine schnelle und reproduzierbare Verfahren zur Herstellung von Kernextrakten von kleinen Mengen von HeLa-Zellen als Monolayer gewachsen eingerichtet. Wir haben gezeigt, dass diese Extrakte robust durch die zeigen, dass die Kinetik und Effizienz der RNAP II Transkription / Spleißen Assays ähnlich in den Klein-und Bulk-Kernextrakten sind. Wir zeigten den Nutzen der Extrakte durch den Nachweis, dass Extrakte aus Zellen mit einem Medikament behandelt Inhibitor Spleißen vorbereitet aktiv sind, für die Transkription aber defekt beim Spleißen.
Unsere Methode zur Herstellung kleinen nukleären Extrakten wurde durch Kombinieren und Optimierung von Methoden zur Herstellung zuvor Extrakte aus HeLa-Zellen in Suspension in großem Maßstab gezüchtet 1,8 und ein Verfahren für die kleine Herstellung von Extrakten 9 wurde hergestellt. Wir haben unsere Protokoll, weil die früheren kleinen Extrakte wurden nicht funktionsfähig für einige Assays, wie der gekoppelte Transkription / splicing Assay. Ein wichtiger Unterschied zwischen dem bisherigen kleinräumigen Protokoll 9 und unser ist, dass wir Bedingungen zur Lyse von Zellen mit Hilfe eines Mini-Dounce optimiert, während die vorherige Protokoll lysiert Zellen, indem sie durch eine kleine 9-Gauge-Nadel. Die Nadel-Lyse führt zu Blasen, die erklären, warum die Extrakte inaktiv waren und / oder schwierig, für einige Tests reproduzieren kann. Außerdem haben wir einen Schritt, um unsere Konzentration Protokoll. Dieser Schritt erhöht die Wirksamkeit der Extrakte, die extrem empfindlich auf Konzentration sind, und beschränkt auch die Variabilität zwischen den Extrakten, die naturgemäss zu kleinräumigen Vorbereitungen ist. Schließlich wird unsere Vorbereitung routinemäßig mit nur drei 150 mm Platten von Monolayer-Zellen durchgeführt, ohne nennenswerte Wirkung auf die Aktivität im Vergleich zum Bulk-Extrakten. Somit ist das Verfahren leicht zugänglich für kleinere Präparate, die teure Reagenzien oder begrenzte Zelle Verfügbarkeit erfordern. Zum Beispiel haben wir SMA hergestelltLL-Skala Auszüge aus RNAi-Knockdown-Zellen und von chronischer lymphatischer Leukämie (CLL) Patienten-Zellen, und verwendet diese Extrakte für die funktionale und / oder biochemischen Assays (EGF, JLH, TY und RR, unveröffentlicht). Wir haben festgestellt, dass die Extrakte sind wertvoll für RNAi gefolgt von spezifischen biochemischen Assays, wie immunopreciptations, Western, und Silberfärbung. Nach der Ermittlung der Wirksamkeit von Zuschlag für ein bestimmtes Protein, kann eine detailliertere Untersuchung durchgeführt, indem eine stabile Knockdown-Zellinie, die als zusätzliche Extrakte bei niedrigeren Kosten herzustellen werden kann durchgeführt werden. Massenspektrometrie von Proteinen, die in Immunpräzipitaten aus diesen Zelllinien erhalten Zuschlag stellt auch eine nützliche Anwendung des Verfahrens sein. Zusätzlich zu der gekoppelten Transkription / Spleißen Assay, dass wir als ein Beispiel für unsere Protokollbeschreibung hier verwendet wird, sollte die kleine Extrakte, die allgemein in zahlreichen funktionellen und biochemischen Assays, wie sie für die verschiedenen Runde verwendeteps in der Genexpression (zB Capping, Spleißen, Transkription, Polyadenylierung, microRNA Verarbeitung). Das Protokoll kann auch für Patienten Zelltypen, die entweder in Suspension erhalten werden können (wie die CLL-Zellen) oder in Kultur gezüchtet werden (z. B. Patienten Fibroblasten) angepasst werden. Schließlich sollte die cytoplasmatische Fraktion während des Verfahrens erhalten, die nützlich für sowohl funktionell als auch biochemische Assays, die in das Zytoplasma erfordern.
Offenlegungen
Produktion und freien Zugang zu diesem Artikel wird von Abcam, Plc gesponsert.
Danksagungen
Wir danken M. Winkelbauer-Hurt, E. Ibrahim, S. Valencia, K. Dufu, H. Cheng für hilfreiche Diskussionen. HeLa-Zellen wurden vom National Zellkultur Center (Minneapolis, MN) erhalten. Wir danken auch Eisai Co., Ltd für die Bereitstellung von E7107 und das Nikon Imaging Center an der Harvard Medical School für die Hilfe bei der Lichtmikroskopie. Diese Arbeit wurde durch ein NIH GM043375 zu RR und EGF und NRSA Gemeinschaft unterstützt werden, um JLH.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Vollständiger Name des Reagenz | Firma | Katalog-Nummer |
| HEPES | 4 - (2-Hydroxyethyl) piperazin-1-ethansulfonsäure | Sigma | H3375-500G |
| MgCl 2 · 6 H 2 O | Magnesiumchlorid Hexahydrat | Sigma | M2670-500G |
| KCl | Kaliumchlorid | Fischer | P335-212 |
| PMSF | Phenylmethansulfonylfluorid | Sigma | P7626-100G |
| DTT | Dithiothreitol | Amerikanischen Bioanalytische | AB00490-5G |
| EDTA | Ethylendiamintetraacetat, Dinatriumsalz, Dihydrat | Amerikanischen Bioanalytische | AB00500-01000 |
| Glycerin | MP Biomedicals | 800689 | |
| DMEM | Dulbecco Minimal Essential Medium | Invitrogen | 11995-073 |
| FBS | Fötalem Rinderserum | Gibco | 16140 |
| Penicillin / Streptomycin | Gibco | 15070 | |
| PBS | Phosphate Buffered Saline | Cellgro | 21 bis 040-CV |
| Trypanblau Stain 0,4% | Gibco | 15250 | |
| Zell-Lifter | Corning | 29442-200 | |
| 150mm Plates | VWR | 353025 | |
| Erweiterte Mikropipettenspitze | Denville | P1126 | |
| Dounce Homogenisator, 1ml, mit engen Pistill | Wheaton | 357538 | |
| Slidealyzers, MWCO 10 kDa | ThermoScientific | 69572 | |
| Mini-Centricons, MWCO 3kDa | Millipore (Amicon) | UFC500396 |
Tabelle 1. Spezifischen Reagenzien und Ausrüstung.
| Lösung | Finale | Lager | Dispense |
| Hypotone | 10 mM HEPES, pH 7,9 | 1M HEPES, pH 7,9 | 5 ml |
| 1,5 mM MgCl 2 | 1 M MgCl 2 | 750 ul | |
| 10 mM KCl | 3M KCl | 1,67 ml | |
| 0,2 mM PMSF | 200 mM PMSF | 500 ul | |
| 0,5 mM DTT | 2M DTT | 125 ul | |
| Bringt bis zu 500 ml mit Wasser | |||
| Wenig Salz | 20 mM HEPES, pH 7,9 | 1M HEPES, pH 7,9 | 2 ml |
| 1,5 mM MgCl 2 | 1 M MgCl 2 | 150 ul | |
| 20 mM KCl | 3M KCl | 667 ul | |
| & Nbsp; | 0,2 mM EDTA | 0,5 M EDTA | 40 ul |
| 25% Glycerin | Glycerin | 25 ml | |
| 0,2 mM PMSF | 200 mM PMSF | 100 ul | |
| 0,5 mM DTT | 2M DTT | 25 ul | |
| Bringt bis zu 100 ml mit Wasser | |||
| Hohem Salzgehalt | 20 mM HEPES, pH 7,9 | 1M HEPES, pH 7,9 | 2 ml |
| 1,5 mM MgCl 2 | 1 M MgCl 2 | 150 ul | |
| 1,4 M KCl | 3M KCl | 48 ml | |
| 0,2 mM EDTA | 0,5 M EDTA | 40 ul | |
| 25% Glycerin | Glycerin | 25 ml | |
| 0,2 mM PMSF | 200 mM PMSF | 100 ul | |
| 0,5 mM DTT | 2M DTT | 25 ul | |
| Bringt bis zu 100 ml mit Wasser | |||
| Dialyse | 20 mM HEPES, pH 7,9 | 1M HEPES, pH 7,9 | 10 ml |
| 100 mM KCl | 3M KCl | 16,625 ml | |
| 0,2 mM EDTA | 0,5 M EDTA | 200 pl | |
| 20% Glycerin | Glycerin | 100 ml | |
| 0,2 mM PMSF | 200 mM PMSF | 500 ul | |
| 0,5 mM DTT | 2M DTT | 125 ul | |
| Bringt bis zu 500 ml mit Wasser |
Tabelle 2. Lösungen für die Kern-Präparat.
Referenzen
- Krainer, A. R., Maniatis, T., Ruskin, B., Green, M. R. Normal and mutant human beta-globin pre-mRNAs are faithfully and efficiently spliced in vitro. Cell. 36, 993-1005 (1984).
- Ghosh, S., Garcia-Blanco, M. A. Coupled in vitro synthesis and splicing of RNA polymerase II transcripts. Rna. 6, 1325-1334 (2000).
- Das, R. Functional coupling of RNAP II transcription to spliceosome assembly. Genes Dev. 20, 1100-1109 (2006).
- Hicks, M. J., Yang, C. R., Kotlajich, M. V., Hertel, K. J. Linking splicing to Pol II transcription stabilizes pre-mRNAs and influences splicing patterns. PLoS Biol. 4, e147 (2006).
- Yu, Y., Das, R., Folco, E. G., Reed, R. A model in vitro system for co-transcriptional splicing. Nucleic Acids Res. 38, 7570-7578 (2010).
- Kotake, Y. Splicing factor SF3b as a target of the antitumor natural product pladienolide. Nat. Chem Biol. 3, 570-575 (2007).
- Folco, E. G., Coil, K. E., Reed, R. The anti-tumor drug E7107 reveals an essential role for SF3b in remodeling U2 snRNP to expose the branch point-binding region. Genes. 25, 440-444 (2011).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res. 11, 1475-1489 (1983).
- Lee, K. A., Bindereif, A., Green, M. R. A small-scale procedure for preparation of nuclear extracts that support efficient transcription and pre-mRNA splicing. Gene Anal. Tech. 5, 22-31 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten