Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Genetic Study of Axonregeneration mit kultivierten adulten Spinalganglienneuronen
In diesem Artikel
Zusammenfassung
Ein In-vitro- Modell für genetische Untersuchung von Axonregeneration mit kultivierten adulten Maus Spinalganglienneuronen beschrieben wird. Das Verfahren umfasst einen Schritt zur re-suspension/re-plating Axon Nachwachsen von Neuronen unterzogen genetische Manipulation zu ermöglichen. Dieser Ansatz ist besonders nützlich für die Loss-of-Funktions-Studien von Axonregeneration unter Verwendung von RNAi-basierten Protein Knockdown.
Zusammenfassung
Es ist bekannt, dass ausgereifte Nervenzellen im zentralen Nervensystem (ZNS) kann sich nicht regenerieren ihre Axone nach Verletzungen durch verminderte intrinsische Fähigkeit, das Wachstum der Axone und eine feindliche Umgebung in der reifen ZNS 1,2 zu unterstützen. Im Gegensatz dazu reifen Neuronen im peripheren Nervensystem (PNS) leicht nach Verletzungen regenerieren 3. Adult Spinalganglien (DRG) Neurone sind bekanntlich robust regenerieren nach peripheren Nervenverletzungen. Jede DRG Neuron wächst ein Axon aus der Zelle soma, die verzweigt sich in zwei Äste axonalen: ein peripheres Filiale innervieren peripheren Ziele und einen zentralen Zweig, der sich in das Rückenmark. Verletzung der DRG peripheren Axone führt zu erheblichen Axonregeneration, während zentraler Axone im Rückenmark schlecht regenerieren nach der Verletzung. Allerdings, wenn die periphere axonale Schädigung tritt vor der Verletzung des Rückenmarks (ein Prozess namens der Konditionierung Läsion), die Regeneration des zentralen Axone ist greatly verbesserte 4. Darüber hinaus teilen die zentralen Axone von DRG-Neuronen der gleichen feindlichen Umgebung wie absteigend corticospinaler Axone im Rückenmark. Gemeinsam wird die Hypothese aufgestellt, dass die molekularen Mechanismen, die Axonregeneration von erwachsenen DRG-Neuronen genutzt werden, um ZNS Axonregeneration zu verbessern. Als Ergebnis findet man adulte DRG-Neuronen heute weithin als Modellsystem zur Untersuchung der regenerativen Axonwachstum 7.5 verwendet.
Hier beschreiben wir ein Verfahren zur adulten DRG Neuronenkultur, die für genetische Studien Axonregeneration in vitro verwendet werden können. In diesem Modell erwachsenen DRG-Neuronen sind genetisch mittels Elektroporation vermittelte Gentransfektion 6,8 manipuliert. Durch Transfektion von Neuronen mit DNA-Plasmid oder si / shRNA, ermöglicht dieser Ansatz sowohl Gewinn-und Verlust-of-function Experimente über die Rolle von jedem Gen-of-Interest in Axonwachstum aus adulten DRG-Neuronen zu untersuchen. Wenn Neuronen mit Si / shRNA transfiziert werden, ist die gezielte endogenes Proteinin der Regel nach 3-4 Tagen in der Kultur, während welcher Zeit robuste Wachstum der Axone bereits aufgetreten ist aufgebraucht, so dass die Loss-of-Funktions-Studien weniger wirksam. Um dieses Problem zu lösen, umfasst das hier beschriebene Verfahren eine Resuspension und Re-Plattierungsschritt nach der Transfektion, die Axone von Neuronen in der Abwesenheit des Zielproteins wieder wachsen können. Schließlich bieten wir ein Beispiel für die Verwendung dieser in-vitro-Modell, um die Rolle eines Axonregeneration-assoziierten Gens c-Jun, bei der Vermittlung Axonwachstum aus adulten DRG-Neuronen 9 zu studieren.
Protokoll
1. Vorbereitung der Deckgläser, Kulturmedium und Verdauungsenzyme
- Die 12-mm rund Nr. 1 Deckgläser werden für die neuronale Kultur verwendet. Die Deckgläser werden gereinigt mit 10% HCl über Nacht, gefolgt von Ultraschall-Waschung mit destilliertem und entionisiertem Wasser für 3-mal (20 min / Zeit). Die gereinigten Deckgläser in 70% Ethanol für den späteren Gebrauch gespeichert. Vor jedem Experimente sind die Deckgläser Luft getrocknet und in das Kulturmedium Platte gelegt.
- Zur Beschichtung der getrockneten Deckgläser wurden 100 ul Beschichtungslösung, enthaltend 100 ug / ml Poly-D-Lysin und 10 pg / ml Laminin funktionierende Lösung wird auf jede Deckglas zugegeben und die Kultur Platte wird in eine 37 ° C Inkubator überführt. Nach 1-2 h wurde die Beschichtungslösung entfernt und die Deckgläser werden 3 mal mit sterilem 1X PBS gewaschen.
- Um das Kulturmedium, das Minimum Essential Medium (MEM) herzustellen wird mit 5% fötalem Rinderserum (FBS), 1 × Penicillin-Streptomycin-Lösung (500 Einheiten Penicillin ergänztlin und 500 ug Streptomycin), 1X Glutamax I-Ergänzung, und die Reagenzien, die antimitotische 20 uM 5-Fluor-2-desoxyuridin und 20 uM Uridin (FDU / R). Für die serumfreiem Medium wird die FBS mit dem Zusatz B27.
- Die Collagenase Eine Lösung wird durch Auflösen von Collagenase Ein Pulver mit MEM, um eine Arbeitskonzentration von 1 mg / ml zu hergestellt. Für die Trypsin wird das 1X TrypLE Express verwendet.
2. Dissection und Ernte der erwachsenen Maus DRG-Neuronen
- Nach Tötung der 6 - bis 10-Wochen alt erwachsenen Maus, entfernen Sie die Rückenhaut und schneiden Sie die gesamte Wirbelsäule. Waschen Sie die Wirbelsäule entfernt mit 1 X PBS 2-3 mal.
- Stecken Sie die Wirbelsäule entfernt zum Sezieren Platte mit ventralen Seite nach oben und sorgfältig entfernt Muskeln, um die sensorischen Nerven unter einem Binokular aussetzen. Die Nerven an DRGs an der Holz-Ebene sind die dicksten und leicht zu finden. Daher ist für die meisten Experimente nur der LendenwirbelsäuleDRGs werden geerntet.
- Schneiden Sie durch die einzelnen Wirbel entlang der Mittellinie mit einer kleinen Schere vorsichtig entfernen und die Bandscheiben. Mit einer Pinzette, jeden Wirbel Aufgeteilt ist das Rückenmark freizulegen.
- Zu sezieren Sie die DRGs Schnittholz, Bauholz hebe jeden Nerv mit einer Pinzette und Verfolgung in Richtung Rückenmark, um die zugehörigen Lendenwirbel DRGs (aus L1 bis L6) zu lokalisieren.
- Schneiden Sie jedes DRG aus angeschlossenen peripheren Nerven, dorsalen und ventralen Wurzeln mit Feder Schere, und speichern sie in Mikrozentrifugenröhrchen mit MEM-Medium auf Eis gestellt. Mehr DRGs an verschiedenen spinalen Ebenen (z. B. Brust-DRGs) kann in ähnlicher Weise, wenn notwendig, präpariert werden.
3. Verdauung und Dissoziation von erwachsenen Maus DRG-Neuronen
- Nach dem Sammeln aller DRGs seziert, ersetzen Sie die MEM-Medium mit 1 ml Collagenase Eine Lösung und Inkubation des Mikrozentrifugenröhrchen bei 37 ° C für 90 min.
- Ersetzen Kollagenase eine Lösung mit 500 ul 1X TrypLE Express sosung und bei 37 ° C für 15-20 min.
- Entfernen Sie die TrypLE Express-Lösung und waschen die DRGs mit 1 ml vorbereitete Kulturmedium (mit 5% FBS) für die 3-fache.
- Fügen Sie 600 ul Kulturmedium und sanft und Abpipettieren, um die Gewebe für 20-30 mal mit einer 1 ml blau verreiben, absolvierte Pipettenspitze.
- Nach Verreiben, damit die nicht-dissoziierten Gewebe zu beruhigen, um dem Boden des Mikrofuge und übertragen Sie die Zellsuspension auf eine 10 ml sterilen Röhrchen. Fügen Sie eine weitere 600 ul Kulturmedium und wiederholen Sie den Vorgang, bis Verreibung den meisten Geweben dissoziiert sind. Die erhaltene Zellsuspension enthält sowohl Neuronen und nicht-neuronalen Zellen. In den meisten Fällen werden die Zellen von 6 DRGs (~ 5 × 10 4) für eine Elektroporation Reaktion verwendet.
4. Genetische Manipulation von Neuronen mittels Elektroporation
- Bereiten Sie die Transfektion durch Mischen der Lösung für Amaxa Nukleofektion Mausneuronen mit DNA-Plasmide (~ 10 ug) Oder siRNA Oligos (~ 0,2 nmol), um ein Endvolumen von 100 ul für jede Transfektion.
- Zentrifugation der dissoziierten Zellen bei 680 UpM für 7 min bei Raumtemperatur, und entsorgen Überstand so weit wie möglich. Fügen Sie den vorbereiteten Transfektionslösung und sanft und Abpipettieren 3-4 mal mit 200 ul Pipettenspitzen zu resuspendieren die Zellen.
- Übertragen der Zellsuspension mit der Transfektion Lösung des Elektroporationsküvette gemischt und Elektroporation der Zellen mit dem Amaxa Nucleofector System-Programm G-013.
- Nach der Elektroporation sogleich hinzufügen, 500 ul vorgewärmtes (37 ° C) Kulturmedium, das FBS in die Küvette und übertragen die gesamte Lösung (~ 600 ul) in die beschichtete Platte bei Kultur gewünschten Zelldichten. Für das Experiment, die Resuspension und Re-Plattieren erfordert, sind Neuronen direkt auf der Kunststoff-Kulturschale mit hoher Dichte (10.000 bis 20.000 Zellen / Vertiefung) kultiviert. Für Experiment, das direkt untersucht Axonwachstum, sind Neurone vernickelt onto beschichteten Deckgläsern bei niedrigerer Dichte (3000-5000 Zellen / Well). Legen Sie die Kultur Platte in den Brutschrank (37 ° C, 5% CO 2).
- Vier Stunden nach dem Ausstreichen, wenn Neuronen zu den Substraten angebracht haben, ersetzen Sie die sanft Kulturmedium (enthält die Amaxa Nukleofektion Lösung) mit 500 ul frisch und vorgewärmtes Kulturmedium, und die Platte zurück in den Inkubator für zusätzliche Kultur (37 ° C , 5% CO 2). Sowohl Kulturmedium, das FBS oder das Serum-freiem Medium kann in diesem Schritt verwendet werden.
5. Die Züchtung Adult DRG-Neuronen für Axonwachstum Analyse
- Für Neuronen mit DNA transfiziert, kann die Expression von Gen-von-Interesse (zB EGFP) bereits einige Stunden nach der Elektroporation beobachtet werden. Für Neuronen mit siRNAs transfiziert wir in der Regel 3-4 Tage warten, um eine ausreichende Depletion der endogenen Proteinen erlauben. Die kultivierten Neuronen kann entweder direkt zur Axonwachstum Analyse werden bei vario fixiertuns Zeitpunkten (1-4 Tage nach der Elektroporation) oder resuspendiert und erneut ausplattiert, um Axon Nachwachsen (siehe unten) zu analysieren.
- Für RNAi-vermittelten loss-of-function-Studien können die kultivierten Neuronen resuspendiert werden und neu beschichtet, damit Axone von Neuronen, in denen die gezielte Proteine bereits erschöpft sind wieder nachwachsen. Dazu ersetzen Sie die alte Kulturmedium der High-Density-kultivierten Neuronen mit 1 ml vorgewärmtes frisches Medium und Pipette vorsichtig nach oben und unten für 6-10 mal wieder zu suspendieren die angeschlossenen Neuronen aus der Kulturschale. Da nicht-neuronalen Zellen (zB Schwann-Zellen) zu befestigen viel enger an der Kulturschale als Neuronen, sind die resuspendierten Zellen meist Neuronen.
- Übertragen Sie die resuspendiert Neuronen in ein Mikrozentrifugenröhrchen und sanft verreiben 10-15 mal neu zu distanzieren, die Zellklumpen in die einzelne Zelle Suspension.
- Re-Platte die Re-dissoziierter Neuronen auf neu hergestellt Deckgläser mit geringer Dichte (3000-5000 Zellen / Well) und Kultur über Nacht (16-24 h).
6. Fixierung, Immunfärbung und Fluoreszenz-Imaging
- Saugen Sie das Medium, und fügen Sie 4% Paraformaldehyd (PFA) (200 ul / Vertiefung), um die Zellen für 15-20 min bei Raumtemperatur zu beheben. Die fixierten Zellen werden dann mit 1 × PBS für 3-mal gewaschen.
- Absaugen des PBS versetzen und Blocking-Lösung (1% Rinderserumalbumin, 0,1% Triton X-100 und 2,0% normalem Ziegenserum in PBS 1X) an die festen Neuronen für 60 min bei Raumtemperatur.
- Um Etikett Axone, sind die Neuronen Immuno-gefärbt mit anti-Neurofilamente oder Anti-Tubulin-Antikörper βIII. Dazu legen Sie eine 30μl Tropfen primärer Antikörper-Lösung (1:1200 Verdünnung für die βIII-Tubulin-Antikörper) auf einem Parafilm für jedes Deckglas. Kehren Sie die Deckgläser und legt sie auf den primären Antikörper-Lösung für 60 min bei Raumtemperatur.
- Zurück Deckgläser auf die ursprüngliche Kultur und Teller waschen Sie sie mit 1X PBS für 3 mal.
- Wiederholen Sie diesen Vorgang für die Sekundarstufe einskörper-.
- Waschen Sie die Deckgläser mit destilliertem Wasser für 3-mal, und dann montieren Deckgläser auf Glasplättchen mit dem Montage-Lösung (zB Gold-ProLong Antifade).
- Die gefärbten Neuronen mit einem Fluoreszenz-Mikroskopie mit einer Digitalkamera abgebildet werden. Die Axon-Längen werden gemessen und analysiert mit bildgebenden Analyse-Software.
7. Repräsentative Ergebnisse
In der Abwesenheit jeglicher extrazelluläre Wachstumsfaktoren, die erwachsenen DRG-Neuronen in der Regel beginnen zu wachsen Axone 48 h nach der ersten Beschichtung. Die Axone zeigen oft verzweigten Morphologie (Abbildung 1). Im Gegensatz dazu beginnen die erneut ausplattiert Neuronen zu verlängern Axone nur wenige Stunden nach dem Ausstreichen und die Axone zu einem stark verringerten Verzweigung (2) länglich ist. Diese Ergebnisse legen nahe, dass neu vergoldet Neuronen ähnliche Eigenschaften teilen, zu denen der Konditionierung verletzten Neuronen. Mit diesem Ansatz haben wir vor kurzem durchgeführt Verlust-of-function-Studien, die Rolle der Axonregeneration assoziierten Transkriptionsfaktor c-Jun in Axonwachstum aus adulten DRG-Neuronen in vitro zu untersuchen. Die Ergebnisse zeigten, dass die Elektroporation einer Gruppe von 4 verschiedenen siRNAs verschiedenen Regionen von c-Jun (ON-TARGETplus) deutlich verringert die Proteinexpression von c-Jun in adulten DRG Neuronen 3 Tage nach der Transfektion (3) 9. Wenn die Neuronen wieder ausplattiert und über Nacht waren, Axonwachstum von c-Jun-Knockdown Neuronen wurde signifikant reduziert (Kontrolle: 348,37 ± 16.21mm; Si-C-Jun: 262,32 ± 15,69 um, Abbildung 3) 9. Diese Ergebnisse zeigen, dass die kultivierten adulten DRG-Neuronen ein nützliches Modellsystem, um das Wachstum der Axone aus adulten Nervenzellen zu studieren.

1. Adulten Maus DRG-Neuronen mit geringer Dichte für 3 Tage kultiviert. Die Neuronen wurden mit anti gefärbt - & beta; III Tubulin-Antikörper. Beachten Sie, dass die meisten Axone verzweigte Strukturen aufweisen. Maßstabsbalken: 125 um.
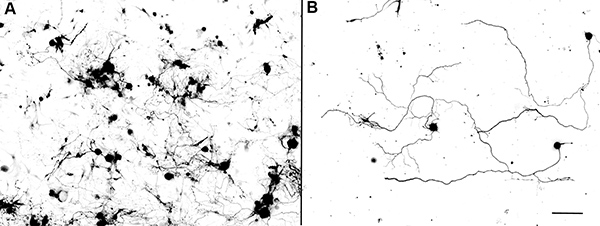
Abbildung 2. Re-Plating erwachsenen Maus DRG-Neuronen nach 3 Tagen in der Kultur. (A) Erwachsene DRG-Neuronen mit hoher Dichte für 3 Tage kultiviert. (B) Re-plated erwachsenen DRG-Neuronen wurden bei niedriger Dichte für über Nacht kultiviert. Beachten Sie, dass die meisten Axone zeigen längliche Morphologien mit wenig Axon Verzweigung. Maßstabsbalken: 250 &mgr; m in einem und 125 um in B.
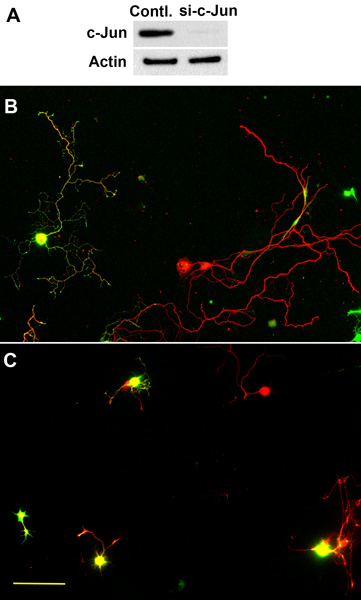
Abbildung 3. Rolle von c-Jun in Axonwachstum aus adulten DRG-Neuronen in vitro. (A) Western Blot Analyse von c-Jun in adulten Maus DRG-Neuronen nach der Elektroporation von c-Jun siRNAs. Das Ergebnis zeigt deutlich verringertem Gehalt an c-Jun. (B) Kontrolle Neuronen mit EGFP transfiziert wuchs lange Axone nach einer erneuten Beschichtung und-Nacht-Kultur. (C) Co-trans-fektion von c-Jun siRNAs und EGFP eingeschränkter Axonwachstum aus adulten DRG-Neuronen nach der erneuten Plattierung und-Nacht-Kultur. Rot: TuJ-1-Färbung, grün: EGFP. Maßstabsbalken: 125 um. Diese Ergebnisse wurden in Saijilafu et al veröffentlicht worden. 9.
Diskussion
Adult DRG-Neuronen ihre Axone regenerieren robust nach peripheren Nervenverletzungen in vivo und in vitro, wodurch ein nützliches System zu Axonregeneration bei erwachsenen Tieren zu studieren. In-vitro-Kultur von adulten DRG-Neuronen wird immer eine weit verbreitete Methode, um die molekularen Mechanismen zu untersuchen, mit denen Axonregeneration geregelt wird. Die In-vitro-Verfahren zur Kultivierung von adulten Maus DRG-Neuronen hier vorgestellten ermöglicht eine schnelle und eff...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde durch Stipendien an FZ vom NIH (R01NS064288) und der Craig H. Neilsen Stiftung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| MEM | Invitrogen | 11090-081 | |
| Poly-D-lysin-hydrobromid | Sigma-Aldrich | P6407 | |
| Laminin | Invitrogen | 23017-015 | |
| 5-Fluor-2-desoxyuridin | Sigma-Aldrich | F0503 | |
| Uridin | Sigma-Aldrich | U3003 | |
| Collagenase A | Roche | 10103578001 | |
| TrypLE Express | Invitrogen | 12604-013 | |
| Fötales Rinderserum | Invitrogen | 10270-098 | |
| Penicillin-Streptomycin (100X) | Invitrogen | 15140-122 | |
| Glutamax-I (100X) | Invitrogen | 35050-038 | |
| Deckgläser (# 1) | Electron Microscopy Sciences | 72196-12 | |
| 24-Well-Zellkulturplatte | Becton Dickinson | 35-3047 | |
| 1X PBS | Mediatech | 21 bis 040-CV | |
| Sterilem, destilliertem und entionisiertem Wasser | Mediatech | 25 bis 055-CV | |
| Nucleofector und Elektroporation Kits für Mäuseneuronen | Lonza | VPG-1001 | |
| ON-TARGETplus siRNA gegen c-Jun | Dharmacon | L-043.776 | |
| Anti - βIII Tubulin-Antikörper (TuJ-1) | Covance | MMS-435P | |
| ProLong Gold-Antifade Montagelösung | Invitrogen | P36930 |
Referenzen
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7, 617-627 (2006).
- Liu, K., Tedeschi, A., Park, K. K., He, Z. Neuronal Intrinsic Mechanisms of Axon Regeneration. Annu. Rev. Neurosci. , (2010).
- Zhou, F. Q., Snider, W. D. Intracellular control of developmental and regenerative axon growth. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361, 1575-1592 (2006).
- Neumann, S., Woolf, C. J. Regeneration of dorsal column fibers into and beyond the lesion site following adult spinal cord injury. Neuron. 23, 83-91 (1999).
- Liu, R. Y., Snider, W. D. Different signaling pathways mediate regenerative versus developmental sensory axon growth. J. Neurosci. 21, RC164 (2001).
- Zhou, F. Q. Neurotrophins support regenerative axon assembly over CSPGs by an ECM-integrin-independent mechanism. J. Cell Sci. 119, 2787-2796 (2006).
- Zou, H., Ho, C., Wong, K., Tessier-Lavigne, M. Axotomy-induced Smad1 activation promotes axonal growth in adult sensory neurons. J. Neurosci. 29, 7116-7123 (2009).
- Zhou, F. Q., Zhou, J., Dedhar, S., Wu, Y. H., Snider, W. D. NGF-induced axon growth is mediated by localized inactivation of GSK-3beta and functions of the microtubule plus end binding protein APC. Neuron. 42, 897-912 (2004).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat. Commun. 2, 543-54 (2011).
- Costigan, M. Replicate high-density rat genome oligonucleotide microarrays reveal hundreds of regulated genes in the dorsal root ganglion after peripheral nerve injury. BMC Neurosci. 3, 16 (2002).
- Xiao, H. S. Identification of gene expression profile of dorsal root ganglion in the rat peripheral axotomy model of neuropathic pain. Proc. Natl. Acad. Sci. U.S.A. 99, 8360-8365 (2002).
- Michaelevski, I. Signaling to transcription networks in the neuronal retrograde injury response. Sci. Signal. 3, ra53 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten