Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufzählung der wichtigsten peripheren Blut Leukozyten Populationen für Multicenter Clinical Trials mit einem Vollblut Phenotyping Assay
In diesem Artikel
Zusammenfassung
In diesem Bericht zeigen wir, die Färbung und Analyse Schritte eines Phänotypisierung Assay auf frischem Vollblut durchgeführt, um wichtige angeborenen und adaptiven Leukozytenpopulationen aufzuzählen. Wir betonen, Überlegungen für die Durchführung dieser Verfahren im Rahmen einer multizentrischen klinischen Studie.
Zusammenfassung
Kryokonservierung von Leukozyten des peripheren Blutes wird häufig verwendet, um Zellen für die Immunantwort Auswertungen in klinischen Studien erhalten und bietet viele Vorteile für eine einfache und Standardisierung von immunologischen Einschätzungen, aber nachteilige Auswirkungen dieses Prozesses haben auf einigen Zellpopulationen, wie Granulozyten, B-Zellen beobachtet und dendritischen Zellen 1-3. Untersuchung frischen Leukozyten gibt ein genaueres Bild der in vivo Zustand der Zellen, sondern ist oft schwierig, im Rahmen der großen klinischen Studien durchzuführen. Frische Zell-Assays sind abhängig von freiwilligen Verpflichtungen und Fristen und wenn zeitaufwendig, ihre Anwendung kann unpraktisch aufgrund der Arbeitszeiten von Laborpersonal erforderlich. Zusätzlich, wenn Prüfungen in mehreren Zentren durchgeführt, können Labors die Mittel und Ausbildung erforderlich, die Assays durchzuführen, die nicht in ausreichender Nähe zu klinischen Standorten befinden. Um diese Probleme anzugehen, haben wir develwickelt einen 11-farbe Antikörperfärbung Panel, das mit TruCOUNT Röhrchen (Becton Dickinson, San Jose, CA) verwendet werden, um Phänotyp und Auflisten der großen Leukozytenpopulationen im peripheren Blut, wodurch stabilere zelltypspezifisch Informationen als Assays, wie ein komplettes Blutbild (CBC) oder Assays mit kommerziell erhältlichen Platten für TruCOUNT Rohre, die nur für ein paar Zelltypen Flecken entwickelt. Die Färbung ist einfach, erfordert nur 100 ml frisches Vollblut, und dauert etwa 45 Minuten, so dass es möglich ist für Standard-Blut-Verarbeitung Labors durchzuführen. Es ist aus dem BD TruCOUNT Rohr technisches Datenblatt (angepasst Version 8/2010 ). Die Färbung Antikörper-Cocktail können im Voraus in der Masse an einem zentralen Assay Labor hergestellt und versendet die Verarbeitung vor Ort Labors. Stained Rohren befestigt werden kannund eingefroren für den Versand an die zentrale Assay Labor für multicolor Durchflusszytometrie. Die Daten aus dieser Färbung Panel generiert werden verwendet, um Veränderungen in Leukozytenkonzentrationen im Laufe der Zeit in Bezug auf Intervention verfolgen und könnte leicht weiter entwickelt werden, um die Aktivierung Staaten von spezifischen Zelltypen des Interesses zu beurteilen. In diesem Bericht zeigen wir, das Verfahren durch den Blut-Verarbeitung Laboranten zur Färbung von frischem Vollblut und die Schritte, um diese gefärbten Proben an einem zentralen Test-Labor Unterstützung einer multizentrischen klinischen Studie zu analysieren durchzuführen. Die Video-Informationen das Verfahren, wie es im Rahmen einer klinischen Studie Blutentnahme in der HIV Vaccine Trials Network (HVTN) durchgeführt wird.
Protokoll
Hinweis: Um die Fluorophor-konjugierten Antikörpern vor Licht zu schützen, führen Sie alle Schritte in einer Bio-Sicherheits-Schrank mit dem Licht aus.
Ein. Antikörperfärbung Systemsteuerung Vorbereitung
- Die Antikörper-Färbung Panel kann in Tabelle 1 zu finden. Antikörperkonzentration sollte durch Titration mit Vollblut definiert werden und unter Verwendung des gleichen Durchflusszytometrie Ausrüstungen und Verfahren, die verwendet werden, um die Proben zu erwerben Phänotypisierung gebeizt wird.
- Sobald geeignete Färbung Titer bestimmt werden, kombinieren alle Antikörper in einen einzigen Mischung in einem Lock-Kapselrohr. Hinzufügen Strömung Waschpuffer (Dulbeccos PBS mit 2% hitzeinaktiviertes fötales Rinderserum), um das Gesamtvolumen auf 100 ul zu bringen. Skalieren der Mischung für die Anzahl von Abtastwerten ist angefärbt. Dieses Gemisch kann bei 4 ° C für bis zu acht Wochen gelagert werden.
2. Färbung
- Wenn das Blut gesammelt wird, ist für andere Zwecke in ad verwendet werdendition diesem Assay, setzen Sie ein Aliquot beiseite, während mehr Zeit-und Kleinschreibung auf die verbleibende Blut durchgeführt werden. Das Aliquot kann bei Raumtemperatur bis zu 4 Stunden nach der Blutabnahme ohne nennenswerte Zellverlust gespeichert.
- Überprüfen, dass es ein intaktes Wulst Pellet am Boden des Rohrs und TruCOUNT Etikett das Rohr zu identifizieren wobei die Probe gefärbt. In HVTN klinischer Studien, deren Laboratory Data Management System (Frontier Science and Technology Research Foundation; Amherst, NY) wird verwendet, um zu kennzeichnen und zu verfolgen gefärbten Proben.
- Notieren Sie die Chargennummern und Verfallsdaten aller Reagenzien. Notieren Sie sich die TruCOUNT tube bead Zählnummer durch den Hersteller auf der Tasche der Rohre vorgesehen, stellen Sie sicher, dass die Chargennummer auf dem Beutel die Lotnummer auf dem Schlauch.
- Verwenden Reverse Pipettieren genau Je 100 ul Vollblut in die TruCOUNT Rohr, knapp oberhalb der Metall-Halterung. Vermeiden Verschmieren Blut an der Seite des Rohres.
- Verwenden von regulären (vorwärts) Pipettiertechnik, Pipette 100 ul des gemischten Antikörperfärbung Panel (siehe Tabelle 1) in die TruCOUNT Röhre. Das Röhrchen und vortexen bei niedriger Drehzahl für ca. 15 Sek. mischen. Sichtprüfen Rohr zu gewährleisten, dass der Wulst Pellet vollständig gelöst ist.
- Inkubieren TruCOUNT Röhrchen für 15 Minuten bei Raumtemperatur (15-30 ° C) im Dunkeln.
- Wenn nötig, Einen aliquoten von 10 × FACS Lyse Lösung 1X mit diH 2 O. Zusatz von 900 ul 1 × FACS Lysing Lösung des Rohres.
- Das Röhrchen verschließen und gründlich vortexen bei niedriger Drehzahl für ca. 15 Sek. mischen. Schieben Sie den Deckel fest in Sperrstellung auf dem Rohr und Dichtung mit Labor-Film.
- Bewahren Sie das Rohr bei -65 ° C bis -95 ° C, bis die Probe für den Versand an die zentrale Analyse Labor oder für die Analyse im Haus bereit. Proben sind in dieser Phase stabil für mindestens vier Wochen. Wenn Versand oder zur quantitativen Bestimmung sofortdiately, kann dieser Schritt weggelassen werden.
3. Versand
Hinweis: Die folgenden Anweisungen verwenden einen isolierten Versandsystem von Saf-T-Pak, Inc. speziell für Transportzwecke Kategorie B ausgenommen biologische Stoffe nach International Air and Transport Association (IATA) entworfen. Bei der Analyse der Proben in der gleichen Position wie die Färbung auftrat, Abschnitt 4 gehen.
- Proben können sofort nach dem Färben oder versendet werden, sobald sie bei -65 ° C eingefroren bis -95 ° C. Wickeln Sie jedes Rohr komplett in Folie und in die gefärbte Probe Box. Legen Sie die gefärbte Probe Box innerhalb einer dichten Poly-Beutel mit einem saugfähigen Material.
- Legen Sie die Dichtheit Poly-Beutel und Inhalt in einen Tyvek Beutel und Dichtung mit so wenig Luft wie möglich in der Tasche.
- Legen Sie die Probe-Paket (Probe innerhalb sekundäre Verpackung) innerhalb des inneren braunen Kasten.
- Setzen Sie den inneren braun box im Styropor Brust, Befestigung in die Vertiefung der Verschiebung zu verhindern.
- Füllen Sie das Styropor Brust mit Trockeneis (ca. 8 kg) und legen Sie den Deckel fest auf der Brust.
- Sicher Band der Versandkarton und Schiff als biologische Substanz, Kategorie B (UN3373) mit der richtigen Trockeneis (UN 1845) Markierungen, folgen IATA PI-650 Anweisungen.
- Bei Empfang werden die Proben bei -65 ° C gelagert bis -95 ° C, bis sie analysiert werden.
4. Auftauen und Durchflusszytometrie-Analyse
- Entfernen der gefärbten Probe aus dem Gefrierschrank bei Raumtemperatur in der Dunkelheit vor dem Sammeln auf dem Durchflusszytometer aufzutauen. Wenn Daten über mehr als eine Probe, standardisieren den Vorgang für alle Rohre durch Staffelung Auftauen, so dass die Rohre nicht sitzen bei Raumtemperatur für mehr als 1 Stunde lang.
- Proben sollten die unter Verwendung eines Durchflusszytometers vier Laser mit geeigneten Filtern, wie dem BD LSR ausgestattet werdenII. Verwenden Sie Standard-Zytometer Kalibrierung und Fluoreszenzkompensation Methoden zur Datenerfassung 4.
Hinweis: Nicht nach vorne gesetzt streuen oder Seitwärtsstreuung Schwellenwerte während collection 5. TruCOUNT Kügelchen können unterhalb der niedrigsten möglichen Threshold-Einstellung für diese Parameter bewirken, dass ein Teil der Perlen nicht bei der Analyse berücksichtigt werden fallen. Wenn durch das Gerät erforderlich, um eine Schwelle, die niedrigste mögliche Am Cyan-Kanal Schwelle. Da CD45 + Leukozyten mit dem Panel gefärbt wird Cyan positive Am, und TruCOUNT Perlen auch fluoreszieren im Am Cyan-Kanal, sollte dies für alle relevanten Daten entsprechend gesammelt werden können.
- Vortex das Probenröhrchen für 5 Sekunden vor dem Laden auf dem Durchflusszytometer. TruCOUNT Perlen fluoreszieren stark in viele Kanäle. Tor die Perlen während der Sammlung durch Auffinden der Bevölkerung, die stark doppelt positiv für PE Cy5 und APC (die beiden colors, dass die meisten der Perlen leicht unterscheiden von den Zellen können je nach Instrumentierung variieren). Wählen Sie den Wulst Tor als Stoppen Tor, und Daten aufzeichnen, bis mindestens 20.000 Perlen erworben werden.
- Analysieren Sie die Daten mit Hilfe geeigneter Software wie FlowJo (Treestar; Ashland, OR). Abbildung 1 zeigt die Gating-Schema für die Analyse der verschiedenen Leukozyten-Populationen aus einer repräsentativen Kontrolle Blutentnahme verwendet.
5. TruCOUNT Berechnungen
- Jeder TruCOUNT Röhre enthält eine lyophilisierte Pellet fluoreszierende Kügelchen. Nach Zugabe von Flüssigkeit zu dem Rohr und Vortexen sollten die Perlen sich gleichmäßig über der Probe verteilt. Die Zahl der Raupen in der Pellet variiert leicht durch Losnummer und kann auf der Aufbewahrungstasche für die Rohre zu entnehmen.
- Tor die TruCOUNT Perlen und Zellpopulationen wie in Abbildung 1 gezeigt, Veranstaltung zählt für jede Population zu bestimmen. Vergleicht man die Anzahl der Ereignisse in die Wulst Gate zur Gesamtzahl von Kügelchen ursprünglich in der Röhre erlauben, das Verhältnis der Probe gesammelt, die dann verwendet werden, um die absolute Konzentration (dh Zellen / ul) für jede Population zu bestimmen bestimmen. Zellkonzentration (# Zellen / Mikroliter Vollblut) = [# Bevölkerung events / (# bead events / # total Perlen in Pellet)] / 100 ul: Die folgende Gleichung kann für diesen Zweck verwendet werden.
6. Repräsentative Ergebnisse
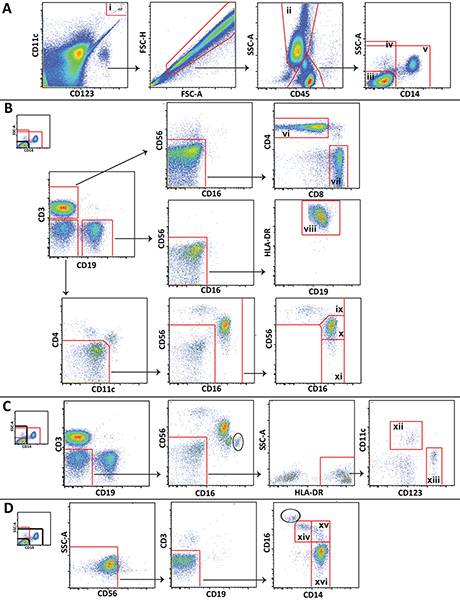
Abbildung 1. Gating-Schema für die Analyse der wichtige Leukozytenpopulationen zeigt repräsentative Daten von einem gesunden Freiwilligen verwendet. A) TruCOUNT Perlen (i) sind gated und ausgeschlossen von Zellen. Granulozyten (ii) werden abgegrenzt und lympohcytes und Monozyten sind in 3 popluations unterteilt: CD14Lymphozyten negativ (iii), alle CD14-negativen Zellen (iv), und nicht-Lymphozyten (v). B) CD14 negativen Lymphozyten sind gated an CD4 + T-Zellen (vi), CD8 + T-Zellen (vii), B-Zellen (viii), CD56 hell NK-Zellen (ix), CD56 dim NK-Zellen (x), und CD56 negativen NK-Zellen zu unterscheiden (xi). C) Alle CD14 negative Zellen sind gated um myeloide (xii) und plasmazytoiden (xiii) dendritische Zellen zu unterscheiden. D) Non-lympocytes sind gated nicht-klassischen (xiv), Mittelstufe (xv) und klassische (xvi) Monozyten zu unterscheiden. Klicken Sie hier für eine größere Abbildung zu sehen .
Spezifischere Zelluntergruppen die nicht in 1 (zB NKT-Zellen oder Neutrophile) gezeigt können auch unter Verwendung der Platte unterschieden präsentieren wir werden, und die Gating-Schema kann erweitert oder modifiziert werden, um spezifische Studie Bedürfnisse zu erfüllen. Bestimmte Gating gezeigten Schritte sind einzigartig für diese Methode. Besonders erwähnenswert ist, einer Einbeziehung Tor undAusschluss Gate sind um die Kügelchen TruCOUNT gezogen und auf die Oberseite voneinander ein bis Gate die Perlen zum Zählen und ein um die Kügelchen aus dem zellulären Analyse (Abbildung 1A) auszuschließen. Auch weil Lymphozyten, Monozyten und Granulozyten nicht so leicht in Vollblut unterscheiden, wie sie in peripheren mononukleären Zellen durch Vorwärtsstreuung und seitliche Streuung, Gating diesen Zellen mit CD45-Expression und Seitenstreuung ist oft notwendig (1A) sind. Kontaminierende Granulozyten (eingekreist), die nicht von Lymphozyten und Monozyten mit CD45 und side scatter getrennt werden konnten unterscheidbar sind in einigen Parzellen durch ihre hohe CD16 Expression (Abbildung 1C und 1D). Die Anzahl der kontaminierenden Granulozyten ist üblicherweise klein, und sie nicht mit Monozyten und NK-Zell-Gating stören.
Access restricted. Please log in or start a trial to view this content.
Diskussion
In diesem Bericht stellen wir eine Bead-basierte Verfahren zum Aufzählen Leukozytenpopulationen in frischem Vollblut mittels Durchflusszytometrie und decken die notwendigen Parameter für den Einsatz in einer multizentrischen klinischen Studie mit zentraler Probenanalyse. Diese Methode baut auf und optimiert die BD TruCOUNT Protokoll und ermöglicht seinen zuverlässigen Einsatz in einer multizentrischen klinischen Studie. Die Färbung Test ist einfach und dauert etwa 45 Minuten in Anspruch, so dass es möglich ist fü...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Jessica Jones, Erica Clark, Constance Ducar, Donna Smith, Roy Lewis, Lily Apedaile, Joanne Wiesner, Devin Adams, Corey McBain und Stephen Voght für ihre Unterstützung bei der Entwicklung dieser Methode, Manuskript und Video.
Diese Arbeit wurde von der Bill and Melinda Gates Foundation CAVD Zuschuss 38.645 (MJM) und National Institutes of Health Zuschüsse UM1 AI068618 und U01 AI069481 (MJM) unterstützt. EA-N. wird durch NIH Grant T32 AI007140 unterstützt. Wir danken dem James B. Pendleton Charitable Trust für ihre großzügige Ausstattung Spende.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent Name | Firma | Katalog-Nummer | |
| TruCOUNT Absolute Counting Tubes | BD Biosciences | 340334 | |
| 10X FACS Lyselösung | BD Biosciences | 349202 | |
| Kategorie B & Exempt Shipping System, isoliert | Saf-T-Pak | STP-320 | |
| CD45 monoklonalen Antikörpers AmCyan | BD Biosciences | 339192 | |
| CD3 monoklonaler Antikörper FITC | BD Biosciences | 349201 | |
| CD8-PerCP Cy 5,5 monoklonalen Antikörpers | BD Biosciences | 341051 | |
| Alexa Fluor 700 CD4 monoklonalen Antikörperndy | BD Biosciences | 557922 | |
| HLA-DR-ECD monoklonalen Antikörpers | Beckman Coulter | IM3636 | |
| CD14 monoklonalen Antikörper V450 | BD Biosciences | 560349 | |
| CD19 PE monoklonalen Antikörpers | BD Biosciences | 555413 | |
| APC-CD16 monoklonaler Antikörper H7 | BD Biosciences | 560195 | |
| CD56 PE-Cy7 monoklonalen Antikörpers | BD Biosciences | 335791 | |
| CD11c APC monoklonalen Antikörpers | BD Biosciences | 559877 | |
| CD123 PE-Cy5 monoklonalen Antikörpers | BD Biosciences | 551065 |
Referenzen
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M. The handbook of Experimental Immunology. Herzenberg, L., Blackwell, C., Weir, D. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6(2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten