Method Article
Chirurgische Verfahren für eine Ratte Modell Teilweise Lebertransplantation mit arteriellen Rekonstruktion
In diesem Artikel
Zusammenfassung
Lebertransplantation bei Ratten ist ein unverzichtbares experimentelles Modell für die biomedizinische Forschung. Hier präsentieren wir unsere chirurgischen Verfahren zur orthotopen Ratten Lebertransplantation mit arteriellen Rekonstruktion mit 50% partielle Transplantat.
Zusammenfassung
Lebertransplantation (OLT) in Ratten mit einer ganzen oder teilweisen Graft ist ein unverzichtbares experimentelles Modell für die Transplantation Forschung, wie Studien über Graft Erhaltung und Ischämie-Reperfusion 1,2, Immunreaktionen 3,4, Hämodynamik 5,6 und kleine-for-size-Syndrom 7. Die Ratte OLT gehört zu den schwierigsten Tiermodellen in der experimentellen Chirurgie und verlangt fortgeschrittenen mikrochirurgischen Fähigkeiten, die eine lange Zeit zu lernen, zu nehmen. Folglich hat die Verwendung dieses Modells beschränkt. Da die Zuverlässigkeit und Reproduzierbarkeit der Ergebnisse Schlüsselkomponenten der Experimente, in denen solche komplexen Tiermodellen verwendet werden, ist es wesentlich für Chirurgen, die in Ratten OLT beteiligt sind, um in gut standardisiert und ausgeklügelten Verfahren für dieses Modell trainiert werden.
Während verschiedene Techniken und Modifikationen OLT bei Ratten wurden 8 berichtet, seit das erste Modell war described. by Lee et al. 9 in 1973, die Beseitigung der arteriellen Rekonstruktion 10 und die Einführung der Manschette Anastomosentechnik durch Kamada et al. 11 waren ein großer Fortschritt in diesem Modell, weil sie die Rekonstruktion Verfahren vereinfacht in hohem Maße . In dem Modell durch Kamada et al. Wurde die hepatische rearterialization ebenfalls eliminiert. Da Ratten ohne arteriellen Flow nach Lebertransplantation überleben konnte, gab es erhebliche Kontroversen über den Wert der Leber Arterialisierung. Allerdings hat die physiologischen Überlegenheit der arterialisierte Formgebung zunehmend anerkannt, insbesondere hinsichtlich der Erhaltung der Gallengangssystems 8,12 und die Leber Integrität 8,13,14.
In diesem Artikel präsentieren wir detaillierte chirurgische Eingriffe für eine Rattenmodell OLT mit arteriellen Rekonstruktion mit 50% partielle Transplantat nach ex vivo Leber Resektiontion. Die Rekonstruktionsverfahren für jedes Gefäßes und der Gallengang durch die folgenden Verfahren durchgeführt:; eine Manschette Technik für die Pfortader, ein 7-0 Polypropylen fortlaufende Naht zur supra-und infrahepatische Hohlvene und einem Stent Technik für die Leberarterie und der Gallengang.
Protokoll
Ein. Grundlegende Techniken und gemeinsame Verfahren
- Alle Verfahren werden unter sauber, aber nicht steril Bedingungen durchgeführt.
- Nachdem die Unterleib der Ratte geöffnet wird, werden alle Verfahren unter einem chirurgischen Mikroskop bei einer Vergrößerung von 16x durchgeführt. Ausnahmen sind die ex vivo Leberresektion, die bei 10x durchgeführt wird, und die folgenden Verfahren, die bei 25x durchgeführt werden: Einführen eines Stents in den Gallengang und der Leberarterie und der Wiederaufbau der Leberarterie, der infrahepatische Hohlvene (IHVC) und der Gallengang.
- Wattestäbchen für sanfte Manipulation von Organen, stumpf von Geweben und Komprimierung Blutstillung eingesetzt. Mullkompressen (5 x 5 cm) mit Ringer-Laktat-Lösung eingeweicht werden verwendet, um die Leber oder Darm zurückzuziehen und zu halten Organen feucht. Die Klammer kann Satinsky zum Zurückziehen aus Gaze deckende Darm Richtung der linken oder der Schwanzvene der Ratte, das chirurgische Feld um den IHVC Erweitern verwendet werden.
- Alle Ligationen mit einem 6-0 Seidenfaden mit Ausnahme der Pedikel Leberlappen während der Ex-vivo Leberresektion, wo 4-0 Seidenfäden werden durchgeführt. Die Ligatur durch ein DeBakey Bulldog Klemme oder andere Instrumente gezogen werden, um eine angemessene Spannung auf das ligierte Stelle bereitzustellen, so dass die zweite Ligatur in einem Abstand zu dem ersten hergestellt werden kann, und die Teilung zwischen den zwei Punkten ligierten gut durchführbar ist.
- Alle intravenöse Injektionen werden durch die penile Vene.
- Während der Rekonstruktion Verfahren für die suprahepatische Hohlvene (SHVC), der Pfortader, die Leberarterie und der Gallengang, ein kleiner Klumpen von Öl-basierten Ton wird verwendet, um einen Fingerring einer peripheren vaskulären Klemme oder eine Mücke Pinzette halten um sie fixiert.
2. Präoperative Vorbereitung
- Männliche Lewis Ratten mit einem Gewicht zwischen 230 und 250 g werden als Spender und Empfänger zur Lebertransplantation verwendet. Die Ratten sindgeschuldeten freien Zugang zu Wasser und Nahrung bis zur Einleitung der Narkose.
- Manschette für die Pfortader (Abbildung 1): Bereiten Sie die Manschette für die Pfortader durch Schneiden einer 14-Gauge-Katheter mit einem Nr. 11 Skalpell unter dem Mikroskop. Die Manschette besteht aus einem Körper und einer Verlängerung, die jeweils mit einer Länge von 2 mm. Make Umfangsnuten an der Manschette durch Einklemmen der Wand der Manschette stufenweise umfangsmäßig mit Moskito-Zange, so dass ein Faden straff an der Manschette befestigt werden kann ohne abzurutschen.
- Stents für den Gallengang und Leberarterie (Abbildung 1): Cut 24-Gauge-Katheter mit einem Skalpell unter dem Mikroskop auf Schrägen an beiden Enden der Katheter zu produzieren mit einer Länge von 4 mm für die Leberarterie und 5 mm für den Gallengang .
3. Donor Betrieb
Das Schema der Entfernung der Leber aus dem Spender Ratte ist in Abbildung 2 gezeigt. Dieser Vorgang benötigt ca.imately 30-35 min.
- Anästhesieren die Ratte mit Inhalation von 4 Vol.% Isofluran in 100% Sauerstoff bei einer Flussrate von 4 L / min für die Induktion der Anästhesie und 1,5 Vol.% bei 2 L / min für die Wartung. Injizieren Buprenorphin (0,1 mg / kg) subkutan als Analgetikum. Legen Sie die Ratte auf einem Heizkissen, und befestigen Sie die Oberarme mit den magnetischen Fixateur Einfahren System (Abbildung 3a). Rasur das Fell aus dem gesamten Bauchbereich der Ratte, und sterilisieren die entsprechende Haut mit einer PVP-Jod-Lösung.
- Öffnen Sie den Bauch durch einen Medianschnitt mit bilateralen Erweiterungen. Platzieren einer 5-ml-Spritze unter dem Rücken der Ratte, so dass die SHVC ventral erhöht ist. Mit einer Mücke Zangen, Klemmen und ziehen Sie den Xiphoid gegen den Kopf, und wenden Sie die subkostalen Retraktoren die OP-Feld (Abb. 3a) zu öffnen.
- Sezieren die falciform Ligament und der linken dreieckigen Band. Als nächstes ligieren und teilen die linke phrenic Vene.
- Retrfungieren die mittleren und linken seitlichen Lappen oben mit einem nassen Mulltupfer. Mit bipolaren Pinzette koaguliert und teilen die para-und Speiseröhrenkrebs Schiffe zwischen dem linken seitlichen und vorderen Lobus caudatus.
- Bewegen Sie den Darm außerhalb des Bauches auf die linke Seite der Ratte, und decken Sie sie mit einem feuchten Gaze Tupfer. Ziehen Sie den rechten seitlichen Lappen oben mit einem nassen Mulltupfer. Isolieren der von der IHVC retroperitonealen Gewebe, und das Recht ligieren Nebennierenvenenkatheter, was später kurz vor dem Transplantat Entfernung eingeteilt werden.
- Um einen Stent in den Gallengang (Abbildung 3b) einfügen:
- Ligieren den Gallengang auf der Ebene der Abzweigung der gastroduodenalen Arterie. Die Weichgewebe umgebenden Gallengang sollte so weit wie möglich erhalten werden, und die Trennung der aus dem Gallengang Leberarterie sollte vermieden werden, um ausreichende arteriellen Blutzufuhr zu dem Gallengang sichern.
- Mit geradem Mikro Schere, einen kleinen Einschnitt in der anterioder an der Wand des Gallengangs proximal der ligierten Punkt. Halten Sie die vordere Wand des Einschnitts mit einer geraden Mikropinzette in der linken Hand, legen Sie einen Stent in den Kanal mit Hilfe eines gebogenen Mikropinzette in der rechten Hand, und sichern Sie es mit einem 6-0 Seidenfaden. Eine der geschnittenen Enden des Fadens an den Gallengang wird bei einer Länge von 4 mm gehalten, so daß der Faden während des späteren Anastomose gehalten werden kann.
- Befreien Sie die Pfortader aus den Pylorus und Milzvenen durch Ligation und Dividieren.
- Ligieren und teilen die gastroduodenalen Arterie, dann isolieren die gemeinsame Leberarterie (CHA) aus dem Pankreaskopf zu ihrer Wurzel. Drehen Sie die Leber auf der rechten Seite mit einem Wattestäbchen und sezieren das Band um den Rücken der Leber und der Speiseröhre.
- Nach Abschluss der Vorbereitungen für Leberexzisionsanteils, entfernen Sie die Retraktoren, die Mosquitoklemme für die Xiphoid und die 5-ml-Spritze unter dem Rücken der Ratte. Zurück in den Darm der abdominal Hohlraum.
- Inject 500 IE Heparin-Natrium in 2 ml physiologischer Kochsalzlösung durch den Penis Vene. Etwa 3 Minuten später, setzen Sie die 5-ml-Spritze, die Mosquitoklemme und die Retraktoren. Ligieren die CHA proximal zu ihrer Wurzel. Halten Sie eine der abgeschnittenen Enden des Fadens für die CHA ligiert lang.
- Nach dem Einspannen der IHVC nahe der rechten Nierenvene mit einem Moskito Pinzette, klemmen die Pfortader mit einem Einweg-micro Schiffes Klemme unter dem Stumpf des lienalis. Inzision der vorderen Wand der Pfortader, und legen Sie eine 18-Gauge-Katheter in die Pfortader.
- Perfundieren der Leber in situ mit 60 ml kaltem Histidin-Tryptophan-Ketoglutarat (HTK)-Lösung bei einem hydrostatischen Druck von 20 cm H 2 O. Unmittelbar danach, schneiden Sie die Membran und durchschneiden die intrathorakalen Hohlvene, und schneiden Sie die vordere Wand der IHVC offen, damit die Durchblutung Lösung aus der Leber (Abbildung 3c) gespült werden.
- Klemmen Sie die IHVC mit einem disposable micro Schiffes unterhalb der Leber zu spannen. Excise die Leber durch Sezieren des IHVC etwas unterhalb der Mitte zwischen der Leber und der rechten Nierenvene, die Pfortader unterhalb des Stumpfes des Milzvene, der Membran, die verbleibenden Bänder im hinteren Teil der Leber, der rechte Nebennierenvenenkatheter, und die CHA an seiner Wurzel. Legen Sie die ausgeschnittenen Leber in kalten HTK-Lösung in einer Metallschale in einer Kunststoff-Box voll von zerstoßenem Eis gelagert.
4. Ex vivo Graft Downstream
Alle Verfahren für die Leber Transplantat in der Metall-Tasse mit eiskaltem HTK-Lösung gefüllt durchgeführt. Die ex vivo graft Vorbereitung erfordert ca. 30 min.
- Für die Anbringung einer Manschette auf der Pfortader (Abbildung 4):
Klemmen Sie die Pfortader Stamm mit einem DeBakey Bulldog Klemme. Platzieren Sie die Klemme in einer Position über dem verbrückenden Bechers (4a, b). Legen Sie die Pfortader durch die Manschette, und klemmendie Pfortader wieder zusammen mit der Verlängerung der Manschette an der 12-Uhr-Position (Fig. 4c). Evert die Wand der Pfortader über die Manschette um den Stumpf des Milzvene Außenseite der Manschette an der 7-Uhr-Position (Abbildung 4d) zu positionieren, und sichern Sie die Pfortader mit einem 6-0 Seidenfaden (Abbildung 4e) . - Um einen Stent in die Leberarterie (Abbildung 5) einfügen:
Fix die Leber durch Klemmung beide Ränder der Membran durch Zange, und ziehen Sie die CHA gerade durch Halten der ligierten Thread mit dem DeBakey Bulldog Klemme (Abbildung 5a). Mit geradem Mikro Schere, einen kleinen Einschnitt in der vorderen Wand der CHA. Mit der linken Hand, halten Sie die vordere Wand des Einschnitts mit einer geraden Mikropinzette und mit der rechten Hand, legen Sie einen Stent in die CHA mit einer gekrümmten Mikropinzette. Der Stent wird zuvor mit Heparin-Natrium-Lösung (100 IU / ml) (5b-d) gewaschen. Secure der Stent mit einem 6-0 Seidenfaden, und halten eine der geschnittenen Enden des Fadens in einer Länge von 4 mm. Spülen Sie die Leber durch den arteriellen Katheter mit 5 ml kaltem HTK-Lösung. - Für 50% Leberresektion (Abbildung 6):
- Klemmen Sie den hinteren Lobus caudatus mit einem Moskito Pinzette, um ihn zu beheben. Resezieren den Lappen nach Ligation der Stiel mit einem 4-0 Seidenfaden (Abbildung 7a). In der gleichen Weise, entfernen Sie den vorderen Lobus caudatus.
- Drehen Sie die Kunststoff-Box 90 Grad. Klemmen den rechten Rand der Membran und dem linken Teil des Median Lappens. Machen Sie einen kleinen Schnitt an der oberen Kante der Grenze der bilateralen Teile der Mittellappen, und entfernen Sie dann den linken Teil nach Ligation (Abbildung 7b). Entfernen Sie die linke Seitenlappen nach Ligation des Stiels mit einem 4-0 Seidenfaden. Cauterize die resezierten Leber Oberfläche sorgfältig mit einer bipolaren Pinzette. Als Ergebnis wird die Masse durch ein Leber reduzierttwa 50% 15 (7c, d).
- Für plasty des SHVC (Abbildung 8):
Fixieren Sie die Position der Leber durch Klemmung beide Ränder der Membran mit einem Moskito Pinzette (Abbildung 8a). Trimmen der vorderen Wand der SHVC durch Entfernen des entsprechenden Diaphragmas. Befestigen zwei 7-0 Polypropylen Nähte von der Außenseite zur Innenseite an beiden Ecken als Haltefäden für die spätere Anastomose (Abb. 8b). Dann schneiden Sie die hintere Wand des SHVC. - Bewahren Sie die Transplantats bei 4 ° C in HTK-Lösung in einem kalten Wasserbad.
5. Empfänger Betrieb
Das Schema des Transplantats Implantation in den Empfänger Ratte wird in 9 gezeigt. Der Empfänger Operation erfordert 60-70 min, die 10-11 min anhepatischen Zeit und rund 23-24 min IHVC Spannzeit enthält.
- Führen Sie die gleichen Verfahren wie in den DoNOR-Operation (3.1 bis 3.4) mit Ausnahme der Öffnung der Bauchhöhle durch eine Inzision, ohne bilaterale Verlängerungen (Abbildung 10a).
- Ein nasses Mulltupfer über der rechten Seite des Duodenums und ganze Darm, eine chirurgische Feld um den IHVC erhalten. Legen Sie die linke seitliche und mittlere Lappen in die linke subphrenic Hohlraum, und schieben Sie den rechten seitlichen Lappen oben mit einem nassen Mulltupfer. Isolieren Sie die IHVC aus dem retroperitonealen Gewebe. Ligieren und teilen sich das Recht vor Nebenniere Vene (Abbildung 10b). Mit einem feuchten Gaze und Wattestäbchen, drehen die Leber auf der linken Seite, und zerlegen das Band um den Rücken der Leber.
- Bringen Sie die rechte seitliche Lappen an die anatomische Position. Legen Sie eine feuchte Mulltupfer zu bedecken und ziehen Sie die mittleren und linken seitlichen Lappen nach oben. Transekt den Gallengang direkt unter dem Ast aus dem Lobus caudatus. Die Weichgewebe umgebenden Gallengang sollte so viel wie möglich erhalten bleiben. Halten Sie eine der abgeschnittenen Enden des thLesen ligiert für den Gallengang in 4-mm lang.
- Ligieren und teilen die gastroduodenalen Arterie und die richtige Leberarterie in einem 3-mm Abstand zur Abzweigung von der CHA. Dann, einen Y-Struktur der Arterie am Ende des CHA. Halten Sie eine der abgeschnittenen Enden des Fadens für die ordnungsgemäße Leberarterie bei 4-mm lang ligiert. Drehen Sie die Leber auf der rechten Seite mit einem Wattestäbchen und sezieren das Band um den Rücken der Leber von der linken Seite.
- Nach der intravenösen Injektion von 2 ml Ringer-Laktat-Lösung, klemmen die IHVC mit einem Metall Mikro Gefäß Schelle gleich über der rechten Nierenvene. Klemmen die Pfortader auf der Ebene seiner Gabelung in der Leber Hilus von einer Mücke Pinzette von der linken Seite der Ratte. Klemmen die SHVC zusammen mit der Membran von der rechten Seite von einem umlaufenden Gefäßklemme, und fixieren Fingerringanordnung der Klammer in einem Klumpen Ölbasis Ton.
- Reduzieren Sie die Narkose mit Isofluran bis 0,4 vol% während der anhepatischen Zeit (die DauerCross-Klemmung der Pfortader). Excise der Empfänger nativen Leber durch Sezieren des SHVC, die Pfortader und die IHVC auf folgenden Ebenen: die SHVC, an der Grenze zwischen dem SHVC und in der Leber, und die Pfortader, knapp oberhalb des Kiefers der Mosquitoklemme und Die IHVC, leicht unterhalb der Mitte zwischen der Leber und der rechten Nierenvene (Abbildung 10c). Legen Sie die Transplantats orthotop.
- Für die Anastomose des SHVC durch eine durchgehende Naht (11):
- Verwenden einer gekrümmten Mikropinzette in der linken Hand während der Nähvorgang zum Ergreifen des Gefäßwand oder Halten der Nähnadel. Zuerst legen Sie den Aufenthalt Naht auf den Empfänger SHVC von innen nach außen mit dem beiliegenden 7-0 Polypropylen in der rechten Ecke des Transplantats durch einen Knoten (oder Sie können sich zu binden, nachdem alle Nähen Verfahren abgeschlossen sind) gefolgt. Als nächstes legen Sie die zweite Aufenthalt Naht in der gleichen Weise auf der linken Maiser, die der Startmasche einer fortlaufenden Naht sein wird. Um die Anastomose zu erweitern, zu erfassen und zu halten die Nähte mit DeBakey Bulldogklemmen an beiden Ecken mit sanften Traktion superiolaterally (Abbildung 11a, b).
- Pierce das Nahtmaterial an der linken Ecke durch die Wand auf dem Transplantat Seite von außen nach innen in engem Zusammenhang mit dem Knoten außerhalb, und die hintere Naht Zeile der SHVC intraluminal mit 7 bis 8 Maschen auf der rechten Ecke (Abbildung 11c). Machen Sie die ersten Stiche sorgfältig, so dass die inneren Lumen einander konfrontiert sind. In der rechten Ecke, durchbohren die 7-0 Polypropylen durch das Gefäß auf dem Transplantat Seite nach außen.
- Weiter, vernähen der vorderen Reihe von der Außenseite, von rechts nach links, mit etwa 10 Maschen (Abb. 11d). Vor der Fertigstellung des vorderen Reihe, spülen Sie das Innere mit Ringer-Laktat-Lösung, um Luftblasen zu entfernen. Machen Sie den letzten Stich an der vorderen Reihe so nah wiemöglich, den Aufenthalt Naht an der linken Ecke, und dann binden sie zusammen.
- Für die Rekonstruktion der Pfortader durch eine Manschette Technik (Abbildung 12):
- Klappen Sie die mittlere und linke Seitenlappen oben mit einem nassen Mulltupfer. Klemmen Sie den Empfänger Pfortader an ihrem Zusammenfluss mit dem Pylorus Vene mit einem Einweg-micro Schiffes Klemme von der rechten Seite. Befestigen Sie die Mosquitoklemme dass Klemmen die Pfortader in den Ton, und ziehen Sie die Spitze der Zange in Richtung der Leber Hilus (Abb. 12a, b).
- Inzision der vorderen Wand der Pfortader direkt unterhalb des Kiefers der Mosquitoklemme. Waschen des Inneren des Empfängers Pfortader und der Manschette mit Ringer-Laktat-Lösung. Halten die vordere Wand des Einschnitts mit einer geraden Mikropinzette in der linken Hand und einer Verlängerung der Manschette mit einem gekrümmten Mikropinzette in der rechten Hand. Legen Sie die Manschette in den Empfänger Pfortader tief, und befestigen Sie sie mit einemumlaufende 6-0 Seidenfaden (Abbildung 12c-f).
- Lassen Sie die Klemmen der Pfortader und SHVC und dann reperfuse die Leber. Entfernen der 5-ml-Spritze vom Rücken der Ratte, und erhöhen die Konzentration von Isofluran bis 0,8 Vol.%.
- Für die Rekonstruktion der Leberarterie durch einen Stent-Technik 16 (Abbildung 13):
- Erstens, halten Sie den Faden des Empfängers richtige Leberarterie von einer Mücke Pinzette von der linken Seite, und ziehen Sie sie in Richtung der Leber Hilus, und klemmen Sie die Empfänger-CHA von der rechten Seite in der Nähe der Bauchspeicheldrüse (Abbildung 13a).
- Mit einer geraden Mikropinzette, einen kleinen Einschnitt in der Gabelung des Y-Struktur am Ende des Empfängers CHA eine trichterförmige Öffnung zu machen. Halten des Stents in den Pfropf-CHA mit einem gekrümmten Mikropinzette platziert. Nach dem Waschen jedes Lumen mit Heparin-Natrium-Lösung (100 IU / ml), schieben Sie die Stents in die refänger CHA und sichern Sie es mit einem 6-0 Seidenfaden. Ein Ende dieses Gewindes auf den Empfänger CHA und der 4-mm-Gewinde an den Pfropf CHA zusammen, so dass beide CHAs näher zueinander mit reduzierter Spannung der Anastomosestelle (Abbildung 13b) erhalten. Danach lassen Sie die Klemme.
- Für die Anastomose des IHVC durch eine fortlaufende Naht (Abbildung 14):
Anastomosieren in der gleichen Weise wie für den SHVC, aber mehr Stichen mit feineren Biss (14a-d). Binden der Nähte auf der letzten Masche kann eliminiert werden, oder kann mit einem Bindemechanismus Wachstumsfaktor erreicht werden, um die Stenose anastomotischen durch Anbinden zu fest zu vermeiden. Nach Entklemmspannung, erhöhen die Konzentration der Anästhesie bis 1,0 Vol.%. Wenn die Anastomose sieht stenotischen, erweitern die Anastomose durch Ziehen der bilateralen Aufenthalt Nähten oder Verbreiterung der vorderen Reihe sanft um die Anastomose zu erweitern. - Verwalten 0,5 ml von 8,4% Natriumbicarbonat solution mit 1,0 ml Ringer-Laktat-Lösung intravenös.
- Bewerben kleine Fragmente von TachoSil mit der resezierten Leber Oberfläche zu versiegeln, um die Blutung und Gallenwege Auslaufen zu verhindern.
- Für die Rekonstruktion der Gallenwege durch einen Stent-Technik:
- Halten Sie den Faden des Empfängers Gallengang durch eine Mücke Pinzette von der linken Seite. Befestigen Sie die Mosquitoklemme im Ton, und ziehen Sie die Spitze der Zange in Richtung der Leber Hilus.
- Machen Sie einen kleinen Schnitt in den Gallengang auf der entsprechenden Ebene, so dass die rekonstruierte Gallengang wäre nicht zu lang. Legen Sie die Stents in das Transplantat Gallengang in den Empfänger-Kanal mit Sorgfalt, um eine Drehung zu vermeiden platziert, und sichern Sie es mit einem 6-0 Seidenfaden. Tie setzen auf der Leitung und der Empfänger 4-mm-Gewinde auf dem Transplantat Kanal zusammen, so daß beide Kanäle näher zueinander mit reduzierter Spannung der Anastomosestelle zu erhalten.
- Bei Vollendung der Rekonstruktionsverfahren, injizieren 1 ml 5% Glukoselösung intravenös (Abbildung 15).
- Bestätigen ausreichende Hämostase, und schließen Sie dann den Bauchschnitt durch kontinuierliche 4-0 Vicryl Nähte in zwei Schichten.
6. Postoperative Behandlung und Follow-up
Unmittelbar nach der Operation, den Empfänger zu behandeln Ratte mit einer subkutanen Injektion von Cefuroxim-Natrium (16 mg / kg) und Buprenorphin (0,1 mg / kg) in einem Gesamtvolumen von 1,5 ml isotonischer Kochsalzlösung. Erlauben der Ratte für 60 min in einem speziellen Intensivstation Käfig mit erwärmte Luft (30-35 ° C) und einer Sauerstoffversorgung erholen. Injizieren Buprenorphin (0,1 mg / kg) subkutan als Analgetikum alle 12 Stunden für 3 Tage. Danach bewegen Sie den rat zu einem normalen Käfig, und bieten freien Zugang zu Wasser und Nahrung.
Ergebnisse
Alle Empfänger-Ratten (n = 20) überlebten ohne offensichtliche Komplikationen bis geplanten Euthanasie für Blutabnahme bei 1, 3, 24 und 168 Stunden (7 Tage) nach Reperfusion Portal (n = 5 zu jedem Zeitpunkt). Die Blutproben wurden aus der IHVC durch eine direkte Punktion mit einer 27-Gauge-Nadel gesammelt. Nach der Zentrifugation bei 5340 × g für 10 min wurden die Serumproben gewonnen und analysiert für Alanin-Aminotransferase (ALT), die den Grad der Leberzellschaden nach Transplantation zu reflektieren. Der zeitliche Verlauf von Veränderungen im Serum-ALT-Spiegel ist in Abbildung 16 dargestellt. Die ALT-Spiegel erreichte einen Spitzenwert bei 24 Stunden (Mittelwert ± Standardabweichung: 212,6 ± 67,9 IU / L) und sank dann innerhalb der normalen Grenzen bei 168 hr (33,6 ± 6,8 IU / L).

Abbildung 1. Manschette für die Pfortader (PV) aus einem 14-Gauge-Katheter und Stents für die Leberarterie (HA) und Gallenwege (BD) aus 24-Gauge-Katheter.
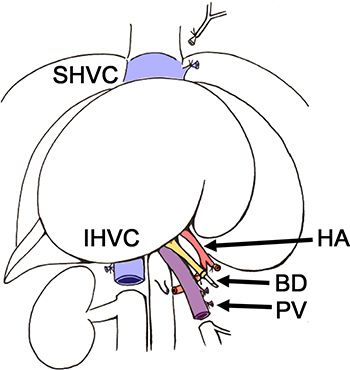
Abbildung 2. Schema der Entfernung der Leber aus dem Spender Ratte BD, Gallengang;. HA, Leberarterie; IHVC, infrahepatische Hohlvene; PV, Pfortader; SHVC, suprahepatische Hohlvene.

Abbildung 3. Donor Betrieb. ein. Die Ratte wird auf einem Heizkissen mit einem magnetischen Fixateur Rückzieheinrichtung platziert. Das Abdomen wird durch eine Inzision mit bilateraler Verlängerungen geöffnet. B. Einsetzen des Stents in den Gallengang. C. Perfusion der Leber über die Pfortader. Abkürzungen sind zu erklärened in 2.

Abbildung 4. Anbringung einer Manschette an die Pfortader. a, b. Die DeBakey Bulldog Klammer, die das Portal Venenstamm erfaßt wird über die Metallschale angeordnet. Der Becher wird in der Kunststoff-Kasten mit zerstoßenem Eis. C gefüllt montiert. Die Pfortader durch die Manschette gelegt wird. D. Die Wand der Pfortader über der Manschette mit dem Stumpf des Milzvene außerhalb der Manschette an der 7 umgestülpt Uhr-Stellung und eine Verlängerung der Manschette an der 12-Uhr-Position. E. Die Pfortader mit einer umlaufenden 6-0 Seidenfaden auf der Manschette befestigt ist. Die schwarzen Pfeile zeigen den Stumpf des lienalis.
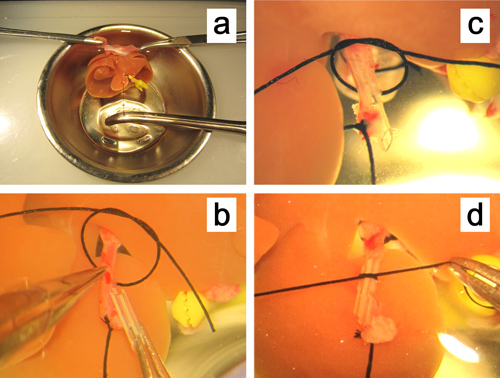
Abbildung 5. Ex vivoEinführen eines Stents in die Leberarterie. ein. Die Leber wird durch Klemmen beider Ränder der Membran befestigt und die Leberarterie geradeaus durch Halten des Gewindes für die Arterie ligiert gezogen. b. Die vordere Wand des kleinen Einschnitts auf der Leberarterie mit einer geraden Mikropinzette gehalten . c, d. Der Stent wird in die Leberarterie eingesteckt und mit einem 6-0 Seidenfaden.

Abbildung 6. Das Schema der ex vivo 50% Leberresektion. Lobes in grauer Farbe entfernt werden. ACL, anterior Lobus caudatus, PCL, posterior Lobus caudatus, LLL, linken seitlichen Lappen; LML, linken Teil des Mittellappen; RML, rechten Teil des Mittellappen; SRL, überlegene rechte seitliche Lappen; IRL, inferior rechten seitlichen Lappen.
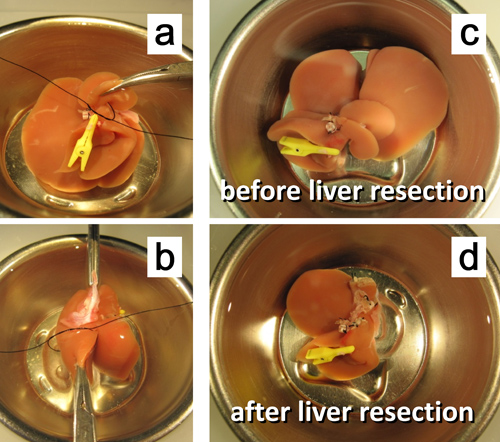
Abbildung 7. Ex vivo 50% Leberresektion. ein. Ligation des Stiels des hinteren Lappens caudatus. b. Ligation des Stiels des linken Teils des mittleren Lappens. c. Die Leber, bevor 50% Resektion. d. Die Leber nach 50% Resektion.
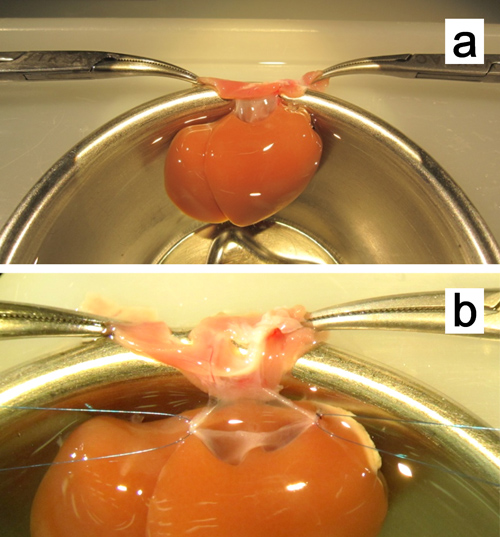
Abbildung 8. Ex vivo Plastik des suprahepatische Hohlvene. ein. Die Leber ist durch Klemmung beide Ränder der Membran mit den Mosquitoklemme fixiert. b. Bleiben Nähte mit 7-0 Polypropylen sind an beiden Ecken angebracht.

Abbildung 9. Schema des Transplantats Implantation in den Empfänger Ratte. Die Rekonstruktionen sind für die supra-und infrahepatische Hohlvene (SHVC und IHVC) mit einem 7-0 fortlaufende Naht, die Pfortader (PV) durch eine Manschette Technik und der Leber durchgeführt Arterie (HA) und Gallenwege (BD) durch ein Stent-Technik.
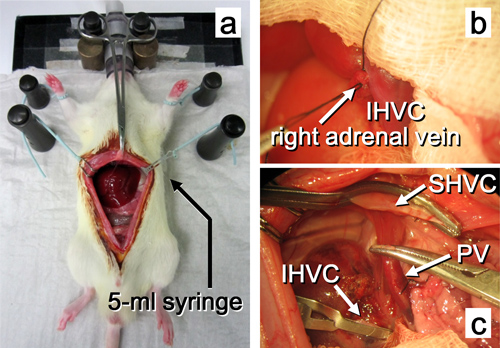
Abbildung 10. Empfänger Operation bis zur Entfernung der nativen Leber. ein. Der Bauch wird durch einen Medianschnitt eröffnet. b. Die rechte Nebenniere Vene ligiert wird. c. Die native Leber herausgeschnitten wird. Abkürzungen sind in Abbildung 2 erläutert.
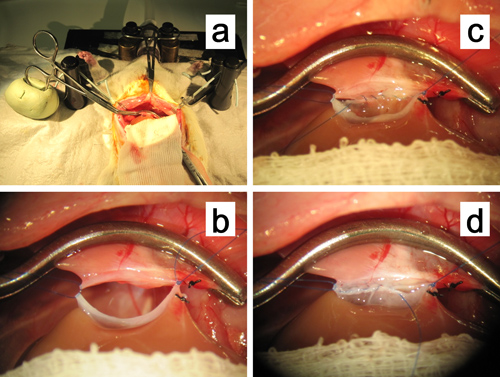
Abbildung 11. Anastomose der suprahePatic Hohlvene. a, b. Die periphere Gefäßklemme zur suprahepatische Hohlvene in einem Klumpen Ölbasis Lehm befestigt. Die Haltefäden an beiden Ecken sind mit leichten Zug gewartet superiolaterally um die Anastomose zu erweitern. C. Kontinuierliche intraluminale Naht der hintersten im Gange. D. Fortlaufende Naht der vorderen Reihe in progress.
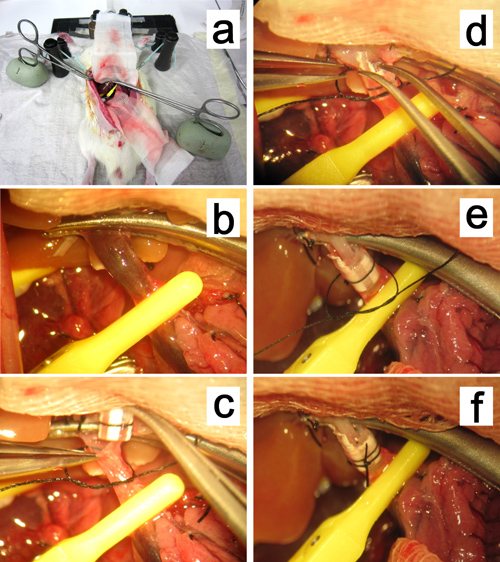
Abbildung 12. Rekonstruktion der Pfortader. a, b. Die Mosquitoklemme Einspannen der Pfortader in der Öl-basierten Ton fest und zog in Richtung der Leber Hilus. cf. Einsetzen der Manschette in die Pfortader.

Abbildung 13. Rekonstruktion der Leberarterie. a, b. g> Einfügen eines Stents in das Gefäß gemeinsame Leberarterie (CHA) an der Bifurkation der A. hepatica propria (PHA) und gastroduodenalen Arterie (GDA).

Abbildung 14. Anastomose des infrahepatische Hohlvene. ein. Die Haltefäden an beiden Ecken. b. fortlaufende Naht der hinteren Reihe. c. fortlaufende Naht der vorderen Reihe. d. Reperfusion des infrahepatische Hohlvene. Abkürzungen sind in Abbildung 2 erläutert.
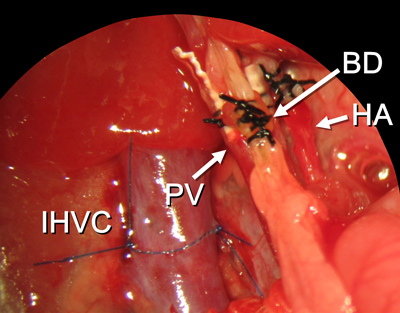
Abbildung 15. Alle Rekonstruktionsverfahren fertig sind. Abkürzungen sind in Abbildung 2 erläutert.
"Abbildung 16" src = "/ files/ftp_upload/4376/4376fig16.jpg" />
Abbildung 16 Postoperative Zeitverlauf der Veränderungen in Serum-Alanin-Aminotransferase (ALT) (n = 20, n = 5 zu jedem Zeitpunkt).. Die Daten werden als Mittelwerte mit Fehlerbalken, die Standardabweichungen zeigen, ausgedrückt. Die ALT-Spiegel erreichte einen Spitzenwert bei 24 h (212,6 ± 67,9 IU / L) und sank dann innerhalb der normalen Grenzen bei 168 hr (33,6 ± 6,8 IU / L).
Diskussion
Das erste Modell der Ratte OLT wurde von Lee et al. 1973 9, bei der alle Behälter einschließlich der Leberarterie durch einen handgenähten Verfahren rekonstruiert und der extrakorporale portosystemischen Shunts verwendet wurde. Dieses Modell war technisch kompliziert und schwierig durchzuführen. Das nächste Modell war ein ohne arteriellen Rekonstruktion und der extrakorporalen Shunt, von den gleichen Autoren 10 in 1975 entwickelt. Anschließend im Jahr 1979 eingeführt, Kamada et al. Die Manschette Anastomosentechnik für das Modell ohne Leber rearterialization 11. Mit diesen Modifikationen wurde OLT bei Ratten mit einer verkürzten Zeit in anhepatischen Empfängers Operationen vereinfacht und wurde in großem Umfang als eine akzeptierte experimentellen Modell verwendet.
Allerdings gab es erhebliche Kontroversen seitdem über die Bedeutung der Leber Arterialisierung bei Ratten OLT 8, weil die Arterialisierung war eine anspruchsvolle Aufgabe, aber did nicht beeinflussen das Überleben nach der Transplantation. Zahlreiche Studien auf hepatische Arterialisierung Verwendung verschiedener Techniken wurden Rekonstruktion 8, wie einem aortischen Segment-zu-Aorta Anastomose 3,9,17, eine Manschette Anastomosentechnik 18,19,20, eine teleskopierbare Technik 5, ein Stent-Technik 13 gemeldet, 16, und eine Hülse Anastomosentechnik 12,21-23. Während die Technik für Ratten-OLT ist noch nicht genormt heute hat sich das Modell arterialisierte zunehmend in seiner physiologischen Überlegenheit 8,12,13,14 begünstigt. Unter den oben erwähnten Techniken wurde eine Stent Technik, die einfach und schnell durchzuführen, war von Lehmann et al. 16 2005. Die Studie zeigte hervorragende Ergebnisse: keine Okklusion Rate wurde im rekonstruierten Leberarterie in 8 h, 24 h, und 6 Monate nach der Reperfusion beobachtet. Deshalb hat dieses Verfahren für Leber Arterialisierung.
Wir Leistungma handgenähte Anastomose für den Wiederaufbau des SHVC und IHVC. Diese Methode stellt die Anastomosestelle mit einem optimalen physiologischen Zustands, der auf die reduzierte Inzidenz von Thrombosen 8 führt, und ist die beste Mikrochirurgie Simulation und Ausbildung für Chirurgen. Darüber hinaus können die Anastomose noch mit kurzen Stummel Gefäß möglich. Bezüglich der Anastomose IHVC, funktioniert diese Methode nicht erfordern eine lange IHVC auf dem Transplantat Seite im Vergleich mit der Manschette Anastomosentechnik. Daher wird, wenn der Spender Nierenvene seziert wird, um das Transplantat IHVC lang zu machen, ist diese Methode für die Transplantation von einem kleinen Transplantat, das eine lange IHVC, wie eine 30% Transplantat, das des rechten seitlichen und caudatus Lappen mit einem kurzen intrahepatischen besteht bedingt Hohlvene ohne SHVC 2.
In Bezug auf die Techniken der Leberresektion bei Ratten, mehrere Verfahren bisher berichtet worden, die beiden wichtigsten Techniken sind die klassische Masse Ligatur-Technikund das Schiff-orientierte Technik 24. Wir führen die klassische Technik zur Ligatur 50% Leberresektion 15, sondern unter einem chirurgischen Mikroskop, das Verfahren feiner zu machen, und um eine Beschädigung der verbleibenden Lappen und Strukturen zu vermeiden.
Wir beschrieben die repräsentative Ergebnisse aus den Empfänger-Ratten in unserem Modell, die Ratten überlebten während der 7-tägigen Beobachtungsperiode ohne offensichtliche Komplikationen. Das Modell kann für verschiedene Zwecke von Experimenten, indem Sie die verschiedenen Einstellungen, wie längerer Kühllagerung, verlängerte warme Ischämie, die Spende nach Herztod umfasst, und die Verwendung von kleineren Lebertransplantate oder Transplantate aus experimentellen Modellen von Leberschäden oder Erkrankungen verändert werden.
Nach unserer Erfahrung gibt es drei entscheidende Faktoren im Laufe der Verfahren, die das Überleben nach der Transplantation, die zuverlässigste Parameter für die Ergebnisse der Ratte OLT beeinflussen können: die Menge des Blutverlustes, die Betriebszeit, espeziell Klemm Zeit der Pfortader und IHVC und die Angemessenheit der Rekonstruktion jedes Schiff, das könnte Stenose, Thrombose führen, oder Blutungen. In einer Einarbeitungszeit von diesem Modell konnten die meisten der Fehler wahrscheinlich auf diese Faktoren zurückzuführen sein. In diesem Video Artikel präsentieren wir Schritt-für-Schritt-Anleitungen für den chirurgischen Eingriffen für unsere Rattenmodell der teilweisen OLT mit arteriellen Rekonstruktion. Während ein Rattenmodell der OLT ist kompliziert und erfordert fortgeschrittene mikrochirurgische Fertigkeiten, bietet dieser Artikel viele praktische Informationen, die als eine gute Anleitung für die Ausbildung und das Erlernen von diesem Modell dienen soll. Lernen dieses Modell effizient ist besonders wichtig für die Verkürzung der Lernzeit, die Verringerung der Anzahl der Tiere und die Kosten für die Praxis benötigt wird, und später reproduzieren zuverlässige Ergebnisse in Experimenten. Dies steht im Einklang mit dem 3R-Konzept (Replacement, Reduction und Refinement) von Tierversuchen, die von Russell und Burch wurde postuliert,1959 25.
Offenlegungen
Wir haben keine widerstreitenden Interessen offen zu legen. Die Ratten werden unter spezifischen pathogenfreien Bedingungen nach den Richtlinien des Bundes für Laboratory Animal Science Associations (FELASA) untergebracht. Alle Experimente wurden in Übereinstimmung mit dem Recht der Bundesrepublik Deutschland über den Schutz von Tieren und "Leitfaden für die Pflege und Verwendung von Labortieren" (National Institutes of Health Veröffentlichung Nr. 86-23, revidiert 1985) durchgeführt.
Danksagungen
Die Autoren danken Pascal Paschenda und Mareike Schulz für ihre technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Firma | Katalog-Nummer | Kommentare |
| Operationsmikroskop | Leica | M651 | |
| Lichtquelle | Schott | KL1500LCD | |
| Wattestäbchen | NOBA Verbandmittel | 974202 | |
| Mullkompressen (5x5 cm) | Fuhrmann | 10002 | |
| Povidonjodlösung | Mundipharma | 6108022.00.01 | |
| Ölbasis Lehm | Debika Unternehmen | 090148 | |
| TachoSil | Takeda Pharmaceuticals International GmbH | EU/1/04/277/001-004 | Angewandt auf resezierten Leberoberfläche |
| Skalpellklingen Nr. 11 | Pfm medical | 200130011 | Herstellung von Manschette und Stents |
| 14-Gauge-Katheter | B. Braun | 4268210S | Manschette für PV |
| 18-Gauge-Katheter | B. Braun | 4268130S | Perfusion über PV |
| 24-Gauge-Katheter | B. Braun | 4269071S | Stent für BD und HA |
| 4-0 Seidenfaden | Resorba | H3F | Leberresektion |
| 6-0 Seidenfaden | Resorba | H1F | |
| 7-0 Prolene (Polypropylen) Nahtmaterial | Ethicon | 8701H | SHVC und IHVC |
| 4-0 Vicryl Naht | Ethicon | V304H | Bauchdeckenverschluss |
| 5-ml-Spritze | Terumo | SS + T05ES1 | Rückenkissen |
| Heizkissen | Thermo | 190 x 260 mm | |
| Magnetic Fixateur Retraktionssystem | Fine Science Tools Inc. | 18200-01 18200-02 18200-03 18200-12 | |
| Kaltwasserbecken | Huber | 740.000X | Graft Erhaltung |
| Bipolare Pinzette | Söring | MBC-200 | |
| Mosquito Zange | BONIMED | 451-476-03 | Zwei Paare verwendet |
| Adson Mikropinzette | Dimeda | 10.176.12 | |
| Curved micro Pinzette | AESCULAP | FD281R | |
| Gerade Mikropinzette | Bonimed | 451-476-03 | |
| Curved Mikro Scheren | Medicon | 05.15.83 | |
| Gerade micro scissors | AESCULAP | FD12 | Mikrochirurgische |
| Schere | AESCULAP | BC211W | |
| Micro Nadelhalter | AESCULAP | FD241R | Wiederaufbau |
| Bürgermeister-Hegar Nadelhalter | Mizuho Ikakogyo | 06-798-00 | Bauchdeckenverschluss |
| DeBakey Bulldog Klemme (gerade) | ULRICH | CV3054 | |
| DeBakey Bulldog Klemme (gebogen) | CODMAN | 37-1062 | |
| Satinsky Klemme | Mizuhoika | 09-230-24 | |
| Periphere arterielle Klemme | Teleflex Medical | 353494 | Empfänger SHVC |
| Micro Schiffes Klemme (Einweg) | AROSurgical Instruments Corporation | TKM-1-60 g | PV, Graft IHVC und Empfänger HA |
| Micro Schiffes Klemme (Metall) | Fine Science Tools Inc. | 18052-01 | Empfänger IHVC |
| Ringer-Laktat-Lösung | Fresenius Kabi | 6150917.00.00 | |
| Normale Kochsalzlösung | DeltaSelect | 1299.99.99 | |
| HTK-Lösung | Dr. Franz Köhler Chemie GmbH | 31268.00.00 | Konservierungslösung |
| Heparin-Natrium | Ratiopharm | 5394.02.00 | 500 IU vor graft Perfusion |
| 8,4% Natriumbicarbonat | Fresenius Kabi | 4399.97.99 | 0,5 ml nach Reperfusion |
| 5% Glucose-Lösung | B. Braun | 6714567.06.00 | 1,0 ml nach Reperfusion |
| Cefuroxim Natrium- | Fresenius Kabi | 38985.01.00 | Antibiotikum, 16 mg / kg |
| Buprenorphin | Essex Pharma | 997.00.00 | Schmerzmittel, 0,1 mg / kg |
| Intensive Care Unit Cage | Brinsea Products Ltd | Vetario S10 | Postoperative Pflege |
Referenzen
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C., Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080 (1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten