Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In ovo Elektroporation von miRNA-basierte Plasmide in der Entwicklung von Neuralrohr und Beurteilung der Phänotypen von DiI Injection in Open-book Vorbereitungen
In diesem Artikel
Zusammenfassung
Ein Verfahren, durch welches die Genexpression in der Neuralrohr sein herunterreguliert kann in einem Zelltyp-spezifische, nachvollziehbar beschrieben. Wir zeigen, wie In ovo Elektroporation von microRNA-basierte Plasmide, raumzeitlich kontrollierten RNA-Interferenz auslösen kann verwendet werden, um commissural Axon Führung in der Entwicklung von Neuralrohrdefekten zu untersuchen.
Zusammenfassung
Kommissuralen dI1 Neuronen wurden ausführlich untersucht, um die zugrunde liegenden Mechanismen Axon Führung während der Entwicklung 1,2 aufzuklären. Diese Neuronen sind im dorsalen Rückenmark und schicken ihre Axone entlang stereotype Bahnen. Kommissuralen Axone zunächst ventral projizieren Richtung und dann über der Bodenplatte. Nach dem Überqueren der Mittellinie, machen diese Axone eine scharfe rostral Turn und Projekt längs zum Gehirn. Jeder dieser Schritte wird durch die koordinierte Tätigkeit der anziehenden und abstoßenden Signalmoleküle reguliert. Die richtige Interpretation dieser Signale ist entscheidend für die Führung von Axonen entlang ihrer abgegrenzten Weg. Somit wird die physiologische Beitrag eines bestimmten Moleküls zu kommissuralen Axon Führung idealerweise im Rahmen des lebenden Embryo untersucht. Dementsprechend müssen Gen knockdown in vivo exakt gesteuert werden, um sorgfältig zu unterscheiden Axon Führung Aktivitäten von Genen, die spielen möglicherweise mehrereRollen während der Entwicklung.
Hier beschreiben wir ein Verfahren zur Knockdown Genexpression im Huhn Neuralrohr in einem Zelltyp-spezifische, nachvollziehbar. Wir verwenden neuartige Plasmidvektoren 3 beherbergen zelltypspezifischen Promotoren / Enhancer, die die Expression eines Fluoreszenzprotein-Marker anzutreiben, direkt gefolgt von einer miR30-RNAi-Transkript 4 (die sich in dem 3'-UTR von der cDNA, die das fluoreszierende Protein) ( Abbildung 1). Wenn in den Entwicklungsbehälter Neuralrohr elektroporiert, hervorzurufen diese Vektoren effiziente Herunterregulation der Genexpression und exprimieren hell fluoreszierenden Marker Proteine ermöglichen die direkte Verfolgung der Zellen erleben Knockdown 3. Mischen verschiedener RNAi-Vektoren vor der Elektroporation erlaubt die gleichzeitige Knockdown von zwei oder mehreren Genen in unabhängigen Bereichen des Rückenmarks. Dies erlaubt komplexen zellulären und molekularen Wechselwirkungen während der Entwicklung untersucht werden, in einer Weise, die schnell, sUmsetzung, präzise und kostengünstig. In Kombination mit DiI Tracing von commissural Axon Trajektorien in Open-book-Präparate 5, ist diese Methode ein nützliches Werkzeug für die in-vivo-Studien der zellulären und molekularen Mechanismen der commissural Axonwachstum und Führung. Im Prinzip könnte jede Promotor / Enhancer verwendet werden, möglicherweise macht die Technik breiter anwendbar für in vivo Studien der Genfunktion während der Entwicklung 6.
Dieses Video zeigt, wie zu handhaben und Fenster Eier, die Injektion von DNA-Plasmiden in das Neuralrohr und die Elektroporation Verfahren. Um commissural Axon Führung zu untersuchen, wird das Rückenmark aus dem Embryo als Open-book-Präparation entfernt, fixiert und injiziert mit DiI zu ermöglichen Axon Wege zu verfolgen. Das Rückenmark wird zwischen Deckgläsern montiert und visualisiert mit Hilfe der konfokalen Mikroskopie.
Protokoll
Ein. Vorbereitung der RNAi Plasmid-DNA für Zelltyp-spezifische Gene Silencing
Plasmide (Abbildung 1) synthetisiert werden unter Verwendung von Standard molekulare Klonierungstechniken, wie zuvor im Detail beschrieben 3,4.
1,1 Klonierung in den Vektoren: oligonucelotide Design
- Wir verwenden die gleichen universellen Oligonukleotide und Klonen Protokolle, die in der Produktinformation mit dem pRFPRNAiC vector 4 (ARK-Genomics), die beschrieben werden.
- Für die Klonierung in den ersten Haarnadel site:
5 'Primer HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
3 'Primer HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - Für die Klonierung in den zweiten Haarnadel site:
5 'Primer HP2:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
3 'Primer HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- Für die Klonierung in den ersten Haarnadel site:
- Wir verwenden Genscript die siRNA Ziel Finder Gen-spezifischen Zielsequenzen wählen: https://www.genscript.com/ssl-bin/app/rnai .
- Primer zur Klonierung eines genspezifischen miRNA in die erste Haarnadel site:
Ein Beispiel für Silencing GFP ist unten gezeigt.
Zielsequenz (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP Vorwärts HP1 = 59mer 
GFP umgekehrt HP1 = 58mer 
Es gibt eine gemeinsame Sequenzen in diesen Oligos dass ein Teil der miRNA flankierenden Sequenzen (Huhn-spezifisch) und gemeinsamen Schleife / Stammsequenzen (aus menschlichen miRNA30) zu bilden. Die genspezifischen Zielsequenzen sind unterstrichen. Beachten Sie, dass es amIsMatch am 5'Basis des Vorlauftrum (fettgedruckt dargestellt; G → A in diesem Beispiel), um die natürliche Fehlpaarung in miRNA30 an dieser Position zu imitieren.
- Primer zur Klonierung eines genspezifischen miRNA in die zweite Haarnadel site:
Ein Beispiel für Silencing LacZ ist unten gezeigt.
Zielsequenz (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ Vorwärts HP2: 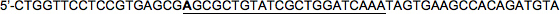
LacZ umgekehrt HP2: 
Beachten Sie, dass wiederum der 5'-Base der Zielsequenz in der Vorlauftrum geändert wurde (fettgedruckt, C → A in diesem Beispiel), so dass es die Antisense-Sequenz Fehlpaarungen, imitiert miRNA30.
1,2 PCR Reaktion und Subklonierung
- Die genspezifischen Oligos sind unsed zusammen mit den universellen Oligos in einer PCR-Reaktion, um die miRNA30 Haarnadel-ähnlichen mit Huhn erzeugen miRNA flankierende Sequenzen.
| Klonierung in ersten Haarnadelkurve Website: 1 ul - 10 ng GFP Vorwärtsprimer HP1 1 ul - 100 ng 5 'Primer HP1 1 ul - 100 ng 3 'Primer HP1 1 ul dNTPs (10 mM) 5 ul 10x Pfu Reaktionspuffer 1 ul Pfu DNA-Polymerase (Promega) 39 ul PCR-Grade Wasser | OR | Klonierung in zweiter hairpin Website: 1 ul - 10 ng LacZ Vorwärtsprimer HP2 1 ul - 100 ng 5 'Primer HP2 1 ul - 100 ng 3 'Primer HP2 1 ul dNTPs (10 mM) 5 ul 10x Pfu Reaktionspuffer 1 ul Pfu DNA-Polymerase (Promega) 39 ul PCR-Grade Wasser |
Zyklen:
| 94 ° C | 94 ° C | 55 ° C | 72 ° C | 72 ° C | 4 ° C |
| 1 min | 30 sec | 30 sec | 1 min | 9 min | halten |
| 30 Zyklen | |||||
- Das PCR-Produkt zu reinigen, mit Restriktionsenzymen verdaut und in den Vektor Subklon:
- Ersten Haarnadelkurve Website: Verwendung NheI und MluI
- Zweiten Haarnadel Website: Verwendung MluI und SphI
- Folgen Sie Standard-Techniken zur Transformation von kompetenten Bakterienzellen. Platte Zellen auf LB-Agar (enthaltend Ampicillin) und Ernte DNA vom Plasmid midipreparation (zB Nucleobond Xtra Midi Kit, Machery-Nagel).
- Suspend konzentrierten Plasmid-DNAin sterile ddH 2 0, messen die Konzentration spektrophotometrisch und bei -20 ° C.
1,3 Sequencing miRNA-Plasmiden
Unter normalen Bedingungen die Sequenzierungsreaktion scheitert oft an starken sekundären Struktur der Haarnadeln. Um diese 7 zu verbessern:
- Führen Sequenzierungsreaktion in 10 mM Tris-Cl mit 0,01 mM EDTA (pH 8,0) statt Wasser. Dies erhöht Umwandlung von supercoiled DNA an ssDNA, die besser geeignet für die Sequenzierung ist.
- Hinzufügen eines Hitzedenaturierungsschritt (98 ° C, 5 min) vor der Sequenzierung. Dieser wandelt superspiralisierten Plasmid-DNA an ssDNA.
2. Elektroporation
2,1 Egg Handling
- Legen Sie die Eier in einen Inkubator Satz auf 38,5 ° C und ~ 45% Luftfeuchtigkeit.
- Inkubieren Sie die Eier, bis die Embryonen die gewünschte Stufe der Entwicklung erreicht haben. Um Axon Führung commissural Neuronen zu untersuchen, typicall wiry elektroporieren Embryonen, wenn sie Hamburger & Hamilton (HH) Stufe 17-18 (nach ca. 3 Tagen Inkubation) 8 erreicht haben. Allerdings müssen Injektion und Elektroporation machen, bevor das Protein von Interesse angesammelt hat, um Knockdown effizient.
- Entfernen der Eier aus dem Inkubator und sie in eine stabile horizontale Lage für 20 min, um den Embryo auf der Oberseite des Eigelbs an der oberen Seite des Eis zu repositionieren. Bringen Sie die Eier in den Inkubator in diesem Zeitraum.
2.2 Herstellung von Reagenzien und Ausrüstung
- Bereiten Sie phosphatgepufferte Kochsalzlösung (PBS) und sterilisieren durch Autoklavieren oder die Lösung durch ein 0,2 um Filter.
- Make Glasmikropipetten durch Ziehen Kapillaren (World Precision Instruments 1B120F-4, 1,2 / 0,68 OD / ID (mm)) in einer geeigneten Zugvorrichtung (zB Narishige PC-10). Brechen Sie die Spitze einer Mikropipette, um einen Spitzendurchmesser von ~ 5 um zu erhalten und verbinden Sie es mit einem Stück Schlauch mitdie entsprechenden Durchmesser.
- Montage der Platinelektroden (0,5 cm lang) fest in einer tragbaren Rahmen, mit einem Abstand zwischen den Elektroden von 0,5 cm. Verbinden Sie die Elektroden mit einem Rechteckimpuls Generator (BTX ECM 830).
- Stellen Sie den Impulsgeber mit den folgenden Parametern:
- Für einseitige Elektroporation: Spannung: 25 V, Anzahl der Impulse: 5, Länge der Impuls: 50 ms, Zwischenpulsintervall: 1 sec
- Für bilaterale Elektroporation: Spannung: 18 V, Anzahl der Impulse: 5, Länge Impuls: 50 ms, Zwischenpulsintervall: 1 sec
- Bereiten Sie eine Spritze mit 18 G Nadel, ein Skalpell, ein spritz Flasche 70% Ethanol und Band.
- Schmelzen Paraffinwachs in einem Becherglas auf einer Heizplatte bei 80 ° C
2,3 Windowing
- Wischen Sie die Eier mit einem Gewebe in 70% Ethanol getränkt.
- Einen Streifen von Klebeband entlang der langen Achse des Eis.
- Machen Sie zwei kleine Löcher in der Eierschale mit einem Skalpell, ein amdas stumpfe Ende des Eis und das andere an der Ecke des zu gefenstert werden.
- Unter Verwendung einer Spritze entfernen ca. 3 ml von Eiklar und jedes Ei durch Einsetzen der Nadel unter einem Winkel von 45 ° in das Loch am stumpfen Ende des Eis. Vorsichtig zu beschädigen das Eigelb.
- Schneiden Sie ein Fenster in der Eierschale mit einer kleinen Schere, horizontal, um eine Beschädigung des Embryos statt. Falls erforderlich, kann die Position des Embryos stammen und markiert mit einem Bleistift, indem ein starkes Licht gegen das stumpfe Ende des Eies. Ein Fenster von 1,5 bis 2 cm im Quadrat ist nützlich für die meisten Anwendungen.
- Dichten Sie das Loch am stumpfen Ende des Eies und Risse in der Eierschale mit geschmolzenem Paraffin, mit einem Pinsel aufgetragen.
- Verschließen Sie die Fenster mit transparentem Klebeband (zB Scotch Magic).
- Bringen Sie das Ei in den Inkubator.
2,4 Elektroporation
- Bereiten sterile Instrumente und wischen Sie den Arbeitsbereich mit 70% Ethanol.
- Bereiten Sie die injection Lösung. Die geeignete DNA-Konzentration durch den Benutzer bestimmt werden und wird nach dem Enhancer / Promotor zur Expression voranzutreiben variieren. Als Anhaltspunkt, wir verwenden in der Regel 0,2-2,0 ug / ul (siehe Diskussion). In insgesamt 20 ul, sollte die Injektion Mischung enthalten:
| RNAi-Plasmid-DNA (in H 2 0) | X ul |
| 20x PBS | 1 ul |
| 0,4% Trypanblau | 2 ul |
| sterile ddH 2 0, bis zu einem Endvolumen von | 20 ul |
Verwenden Sie sanfte Saugwirkung, um die DNA-Mischung in das Glas auf den Schlauch befestigt Mikrokapillare laden.
- Entfernen Sie das Klebeband von der windowed Ei und inszenieren den Embryo nach Hamburger und Hamilton 8.
- Verwenden einer Pinzette und Feder Schere sorgfältig entfernen extraembryonic Membranen aus der kaudalen Hälfte des Embryos. Die Membranen können leicht angehoben werden vom Embryo in dem Bereich, wo die große rechte und linke Dottervenen den Stamm Kraft. Gently reißen oder schneiden die Membranen und ziehen Sie sie auf den Schwanz. Bei Bedarf kann der Embryo besser visualisiert werden durch Injizieren einer Lösung von Tusche oder Fast Green zwischen Keimscheibe und Eigelb als in einem Videosignal durch Boulland und Kollegen 9 gezeigt.
- Spritzen Sie die DNA-Lösung in den zentralen Kanal des Neuralrohrs, knapp oberhalb der Hinterbeine. Kontrollieren Sie das Injektionsvolumen durch den Mund. Der blaue Farbstoff sollte aus der Schwanzspitze bis zum Ventrikel des sich entwickelnden Gehirns ausbreiten.
- Fügen Sie ein paar Tropfen steriler PBS auf der Oberseite des Embryos.
- Die Elektroden parallel zur Anterior-Posterior-Achse des Embryos. Berühren Sie den Embryo oder Blutgefäße.
- Halten Sie die Elektroden stetig und elektroporieren.
- Entfernen Sie vorsichtig die Elektroden und spülen Sie sie mitsteriles Wasser denaturierten Proteine aus dem Eiweiß entfernen.
- Für bilaterale Elektroporation, die Polarität der Elektroden, die Position der Elektroden parallel zu den Embryo und wiederholen Sie die Elektroporation. Nach Spülung der Elektroden in sterilem Wasser.
- Lassen Sie etwas mehr sterile PBS auf den Embryo. Verschließen Sie das Ei mit Klebeband und senden Sie es an den Inkubator, bis die gewünschte Entwicklungsstadium erreicht ist. Einwandfreie Abdichtung ist entscheidend, Dehydratisierung des Embryos zu vermeiden.
3. Spinal Cord Vorbereitungen
3,1 Dissection von Embryonen
- Am HH25-26 (Tag 5 der Inkubation), entfernen Sie den Embryo aus dem Ei mit einer Pinzette oder einer kleinen Löffel. Legen Sie sie in PBS in einer Petrischale mit Silikon (Sylgard Elastomer) beschichtet.
- Entfernen Sie die extraembryonalen Membranen und legte den Embryo auf dem Rücken. Stabilisierung auf der Platte durch Pinning es durch den Hals und Schwanz (mit 0,20 mm Insektennadeln) unter leichtem stretching.
- Whole Embryonen (zum Schneiden höher) kann hier fixierbar ist, durch Ersetzen der PBS mit 4% Paraformaldehyd (PFA) und Inkubation für 1 Std. bei Raumtemperatur. Um Open-book-Vorbereitungen zu treffen, weiterhin das Protokoll mit fixierten Gewebe wie unten beschrieben.
3,2 Isolierung von Rückenmark von Embryonen
- Merken die Glieder, so dass die Stifte in einem Winkel weg von der Embryo eingeführt werden, so dass sie nicht mit der Dissektion nicht stören. Der Embryo ist von unten zu ermöglichen, um Gewebedichte in den folgenden Schritten wahrgenommen werden beleuchtet.
- Entfernen Sie das Herz und die inneren Organe durch Federkraft Schere und leichtem Schaben mit einer Pinzette. Die segmentierte Wirbel und Rückenmark sollten sichtbar sein, wenn alle Organe vollständig entfernt wurden.
- Mit Feder Schere, einen seichten Schnitt durch den Wirbeln, die über das Rückenmark am Hals. Drehen Sie den Embryo 180 ° und machen zwei kurzeLängsschnitte durch den Wirbeln auf beiden Seiten des Rückenmarks, vom Hals in Richtung des Schwanzes. Pinzette einsetzen, um die Klappe von Wirbeln auswärts aus dem Rückenmark und schälen dem Gewebe (enthaltend alle Wirbel) in einem einzigen Streifen in Richtung der Ladebordwand.
- Sanft dehnen und wieder die Fixierung des Embryos durch die Schwanz und Gliedmaßen.
- Verwenden Sie ein feines mikrochirurgischen Skalpells (zB Grieshaber 68.101) oder eine Wolframnadel weggeschnitten die Hirnhäute, die über das Rückenmark. Sucht einem dunklen, dichten Leitung von Gewebe zwischen dem Rohr und dem neuronalen Spinalganglien. Einstellen der Beleuchtungswinkel, falls notwendig. Sanft Längsschneiden entlang dieser Linie zu beiden Seiten des Rückenmarks, vom Hals bis zum Schwanz. Die Hirnhäute sollte aus dem Rückenmark durch die sanfte Dehnung der gepinnten Embryos zu trennen.
- Schnitt durch das Rückenmark auf Höhe des Flügels Knospe und kaudal der Gliedmaßenknospe, und heben Sie die ganze Wirbelsäule aus dem Embryo in einem glatten rostral nach kaudal Bewegung, mit einer Pinzette. Die isolierte Rückenmarks sollte eingetaucht gehalten in PBS bei diesem Schritt werden. Heben Sie ihn nicht aus der Schale.
3,3 Fixation von Open-Bücher
- Verbreiten Sie die isolierten Rückenmark auf einem Spatel und überträgt es auf einen neuen Silikon-lined Petrischale mit 4% Paraformaldehyd in PBS.
- Produzieren einer flachen Halterung Herstellung durch vorsichtiges Pinning das Rückenmark in sechs Positionen (rostral, medial und kaudal auf jeder Seite, mit 0,10 mm Insektennadeln). Wir bezeichnen jedes Präparates von einem kleinen "flag", das nicht nur identifiziert den Embryo, sondern zeigt auch das vordere Ende des offenen Buches-Zubereitung.
- Inkubieren bei Raumtemperatur für 30 min bis 1 Stunde. Open-Pfund sollten nicht über-festgesetzt werden, dies reduziert die Effizienz der DiI Diffusion 10 und erhöht Hintergrund.
- Vorsichtig abgießen 4% PFA und ersetzen Sie es mit PBS. Halten Sie die Gerichte bei 4 ° C bis zum mit DiI oder mount injizieren.
- Beachten Sie die Open-Bücher unter Fluoreszenz miscroscopy und wählen Sie die entsprechende Seite des Open-book mit DiI injizieren.
- Bereiten Schnelle DiI (5 mg / ml in Ethanol) und ziehen Sie die Lösung in ein Glas Mikropipette an Kunststoffrohr. Brechen Sie das Ende der Mikropipette so fein wie möglich, einen sehr kleinen Durchmesser Spitze erhalten. Legen Sie die Nadel in eine Schüssel mit PBS und überprüfen, dass die DiI nicht von der Nadel austreten. Wenn die DiI Lecks, ist die Nadel Durchmesser zu groß. In diesem Fall, bereiten eine neue Nadel.
- Beleuchten die Open-book-Präparate von unten. Sucht einem dichteren Längsstreifen von Gewebe, etwa 1/5 der Breite eines hemibook vom seitlichen Rand der Zubereitung liegt. Dies entspricht den Zellkörper der commissural Neuronen, die fand nur ventral Dachblech sind. Beginnend an einem Ende des Open-book, legen Sie das Glas Nadel in das Gewebe und die Nadel is abgezogen, in einer kleinen Menge von DiI Verwendung eines Mund Pipette aufblähen.
- Arbeiten Sie schnell, was mehrere Injektionen entlang der Länge der Open-book in regelmäßigen Abständen von etwa 0,5 mm. Wenn die Nadel verstopft, deaktivieren Sie es sorgfältig mit einer Pinzette. Wenn die Spitze zu groß (und DiI Lecks), ersetzen Sie die Nadel.
- Wenn Sie jeden offenen Buch fertig, verwenden Sie eine Pipette zum Absaugen und entsorgen überschüssiges, sickerte DiI. Wenn dies nicht in hohen Hintergrund führen.
- Lassen Sie die Vorbereitungen für etwa drei Tage bei 4 ° C, damit der DiI entlang der Axone zu verbreiten.
3.5 Montage für die Bildgebung
- Eine Spritze mit einer 18 G-Nadel, um eine dünne, ununterbrochenen Rand Vakuumfett (z. B. Dow Corning # 976V) um die Ränder eines 24 mm x 24 mm Deckglas ausgebreitet. Fügen Sie einige Tropfen sterile PBS zum Brunnen. Beachten Sie, dass Eindeckmedium enthaltend Glycerin mit n-Propylgallat nicht zusammenarbeiten kann seinmpatible mit DiI 11. Ähnlich kann Vakuumfett niederviskos mit dem PBS und führen zu hohen Hintergrund mischen.
- Entfernen Sie die Stifte aus der Open-Buch und übertragen sie in die PBS Tropfen. Tauchen Sie den Open-book und positionieren Sie es in der Mitte des Brunnens.
- Sanft legen Sie ein weiteres 24 mm x 24 mm Deckglas auf, so dass die Open-book bleibt offen. Falls erforderlich, kann das Deckglas entfernt werden, und der offene-Book repositioniert. Presse sanft an den Rändern der Zubereitung um eine vollständige Abdichtung von Fett zu schaffen. Excess PBS werden während diesem Schritt gequetscht werden. Luftblasen vermeiden.
- Halten Sie die Vorbereitungen im Dunkeln bei 4 ° C bis zur Inspektion bereit und Dokumentation durch Fluoreszenz-Mikroskopie. Dies sollte zügig durchgeführt werden (innerhalb einer Woche), um sicherzustellen, dass die Vorbereitungen nicht austrocknen.
4. Repräsentative Ergebnisse
Elektroporation und Expression von Plasmiden
Unter demvorstehend beschriebenen Bedingungen sollte fluoreszierendes Protein eindeutig nachweisbare im entsprechenden Zelltyp ohne die Notwendigkeit für eine zusätzliche Verstärkung des Signals durch Antikörpermarkierung. Das fluoreszierende Protein sollte nur in der gewünschten Zelltyp / s nachweisbar. Repräsentative Beispiele für Open-book Zubereitungen und Querschnitte von Embryonen mit den verschiedenen Plasmiden elektroporiert werden in Abbildung 2 dargestellt.
Effizienz der künstlichen miRNAs
Künstliche miRNAs gegen ein neues Gen von Interesse muss zunächst für die Effizienz und Spezifität ihrer knockdown Effekte untersucht werden. Wir finden, dass β-Aktin-Promotor-driven Konstrukte, bei 0,25 ug / ul elektroporiert, geeignet für diese 3 sind. Knockdown in vivo kann durch Immunhistochemie oder in situ Hybridisierung getestet werden.
DiI Kennzeichnung
Entsprechend gezielte DiI Injektionen in Wildtyp Embryonensollte mehr als 80% der Injektionsstelle bei ideal, archetypische Bahnen 3 ergibt, wie in Abbildung 3 dargestellt. Tier zu Tier Variabilität sollte niedrig sein.
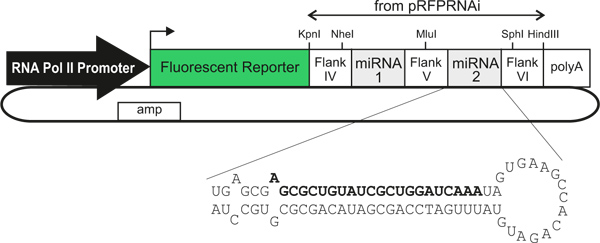
Abbildung 1. Generalized schematische der miRNA-exprimierenden Plasmidvektoren. Die Verwendung von verschiedenen RNA-Polymerase II-Promotoren / Enhancern ermöglicht Zelltyp-spezifische Expression. Die transfizierten Zellen können durch den Ausdruck eines fluoreszierenden Reporter, der direkt verbunden ist (innerhalb eines einzigen Transkript), ein oder zwei künstliche miRNAs, die niederzuschlagen Genexpression. Fett gedruckten Text gibt den Sense-Strang eines künstlichen miRNA gegen LacZ, wie im Text beschrieben.
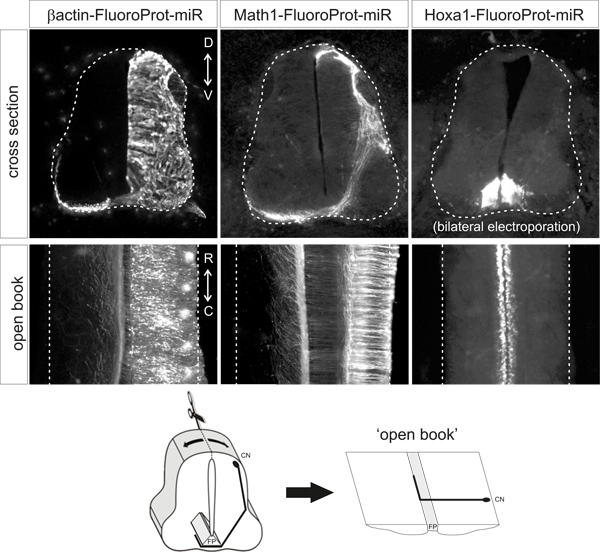
Abbildung 2. Repräsentative Beispiele of fluoreszierendes Protein Expressionsmuster erhalten nach der Elektroporation der angegebenen Plasmidvektoren. Querschnitte und offene Bücher sind von HH25-26 Hühnerembryonen, die bei HH18 elektroporiert wurden. β-Aktin-Promotor die ubiquitäre Expression treibt Math1 Enhancer die Expression in Neuronen und dI1 HOXA1 Enhancer antreibt Expression spezifisch in der Bodenplatte. CN, commissural Neurons; FP, Bodenplatte.
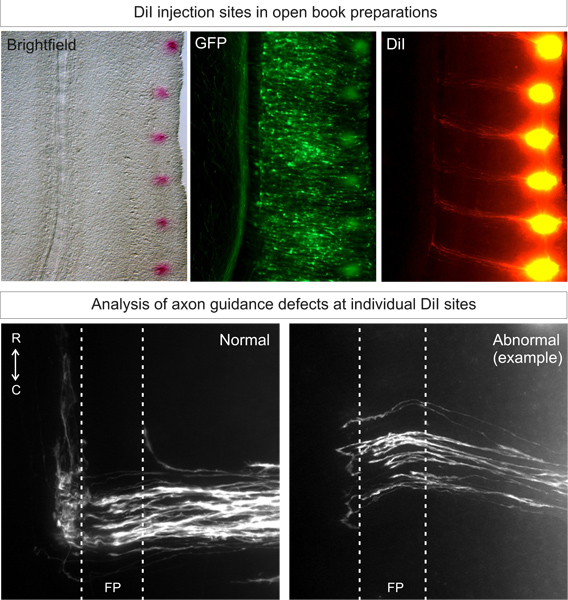
Abbildung 3. Anwendung und Analyse der DiI Injektionsstellen in offenes Buch Vorbereitungen. DiI sollte in einem punktförmigen Muster injiziert werden kann, nahe dem seitlichen Rand des offenen Buches auf dem elektroporierten Seite (identifiziert durch fluoreszierendes Protein Expression). Nach 3 Tagen der Diffusion, sollte kommissuralen Axon Trajektorien sein zu können unter Fluoreszenzmikroskopie sichtbar gemacht. Normale Axon Bahnen wird auf den Boden p wachsenEnde, überqueren Sie die Bodenplatte und dann wachsen und rostral. Abnormal Phänotypen aus Gen-knock down kann auf diese archetypischen Trajektorie verglichen werden. In dem Beispiel, machen einige Axone Stall in der Bodenplatte oder fehlerhafte Drehen Entscheidungen auf der Gegenseite.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese einfache, vektorbasierten künstlichen miRNA Expressionsstrategie kann Knockdown endogenen Genexpression in dem Neuralrohr Huhn verwendet werden. Diese funktionale Tools bieten mehrere Gen-Silencing, zeitliche Steuerung und Zelltyp-Spezifität, die Aufklärung komplexer Entwicklungsverläufe zu erleichtern. Insbesondere haben wir die Brauchbarkeit dieser Plasmide in kommissuralen Axon Führung gezeigt, da die Plasmide können zur Knockdown verschiedenen Genen in kommissuralen Neuronen oder in ihren Zwischenziel, d...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Arbeit im Labor von ES wird durch die Swiss National Science Foundation unterstützt. Wir danken Herrn Dr. Beat Kunz für die Unterstützung bei Dreharbeiten zu danken.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Namen Reagenz | Firma | Katalog-Nummer | |
| 0,5 mm Glaskapillaren | World Precision Instruments | 1B120F-4 | |
| Glasnadel puller | Narishige | PC-10 | |
| Electroporator | BTX | ECM 830 | |
| Sylgard Silikonelastomer | World Precision Instruments | SYLG184 | |
| Wolframdraht, 0,075 mm | World Precision Instruments | TGW0325 | |
| Insect Pins, 0,20 mm | Fine Science Tools | 26002-20 | |
| Insect Pins, 0,10 mm | Fine Science Tools | 26002-10 | |
| Frühling Schere | Fine Science Umols | 15003-08 | |
| Dumont Nr. 5 Zangen | Fine Science Tools | 11252-20 | |
| Dumont Nr. 55 Pinzette | Fine Science Tools | 11255-20 | |
| Schnelle DiI | Molecular Probes | D-7756 | |
| Fluoreszenzmikroskopen | Olymp | SZX12, BX51 |
Referenzen
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21(2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133(2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071(2010).
- Kim, B. G., Dai, H. -N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. ene Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten