Method Article
Gleichzeitige Ganzzellableitungen von Photorezeptoren und Neuronen zweiter Ordnung in eine Amphibie Retinal Scheibe Vorbereitung
In diesem Artikel
Zusammenfassung
Wir beschreiben die Herstellung von dünnen Scheiben von retinalen Wasserorganismen Tiger Salamander ( Ambystoma tigrinum) Und erklären, wie wir diese verwenden Scheiben zu synaptischen Verarbeitung in der Netzhaut durch Einholung Dual whole-cell voltage clamp Aufnahmen von Photorezeptoren und zweiter Ordnung horizontalen und bipolaren Zellen zu studieren.
Zusammenfassung
Eine der zentralen Aufgaben in der Netzhaut Neurowissenschaften ist, um die Schaltung von retinalen Neuronen und wie diese Verbindungen sind verantwortlich für die Gestaltung der Signale an das Gehirn zu verstehen. Photonen werden in der Netzhaut von Stäbchen und Zapfen Fotorezeptoren, die diese Energie in ein elektrisches Signal, übertragen auf andere retinalen Neuronen, wo sie verarbeitet und übermittelt zentrale Vorgaben im Gehirn über den Sehnerv detektiert. Bedeutende frühe Einblicke in retinalen Schaltung und visuelle Verarbeitung kamen aus den histologischen Untersuchungen Cajal 1,2 und später von elektrophysiologischen Ableitungen der Spick Aktivität von retinalen Ganglienzellen - der Ausgang Zellen der Retina 3,4.
Ein detailliertes Verständnis der visuellen Verarbeitung in der Netzhaut ein Verständnis der Signalisierung bei jedem Schritt in dem Weg von dem Fotorezeptor zu retinalen Ganglienzellen. Allerdings sind viele Zelltypen Netzhaut BohrerIED tief im Gewebe und damit relativ unzugänglich für elektrophysiologische Aufnahmen. Diese Begrenzung kann durch Bearbeitung mit vertikalen Scheiben, bei dem Zellen, die sich innerhalb jeder der retinalen Schichten sind deutlich sichtbar und zugänglich für elektrophysiologische Aufnahmen überwunden werden.
Hier beschreiben wir ein Verfahren zur Herstellung von vertikalen Abschnitten Netzhaut von Larven Tiger Salamander (Ambystoma tigrinum). Während dieses Präparat wurde ursprünglich für Aufnahmen mit scharfen Mikroelektroden 5,6 entwickelt, beschreiben wir ein Verfahren für Dual Ganzzell-Voltage-Clamp-Aufnahmen von Photorezeptoren und zweiter Ordnung horizontalen und bipolaren Zellen, in denen wir manipulieren Photorezeptors Membranpotential während gleichzeitig die Aufnahme nach synaptischen Antworten in horizontaler oder bipolaren Zellen. Die Photorezeptoren des Tigers Salamander sind wesentlich größer als die von Säugetieren, so dass dies eine ideale Vorbereitung, in dem t verpflichtenseine technisch anspruchsvollen experimentellen Ansatz. Eine spezialisierte synaptische Struktur in einer nur einer Handvoll von Neuronen, einschließlich lichtempfindlichen Zäpfchen und Stäbchen, die gut für die Aufrechterhaltung einer hohen Rate von Tonic Neurotransmitterfreisetzung 7 geeignet ist gefunden - Diese Experimente werden mit einem Auge in Richtung Sondierung der Signalisierung Eigenschaften des synaptischen Bandes beschrieben , 8 - und wie es zu den einzigartigen Eigenschaften Signalisierung dieser ersten retinale Synapse.
Protokoll
1. Retinal Slices Vorbereitung
- Montieren Sie die Kammer (Design in Abbildung 1 dargestellt). Platz zwei Perlen aus Vakuumfett, Abstand ~ 8-10 mm auseinander, über die Aufnahme Kammer um einen Kanal für Superfusat bilden und in denen die Netzhaut Scheiben einzubetten. Fügen Sie eine zweite Wulst von Fett ein paar Millimeter weiter draußen jenseits jeder dieser beiden Perlen von Fett als Damm und Spillover-Grenze handeln. Setzen Sie einen kleinen dreieckigen Stück Kimwipe am Ende der Kammer, um Flüssigkeit Kontakt mit der Referenz-Elektrode zu gewährleisten.
- Drücken Sie ein Stück Nitrozellulosemembran (~ 5 x 10 mm; 0,8 um Poren) flach auf dem Objektträger in zwei kleine Perlen aus Vakuumfett. Vermeiden Sie Fett direkt unter dem Zentrum der Nitrocellulosemembran, da dies die Netzhaut anhaften können.
- Um das Gewebe Schneidemaschine vorzubereiten, brechen sie ein Double Edge Rasierklinge in 4 Stücke und bringen einen zum Schneiden Arm. Schneiden Sie eine dünne Scheibe nitrocellulOse Membran, um sicherzustellen, daß die Schneidkante der Rasierklinge flach liegt gegen die Aufnahmekammer und schneidet daher sauber durch die Nitrocellulosemembran.
- Halten Sie ein kleines Becherglas von Amphibien Salzlösung (Tabelle 1) auf Eis bei der Präparation entfernt.
- Euthanize Salamander durch Enthauptung. Hemisect den Kopf sagittal und Mark durch das Rückenmark. Die Hälfte des Kopfes auf einem Stück Baumwolle befeuchtet mit Amphibien Kochsalzlösung auf einem Linoleum-Block. Die andere Hälfte des Kopfes kann mit einem feuchten Papiertuch gewickelt werden und bei 4 ° C für die spätere Verwendung in den Tag.
- Enucleate das Auge. Mit kleinen Vannas Schere, schneiden Sie die Haut verbindet den Blick auf die umliegenden Umlaufbahn. Nach der Befreiung der vor dem Auge aus dem umgebenden Gewebe Orbital, ziehen das Auge nach vorne und schieben Sie die Schere unter dem Auge, um durch die Augenmuskeln und Sehnerv geschnitten, befreien das Auge von der Umlaufbahn.
- Legen Sie die entkernte Auge auf einem Bett aus Baumwolle auf derLinoleum Block. Entsorgen Sie den halben Kopf. Überschüssiges Augenhöhlenfett von der Rückseite des Auges.
- Machen Sie einen kleinen Schnitt in der Mitte der Hornhaut mit einem scharfen Skalpell. Entfernen Sie die Hornhaut, indem feine Vannas Schere in den Einschnitt und sich den Schnitt radial in Richtung der ora serrata. Schneiden am Umfang um den ora serrata durch Drehen des Linoleum Block oder die Baumwolle zwischen den Schnitten.
- Nach dem Schneiden den ganzen Weg um das Auge, entfernen Sie die Hornhaut und Linse, indem sie aus der Seite der Augenmuschel. Bewegen Sie den resultierenden Augenmuschel auf eine harte Oberfläche des Linoleum Block angefeuchtet mit Amphibien Kochsalzlösung. Schneiden Sie es in Drittel mit einer scharfen Rasierklinge, mit einer feinen Säge Bewegung, um sicherzustellen, dass Sie alle den Weg durch die Lederhaut geschnitten.
- Legen Sie ein oder zwei Stücke von Augenmuschel auf der Nitrozellulosemembran mit dem Retina-Oberfläche nach unten zeigt. Tauchen Sie die restlichen Stücke mit zusätzlichen Kochsalzlösung und legen Sie sie im Kühlschrank bei 4 ° C ~
- Gently drücken das Stück Augenmuschel gegen die Nitrozellulosemembran mit feinen Pinzette. Tauchen Sie die Nitrocellulosemembran und Augenmuschel Stück mit einigen Tropfen kalten Kochsalzlösung und Amphibien Blot an den Rändern mit Kimwipe um die Netzhaut zu halten. Erneut tauchen die Augenmuschel und Nitrozellulosemembran mit einigen Tropfen kalt Amphibien Kochsalzlösung und abziehen der Lederhaut / Aderhaut / Netzhautpigmentepithel um die Netzhaut zu isolieren (die rosa erscheinen können aufgrund des Vorhandenseins von rohen Rhodopsin). Falls erforderlich, den Sehnerv, die Netzhaut zu befreien.
- Wenn die Netzhaut nicht eingehalten hat dicht, abfließen die Kochsalzlösung mit einem Kimwipe um die Netzhaut stärker nach unten ziehen auf die Nitrozellulosemembran. Ersetzen Sie die Kochsalzlösung. Wiederholen, falls erforderlich.
- Füllen Sie die Kammer mit kaltem Amphibien Kochsalzlösung und überträgt es auf der Bühne des Gewebes Schneidemaschine. Schneiden Sie die Netzhaut und Nitrozellulosemembran in dünne Streifen, die Arbeit von einem Ende zum anderen durch Drehen des Noniusmikrometerin 125 Schritten um. Drücken Sie die Rasierklinge sanft, aber bestimmt durch die Netzhaut und Nitrozellulosemembran.
- Übertragen Sie die Netzhaut Scheiben, indem Streifen Nitrozellulosemembran zum Hauptkanal der Aufnahme Kammer. Heben Sie einen Streifen von Membran frei und dann halten Sie es fest, während sie sich die Kammer darunter, dass auf jeden Fall halten die Scheiben unter Wasser. Integrieren Sie die Kanten der Nitrozellulosemembran in den Streifen von Vakuumfett, dreht sie um 90 Grad nach Netzhautschichten anzuzeigen.
- Drücken Sie die Nitrozellulosemembran flach an der Glasoberfläche. Auch wenn es nicht auf jedem Stück Netzhaut, Ort Streifen Nitrozellulosemembran in regelmäßigen Abständen (ca. 1 mm Abstand) entlang der gesamten Länge der Perfusion Kanal zu helfen, brechen die Oberflächenspannung und verbessern Strömung.
2. Gepaart Ganzzellableitungen
- Nachdem alle Scheiben übertragen worden sind, bewegen Sie die Aufnahme Kammer auf die Bühne eines aufrechten, festenStage-Mikroskop und bringen Sie die Referenz-Elektrode führen. Konzentrieren Sie sich auf den Scheiben mit einem langen Arbeitsabstand, Eintauchen in Wasser, 40-60X Ziel. Das Mikroskop sollte auf Lufttisch zur Schwingungsdämpfung angeordnet und eingeschlossen in einem Faradayschen Käfig um eine elektrische Störung zu verringern.
- Superfuse die Scheiben kontinuierlich mit einer Geschwindigkeit von 1 ml / min mit Amphibien Kochsalzlösung mit 100% O 2 geleitet. Verbinden Sie die Saug-, dafür zu sorgen, dass die Zu-und Abfluss ausgeglichen sind. Abfluss durch Drehen des abgeschrägten Ende der Vakuum-Nadel oder durch Bewegen des Kimwipe am Ende der Kammer näher oder weiter weg von dem Abfluss Nadel geregelt werden. Die Zubereitung kann bei Raumtemperatur gehalten oder abgekühlt werden mit einer Peltier-Vorrichtung oder durch einfaches Einstellen einer Packung Eis auf dem Mikroskoptisch.
- Untersuchen Scheiben unter dim oder Infrarot-Licht und identifizieren ein Paar von Zellen - ein Photorezeptor (Stab oder Kegel) und in der Nähe horizontal oder bipolaren Zellen - bis Ziel für whole-cell recording. Rods kann identified durch ihre großen Zellkörper und prominente stabförmigen äußeren Segmente (2A). Cones sind kleiner als Stangen und haben kleine konische äußere Segmente. Bipolare Zelle und horizontalen Zelle somas sind in der äußersten Reihe von Zellen in dem Körper innere Körnerschicht (INL, 2B und 2C).
- Vor der Herstellung Scheiben, mit einer Pipette Abzieher Pipetten aus Borosilikatglas (1,2 mm Außendurchmesser, 0,95 mm Innendurchmesser mit einem Glas Filament) herzustellen. Die Spitze jedes Mikropipette sollte ~ 1-2 Mikrometer im Durchmesser.
- Die Verwendung eines nicht-metallischen Füllung Nadel (z. B. ein aus einer 1-ml-Spritze oder einer Mikrofiltration hergestellt), füllen Pipetten mit der intrazellulären Lösung (Tabelle 1) und heften sich an dem Elektrodenhalter.
- Elevate das Mikroskop-Objektiv leicht. Positionieren Sie den Photorezeptor Pipette unter dem Ziel und dann senken Sie es so, dass die Spitze knapp oberhalb der Scheiben positioniert ist. Wiederholen Sie mit ter zweite Pipette.
- Stellen Sie einem in der Baseline aktuellen Pegel am Verstärker-Offset. Überprüfen Sie die Pipette mit einem Widerstand 5-10 mV depolarisierenden Puls. Wir verwenden in der Regel, dass Pipetten Bereich 10-15 MOhm, das Ergebnis der Langkegel der Welle und niedrige Osmolarität der Amphibien Pipettenlösungen. Bei höheren Säugetieren Osmolarität Lösungen weisen diese gleichen Pipetten Widerstandswerte von ~ 8-12 MOhm. Während wir größere Spitzendurchmessern mit Widerstandswerte von 3-4 MOhm in Amphibien-Lösungen eingesetzt haben, werden die Vorteile durch einen geringeren Zugang Widerstand vorgesehen durch eine größere Schwierigkeiten bei der Abdichtung auf Zellmembranen und einer schnelleren Überblick über Kalzium-Ströme und andere second messenger Offset -sensitive Antworten.
- Während der Anwendung leichter Überdruck, positionieren Sie den postsynaptischen Pipette so daß es die horizontale oder bipolar Zellkörper. Dann positionieren präsynaptischen Pipette so daß es die Zellkörper einer Stange oder eines Kegels Photorezeptor. Recordings appear stabiler zu sein, wenn Pipettenspitzen kontaktieren Sie das innere Segment anstelle der soma, besonders in Zapfen.
- Während die Überwachung der Widerstand, lassen Sie die positiven Druck auf die postsynaptischen Pipette. Manchmal ist die Freisetzung von positiven Druck, der ausreicht, um eine Giga-Ohm-Dichtung zu bilden. Falls nicht, gelten sanfte Saugwirkung mit einer 1 ml Spritze oder durch den Mund. Nachdem die Spitze Widerstand> 100 gewachsen MOhm, gelten einem Haltepotential von -60 mV. Nach Erhalt einer Gigaohm Dichtung, null heraus keine Pipette Kapazität Transienten und wiederholen Sie den Vorgang für die Abdichtung Photorezeptor Pipette Anlegen einer Haltepotential von -70 mV.
- Rupture der Patch mit Ihrem Mund oder eine Spritze zum Saugen zu jeder Zelle wiederum gelten. Rods, Kegel und bipolaren Zellen typischerweise Bruch mit sanften Sog. Beziehen whole-cell-Konfiguration mit einem horizontalen Speicherzellen eine größere Saugwirkung (dh mit einer 3-ml-Spritze) in Kombination mit stark praktischen Spannungsimpulse mit dem "zap" f gelieferteneature der Patch-Clamp-Verstärker. Reißen der Membran und Etablierung von Ganzzell-Konfiguration wird durch das Auftreten von Ganzzell-Kapazität Transienten offensichtlich.
- Bestätigen Identität des postsynaptischen Zelle physiologisch durch Anlegen eines Lichtblitz und liefert eine Reihe von Schritten Spannung von -120 bis +40 mV in 20 mV-Schritten (Abbildungen 3 und 4).
- Um zu beurteilen, wenn das Paar von Zellen synaptisch verbunden sind, liefern eine kurze (25-100 ms), 60 mV Depolarisation Schritt auf den Photorezeptor (bis -10 mV, in der Nähe der Spitze der L-Typ spannungsabhängigen Calcium-Strom) und schauen für postsynaptischen Ströme in der zweiten Ordnung Neuron (Abbildung 5). Eine starke depolarisierenden Schritt sollte eine schnelle, transiente innen postsynaptischen Strom in der post-synaptischen horizontal oder OFF bipolaren Zelle durch ein Platzen der Vesikel-Freisetzung aus dem Konus (Abbildung 5) verursacht zu evozieren.
Ergebnisse
Repräsentative Spuren des Lichts Antworten von Neuronen in vertikale Scheiben Salamander Netzhaut sind in Abbildung 3 dargestellt. Der Kegel, horizontal Zelle und OFF Bipolarzelle alle zeigen eine nach außen in Reaktion auf Licht Ausbruch. Der prominente Einwärtsstrom nach dem Lichtblitz in der horizontalen und bipolaren Zelle Aufnahmen wird durch die erhöhte Freisetzung von Glutamat aus Photorezeptoren, wie sie bei Licht versetzt depolarisieren verursacht. Die ON Bipolarzelle antwortet mit einer nach innen gerichteten Strom bei Licht Ausbruch aus einem Zeichen-invertierenden metabotropic Glutamat-Rezeptor-Signalkaskade und Aktivierung von TRPM1 Kanäle 9. Horizontal Zellen und bipolaren Zellen voneinander durch ihre Beziehungen IV (Fig. 4) unterscheiden. Horizontal-Zellen haben in der Regel eine lineare oder einwärtsgleichrichtenden IV und niedrigen Eingangswiderstand (<500 MOhm; 4A), während bipolaren Zellen einen hohen Eingangswiderstand haben(0,5-2 GOhm) und nach außen Berichtigung I - V (4B) Abbildung 5 zeigt repräsentative Ergebnisse aus Aufnahmen von einem Kegel-horizontal Zellpaar (5A) und Kegel-OFF Bipolarzelle Paar (Abbildung 5B).. In jedem, depolarisierenden den Kegel auf -10 mV aus einem Haltepotential von -70 mV evozierte einen spannungsabhängigen Calcium-Strom in der Kegel und schnell nach innen EPSC in horizontaler oder bipolare Zelle. Diese starke Impulse ausreichend ist, um die leicht lösbare Pool von ~ 20 Vesikeln aus jedem synaptischen Band, was zu einer EPSC von ~ 47 pA / Band 10 zu entleeren. Die horizontale Zelle EPSC in 5A betrug 232 pA, was darauf hindeutet, dass es 5 Band Kontakte aus dem präsynaptischen Membran erhalten. Eine ähnliche Schätzung aus dem 178 pA EPSC im Off Bipolarzelle (5B) deutet darauf hin, dass es 4 Band Kontakte aus dem präsynaptischen Membran erhalten.
| Amphibien Kochsalzlösung | Presynaptic Pipette | Postsynaptische Pipette | |
| NaCl | 116 mM | 3,5 mM | 3,5 mM |
| KCl | 2,5 mM | ||
| CaCl 2 | 1,8 mM | 1 mM | 1 mM |
| MgCl 2 | 0,5 mM | 1 mM | 1 mM |
| HEPES | 10 mM | 10 mM | 10 mM |
| Glucose | 5 mM | ||
| Cs-Glutamat * | 40 mM | ||
| Cs-Gluconat ** | 50 mM | 90 mM | |
| Tetraethylammoniumchlorid | 10 mM | 10 mM | |
| ATP-Mg | 9 mm | 9 mm | |
| GTP | 0,5 mM | 0,5 mM | |
| EGTA | 5 mM | 5 mM | |
| pH *** | 7.8 | 7.2 | 7.2 |
| Osmolarität **** | 245 mOsm | 240 mOsm | 240 mOsM |
* Cs-Glutamat wird durch Neutralisation von 40 mM L-Glutaminsäure 40 mM CsOH in der Pipette Lösung hergestellt. A 1 M ** Bestand von Cs-Gluconat wird durch Neutralisieren einer Lösung von 45-50% CsOH mit D-Gluconsäure. *** Die pH-Wert sollte mit NaOH für die extrazelluläre Lösung und CsOH für die Pipette Lösungen eingestellt werden. **** Halten der Osmolarität der Pipettenlösungen knapp unter der extrazellulären Lösung verhindert Zellschwellung und verbessert Langlebigkeit der Aufnahme.
Tisch1. Komponenten und Parameter für die Standard-intra-und extrazellulären Lösungen in diesem Protokoll verwendet.
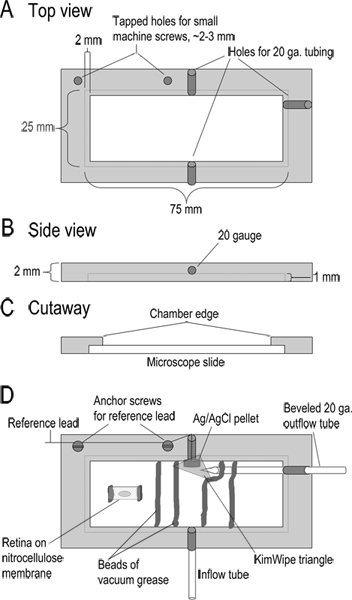
Abbildung 1. Recording Kammer-Konstruktion. (AC) Top, Seiten-und Schnittansichten der Aufnahme Kammer zeigt Dimensionen. Die Kammer wird von einem 2 mm dickes Stück Acryl gefertigt. (D) montiert Kammer. Superfusat tritt in die Kammer durch einen 10 cm Länge der Teflon-Schlauch (Zufluss Rohr; Typ 24LW). Superfusat durch Anwendung milder Ansaugen einer abgeschrägten 20 Gauge Metallrohr an der anderen Seite der Kammer entfernt. Angrenzend an diesem Ausgang Rohr ist ein Ag / AgCl Referenzelektrode Pellet. Das Blei aus dieser Referenz-Elektrode mit der Referenz-Eingang des headstage verbunden. Ein kleines Dreieck von Kimwipeüber der Referenzelektrode angeordnet, um es in Kontakt mit der Lösung zu halten und zu regulieren Lösung fließen in den Ablaufschlauch. Der Boden der Kammer befindet, indem ein Objektträger in die ausgesparten Ränder der Kammer ausgebildet. Der Objektträger wird an Ort und Stelle mit einem Wulst aus Vakuumfett statt. Strips von Nitrozellulosemembran mit retinalen Scheiben sind in Perlen Vakuumfett, die einen Kanal für Lösung zu fließen bilden eingebettet. Vor der Durchführung Scheiben wird eine 5 x 10 mm Stück Nitrozellulosemembran in die Kammer mit zwei kleinen Perlen Vakuumfett befestigt. Ein Stück der Augenmuschel ist vitrealen Seite nach unten auf dieser Nitrocellulosemembran und abgehoben, sobald die Netzhaut anhaftet. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
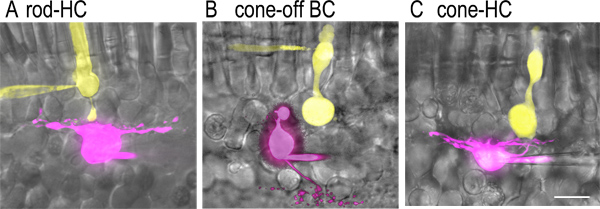
Abbildung 2. Dye-gefüllte Zelle in Paaren vertikale Scheibe Vorbereitung. A) Bilder einer Stange und synaptisch-gekoppelten horizontalen Zelle, die mit kontrastierenden Fluoreszenzfarbstoffen über die Patch-Pipette bei gleichzeitiger whole-cell recording eingeführt gefüllt waren. Lucifer Gelb (2 mg / ml) wurde in der Stange Pipettenlösung (gelb) und sulfarhodamine B (1 mg / ml) wurde in der horizontalen Zelle Pipettenlösung (purple) inbegriffen. Fluoreszenzbilder wurden wurden mit einer drehenden Scheibe konfokalen Mikroskop (Perkin Elmer Ultraview LCI) mit einer gekühlten CCD-Kamera (Orca ER) ausgestattet und an der festen Phase Mikroskop (Nikon E600 FN mit 60X, 1,0 NA Wasserimmersionsobjektiv). Diese Bilder wurden auf Hellfeld-Bilder der entsprechenden retinalen Scheiben mit Adobe Photoshop. B) Bilder eines Kegels und OFF Bipolarzelle synaptisch-gekoppelten überlagert. Die bipolare Zelle Axonterminal verzweigt in der äußersten (S1) Sublamina der inneren Plexiformschicht in der Nähe der Grenze mit der inneren Körnerschicht. C) Bilder eines Kegels und synaptisch-gekoppelten horizontalen Zelle. Beachten Sie, dass die Kegel-Terminals beträchtlich größer als der Axonterminal der Stange sind. Obwohl horizontalen Zellen kann durch die längliche Form ihrer Zellkörper, Zellkörper der ON-OFF-und bipolaren Zellen in der INL nicht leicht unterschieden werden vor der Aufnahme identifiziert werden. Man kann jedoch verschoben OFF bipolaren Zellen, die Zellkörper sind in den ONL und von Zapfen durch das Fehlen von inneren und äußeren Segmenten unterscheiden kegelförmigen lösungsbezogen. Der Maßstab ist 20 um.
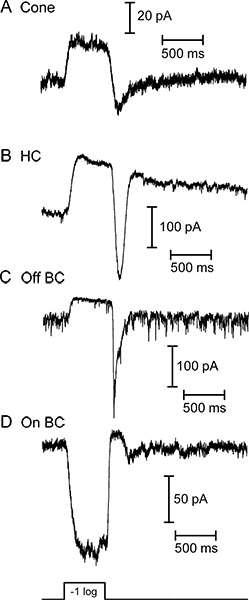
Abbildung 3. Ströme unter Spannungsklemme von vier verschiedenen retinalen Neuronen in Reaktion auf eine helle 500 msec Blitz von weißem Licht aufgezeichnet Licht hervorgerufen. Der Konus (A), horizontal Zelle (B), und aus bipolaren Zelle (C) alle reagierten mit einer nach außen laufenden leuchten. (D) Die auf Bipolarzelle reagierte auf die gleiche Licht Stimulus mit einem nach innen gerichteten Strom. Das Grundrauschen des off bipolaren Zelle (C) ausgestellt spiegelt eine kontinuierliche Freisetzung synaptischer Vesikel in der Dunkelheit, wenn Photorezeptoren in Licht hyperpolarisieren abnimmt. Antworten aus diesen vier Zellen wurden in separaten Aufnahmen mit Scheiben unter weißem Licht hergestellt wurde. Die Intensität des weißen Lichts Stimulus in diesen Beispielen verwendeten individuelle Antworten in horizontalen und bipolaren Zellen entspricht 580 nm Photonenfluss von 1 x 10 5 Photonen / sec / 2 um.
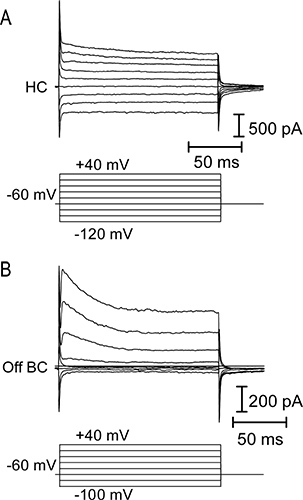
Abbildung 4. Strom-Spannungs (IV) Beziehungen von horizontal und aus bipolaren Zellen. (A) Deckplatte, Membranströme durch eine Reihe von 150 msec Schritten Spannung von -120 bis +40 mV in 20 mV-Schritten (unten) in eine horizontale Zelle angelegt hervorgerufen. Horizontal-Zellen haben typischerweise eine niedrige Eingangswiderstand und linearen oder einwärtsgleichrichtenden IV Beziehungen. (B) IV Beziehung eines aus bipolaren Zelle in Reaktion auf eine Reihe von Spannungsstufen. Bipolar-Zellen haben einen höheren Eingangswiderstand und einen nach außen Gleichrichten IV, durch die Aktivierung von spannungsabhängigen Kaliumkanälen Ströme.
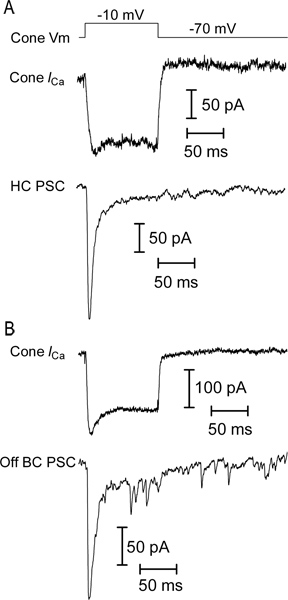
Abbildung 5. Beispiele gepaart Aufzeichnen von Daten. (A) Aufnahme des Konus spannungsabhängigen Calcium-Strom (Cone I Ca ) als Reaktion auf einen Schritt 100 msec bis -10 mV von einem Haltepotential von -70 mV (Cone V m). Leak und Kapazität Transienten wurden abgezogen mit einem P / 8 Lecksubtraktion Protokoll. Eine schnelle exzitatorischen postsynaptischen Strom (EPSC; HC PSC) wurde synchron von einer horizontalen Zelle aufgenommen, die zeigen, dass diese beiden Zellen synaptically gekoppelt sind (b) eine EPSC wurde in einem Aus Bipolare Zelle in Reaktion auf den gleichen Reiz in einem anderen erfasst. Kegel.
Diskussion
Die Netzhaut Scheibe Vorbereitung hat sich als sehr nützlich für die Analyse der Schaltungen und Mechanismen von der Netzhaut eingesetzt, um visuelle Informationen verarbeiten. Die Möglichkeit, ganze Zelle Aufnahmen gleichzeitig erhalten von Pre-und Post-synaptischen Neuronen war besonders hilfreich bei diesem Unterfangen. Gepaart ganze Zelle Aufnahmen sind viel einfacher zu erreichen als mit Scheiben mit Flachbild-mount Netzhaut Vorbereitungen, weil die verschiedenen Netzhaut Schichten ausgesetzt sind. Darüber hinaus wegen ihrer großen Netzhautneuronen haben Salamander eine lange Geschichte als einer retinalen Vorbereitung und bieten daher eine besonders gut charakterisierte Modell-System.
Mit etwas Übung können gesunde Scheiben Salamander Netzhaut regelmäßig hergestellt werden. Ein paar wichtige Schritte machen den Unterschied zwischen Erfolg und Misserfolg. 1) Stellen Sie sicher, dass die Rasierklinge auf das Gewebe Schneidemaschine montiert ist, so dass es flach auf der Glasoberfläche und Scheiben legt sauber obwohl beide das Gewebe und underlying Nitrozellulosemembran. Wenn Sie einen sauberen Schnitt durch die Nitrozellulosemembran gemacht haben, sollten Sie hören ein leises Klicken, wenn die Rasierklinge auf die Oberfläche der Glasträger. 2) Stellen Sie sicher, dass die Netzhaut der Nitrozellulosemembran eingehalten. Ansonsten kann die Netzhaut schweben von der Membran auf jeder Stufe der Verfahren. 3) Setzen Sie geschnittenen Scheiben in die Luft, da dies viele der oberflächlichen Zellen schädigen. 4) Stellen Sie sicher, dass die Scheiben und Nitrozellulosemembran liegen flach auf der Glasplatte, so dass die Netzhautschichten offensichtlich stehen unter dem Binokular. 5) Stand der Erstattungssätze bei Superfusat Zufluss und Abfluss, um zu vermeiden Überlaufen der Aufnahme Kammer. Dies verhindert, dass plötzliche Veränderungen in der Lösung Ebenen, die abrupten Bewegungen Gewebe verursachen kann. 6) Wählen eines gesunden Paar von Zellen nahe beieinander. Cells mit glatten Zytoplasma sind gesünder als Zellen mit körnigen Zytoplasma. Cells tiefer in der Scheibe sind eher intakt synaptischen con behaltenKontakte. 7) Stellen Sie sicher, dass die Pipettenspitze nicht gebrochen oder gebürstet gegen andere Gewebe oder Schutt auf dem Weg nach unten zu den Zellen. 8) Überprüfen Sie die Pipette Widerstand, um sicherzustellen, dass es nicht mit Schutt oder eine Blase, die beide machen es schwierig, eine Qualität whole-cell Aufnahme erhalten kann verstopft.
Anstatt Anbringen der Netzhaut Nitrozellulosefilter Papier, einbetten einige Forscher Netzhaut in einem Block von Agar und verwenden Sie einen Vibratom der Netzhaut Scheiben schneiden. Obwohl wir nicht diesen Ansatz haben versucht, Kim et al. Diskutieren 11 Vorteile beider Ansätze. In ihrer Erfahrung, bietet der Agar-basierten Ansatz eine konsequentere Ausbeute von flachen Scheiben mit gut abgegrenzt Netzhautschichten aber das Filterpapier Ansatz ergibt gesündere Photorezeptoren.
Stäbchen und Zapfen sind verantwortlich für Transduzieren Licht in Änderungen des Membranpotentials. Gepaart mit Aufnahmen, kann das Membranpotential von Stangen oder Kegel sein manipuldirekt und so die Fähigkeit, Licht zu erzeugen Reaktionen ated zwar hilfreich für die Identifizierung Zelltypen, kann nicht entscheidend sein. Wir haben daher oft vorzubereiten Scheiben in weißem Licht. Selbst wenn jedoch unter heller Beleuchtung hergestellt, kann Salamander Netzhautneuronen erzeugen große Licht Reaktionen wie die Reaktionen in dargestellt. 3. Dies ist teilweise auf einen relativ großen Reservoir von Chromophors in der großen äußeren Segment Volumen, sondern kann auch durch die Fähigkeit der Müller-Zellen zu 11-cis-Retinal regenerieren für Kegel 12. Um vollständig dunkel-adaptierte Licht Antworten zu erhalten, kann man die Scheiben unter Infrarot-Beleuchtung vorzubereiten. Für Dissektionen unter Infrarot-Licht, legen wir GenIII Bildverstärkern (Nitemate NAV3, Litton Industries, Tempe, AZ) an die Okulare des Binokular und beleuchten das Gewebe mit einer Infrarot-LED-Taschenlampe. Zum Nuten und andere Verfahren, die nicht unter dem Binokular durchgeführt werden, setzen wir ein Head-Mounted-image Verstärker. Für die Anordnung der Patch-Pipetten visualisieren wir Scheiben unter Verwendung eines Infrarot-empfindliche CCD-Kamera (z. B. Watec 502H, Watec Inc., Middletown, NY), die an der aufrechten, festen Phase Mikroskop. Mit diesen Vorsichtsmaßnahmen kann man erhalten Stab Antworten ausstellenden einzelnes Photon Empfindlichkeit 6, 13.
Eine Begrenzung der Arbeitszeit in der Netzhaut Scheiben ist, dass lange zelluläre Prozesse von großen Feld Netzhautneuronen kann viele ihrer Dendriten beim Zerschneiden Verfahren verlieren. Retinal Scheibe Zubereitungen sind daher nützlich für die Untersuchung der Physiologie der Zellen, in denen die synaptischen Kontakte umfassen Prozesse der Nähe der Zellkörper. Amphibien und Säuger-Retina teilen viele der gleichen Zelltypen und nutzen ähnliche physiologische Mechanismen 14-16. Während Salamander Retina ist ein gutes Modell für viele Aspekte der Netzhaut von Säugetieren, scheint ein wichtiger Unterschied zu der Anwesenheit eines dedizierten Stange Weg in Säugetieren sein, dass involves Kontakte von spezialisierten Stab bipolaren Zellen auf AII Amakrinzellen 14. Eine weitere Einschränkung des Salamanders Netzhaut ist die geringe Anzahl von genetischen Werkzeuge, die speziell für diese Art entwickelt. Allerdings Antikörper und shRNA Reagenzien, die auf gut konservierten Regionen in anderen Arten erfolgreich in Salamander verwendet werden, ebenso wie viele niedermolekulare Inhibitoren und Peptidreagenzien. Zusätzlich mit ein paar Änderungen in Technik, kann Netzhaut Scheiben aus anderen Spezies, in denen einige dieser Werkzeuge sind leichter verfügbar, hergestellt werden.
Über ihre Nutzbarkeit für gepaarte Ganzzell-Aufnahme wird der Salamander retinalen Schicht Zubereitung auch zugänglich für eine Vielzahl von anderen Ansätzen. Wie oben diskutiert, kann retinalen Schichten verwendet werden, um Licht Reaktionen in Kombination mit verschiedenen Protokollen Spannungsklemme 17 zu untersuchen. Retinal Neuronen können auch mit Fluoreszenzfarbstoffen empfindlich auf Ca 2 + geladen werden, Cl - oder Na+ Eingeführt durch die Patch-Pipette oder durch Bad-Anwendung 15,18-20. Ein fluoreszierendes Peptid, das an den synaptischen Band 21 bindet, kann durch den Patch-Pipette eingeführt werden und für die Bildgebung verwendet das Band 10 oder, wenn konjugiert mit Fluorescein, bei akut und selektiv eine Beschädigung des Bandes 22. Wir haben auch Netzhaut Scheiben in Kombination mit Quantenpunkten verwendet, um die Bewegungen der einzelnen Calciumkanäle in Stäbchen und Zapfen Synapsenenden 23 überwachen. Somit ist das vertikale retinalen Schicht eine vielseitige Versuchsansatz zur Untersuchung grundlegenden synaptischen Mechanismen und die einzigartigen Verarbeitungsfunktionen an dem ersten Synapse im visuellen Signalweg durchgeführt.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von Research finanziert, um Blindheit und National Institutes of Health Zuschuss EY10542 verhindern.
Materialien
| Name | Company | Catalog Number | Comments |
| Tissue slicer | Stoelting | 51425 | |
| Double edge razor blades | Ted Pella, Inc | 121-6 | |
| Nitrocellulose membranes | Millipore | AAWP02500 | Type AAWP 0.8 mm pore |
| Borosilicate glass pipettes | World Precision Instruments | TW120F-4 | 1.2mm OD 0.95 mm ID |
| Ag/AgCl pellet | Warner | E206 | |
| MicroFil | World Precision Instruments | MF34G-5 | 34 ga. Filling needle, 67 mm long |
Referenzen
- Ramòn y Cajal, S., Thorpe, S. A., Glickstein, M. . The Structure of the Retina. , (1972).
- Piccolino, M. Cajal and the retina: a 100-year retrospective. Trends Neurosci. 11, 521-525 (1998).
- Hartline, H. K. The response of single optic nerve fibers of the vertebrate eye to illumination of the retina. Am. J. Physiol. 121, 400-415 (1938).
- Kuffler, S. W. Discharge patterns and functional organization of mammalian retina. J. Neurophysiol. 16, 37-68 (1953).
- Werblin, F. S. Transmission along and between rods in the riger salamander retina. J. Physiol. 280, 449-470 (1978).
- Wu, S. M. Synaptic connections between neurons in living slices of the larval tiger salamander retina. J. Neurosci. Meth. 20, 139-149 (1987).
- Heidelberger, R., Thoreson, W. B., Witkovsky, P. Synaptic transmission at retinal ribbon synapses. Prog. Retin. Eye Res. 24, 682-720 (2005).
- Schmitz, F. The making of synaptic ribbons: how they are built and what they do. Neuroscientist. 15, 611-624 (2009).
- Morgans, C. W., Brown, R. L., Duvoisin, R. M. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells. Bioessays. 32, 609-614 (2010).
- Bartoletti, T. M., Babai, N., Thoreson, W. B. Vesicle pool size at the salamander cone ribbon synapse. J. Neurophysiol. 103, 419-423 (2010).
- Kim, M. H., Vickers, E., von Gersdorff, H. Patch-clamp capacitance measurements and Ca2+ imaging at single nerve terminals in retinal slices. J. Vis. Exp. (59), e3345 (2012).
- Wang, J. S., Estevez, M. E., Cornwall, M. C., Kefalov, V. J. Intra-retinal visual cycle required for rapid and complete cone dark adaptation. Nat. Neurosci. 12, 295-302 (2009).
- Thoreson, W. B., Tranchina, D., Witkovsky, P. Kinetics of synaptic transfer from rods and cones to horizontal cells in the salamander retina. Neuroscience. 122, 785-798 (2003).
- Wu, S. M. Synaptic organization of the vertebrate retina: general principles and species-specific variations: the Friedenwald lecture. Invest. Ophthalmol. Vis. Sci. 51, 1263-1274 (2010).
- Babai, N., Thoreson, W. B. Horizontal cell feedback regulates calcium currents and intracellular calcium levels in rod photoreceptors of salamander and mouse retina. J. Physiol. 587, 2353-2364 (2009).
- Babai, N., Morgans, C. W., Thoreson, W. B. Calcium-induced calcium release contributes to synaptic release from mouse rod photoreceptors. Neuroscience. 165, 1447-1456 (2010).
- Thoreson, W. B., Burkhardt, D. A. Contrast encoding in retinal bipolar cells: current vs. voltage. Vis. Neurosci. 20, 19-28 (2003).
- Thoreson, W. B., Bryson, E. J., Rabl, K. Reciprocal interactions between calcium and chloride in rod photoreceptors. J. Neurophysiol. 90, 1747-1753 (2003).
- Cadetti, L., Bryson, E. J., Ciccone, C. A., Rabl, K., Thoreson, W. B. Calcium-induced calcium release in rod photoreceptor terminals boosts synaptic transmission during maintained depolarization. Eur. J. Neurosci. 23, 2983-2990 (2006).
- Luo, J., Boosalis, B. J., Thoreson, W. B., Margalit, E. A comparison of optical and electrophysiological methods for recording retinal ganglion cells during electrical stimulation. Curr. Eye Res. 37, 218-227 (2012).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Snellman, J., Mehta, B., Babai, N., Bartoletti, T. M., Akmentin, W., Francis, A., Matthews, G., Thoreson, W. B., Zenisek, D. Acute destruction of the synaptic ribbon reveals a role for the ribbon in vesicle priming. Nat. Neurosci. 14, 1135-1141 (2011).
- Mercer, A. J., Chen, M., Thoreson, W. B. Lateral mobility of presynaptic L-type calcium channels at photoreceptor ribbon synapses. J. Neurosci. 31, 4397-4406 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten