Method Article
Erzeugung von Aktuell transgenen Ratten durch
In diesem Artikel
Zusammenfassung
Gene bei der Entwicklung des Kortex oder des Hippokampus von Ratten über in utero Elektroporation (IUE) an E16 manipuliert werden, um eine schnelle und gezielte Modifikationen der neuronalen Verbindungen für spätere Untersuchungen des Verhaltens oder der Neuropathologie in erwachsenen Tieren ermöglichen. Postnatale in-vivo-Bildgebung für die Kontrolle der IUE Erfolg durch Biolumineszenz der Aktivierung co-transfizierten Luciferase durchgeführt.
Zusammenfassung
In utero Elektroporation (IUE) ist eine Technik, die genetische Veränderung von Zellen zur Untersuchung der neuronalen Entwicklung ermöglicht im Gehirn. Bisher wurde die Verwendung von IUE zur Untersuchung Verhalten oder Neuropathologie im erwachsenen Gehirn durch unzureichende Methoden zur Überwachung des Erfolgs IUE Transfektion von nicht-invasiven Techniken in postnatale Tiere beschränkt.
Für die vorliegende Studie wurden Ratten E16 für IUE verwendet. Nach intraventrikuläre Injektion von Nukleinsäuren in die Embryonen, die Positionierung der Pinzetten Elektroden war kritisch für die Ausrichtung entweder der Entwicklungs Kortex oder des Hippokampus.
Ventrikulären Co-Injektion und Elektroporation von einem Luciferase-Gen erlaubt die Überwachung der transfizierten Zellen postnatal nach intraperitonealer Injektion von Luciferin in der narkotisierten Live P7 Welpen durch in vivo-Biolumineszenz unter Verwendung eines IVIS Spectrum Vorrichtung mit 3D Quantifizierungssoftware. DISC1 Gens in das Rattencortex führte zu Amphetamin Empfindlichkeit. Co-transfizierten GFP konnte in Neuronen von Post-mortem-Fluoreszenzmikroskopie in Gefrierschnitten angibt, bei ≥ 6 Monate nach der Geburt vorhanden Genexpression festgestellt werden.
Wir schließen, dass postnatale Biolumineszenz-Bildgebung ermöglicht die Bewertung des Erfolgs von transienten Transfektionen mit IUE bei Ratten. Untersuchungen über den Einfluss der aktuellen Gen-Manipulationen während neurodevelopment auf den Erwachsenen-Gehirn und seine Konnektivität sind sehr erleichtert. Für viele wissenschaftliche Fragen, kann diese Technik zu ergänzen oder sogar ersetzen die Verwendung von transgenen Ratten und eine neuartige Technologie für die Verhaltensneurowissenschaften.
Einleitung
Die Entwicklung der in utero Elektroporation (IUE)-Methode, die eine Modulation der Genexpression im sich entwickelnden Gehirn ermöglicht, hat einen Durchbruch, da es aktiviert Studium der Entwicklung des Nerven relativ einfach gewesen. 1-7 Änderungen im Expressionsspiegel eines Zielgens in eine bestimmte Hirnregion während der embryonalen und / oder perinatale Entwicklung bei Nagern wurden nachweislich Einfluss der neuronalen Proliferation, Migration, Verzweigung und Konnektivität kritisch. 8-10
Schizophrenie ist eine Geisteskrankheit Komplex mit akuten und chronischen Symptomen, die Neuroentwicklungsanomalien 11, 12 und daher viele der identifizierten Kandidatengene für Schizophrenie sind für mögliche modulierende Wirkungen auf die Entwicklung des Nervensystems wie zum Beispiel untersucht, bezogen wurde die aufgeschlossene-in-Schizophrenie -1 (DISC1)-Gen 13-15.
Die Entwicklung des Gehirns ist Regulatdurch genetische Faktoren und deren Wechselwirkungen mit der Umwelt, die Rollen in der prä-, peri-und postnatalen Entwicklungszeiten spielen ed. Ein Haupt genetische Risikofaktor für verschiedene Verhaltensstörungen ist die DISC1 16 Gen. DISC1 Knockdown führt zur Migration Defekte bei Mäusen 13, 17, und Manipulation von DISC1 Expression in der Entwicklung von IUE Kortex wurde gezeigt, dass das Verhalten der erwachsenen Mäuse 18 auswirken.
Manipulieren Gehirn Genexpression durch IUE 19 hat mehrere Vorteile gegenüber der Erzeugung von transgenen Tierlinien. Zunächst wird die Genexpression in Bereichen von Interesse innerhalb von Wochen bis Monaten, anstatt mehrere Generationen der Zucht transgener Nager Linien erreicht. Zweitens werden die Kompensationsmechanismen während der frühen Entwicklung, die Phänotypen in Keimbahn-engineered 20 Tiere schützen kann vermieden. Dritte, durch Targeting nur eine bestimmte Zellpopulation oder bestimmten Bereich des Gehirns, migratioder Proliferation Unterschiede können direkt mit dem nicht-mutierten Kontrolle verglichen werden oder kontralateralen Seite, wenn einseitige electroporations gewählt werden. Andererseits bedeutet IUE nicht die Genauigkeit der Promotor getriebene cre / lox-induzierte Zeitpunkt der Expression und nur eine Subpopulation von Zellen in einem bestimmten Bereich ausgerichtet ist, die zu einem Mosaik Art von Genexpressionsmustern.
Für viele Anwendungen in der experimentellen erwachsenen Nagetieren, kann eine vorübergehende Transfektion einer begrenzten Anzahl von Zellen in einer Gehirnregion ausreichend oder sogar erwünscht sein, so dass der Hauptvorteil der stabilen Keimbahn-transgene Nager ist vernachlässigbar. In der Tat ist IUE nützlich, zu untersuchen, ob einige abnormal entwickelt Zellen können ein ganzes Netzwerk von Zellen oder Schaltungen beeinflussen. Ein weiterer Vorteil kann die Fähigkeit, nicht zellautonome Wirkung eines Gens durch die Mosaik Natur der Hit zu demonstrieren. Darüber hinaus ist die Herstellung von transgenen und Knockout-Ratten noch in den Kinderschuhen und die Verwendungvon IUE in dieser Art für das Studium abweichende Gehirnentwicklung Folgen ist von hohem Interesse.
Bisher ein wesentliches Hindernis der Verwendung von IUE zur Untersuchung der Folgen Interventions in dieser Tiere Erwachsene ist die mangelnde Kontrolle Elektroporation Erfolg. So weit, GFP-co-transfiziert fluoreszierende Nervenzellen in der Live neugeborenen Rattenjungen konnte nicht unter einer geeigneten Fernglas Fluoreszenz-Mikroskop oder mit der Fluoreszenz-Bildgebung des IVIS Spectrum nachgewiesen werden.
Um dieses Hindernis zu überwinden, wir co-transfiziert ein Luciferase-Reportergens durchgeführt und Biolumineszenz-Live-Bildgebung von Jungtieren durch 3-dimensionale (3D) Quantifizierung der IUE Gehirnbereich.
Als ein Beispiel zur Demonstration der Anwendbarkeit dieses Verfahrens in einem späteren funktionellen Assay testet die Neuroentwicklungs genetische Manipulation, eine Co-Injektion von Plasmiden, die menschliche DISC1, Luciferase und GFP in den lateralen Ventrikel des Rattenembryonen 3 gefolgt durch Elektroporation mit einer Pinzette Elektrode durchgeführt wurde. Während die Fluoreszenzsignale nicht in postnatalen Stadien in vivo nachgewiesen werden, wurde eine feste Biolumineszenz-Signal von Luciferin Stoffwechsel von co-transfizierten Luciferase-Gen abgeleitet bis zu fünf Wochen nach der Geburt festgestellt. 3D-Messungen der Elektroporation Gehirnbereich erlaubt die Quantifizierung wobei Welpen mit zu wenig oder falsch Elektroporation waren von Anfang an erkannt, so, so dass die Zuordnung der IUE Tiere (Gen von Interesse und Rührei Steuerung) zu Versuchsgruppen mit pass Elektroporation Gehirn Bereichen geringer Variabilität . Die Verwendung von adulten Ratten IUE in Verhaltensexperimenten wurde als ein Beispiel für die Nützlichkeit dieses Protokolls gezeigt.
Protokoll
In Übereinstimmung mit nationalen und europäischen Gesetzgebung, Alle Tierversuche wurden von der zuständigen Landesministerium für Natur, Umwelt und Verbraucherschutz (87-51.05.2010.A301 LANUV NRW) zugelassen.
1. In utero Elektroporation
Dieses Verfahren ist im Detail in JoVE für die Ratte durch Walantus et al. 3 sowie Rice et al. 4 beschrieben und wird hier nur kurz zusammengefaßt. Ein Wurfgröße von 6-8 Jungtieren ergibt ein gutes Ergebnis. Es sollte mindestens zwei nicht-Elektroporation Embryonen, um die Gesamtüberlebensrate zu erhöhen (siehe unten).
- Vorbereitung DNA-Gemisch, das 1,5 ug / ul enthält Target-Plasmid (shRNA: pENTR-U6, Invitrogen, Eugene, OR / DISC1 Expression: pCAX 21), 0,5 &mgr; g / &mgr; l Luciferase-Plasmid, enthaltend (pCAX), 0,5 ug / ul GFP das Plasmid (pCAGGS 22) in 1x PBS-Lösung gefärbt Licht blue mit Fast Green Dye.
- Bereiten Injektionsnadeln aus Glas Kapillaren mit einem Nadel Pipette Puller. Und sterilisieren chirurgische Instrumente entweder durch Autoklavieren oder Inkubation mit einem alkoholhaltigen Desinfektionsmittel (Kodan Tinktur forte).
- Verwalten einer präoperativen Dosis von Buprenorphin (0,05 mg / kg) 15 min vor der Operation, eine schwangere Ratte 16 Tage nach der Befruchtung (E16). Dann betäuben das Tier in einer Isofluran Kammer.
- Nach der Anästhesie, legen Sie die Ratte in Rückenlage auf einer 37 ° C-Betrieb erwärmt Tisch mit Atemmaske auf die Anästhesie-Gerät verbunden ist, unter Verwendung von Sauerstoff-Einstellung bei 0,4 L / min und Isofluran bei 1,8%.
- Nach der Rasur der Bauch, desinfizieren die rasierte Fläche dreimal mit kodan Tinktur Forte (ein Alkohol-Desinfektionsmittel).
- Decken Sie die Ratte mit sterilen Tüchern, Belichten nur das Operationsfeld rasiert.
- Führen Sie in utero Elektroporation.
- Schneiden Sie den Bauch mit einem scissor entlang der Linea alba (~ 2 cm).
- Expose die Gebärmutterhörner sorgfältig mit einem Ring Pinzette.
- Achten Sie auf die Gebärmutterwand nass mit sterilem PBS erwärmt während der ganzen Operation zu halten.
- Inject DNA-Lösung mit einer dünnen Nadel in ein Glas des lateralen Ventrikel der Embryonen.
- Legen Sie die 7 mm-Elektrode um den Kopf des Embryos. Um eine Zellpopulation der oberen kortikalen Schichten getroffen, führen Sie die IUE bei E16 23 und die Position der positiven Elektrode auf der Halbkugel über der Herzkammer injiziert mit einer leichten Rücken / Seitenneigung. Um gezielt Hippocampus Zellen ändern die positive Elektrodenplatzierung auf der gegenüberliegenden Seite, als der eingespritzten Ventrikel mit seitlichen etwas Rücken Richtung (Abbildung 1).
- Führen Elektroporation von fünf 50 ms Pulse bei 55 V mit 950 msec Pausen mit einem Rechteckimpuls Elektroporator.
- Ersatz die erste Embryo in der vaginalen Ende jedes Uterushorns zur Erhöhung ter Überlebenschancen aller Embryonen.
- Setzen Sie die Hörner Gebärmutter wieder in die Mutter Ratte.
- Stich in die Bauchwand mit einem resorbierbaren Vicryl chirurgisches Nahtmaterial.
- Schließen Sie die Haut mit der Vicryl Nahtmaterial oder mit Wundklammern.
- Legen Sie die Mutter Ratte zurück in den Käfig und warm halten für 2-3 Stunden.
- Halten Sie die Ratten allein in ihrem Käfig in der Tierhaltung Raum und Futter ad libitum. Sie geben der Geburt zwischen E22-24.
- Halten Sie die Rattenjungen mit ihrer Mutter für drei Wochen und trennen sie anschließend nach Geschlecht.
2. Biolumineszenz Live-Imaging der enzymatischen Reaktion Luciferase
Diese Methode wird verwendet, um die Position der in utero transfizierten Zellen zu analysieren. Co-Elektroporation Leuchtkäfer-Luciferase-cDNA wird in die aktive Luciferase, die auf die Metabolisierung D-Luciferin zu Oxyluciferin, ein Photon emittiert (Fig. 2 übersetzt ). Die resultierende Lumineszenz in den Gehirnen von positiven elektroporiert junge Ratten in einem IVIS Spectrum bis zum Alter von etwa 35 Tage postnatal (Fig. 4) erfaßt werden.
In der vorliegenden Studie wurde die Luciferase-Assay und Biolumineszenz-Bildgebung durchgeführt, beginnend bei P7. Dieser Zeitpunkt wurde gewählt, damit Mutter und Welpen von Geburt an Stress zu erholen. Wenn Sie zu Beginn der Arbeit mit den Welpen bei P0, pup Überleben schwer betroffen wurde, dass die Jungtiere wurden tot aufgefunden oder von der Mutter gefressen.
Zunächst werden Rattenjungen mit erfolgreichen Elektroporation von einem 2D-Bild Biolumineszenz mit einer Belichtungszeit von drei Minuten identifiziert. Anschließend werden positive Welpen für die Erstellung von 3D-Bildern, um die Lage der Elektroporation Bereich zu spezifizieren.
- Verdünnen D-Luciferin-Natriumsalz in PBS auf eine Konzentration von 15 mg / ml und sterilisiert durch Filtration durch eine sterile Spritzenfilter.
- Wiegen Sie die Welpen.
- Nehmen Sie den Welpen in einer Hand mit dem Bauch nach oben und strecken Sie den Bauch ein wenig. Spritzen Sie 10 ul / g Körpergewicht Luziferinlösung intraperitoneale. Für ältere und agiler diejenigen, vorge betäuben die Welpen mit Isofluran in der Induktionskammer vor der Injektion des Luciferin.
- Schalten Sie die Isofluran Zustrom der XGI-8 Gas Anästhesie-System innerhalb des IVIS Spectrum mit 3% Isofluran.
- Setzen Sie die Schnauze des Tieres in die Glas Nase Zapfen der Anästhesie-System.
- Halten Sie das Tier in Bauchlage, bis er in tiefer Narkose (2-3 min). Dann reduzieren Sie die Isofluran-Zustrom auf 1,5%.
- Wählen Sie ein 2D-Biolumineszenz-Messung, um positive Welpen aus der ganzen Wurf zu wählen. Verwenden Sie die folgenden Einstellungen
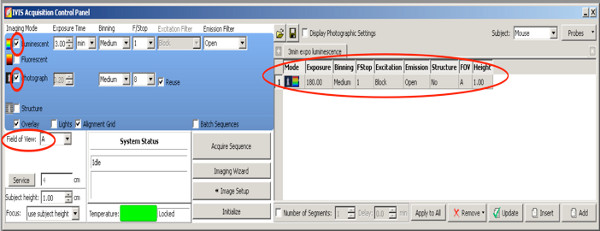
Klicken Sie hier, um eine größere Abbildung anzuzeigen .- Legen Sie ein checkmark auf Medium Fotografie mit Binning und F / Stop bei 8, nimmt die Kamera ein Foto von oben nach Beginn der Messung.
- Stellen Anregungsfilter: block.
- Stellen Emissionsfilter: geöffnet.
- Stellen Binning bis mittel.
- Set F / Stop in 1.
- Stellen Bühnenniveau A.
- Stellen Lumineszenz Belichtungszeit auf 180 Sekunden.
- Zur Erstellung von 3D-Bildern, um besser zu quantifizieren, die Elektroporation von den positiven Bereich Welpen, verwenden Sie die folgenden Einstellungen für DLIT Firefly Luziferase.
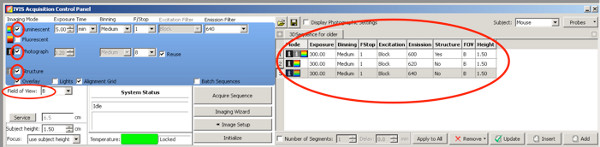
Klicken Sie hier, um eine größere Abbildung anzuzeigen .- Setzen Sie ein Häkchen auf Foto, die Kamera nimmt ein Foto von oben nach Beginn der Messung.
- Setzen Sie ein Häkchen auf Struktur, wird die Oberfläche des Tieres durch das IVIS vor der Biolumineszenz-Messung gescannt.
- Use folgende Emissionsfilter und Belichtungszeiteinstellung bis zum Alter von zwei Wochen:
Emissionsfilter 1: 590 nm, Belichtungszeit 300 Sekunden
Emissionsfilter 2: 600 nm, Belichtungszeit 240 Sekunden
Emissionsfilter 3: 620 nm, Belichtungszeit 180 Sekunden
Emissionsfilter 4: 640 nm, Belichtungszeit 120 Sekunden
Für Ratten älter als P20
Emissionsfilter 1: 600 nm, Belichtungszeit 300 Sekunden
Emissionsfilter 2: 620 nm, Belichtungszeit 300 Sekunden
Emissionsfilter 3: 640 nm, Belichtungszeit 300 Sekunden
Klicken Sie hier, um eine größere Abbildung anzuzeigen .
Aufgrund der Abnahme in der Signalstärke bei älteren Tieren ist die Belichtungszeit für die drei besten Emissionsfilter ein. - Stellen Bühnenstufe B
- Stellen Binning bis mittel.
- Set F / Stop bei 1
- Nach der Messung mar k die Ratten durch eine Ohröffnung Code, um sie voneinander zu unterscheiden und sie zu den IVIS Live-Imaging Bilder entsprechen
- Am Ende des Messverfahrens, schalten Sie Isofluran Zustrom und halten Sie die Ratte auf der erwärmten Platte für einige Minuten, bevor es wieder in seinen Käfig.
3. Analyse der Biolumineszenz Images
Die Erzeugung von 3D-Bilder, 3D-Filme und die Quantifizierung des Volumens der Signalquelle wird von der Living-Image Software auf dem IVIS Spectrum vorinstalliert gemacht.
- Erzeugung von 3D-Bildern
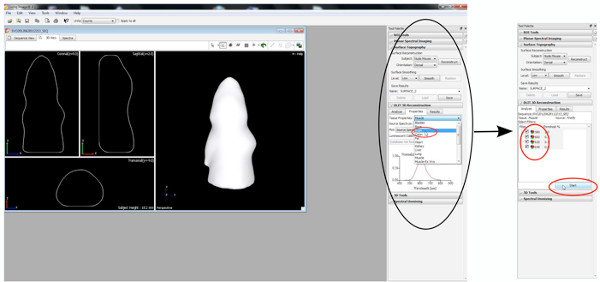
- Zunächst rekonstruieren eine Oberflächentopographie, daher setzen Schwelle zwischen 20-30%.
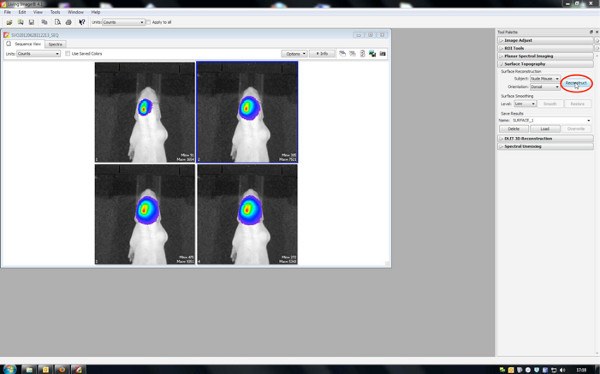
Klicken Sie hier, um eine größere Abbildung anzuzeigen .
een 6 "src =" / files/ftp_upload/50146/50146screen6.jpg "/> - Starten DLIT 3D-Rekonstruktion mit einem Bild Schwelle von 10% für jede Wellenlänge.
Klicken Sie hier, um eine größere Abbildung anzuzeigen .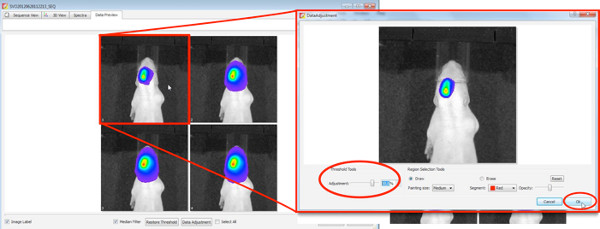
Klicken Sie hier, um eine größere Abbildung anzuzeigen .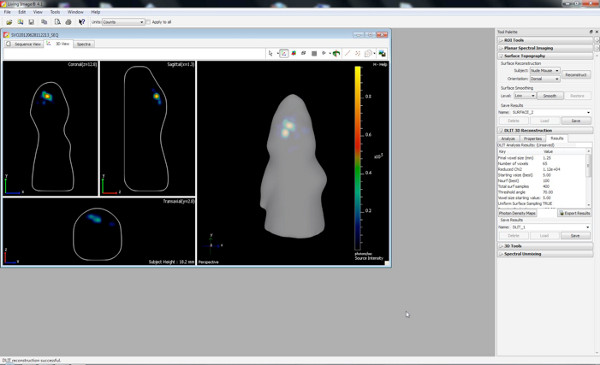
Klicken Sie hier, um eine größere Abbildung anzuzeigen . - 3D-Filme erstellen, indem Sie die Taste animieren in der 3D-Werkzeugleiste.
- Wählen Sie verschiedene Ausrichtungen des 3D-Bildes sowie das Zoomen Ansichten als Schlüsselbilder und drücken Sie die "Record & #39, Taste, die Aufzeichnung der Wechsel von einer Position / Orientierung zum anderen.
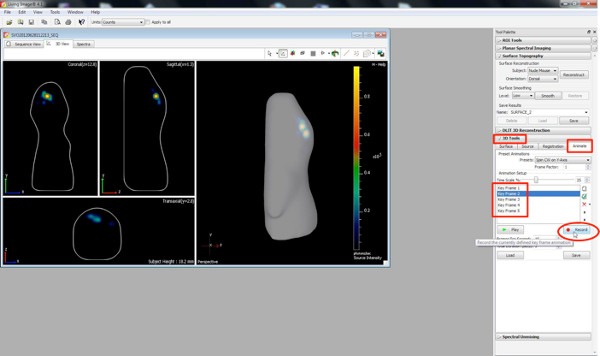
Klicken Sie hier, um eine größere Abbildung anzuzeigen .
- Zunächst rekonstruieren eine Oberflächentopographie, daher setzen Schwelle zwischen 20-30%.
4. Verhaltenstest
Verhaltenstests wurden in, um festzustellen, ob IUE-vermittelte Gen-Manipulationen in der Ratte könnte langfristige Auswirkungen, die bis ins Erwachsenenalter fortbestehen zu initiieren durchgeführt. Im vorliegenden Fall wurde die Wirkung von transienten, einseitige voller Länge menschlichen DISC1 kortikalen Überexpression nach IUE wurde durch Testen Fortbewegung in einem offenen Feld (OF), mit und ohne einer niedrigen Dosis von Amphetamin, als eine spezifische Test für Dopamin-ähnliche sucht Verhalten 24. In einem ähnlichen Verfahren durchgeführt von Niwa et al. IUE in Mäusen unter Verwendung DISC1 Knockdown, IUE-Mäusen, nicht aber Kontrollen zeigten ÜberempfindlichkeitAmphetamin 18.
Ratten, die in utero Elektroporation wurden mit einer Überexpression DISC1 Vektor wurden unter Laborbedingungen mit 12 Stunden Licht von 7.00 Uhr bis 7.00 Uhr statt und wurden ad libitum gefüttert. Bei 3 Monate alt, unterzog Ratten Verhaltenstests.
Zur Quantifizierung der Fortbewegung als eine Auslese von Amphetamin-Effekte, ein Open-Feld einer Tru-Scan-System-Aktivität in einem schall-und licht isoliert Kammer befindet, verwendet. Dieses System misst die Zeitdauer und Entfernung der Tier bewegt, Zeit und Distanz in der Marge oder in der Mitte offenen Feld verbrachte, als auch das Erziehungsverhalten 25.
- Am ersten Tag, zu testen, nachdem Kochsalzinjektion
- Wiegen der Tiere.
- Inject intraperitoneal 1 ul / g Körpergewicht von einer Kochsalzlösung (1x PBS).
- Direkt nach der Injektion, legte das Tier in den offenen Bereich und starten Sie die Messung der TruScan-System. Rekord für 15 Minuten eind unterteilen Daten in 3 x 5 min Teile.
- Setzen Sie das Tier wieder in seine Heimat Käfig.
- Zweiter Tag, Test auf Amphetamin-Injektion
- Wiegen der Tiere.
- Inject intraperitoneal 1 ul / g Körpergewicht einer 0,5 mg / ml Lösung Amphetamin.
- Direkt nach der Injektion setzen das Tier in den offenen Bereich und starten Sie die Messung der TruScan-System. Rekord für 15 Minuten zu unterteilen und Daten in 3 x 5 min Teile.
- Bringen Sie das Tier in seinen Heimkäfig.
- Analysieren Sie die Fortbewegung und Aufzuchtverhalten durch spezifische Tru Scan-Software generiert. Erstellen von Diagrammen mit GraphPad (Prisma) und berechnen Statistiken, die von SPSS Statistics-Software.
Ergebnisse
Abbildung 3 zeigt die Live-Imaging-Messungen von drei Rattenjungen bei P7 nach der Injektion von 150 mg Luciferin / kg Körpergewicht. Unterschiede der Signalstärke, welche die Variabilität in der Effizienz der IUE sichtbar. Starke Signale wurden Biolumineszenz bis P36 (Figur 4) gespeichert. In Fig. 5 ist die Fähigkeit, kortikale (5A und 5C) und Hippocampus-(5B und 5D) Elektroporation durch Biolumineszenz-Bildgebung definieren dargestellt. Korrelation des Biolumineszenz-Signal (Fig. 7A) mit dem Fluoreszenzsignal nach Schädel Entfernung (7B) und der entsprechenden GFP-elektroporierten Zellen in kryogeschnitten Gehirn (Fig. 8) auf P14 sind in den Fig. 6-8 dargestellt. Zu beachten ist, gab es keinen Nachweis eines Fluoreszenzsignals in lebenden Ratten zu jedem Zeitpunkt.
Zelt "> In-vivo-Biolumineszenz-Bildgebung ermöglicht ungefähre Diskriminierung verschiedener elektroporiert Gehirnbereichen von 2D (Fig. 5A und 5B), die stark mit der DLIT Programm der Software IVIS Spectrum Erzeugung von 3D-Bildern (Figuren 5C und 5D) verbessert wird. In den gezeigten Beispielen Elektroporation des präfrontalen Cortex und Hippocampus-Zeit bestimmt werden. Es sei darauf hingewiesen, dass zwar mit dem Ziel, den Hippocampus Elektroporation einige Vorläuferzellen der Hirnrinde liegen dorsal des Hippocampus kann auch getroffen werden (Fig. 7) werden.Ratten einseitig in utero mit pCAX Vektor in die Rinde elektroporiert und anschließend Überexpression in voller Länge menschlichen DISC1 wurden sowohl für spontane und Amphetamin-induzierten Hyperaktivität als Erwachsene untersucht. Ratten, die mit pCAX-DISC1 elektroporiert waren überempfindlich auf einer niedrigen Dosis von Amphetamin. Diese Ratten signifikant bewegt moRe nach Amphetamin-Behandlung als nach den Kochsalzinjektion, während Kontrolltiere nicht (Abbildung 10).
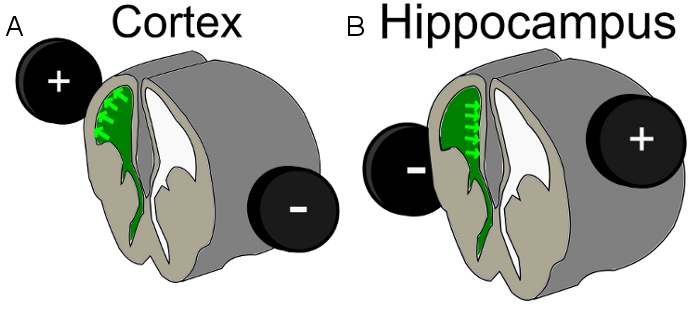
Fig. 1 ist. Schema der Elektrodenposition für A) Kortex Elektroporation und B) Hippocampus Elektroporation, grün = injizierte DNA-Mix in der Herzkammer.
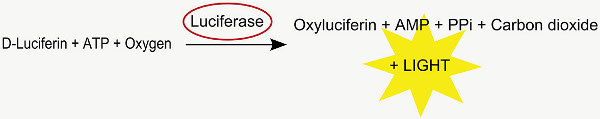
2. Die Luciferase-Reaktion.
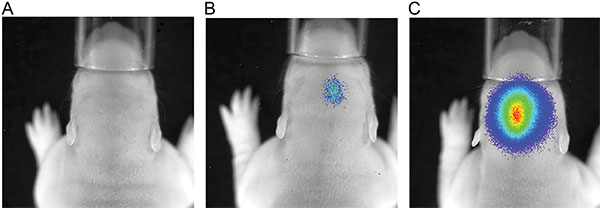
3. Lumineszenzmessung von P7 Ratten nach Injektion von 150 mg / kg Körpergewicht Luciferin; Belichtungszeit 180 sec; A) Ratten ohne Lumineszenzsignal, B) Ratten mit einem schwachen Signal Biolumineszenz, C) Ratte mit einem starken Lumineszenz-Signal.
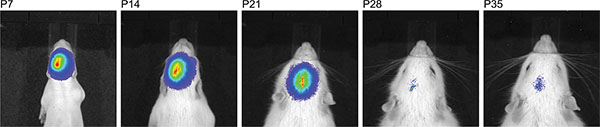
4. Zeitlinie aufeinanderfolgender Biolumineszenz-Messungen derselben Ratten nach Injektion von 150 mg / kg Luciferin zeigt eine große Zeitfenster, in dem IUE Erfolg nachgewiesen werden können.
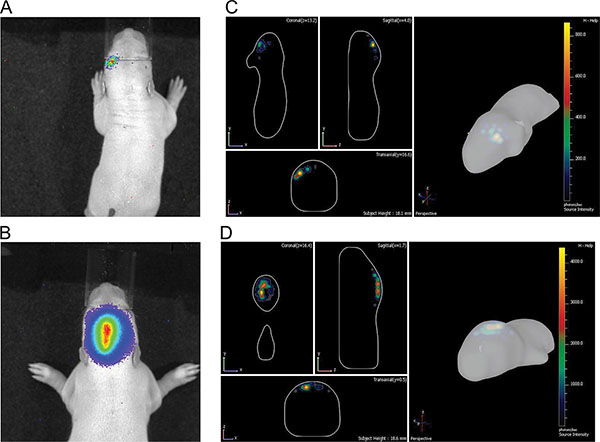
. Abbildung 5 Abbildung der Unterschiede zwischen kortikalen und hippocampalen Elektroporation bei P7 A) und B) 2D-Bildern;. C) und D) 3D-Bilder, A) und C) aus Rinde, B) und D) von Hippocampus.files/ftp_upload/50146/50146fig5highres.jpg "> Klicken Sie hier für eine größere Abbildung zu sehen.
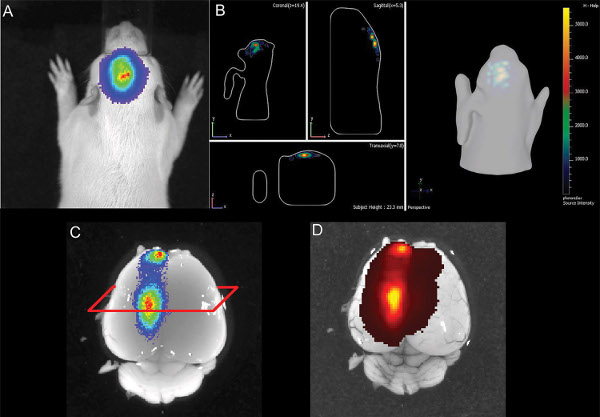
6. Illustration von E16 Hippocampus einer Ratte Elektroporation Welpen bei P14 A) 2D-Bild der Biolumineszenz B) 3D-Darstellung des Biolumineszenz-Signal C) seziert Gehirn mit Biolumineszenz-Signal D) Gehirn mit GFP-Auflicht-Fluoreszenz-Signal. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
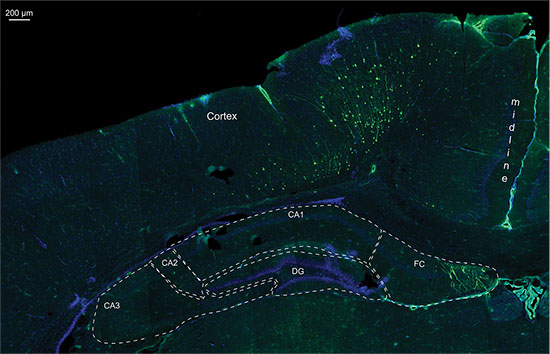
Abbildung 7. Detail eines Fluoreszenz-Bild aus einer 20 um Kryo Schnitt des gleichen P14 Rattenhirn mit GFP enthaltende Plasmid elektroporiert und LuciferaseVektor, Kerne mit DAPI-Färbung; CA1-3 = 1-3 Ammonshorn, DG = Gyrus dentatus, FC = Fasciolarum cinereum.
Video 1. 3D-Animation eines Hippocampus Elektroporation Ratte auf P14.
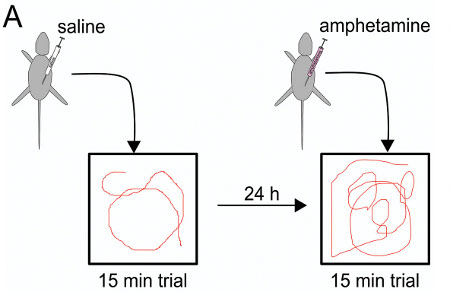
Abbildung 8. Benzedrintest Schema: am ersten Tag Kochsalzinjektion vor dem Versuch 15 min, 24 Stunden später Amphetamin-Injektion vor der Prüfung in der offenen Feldkammer.
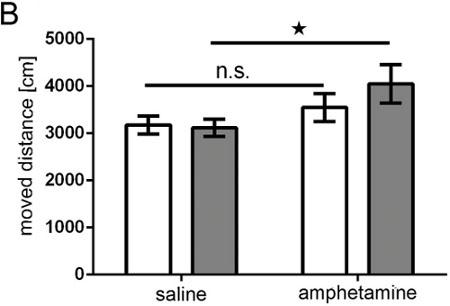
Abbildung 9. Amphetamin-Test. Bar Graph, bewegten Abstand (in cm) des Tieres durch eine Truescan-System über 15 min Weiße Balken = Kontrollgruppe aufgenommen;. Graue Balken = DISC1 Überexpression Gruppe; Kontrollgruppe n = 10; DISC1 Überexpression Gruppe n = 11; ANOVA: geno * p = 0,043 Behandlung, T-Test für Gesamtzeit Kochsalzlösung vs Amphetamin ns = nicht signifikant pcontrol = 0,172, pDISC1 = 0,001.
Diskussion
Unsere Untersuchung zeigt, dass IUE geeignet ist, erwachsenen Ratten mit Neuronen, die ein Transgen in einem selektiven Bereich des Gehirns, und dass als Ergebnis dieser Maßnahme, diese Tiere zeigen Verhaltensänderungen Funktionalität des geführt Manipulation anzeigt, zu erzeugen. In dieser Studie als ein Beispiel, Ratten überexprimieren DISC1 einseitig in einem kleinen Teil des präfrontalen Cortex zeigte Überempfindlichkeit gegen Amphetamin (Abbildung 9).
Auswählen Ratten für die Elektroporation Erfolg durch in vivo Biolumineszenz-Bildgebung war wirksam bei der Kontrolle für die inhärente Variabilität der IUE Zelltransfektion und wurde angelegt, um Gruppen mit einer homogenen IUE Bereich der niedrigen interindividuelle Variabilität für spätere Untersuchungen zu generieren.
In dieser Studie konnten wir elektroporiertem Welpen aus dem Wurf durch Nachweis der Co-Elektroporation GFP-induzierte Fluoreszenz bei Neugeborenen Tier auswählen, auch though zur gleichen Zeit und im gleichen Tier ein Biolumineszenz-Signal der ebenso Co-Elektroporation Luciferase-Luciferin konnte nach Injektion (Abbildung 6) festgestellt werden, und die GFP-exprimierenden Neuronen waren noch in einem Alter von sechs Monaten im Gehirn vorhanden. Wir schließen, dass, gut geeignet, um Tiere mit erfolgreichen Elektroporation Gehirn (Abbildung 3) zu differenzieren in der Ratte ist die Luciferase / Luciferin-Reaktion.
Die quantitative Überwachung der IUE Erfolg betrifft die Stärke des Biolumineszenz-Signal, das durch die Grafen von Photonen innerhalb der gleichen Belichtungszeit (Fig. 3) gemessen wird, und entspricht der enzymatischen Aktivität des co-exprimierten Luciferase. Kleine Biolumineszenz-Signale von 100-200 Grafen von Photonen nachweisbar, und bei einer Ausstrahlung von ~ 1x10 4 Photonen / sec / cm 2 / Steradian Show 1000-2000 GFP-gefärbten Zellen in der Histologie in der 6 Monate alte Rattenhirn. Die höchste Signal dispverlegt eine Ausstrahlung von bis zu ~ 5x10 6 Photonen / sec / cm 2 / Steradian und ~ 64.000 zählt.
In der Sprague Dawley-Rattenstamm verwendet, beobachteten wir eine Schwächung des Biolumineszenz-Signal in Längsrichtung mit zunehmendem Alter und das Signal über das Alter von P35 (Abbildung 4) verschwunden. Zu diesem Zeitpunkt wissen wir nicht, ob entweder die transiente Plasmid-Vektor-basierte Expression von Luciferase abnimmt, oder wenn der Biolumineszenz-Signal aufgrund der zunehmenden Hirnmasse oder beides sind die Ursachen für das Verschwinden Signal schwächt. Für die vorliegende funktionelle Assays in erwachsenen Ratten wurde die Selektion für Verhaltensstudien lediglich auf den Standort des Signals, aber nicht durch Biolumineszenz Signalstärke.
Auch wenn 3D quantitative Biolumineszenz-Überwachung erlaubt die Differenzierung zwischen verschiedenen Bereichen Elektroporation (Abbildung 5), wurde deren Richtigkeit für Zellen in der Tiefe befindet Cent begrenztnsion des Gehirns. Fig. 6 zeigt ein Beispiel eines hippocampalen Elektroporation, wo die Messung der Biolumineszenz in der 2D-und dem 3D-Bild zeigte eine gute Positionierung der Elektroporation. In der post mortem Gehirn seziert wurde ein GFP-Fluoreszenzsignal bei etwa der gleichen Position wie der Biolumineszenz-Signal detektiert, was anzeigt, korrekte Ausrichtung des Hippocampus. Histologie zeigt, dass aber auch Zellen in der Rinde des dorsalen Hippocampus gezielt worden war (Fig. 7). Dies zeigt, dass die Biolumineszenz-Assay ist ein nützliches Werkzeug, um positive, IUE Welpen erkennen und auch eine Vorstellung von der Elektroporation Bereich haben, aber letztlich Bildgebung kann nicht post mortem Histologie positiv Zielzellen genau lokalisieren zu ersetzen.
Unsere Demonstration zeigt Versprechen für die Anwendung der IUE-Technologie, um subtile gezielte Manipulationen der kortikalen Gehirnregionen Hippocampus oder zu aberrances in C simulieren erzeugenortical Migration oder anderen Mängeln, die die Entwicklung des Nerven erwachsenen Tier beeinflussen können. Während bilaterale Elektroporation 26 hat den Vorteil einer größeren Wahrscheinlichkeit Wirkung auf das Verhalten gibt es auch mehr Sterblichkeit der Embryos. Einseitige Elektroporation wurde, um die beiden Halbkugeln mit einem als interne Kontrolle sowie für die Ansicht, dass auch IUE Manipulation in einem einseitigen, kleinen Region ist ausreichend, um Verhalten zu ändern vergleichen gewählt. IUE-induzierte Veränderungen der Konnektivität oder Architektur zwischen Neuronen können somit ohne eine Läsion hervorzurufen und die erforderliche Übereinstimmung der zu-sein-IUE-manipuliert Region mit den entsprechenden Verhaltenstest induziert wird, hängt von der wissenschaftlichen Frage.
Fehlersuche
Reduzierte Wurfgröße Es gibt mehrere Vorschläge zur Erhöhung der Überlebensrate der Jungtiere IUE. Erstens, die Verwendung von sehr dünnen Glas-Kapillaren bei der Elektroporation, um Gewebe zu minimieren Lesion empfohlen. Zweitens, nicht die erste Embryo elektroporieren am Scheiden Ende jeder Uterus Horn: Tod des Erstgeborenen Embryo erhöht die Chancen auf einen Abbruch aller anderen Embryonen. Drittens, nach der Geburt, die Mutter zu töten Ratten oft Teil ihrer Nachkommen durch perinatalen Stress. Um zusätzlichen Stress zu reduzieren, nicht mit dem Live-Bild direkt nach der Geburt beginnen, sondern warten für sieben Tage.
GFP-Fluoreszenz-Detektion der Welpen
Nach einer Woche nach der Geburt, kein Signal der Fluoreszenz entweder mit Live-Fernglas fluoreszenzmikroskopische Abbildung oder Fluoreszenz-Imaging mit der IVIS Spectrum (Epi-Fluoreszenz und transfluorescence Modi, für GFP Anregung / Emission: 465/520 nm und 500/540 nm). Es ist möglich, dass sowohl die begrenzte Übertragung von kurzen Wellenlänge Anregungs-und Emissionslicht durch Gewebe wie der Schädel und der hohen Autofluoreszenz Hintergrund der Haut mit Fluoreszenz unter dem desc verhindernribed Bedingungen bei der Ratte. Wie in Fig. 6 gezeigt, kann die Luciferase-Signal im lebenden Tier auch im Gehirn seziert (ohne Schädel) nachgewiesen werden, und es gibt auch ein Fluoreszenzsignal detektierbar (Fig. 6D) ist.
Differenzierung der Biolumineszenz in eng benachbarten Hirnregionen
Auch in der 3D-Darstellung die Lage der Biolumineszenz-Bereich kann nicht zu 100% vorhergesagt werden. Insbesondere Zellen auf oder unterhalb der vorhergesagten Bereich kann auch zufällig gezielt und transfiziert werden. Die genaue Position ist durch post mortem (Fluoreszenz) Histologie gesteuert werden (siehe Abbildung 7).
Offenlegungen
Die Autoren dieser Studie haben keine finanziellen Interessen an dieser Studie und wurden nicht von der Industrie für diese Studie gefördert. Offener Zugang Gebühren wurden von PerkinElmer Inc. post-Veröffentlichung beigetragen.
Danksagungen
Die Autoren danken Tracy Young-Pearse und Atsushi Kamiya für die Bereitstellung von Plasmiden.
CK und (DE 792/2-4) an Masse; Diese Arbeit wurde von NEURON-ERANET entdecken OR und CK (BMBF 01EW1003), DFG (GRK1033 Ko 1679/3-1) gefördert
Materialien
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||
| Reagent name | |||||||||||||||||||||||||||||||
| Dulbecco's Phosphate-Buffered Saline (PBS) | Invitrogen | 14190-250 | without calcium, without magnesium | ||||||||||||||||||||||||||||
| D-luciferin, sodium salt | SynChem OHG, Germany | BC218 | CAS number: 103404-75-7 substrate for firefly-luciferase | ||||||||||||||||||||||||||||
| Fast Green FCF | Sigma Aldrich, USA | F7258-25G | CAS: 2353-45-9 | ||||||||||||||||||||||||||||
| D-Amphetamine | Sigma Aldrich, USA | A 5880 | CAS: 51-63-8 | ||||||||||||||||||||||||||||
| kodan Tinktur forte | Schülke Mayr GmbH, Germany | 104 005 | |||||||||||||||||||||||||||||
| Material / product | |||||||||||||||||||||||||||||||
| Glass capillaries | Sutter Instrument | Novato, California, USA | borosilicate glass O.D.:1 mm, I.D.: 0.78 mm | ||||||||||||||||||||||||||||
| Needle Pipette Puller | David Kopf Instruments | Tujunga, California, USA | |||||||||||||||||||||||||||||
| Tweezer electrode | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | 7 mm in diameter platinum disc electrodes (CUY650P7) | ||||||||||||||||||||||||||||
| Surgical Scissors - sharp | Fine Science Tools | Heidelberg, Germany | Straight, 12 cm (14002-12) | ||||||||||||||||||||||||||||
| Ring Forceps | Fine Science Tools | Heidelberg, Germany | 2.2 mm ID, 3 mm OD (11021-12) | ||||||||||||||||||||||||||||
| Square wave pulse electroporator (CUY21SC) | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | (CUY21SC) | ||||||||||||||||||||||||||||
| Vicryl surgical suture material | Ethicon | Norderstedt, Germany | 3-0; 2 Ph. Eur; | ||||||||||||||||||||||||||||
| Wound Clip Applicator | Fine Science Tools | Heidelberg, Germany | Reflex 9 mm (12032-09) | ||||||||||||||||||||||||||||
| Syringe filter | VWR | Darmstadt, Germany | 0.45 μm cellulose acetate | ||||||||||||||||||||||||||||
| IVIS Spectrum | Caliper Life Science / PerkinElmer | Waltham, MassachusettsUSA | |||||||||||||||||||||||||||||
| XGI-8 Gas Anesthesia System | PerkinElmer | Waltham, Massachuset tsUSA | |||||||||||||||||||||||||||||
| Open-field | Coulbourn Instruments | Allentown, USA | (40 x 40 x 39 cm) | ||||||||||||||||||||||||||||
| Tru Scan activity system | Coulbourn Instruments | Allentown, USA | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Referenzen
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In Utero Intraventricular Injection and Electroporation of E16 Rat Embryos. J. Vis. Exp. (6), e236 (2007).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero Electroporation followed by Primary Neuronal Culture for Studying Gene Function in Subset of Cortical Neurons. J. Vis. Exp. (44), e2103 (2010).
- Takahashi, M. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155 (2002).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J Comp Neurol. 483, 329-340 (2005).
- Young-Pearse, T. L., et al. A critical function for beta-amyloid precursor protein in neuronal migration revealed by in utero RNA interference. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 27, 14459-14469 (2007).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Sapir, T., et al. Accurate balance of the polarity kinase MARK2/Par-1 is required for proper cortical neuronal migration. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 28, 5710-5720 (2008).
- Weinberger, D. R. From neuropathology to neurodevelopment. Lancet. 346, 552-557 (1995).
- Murray, R. M., Lewis, S. W. Is schizophrenia a neurodevelopmental disorder?. British Medical Journal. 295, 681-682 (1987).
- Kamiya, A., et al. A schizophrenia-associated mutation of DISC1 perturbs cerebral cortex development. Nat Cell Biol. 7, 1167-1178 (2005).
- Miyoshi, K., et al. Disrupted-In-Schizophrenia 1, a candidate gene for schizophrenia, participates in neurite outgrowth. Mol Psychiatry. 8, 685-694 (2003).
- Mao, Y., et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell. 136, 1017-1031 (2009).
- Millar, J. K., et al. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum Mol Genet. 9, 1415-1423 (2000).
- Steinecke, A., Gampe, C., Valkova, C., Kaether, C., Bolz, J. Disrupted-in-Schizophrenia 1 (DISC1) is necessary for the correct migration of cortical interneurons. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 32, 738-745 (2012).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In utero electroporation as a tool for genetic manipulation in vivo to study psychiatric disorders: from genes to circuits and behaviors. The Neuroscientist : a Review Journal Bringing Neurobiology, Neurology and Psychiatry 18. , 169-179 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. 6, 1277-1283 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Development, Growth & Differentiation. 41, 335-344 (1999).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Featherstone, R. E., Kapur, S., Fletcher, P. J. The amphetamine-induced sensitized state as a model of schizophrenia. Progress in Neuro-psychopharmacology & Biological Psychiatry. 31, 1556-1571 (2007).
- Pum, M., Carey, R. J., Huston, J. P., Muller, C. P. Dissociating effects of cocaine and d-amphetamine on dopamine and serotonin in the perirhinal, entorhinal, and prefrontal cortex of freely moving rats. Psychopharmacology. 193, 375-390 (2007).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten