Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Stereotaktische Injektion von microRNA-exprimierenden Lentiviren der Maus Hippocampus CA1 Region und Beurteilung der Behavioral Outcome
In diesem Artikel
Zusammenfassung
MicroRNAs haben eine bedeutende Rolle in der Struktur des Gehirns und Funktion. Hier beschreiben wir eine Methode, um durchzusetzen Hippocampus miRNA-Überexpression mit stereotaktische Injektion eines gentechnisch miRNA-Expression lentivirus. Dieser Ansatz kann als eine relativ schnelle Weg zu der Beurteilung dienen In vivo Auswirkungen der überexprimierten miRNAs in spezifischen Hirnregionen.
Zusammenfassung
MicroRNAs (miRNAs) sind kleine regulatorische einzigen RNA-Moleküle etwa 22 Nukleotide lange, die kann jeder Ziel-mRNA-Transkripte und zahlreiche dim eine ganze Genexpression Weg durch Induktion Zerstörung und / oder Hemmung der Translation dieser Ziele. Mehrere miRNAs eine wichtige Rolle spielen bei der Aufrechterhaltung neuronaler Struktur und Funktion und in höheren Funktionen des Gehirns, und Methoden zur Manipulation ihrer Ebenen für die Erkundung dieser Funktionen gesucht. Hier präsentieren wir einen direkten in vivo-Verfahren zur Untersuchung der kognitiven Folgen der erzwungenen miRNAs Überschuss in Mäusen durch stereotaktische Injektion von miRNA-encoding Viruspartikel. Konkret beinhaltet das aktuelle Protokoll Injektion in den Hippocampus CA1-Region, die Säugetier-Speicher-Konsolidierung, Lernen und Stress-Reaktionen beiträgt und bietet eine bequeme Injektionsstelle. Die Koordinaten werden gemäß der Maus bregma und Viren Perfusion digital gesteuert und gehalten sehr langsam gemessen.Nach der Injektion wird die Operation Wunde verschlossen und die Tiere erholen. Lentiviren kodiert Schalldämpfer der entsprechenden mRNA Ziele dienen, um die spezifische miRNA / Target-Wechselwirkung verantwortlich für den beobachteten Effekt implizieren, mit naiven Mäuse, Mäuse mit Kochsalzlösung und Mäuse mit "leeren" Lentivirusvektoren als Kontrollen injiziert. Einen Monat nach der Injektion werden die Tiere in der Morris Water Maze (MWM) zur Beurteilung ihrer Navigation Lernen und Gedächtnis Fähigkeiten untersucht. Die MWM ist ein runder Behälter mit gefärbtem Wasser mit einer kleinen Plattform 1 cm unter der Wasseroberfläche untergetaucht gefüllt. Stetige visuelle Hinweise um den Tank für die räumliche Navigation (Ton und der Erde das Magnetfeld kann auch helfen, die Tiere in der Navigation) erlauben. Videokamera-Überwachung ermöglicht die Messung der Strecke von Bad und die Zeit zu finden und betragen die Plattform. Die Maus wird zuerst gelehrt, dass die versteckte Montage-Plattform bietet einen Ausweg aus der erzwungenen Schwimmen, es wird dann für die Verwendung dieser Flucht-und f getestetndlich ist die Plattform entfernt und Sonde Tests prüfen, ob die Maus erinnert sich an seine früheren Standort. Wiederholte Tests über mehrere Tage hintereinander markieren verbesserte Leistung der getesteten Mäuse in kürzeren Latenzzeiten zu finden und montieren Sie die Plattform, und da immer mehr direkte Wege, um die Plattform oder seine Position zu erreichen. Bei Nichterscheinen solche Verbesserung stellt beeinträchtigt Lernen und Gedächtnis und / oder Angst, die dann geprüft werden kann speziell (zB im erhöhten Plus-Labyrinth). Dieser Ansatz ermöglicht die Validierung von spezifischen miRNAs und Ziel-Transkripte in der untersuchten kognitiven und / oder Stress-Prozesse.
Einleitung
Die Rolle von miRNAs in bestimmten Funktion des Nervensystems wurde kürzlich von lentiviralen Injektion in mehreren Studien in Frage gestellt worden. MiRNAs gefunden werden entscheidend für die Aufrechterhaltung und Umformen Synapse Struktur 1, 2 und Synaptogenese Synapse Umbau und Wartung 3. Diese Studien deuten stark darauf hin, dass miRNAs tätig sind, über vielschichtigen regulatorische Effekte sowohl in der Gestaltung und bei der Aufrechterhaltung der Hauptausgang des Nervensystems, die kognitive Funktion. Stereotaktische Injektion von Lentivirus Teilchen in bestimmten Regionen im Gehirn von Nagetieren ermöglicht die Suche nach Änderungen in Synapse Morphologie und neuronaler Aktivität und wurde für die Herstellung der funktionelle Bedeutung überexprimierten Transkripte 4,5 verwendet. Direkte Infektion von Neuronen an wohldefinierten Hirnareale mit miRNA-exprimierenden Lentiviren kann in Studien des Alterns, Gehirn-Erkrankungen und Neurodegeneration beteiligt sein; Studium der miRNAs im Bereich der Verhaltens-Regulierung 6-8 sind in einer weit weniger fortgeschrittenen Stadium, und stereotaktische Injektion von miRNA-Expression lentivirus Teilchen durch Verhaltenstests gefolgt kann nützlich sein, für solche Zwecke. Eine wesentlich aufwendigere Verfahren zur Induktion über-oder unter-Ausdruck beinhaltet gentechnisch Knock-in-oder Knockout-Mäusen. Genetische Systeme können weiter für die bedingte und zeitliche Steuerung der Expression (zB Cre-Lox, Tet-Systeme) ermöglichen, aber diese bieten kaum die räumliche Spezifität der Injektion und es gibt fast immer eine gewisse Undichtigkeit. Auch müssen die technischen Verfahren nicht operiert und kann über Labors mit relativ guter Reproduzierbarkeit verwendet werden, jedoch sind sie langsamer und benötigen viel mehr personelle und finanzielle Ressourcen. Darüber hinaus ist die zeitliche Steuerung der Über-oder Unter-Expression in injizierten Mäusen ist weitaus genauer verglichen mit gentechnisch veränderten Mäusen.
Protokoll
1. Lentivirus Vorbereitung
- Wachsen HEK-Zellen 293FT bis 90% Konfluenz.
- Am Tag der Transfektion Änderung Zellmedium serumfreiem DMEM, ergänzt mit 1 mM Glutamin und 50 mg / ml Penicillin-Streptomycin.
- Co-Transfektion der Zellen mit einem pLKO.1-Puro Vektor und mit Plasmiden, die für das Delta-R8.2 und VSV-G-Reste und der miRNA von Interesse unter Verwendung von 10 ul 1 mg / ml Polyethylenimin als Träger 9.
- Sammle verpackten Lentiviren bei 24 h und 48 h nach der Transfektion Filter durch 0,45 um-Filter.
- Konzentrieren Sie sich die Lentiviren mit Ultrazentrifugation in 70.000 xg für 2 h und 15 ° C, und Aliquot bei -70 ° C.
- Messen Virustiter durch Infizieren von HEK-293T-Zellen, die mit seriell verdünnten Virus Zubereitungen (1 bis 10 -6 ml Vektor pro Vertiefung). Die resultierende Titer (mindestens ~ 1 × 10 9 infektiöse Partikel pro ml wird empfohlen) ist für die Expression des ge ausgewertetne von Interesse, mit Puromycin-Selektion und Quantifizierung von GFP-exprimierenden Viren durch Zählen fluoreszierenden Zellen.
Für weitere detaillierte Protokoll lentivirus Herstellung siehe 10.
2. Vorbereiten Tiere für Chirurgie
- Chirurgen Gewand sollte OP-Kittel, sterile Handschuhe, Mütze und Maske.
- Wiegen Sie das Tier dann betäuben sie mit einem IP-Injektion eines Ketamin Mischung, wobei das Volumen proportional zu dem Tier Gewicht wie für jedes Arzneimittel angegeben. Für eine Ketamin / Xylazin Mischung wird ein Dosisbereich von 80-200 mg / kg Ketamin und 7-20 mg / kg Xylazin in der Regel für Mäuse verwendet.
- Warten Sie, bis das Tier vollständig betäubt, dann aus Mangel an Rückzug Reflex im Hinterbein des Tieres überprüfen, indem sich das Bein und dann die Taste mit dem Finger.
- Injizieren Sie das Tier subkutan mit Rimadyl, wie auf der Verpackung angegeben ist, zur Schmerzlinderung. Typische Dosisbereich für Rymadil ist 5-10 mg.
- Legen Sie das Tier auf einem Heizkissen, um einen stetigen Körpertemperatur zu halten und befeuchten die Augen mit Salbe.
- Shave den Bereich zwischen den beiden Ohren mit einer Fräsmaschine.
- Desinfizieren Sie die Haut mit betadine.
3. Die Exposition der Schädel und Bohren
- Legen Sie das Tier innerhalb des stereotact indem die Stangen in die Spalten knapp vor dem Tier die Ohren.
- Verwenden Sie ein Skalpell, um eine Vorwärts-Rückwärts-Schnitt von ca. 1,5 cm zwischen den Ohren machen und halten Sie es mit der Operation Klemmen (serfines) zu öffnen.
- Reinigen Sie die Oberfläche des Schädels mit einem Wattestäbchen, bis der Schnittpunkt zwischen der Kranznaht und sagittalen Nähten, dh die Bregma und den Schnittpunkt zwischen den koronalen und lambdoiden Nähte, dh Lambda, sichtbar sind.
- Richten Sie die Spitze der Spritze, durch die stereotact gehalten, der Bregma Punkt, an allen drei Achsen. Notieren Sie sich die Koordinaten. Dieser Punkt würde als Null-po berücksichtigt werdenint in allen drei Achsen.
- Heben Sie die Spritze in der vertikalen Achse, so dass eine ebene Bewegung nicht kratzen würde den Schädel und bewegen Sie die Spritze Kopf an die richtige Stelle. Hippocampus CA1 Injektionen erfordern die folgenden Koordinaten relativ zum Bregma in mm: -2 an der vorderen / hinteren Achse, ± 1,8 bei der lateralen / medialen Achse bzw. -1,5 an der dorsal / ventral Achse.
- Senken Sie die Spitze der Spritze, bis er den Schädel berührt und markieren Sie die Stelle mit einem Marker. Entfernen Sie die Spritze zurück, um zu vermeiden Stechen.
- Bohren Sie ein flaches Loch, nur in den Schädelknochen mit einem feinen Bohrer. Halten Sie den Bohrer stetig, damit es nicht weiter in die weichen Gewebe unter bohren. Sie können dies durch Verstetigung einerseits mit dem anderen und durch Bohren in kurzen Impulsen zu verhindern.
4. Die Injektion des Lentivirus
- Ziehen Sie 0,5 ml der konzentrierten Lösung lentivirus.
- Legen Sie die Spritze über dem Loch und langsam und senkrecht absenken, bis es reaches die Oberfläche des Schädels. Fahren Sie mit der Spritze in das Gehirn sehr langsam senken. Bei diesem Schritt einige Blutungen auftreten, die nicht unbedingt auf eine fehlgeschlagene Penetration. Kommt es zu Blutungen wischen Sie sie mit einem Wattestäbchen.
- Stellen Sie den digitalen Pumpe bis 0,02 ml / min (0,5 ul würde in 25 min injiziert werden) und Infusion starten. Langsame Infusion ermöglicht eine effektive Ausbreitung des Virus in das Gewebe und verhindert Rückfluss. In einigen Spritze Arten betrachten Einsetzen der Spritze für eine zusätzliche Tiefe von 0,5 mm vor dem Rückzug zu den ursprünglichen Koordinaten und Infusion.
- Nach Infusion beendet ist für zusätzliche 5 Minuten, um das Material in das Gehirn statt Rückzug zurück in den Kanal mit der Spritze ausgebildet verbreiten.
- Entfernen Sie die Spritze sehr langsam und achten Sie zurück fließt. Wenn eine Rückströmung bei diesem Schritt festgestellt wird, wurde ein Teil des eingespritzten Materials wahrscheinlich verloren.
5. Wound Sealing and Recovery
- Seal the gewickelt mit Histoacryl. Achten Sie darauf, zu vermeiden undicht des Histoacryl in die Augen.
- Injizieren Sie das Tier intraperitoneal (IP) mit 1 ml vorgewärmten Kochsalzlösung, um eine Dehydratation zu vermeiden.
- Legen Sie das Tier in einem Käfig, der Erholung auf einem Heizkissen positioniert ist. Sehen Sie sich das Tier, während es für eine weitere Stunde erholt.
Bei der Gewichtsabnahme, Appetitlosigkeit, Schwäche sollte / Unfähigkeit, Futter oder Wasser, moribund oder Infektion, Euthanasie des Tieres zu erhalten durchgeführt werden. Akzeptierte für Euthanasie von Nagetieren sind Barbiturate, Inhalations-Anästhetika, CO 2, CO, oder Kaliumchlorid in Verbindung mit Vollnarkose.
Nach 4 bis 6 Wochen, beurteilen des Tieres Navigationsspeicher im Morris Water Maze beurteilt. Das wird in der Regel infizieren lentivirus meisten Zellen innerhalb der Injektion Sphäre.
6. Behavioral Assessment im Morris Water Maze
- Trainieren Sie die Tiere in der Morris Wasser-Labyrinth. Für genaue Ausbildung und Prüfung Protokoll sehen 11. Nach jedem Versuch, trocknen das Tier mit einem trockenen Tuch, ersetzen Sie ihn in seinem Käfig und erfrischen das Wasser in den Tank.
- Testen Sie die Tiere im Morris Water Maze an 3 aufeinanderfolgenden Tagen, 4 Versuche jeden Tag. Jeden Tag legen, das Tier in das Labyrinth in jeder der 4 Richtungen des Labyrinths (Nord, Süd, Ost und West) in einer sich verändernden, um z. B. einen Tag: Ost-West-Nord-Süd-, Tag zwei: West-Süd -Nord-Ost. Wischen Sie die Tiere nach jedem Versuch.
- Während der Testläufe verfolgen das Tier mit einem Tracking-System wie Noldus Trackingsystem.
- Nach der 12. Test-Studie, legen Sie das Tier in den Wassertank ohne die Plattform für eine Minute. Dies würde verwendet, um die Suchstrategie das Tier nimmt zu analysieren.
- Analysieren Sie die Daten wie in 12 vorgeschlagen.
Ergebnisse
Die Injektion von 0,5 ul Lentivirus in der CA1-Region des Hippocampus der Maus, mit der Strömungsgeschwindigkeit beim Protokoll angegeben ergibt einen infizierten Bereich von etwa 1 mm im rostralen-kaudalen Achse und etwa 0,5 mm in der medial-lateralen und vorderen -posterioren Achsen (Abbildung 3).
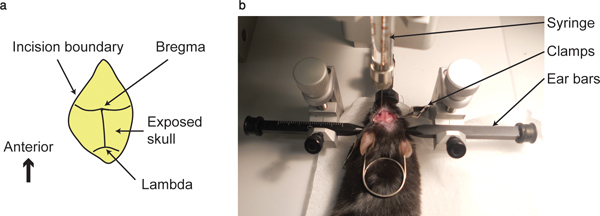
Abbildung 1. Bregma Punkt und Einspritzvorrichtung. (A)<...
Diskussion
Stereotaktische Injektion eines Lentivirus ist ein relativ schnelles Verfahren zur in vivo Beurteilung sowohl Vorwärts-oder Rückwärts-Regulation verschiedener Gene und miRNA. Die wichtigste Alternative ist eine gentechnisch veränderte Maus, die ein viel mühsame und zeitaufwendige Technik dann direkt lentivirus Injektion ist. Darüber hinaus ist die Regelung bis in lentivirus Injektion, tritt zu einem bestimmten Zeitpunkt in der erwachsenen Maus und beinhaltet keine Möglichkeit Undichtigkeit während der E...
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Diese Studie wurde von der Edmond und Lily Safra Center for Neurowissenschaften (SB Gemeinschaft), The Legacy Heritage Biomedical Science Partnership Programm der Israel Science Foundation (Grant No 378/11, zu HS) und der Deutsch-Israelischen Stiftung für wissenschaftliche unterstützt Forschung und Entwicklung (GIF) (Grant No 1093-32.2/2010 zu HS).
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 | |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 | |
Referenzen
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten