Method Article
V3 Stain-free Workflow für eine praktische, bequeme und zuverlässige Total Protein Loading Control in Western Blotting
In diesem Artikel
Zusammenfassung
V3-Workflow ist ein Western-Blot-Verfahren mit fleckenfreien Gelen. Die fleckenfreie Technologie ermöglicht es Forschern, die Proteintrennungsqualität zu visualisieren, die Übertragungseffizienz zu überprüfen und vor allem die Veränderung des von Interesse interessierten Proteins mithilfe der gesamten Proteinquantifizierung als zuverlässige Belastungskontrolle zu validieren.
Zusammenfassung
Der westliche Blot ist eine sehr nützliche und weit verbreitete Labortechnik, aber seine Ausführung ist eine Herausforderung. Der Workflow wird oft als "Black Box" charakterisiert, da ein Experimentalist nicht weiß, ob er bis zum letzten von mehreren Schritten erfolgreich ausgeführt wurde. Darüber hinaus wird die Qualität der westlichen Blot-Daten manchmal aufgrund des Mangels an effektiven Qualitätskontrollinstrumenten während des gesamten westlichen Blotting-Prozesses in Frage gestellt. Hier beschreiben wir den V3-Western-Workflow, der fleckenfreie Technologie anwendet, um die Hauptprobleme im Zusammenhang mit dem traditionellen Western Blot-Protokoll anzugehen. Dieser Workflow ermöglicht es Forschern: 1) ein Gel in etwa 20-30 min laufen; 2) die Qualität der Probentrennung innerhalb von 5 min nach dem Gellauf zu visualisieren; 3) Proteine in 3-10 min zu übertragen; 4) quantitativ die Übertragungseffizienz zu überprüfen; und vor allem 5) Veränderungen des Proteins von Interesse mit der totalen Proteinbelastungskontrolle zu validieren. Dieser neuartige Ansatz eliminiert die Notwendigkeit, den Blot für Haushaltsproteine wie β-Actin, β-Tubulin, GAPDH usw. zu entfernen und zu reprosieren. Der V3-Schmutz-Workflow macht den Western-Blot-Prozess schneller, transparenter, quantitativer und zuverlässiger.
Einleitung
Western Blot ist eine sehr nützliche Technik9, aber es gibt zwei große Herausforderungen mit westlichen Blotting: langen und arbeitsintensiven Prozess und Qualität der Daten. Ein traditionelles Protokoll benötigt ca. 2 Tage. Es umfasst viele Schritte, einschließlich Probenvorbereitung, Gelguss, Proteinelektrophorese und Transfer, Membranblockierung gefolgt von Antikörper-Inkubation, Bildgebung, und ziemlich oft, Reprobing, und schließlich Datenanalyse. Während dieses gesamten Prozesses gibt es keine zuverlässigen und flexiblen Werkzeuge für die Prozesssteuerung. Daher können bei jedem Schritt Fehler auftreten, und diese Fehler haben das Potenzial, Datenartefakte zu generieren. Daher sind Ladekontrollen im westlichen Blotting unerlässlich, um die Fehler zu identifizieren und zu korrigieren. Die Belastungskontrolle erfolgt in der Regel durch Überprüfung des Proteinspiegels eines Referenzproteins in jeder Probe, um festzustellen, ob es gleich dargestellt wird. Menschen verwenden oft Housekeeping-Proteine, wie z. B. β-Actin, β-tubulin, GAPDH, als Ladekontrolle.
Die Qualität der westlichen Blot-Daten hängt von einer zuverlässigen Ladekontrolle ab. Bei der Verwendung von Haushaltsproteinen für Dieladekontrollen bestehen jedoch zwei berechtigte Bedenken: 1) die Antikörper-basierte Immundetektion der Housekeeping-Proteinbänder ist oft gesättigt, so dass man die Belastungsunterschiede zwischen den Proben30nicht unterscheiden kann; 2) der Gehalt an Proteinexpression kann in den Proben unter bestimmten experimentellen Bedingungen variieren, z. B. siRNA-Behandlung, Zelltod, Zelldifferenzierung, etc.11,28,3,6,10,21. Aufgrund dieser Bedenken verlangen wissenschaftliche Fachzeitschriften nun, dass "für quantitative Vergleiche geeignete Reagenzien, Steuerungen und bildgebende Verfahren mit linearen Signalbereichen verwendet werden sollten" (Naturrichtlinie). In ähnlicher Weise fordern Redakteure des Journal of Clinical Investigation zuverlässigere Ladekontrollen24. Aus diesen Gründen muss ein Housekeeping-Protein validiert werden, um als Ladekontrolle verwendet zu werden. Zunächst muss man sicherstellen, dass es im linearen Dynamikbereich der Immundetektionsmethode14,29gemessen wird. Zweitens muss man sicherstellen, dass es konsequent in allen Proben26,31,25,19,20ausgedrückt wird.
Eine alternative Lösung für eine zuverlässige Belastungskontrolle ist die Verwendung der Gesamtproteinmessung aus dem Fleck. Einige Forscher haben die Flecken mit totalen Proteinflecken wie Coomassie, Flamingo Pink, Sypro Ruby, Amido Black, Ponceau S und fleckenfreie Technologie gefleckt, um das gesamte Proteinsignal in jeder Spur als Ladekontrolle16,20,13,27,1,4,12zu messen. Die gesamte Proteinbelastungskontrolle vermeidet die Fallstricke, die mit Housekeeping-Proteinen verbunden sind. Erstens ist es eine wahre Reflektion der Menge an Protein für jede Probe geladen. Zweitens weist der Gesamtproteinfleck einen hervorragenden linearen Dynamikbereich im gemeinsamen Belastungsbereich für die Western-Blot-Analyse auf (10-50 g Protein eines komplexen Zelllysats) und unterscheidet den Belastungsunterschied zwischen den Probengenau 12.
Die fleckenfreie Technologie ist eine neuartige Gesamtprotein-Färbungsmethode, bei der eine einzigartige Verbindung in Acrylamid-Gel-Lösung gemischt und gleichmäßig im gegossenen Gel verteilt wird. Nach Abschluss der Elektrophorese wird das Gel mindestens 1 min UV-Licht ausgesetzt, so dass die Fleckenverbindung mit den Tryptophan-Rückständen im Protein reagiert. Die Proteine werden unter UV-Licht erregbar, um ein starkes fluoreszierendes Signal zu geben, das in einem fleckenfreien, aktivierten Imager wie dem ChemiDoc MP-System visualisiert und quantifiziert werden kann. Die fleckenfreie Verbindung selbst absorbiert jedoch kein UV-Licht, was zu einem niedrigen Hintergrund des Gelbildes führt. Die Modifikation der Tryptophan-Rückstände ist irreversibel und Proteine können nicht nur im Gel, sondern auch auf dem Fleck jederzeit nach dem Proteintransfer visualisiert werden.
Die fleckenfreie Technologie wird im V3 Western Workflow (Abbildung 1) eingesetzt, um die hauptbelangen Beschwerden über den traditionellen Workflow zu beheben, insbesondere die Bedenken bei der Verwendung von Haushaltsproteinen als Ladesteuerung. Mit diesem Workflow könnte man: 1) ein Gel in ca. 20-30 min, 2) überprüfen Probenintegrität und Proteintrennung Qualität in 5 min nach Gellauf; 3) Übertragen von Proteinen in 3-10 min; 4) die Übertragungseffizienz quantitativ zu überprüfen; und 5) am wichtigsten ist, Änderungen des Wertes des Proteins von Interesse mit der totalen Proteinbelastungskontrolle zu validieren.
Protokoll
1. Protein-Probenvorbereitung
(Ein typisches Verfahren zur Extraktion von Proteinen aus der Zellkultur wird beschrieben)
- Legen Sie die HeLa-Zellkulturschale in Eis und waschen Sie die Zellen mit eiskalter Tris-gepufferter Saline (TBS; 20 mM Tris-HCl, pH 7,5, 150 mM NaCl).
- Aspirieren Sie das TBS, dann fügen Sie 1 ml pro 100 mm Schale eiskalten RIPA Puffer (50 mM Tris-HCl pH 8.0, 150 mM NaCl, 1% NP-40, 0,5% Natriumdeoxycholat, 0,1% SDS) ergänzt mit Phosphatase und Protease-Inhibitoren.
- Kratzen Haften zellen aus der Schale mit einem kalten Kunststoff-Zell-Schaber; die Zellsuspension vorsichtig in ein vorgekühltes Mikrozentrifugenrohr übertragen.
- Halten Sie konstante Sergung für 30 min bei 4 °C auf einem Rotator.
- Drehen Sie bei 16.000 x g für 20 min in einer vorgekühlten Zentrifuge von 4 °C.
- Entfernen Sie das Rohr vorsichtig von der Zentrifuge und legen Sie es auf Eis. Den Überstand auf ein frisches Rohr auf Eis geben und das Pellet entsorgen.
- Entfernen Sie ein kleines Volumen (10-20 l) Lysat, um einen Proteintest durchzuführen. Bestimmen Sie die Proteinkonzentration für jede Probe mit dem RC DC Assay Kit.
- Bei Bedarf die Proteinproben für die Langzeitlagerung bei -20 °C aliquotieren. Wiederholte Gefrier- und Tauwetterzyklen verursachen Proteinabbau und sollten vermieden werden.
- Nehmen Sie ca. 20 g jeder Probe, fügen Sie ein gleiches Volumen von 2x Laemmli Probenpuffer (4% SDS, 10% 2-Mercaptoethanol, 20% Glycerin, 0,004% Bromphenolblau, 125 mM Tris-HCl, pH 6,8).
- Erhitzen Sie jede Zelle im Probenpuffer bei 95 °C für 5 min.
- Zentrifuge bei 16.000 x g in einer Mikrozentrifuge für 1 min.
2. Gelelektrophorese mit fleckenfreien Gelen (ca. 30 min)
- Nehmen Sie ein Criterion TGX Any KD fleckenfreies Precast-Gel (ein Midi-Format-Gel), entfernen Sie den Kamm und das Band von der Unterseite der Kassette.
- Legen Sie die Kassette in die Criterion-Zelle und füllen Sie die integrierte obere Pufferkammer mit 60 ml Laufpuffer (25 mM Tris, 190 mM Glycin, 0,1% SDS, pH 8,3). Spülen Sie die Brunnen mit dem laufenden Puffer.
- Füllen Sie jede Hälfte des unteren Puffertanks mit 400 ml Laufpuffer auf die markierte Fülllinie.
- Laden Sie die Proteinproben und die entsprechenden Proteinmarker.
- Legen Sie den Deckel auf den Tank und richten Sie die farbcodierten Bananenstecker mit entsprechenden Buchsen auf den Deckel aus.
- Führen Sie das Gel für 30 min bei 200 V oder 20 min bei 300 V.
3. Fleckenfreie Gel-Bildgebung mit dem Chemidoc MP-System zur Überprüfung der Proteintrennungsqualität (ca. 5 min)
- Entfernen Sie die Gelkassette aus der Zelle. Verwenden Sie das Öffnungswerkzeug der Gelkassette im Criterion Cell Deckel, um die Kassette zu öffnen und das Gel loszulassen.
- Tragen Sie ein paar Milliliter Wasser auf die Mitte des UV-Probenfachs des ChemiDoc MP-Imagers auf. Heben Sie das Gel vorsichtig aus der Kassette und legen Sie es auf das Fach.
- Starten Sie die Image Lab-Software und erfassen Sie das fleckenfreie Gelbild (Abbildung 1A) mit den folgenden Einstellungen:
Anwendung: fleckenfreies Gel
Gelaktivierungszeit: 1 min
Bildgebungsbereich: Kriterium Gel
Bildbelichtungszeit: automatisch optimiert für die intensivsten Bänder - Entfernen Sie das Gel aus dem Probenfach und fahren Sie sofort mit dem Übertragungsschritt fort.
4. Proteintransfer mit dem Trans-Blot Turbo System (ca. 10 min)
- Öffnen Sie ein Trans-Blot Turbo Midi PVDF Transfer Pack; legen Sie den unteren Stapel (einschließlich der Membran) auf die Basis der Transferkassette.
- Legen Sie das Gel auf die Membran, legen Sie den oberen Stapel auf das Gel und rollen Sie Blasen aus.
- Legen Sie den Deckel auf die Kassettenbasis und drehen Sie das Zifferblatt, um es zu verriegeln.
- Legen Sie die Kassette in den Blotterschacht ein.
- Starten Sie die Übertragung, indem Sie ein voreingestelltes Turbo-Programm auswählen und die Criterion-Gelgröße (midi) auswählen, und drücken Sie dann RUN. Ein typischer Lauf dauert nur 7 min.
- Wenn der Transfer vorbei ist, zerlegen Sie das Fleck-Sandwich und legen Sie sowohl den Fleck als auch das Gel in einen Behälter mit entionisiertem Wasser.
5. Fleckenfreie Gel- und Blot-Bildgebung mit dem Chemidoc MP-System zur Überprüfung der Proteintransfer-Effizienz und -Qualität (ca. 5 min)
- Legen Sie das Post-Transfer-Gel auf das Probenfach des ChemiDoc MP-Imagers.
- Starten Sie die Image Lab-Software und erfassen Sie das fleckenfreie Bild des Post-Transfer-Gels (Abbildung 1B) mit den folgenden Einstellungen:
Anwendung: fleckenfreies Gel
Gelaktivierungszeit: keine
Bildgebungsbereich: Kriterium Gel
Bildbelichtungszeit: gleiche Belichtungszeit für das Pretransfer-Gelbild - Entfernen Sie das Gel aus dem Probenfach, und stellen Sie dann den Blot (Abbildung 1C) mit den folgenden Einstellungen ab. Halten Sie den Fleck nass mit ein paar Tropfen Wasser oder TBST bei der Bildgebung.
Anwendung: stain-free blot
Bildgebungsbereich: Kriterium Gel
Bildbelichtungszeit: automatisch optimiert für die intensivsten Bänder - Entfernen Sie die Blotungsmembran aus der Probenschale und legen Sie sie in einen Behälter mit TBST (0,1% Tween 20 in TBS).
6. Antikörper-Inkubation
- Blockieren Sie, indem Sie den Fleck in einer Lösung von 3% Rinderserumalbumin (BSA) in TBST bei Raumtemperatur für 1 Stunde platzieren.
- Inkubieren Sie den Blot über Nacht bei 4 °C in der Lösung, die mausprimärer Antikörper enthält, der gegen das erste Zielprotein und den Kaninchen-Primärantikörper aufgebracht wird, der gegen das zweite Zielprotein aufgebracht wird.
- Gießen Sie die Lösung, die den primären Antikörper enthält. Als nächstes waschen Sie den Fleck, indem Sie in 20 ml TBST für 5 min. Wiederholen Sie 4x für insgesamt 5 Wähbe.
- Inkubieren Sie für 1 Stunde bei Raumtemperatur in der sekundären Antikörperlösung, die einen konjugierten Goat-Anti-Maus-Antikörper Dylight 650 und einen Dylight 549 konjugierten Ziegen-Anti-Kaninchen-Antikörper enthält.
- Gießen Sie die Lösung, die den primären Antikörper enthält. Als nächstes waschen Sie den Fleck, indem Sie in 20 ml TBST für 5 min. Wiederholen Sie 4x für insgesamt 5 Wähbe.
7. Bildgebung und Datenanalyse durch Image Lab Software - TotalE Proteinnormalisierung (ca. 5 min)
- Erfassen Sie ein Multiplex-Fluoreszenzbild des Blots (Abbildung 1E), indem Sie ein neues Mehrkanalprotokoll öffnen, drei fluoreszierende Kanäle konfigurieren und das Protokoll ausführen.
Kanal 1:
Bewerbung blot Dylight 650
Bildgebungsbereich: Kriterium Gel
Bildbelichtungszeit: automatisch optimiert für die intensivsten Bänder
Kanal 2:
Bewerbung blot Dylight 549
Bildgebungsbereich: Kriterium Gel
Bildbelichtungszeit: automatisch optimiert für die intensivsten Bänder
Kanal 3:
Anwendung: stain-free blot
Bildgebungsbereich: Kriterium Gel Bildbelichtungszeit: automatisch optimiert für die intensivsten Bänder - Klicken Sie in der Analyse-Toolbox auf das Symbol Normalisierung, und klicken Sie auf Ja, um Spuren und Bänder zu erkennen.
- Wählen Sie "Lanes and Bands tools" aus, und verwenden Sie sie, um bei Bedarf Anpassungen an den Fahrspuren und Bändern vorzunehmen.
- Wählen Sie das fleckenfreie Bild als Normalisierungskanal aus.
- Wählen Sie MW-Analysewerkzeuge aus, und weisen Sie die MW-Standardspuren zu, indem Sie die entsprechenden Kästchen aktivieren.
- Um die normalisierten Volumes anzuzeigen, klicken Sie auf der Symbolleiste auf die Analysetabelle. Alle Berechnungen werden automatisch von der Software durchgeführt, einschließlich des Normalisierungsfaktors und der normalisierten Volumes. Die Intensitätswerte des Zielproteinsband werden nun um die Variation der Proteinlast angepasst. Dies ermöglicht genaue Vergleiche von Zielproteinen zwischen den Proben.
Ergebnisse
1. Bewertung der Probenintegrität, Proteintrennungsqualität und Übertragungseffizienz mit fleckenfreien Gelbildern.
Proteinextrakt aus HeLa-Zellen wurde bei 300 V für 20 min auf einem 18-Well Criterion AnyKD TGX fleckenfreies Gel getrennt. Die Proteinproben wurden 3x in vier verschiedenen Mengen (Lanes 1-3, 40 g; Bahnen 4-6, 30 g; Bahnen 7-9, 20 g; Bahnen 10-12, 10 g). Das Gel wurde 1 min unter UV-Licht aktiviert. Abbildung 2A zeigt das gelbild, das direkt nach der Proteintrennung aufgenommen wurde. Mit diesem Gelbild können die Proteinprobenintegrität(z.B. Abbau) und die Trennqualität(z.B. Proteinfällung) visuell beurteilt werden. Proteine wurden dann 7 min lang mit Trans-Blot Turbo auf eine Nitrocellulosemembran übertragen. Abbildung 2B zeigt das fleckenfreie Bild des Post-Transfer-Gels. Beide Bilder wurden mit der gleichen Belichtungszeit (6,8 Sek.) aufgenommen. Lane 3 und 12 wurden ausgewählt, um die Übertragungseffizienz zu messen. Mit dem Volumenwerkzeug in der Image Lab-Software wurde eine rechteckige Box (blau) gezeichnet, um Spur 3 und 12 auf beiden Gelbildern abzudecken. Die Berechnung auf der Grundlage der Volumenwerte aus diesen Feldern ergab, dass die Übertragungseffizienz beider Fahrspuren 80 % betrug (Abbildung 2C). In diesem Experiment wurde das AnyKD TGX Gel ausgewählt, um kleine bis mittelgroße Zielproteine zu untersuchen, und es war nicht für den Transfer großer Proteine optimiert. Die Optimierung der Übertragungseffizienz würde die Verwendung von geläutes gel(z. B. 4-20%) erfordern. und/oder eine Anpassung der Transferzeit, um den Transfer großer Proteine zu erleichtern. 2. Die fleckenfreie Gesamt-Proteinbelastungskontrolle ist eine zuverlässige Alternative zur Haushaltsbeladungskontrolle im westlichen Blotting, um eine kleine Veränderung des Proteinanteils zu quantifizieren.
MCM-7 ist ein DNA-Lizenzierungsreplikationsfaktor, deren Niveau in Lymphoblastoid-Zelllinien (LCL) nach der Bestrahlungsbehandlung um 20-50% abnimmt. In diesem Experiment wurden Lysate (je 30 g) von vier kontroll- und bestrahlungsbehandelten Lymphoblastoid-Zelllinienkulturen (LCL) auf einem 12-Well-Kriterium AnyKD TGX-Flecken-freien Gel getrennt. Das Gel wurde 1 min unter UV-Licht aktiviert und von Trans-Blot Turbo zur Immunoblotting auf eine PVDF-Membran übertragen. Das Housekeeping-Protein GAPDH (grün) wurde mit einem Kaninchen-Antikörper (Cell Signaling Technology, USA, 1:2.500) und einem Dylight 549 konjugierten Ziegen-Anti-Kaninchen-Antikörper (Rockland, USA, 1:20.000) untersucht. Das protein of interest MCM-7 (red) was sondiert mit a mouse antikörper (Abcam, USA, 1:1,000) and a Dylight 649 konjugated Goat-anti-mouse antikörper (Rockland, 1:10,000).
Abbildung 3A zeigt ein Multiplex-Fluoreszenzbild der Gesamtproteine (blau), MCM-7 (rot) und GAPDH (grün), die in vier kontroll- und bestrahlungsbehandelten LCL-Proben nachgewiesen wurden. Abbildung 3B ist ein fleckenfreies Bild desselben Flecks, das die gesamten Proteinmuster in jeder Probe (30 g) zeigt. Die Image-Labor-Software wählte die Probenspuren (blaue Boxen) aus, um MCM-7, GAPDH und das gesamte Proteinvolumen in jeder Spur zu messen. Die MCM-7-Spiegel wurden entweder gegen die fleckenfreie Gesamtproteinmessung oder gegen GAPDH normalisiert. Die normalisierten MCM-7-Proteinspiegel wurden statistisch analysiert und das durchschnittliche MCM-7-Proteinbandvolumen und die Standardabweichung (n=4) werden in der Tabelle dargestellt (Abbildung 3C). Beide Normalisierungsmethoden ergaben einen leichten Rückgang (ca. 25%) in MCM-7-Proteinspiegeln nach Bestrahlungsbehandlung. Die Daten mit der Gesamtproteinnormalisierung wiesen eine geringere Standardabweichung auf als bei GAPDH als Ladekontrolle.
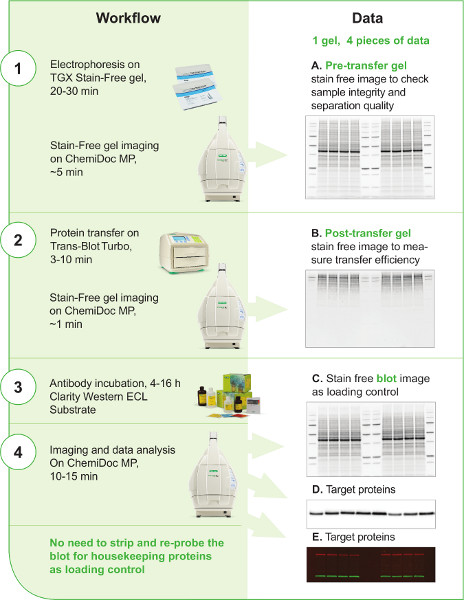
Abbildung 1. V3 Westlicher Workflow. Der V3-Workflow wird in der linken Spalte in 4 Schritten dargestellt. Die wichtigsten Instrumente und Reagenzien, die im Workflow verwendet werden, werden in jedem Schritt gezeigt. Die geschätzte Zeit für jeden Schritt ist ebenfalls enthalten. Die rechte Spalte zeigt, dass mindestens 4 Bilder im V3-Workflow generiert werden können. Die Verwendung der einzelnen Daten wird beschrieben. Die fleckenfreien Bilder des Pretransfer-Gels, des Post-Transfer-Gels und des Blots (A, B, C) können mit traditionellen westlichen Blotting-Techniken nicht leicht erzeugt werden; Diese Bilder und Daten liefern wichtige Informationen und Checkpoints entlang des Verfahrens, um die Kontrolle und Reproduzierbarkeit des Western Blot-Workflows durch den Wissenschaftler zu verbessern. Die Zielproteinsignale können entweder auf einem chemilumineszierenden Blotbild (D) erfasst werden, wenn ein HRP-konjugierter Sekundärantikörper bei der Detektion oder auf einem fluoreszierenden Fleckbild (E) angewendet wurde, wenn multiplexierende fluoreszierende Westernblotting durchgeführt wurde, um mehr als ein Zielprotein gleichzeitig auf demselben Fleck zu detektieren.
Klicken Sie hier, um ein größeres Bild anzuzeigen.

Abbildung 2. Fleckenfreie Bilder von Pretransfer- und Post-Transfer-Gelen im V3-Western-Workflow zur Bewertung der Probenintegrität, Trennqualität und Übertragungseffizienz. (A) Pretransfer-Gel fleckenfreies Bild. (B) Post-Transfer-Gel fleckenfreies Bild. (C) Messung der Proteintransfereffizienz.
Klicken Sie hier, um ein größeres Bild anzuzeigen.
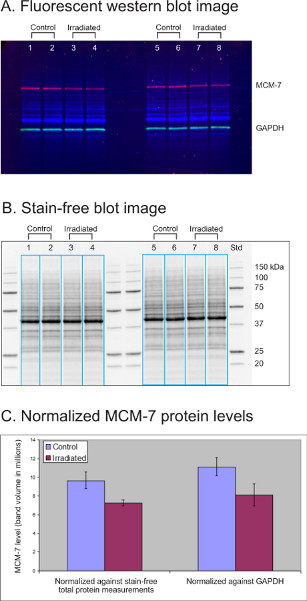
Abbildung 3. Vergleich der fleckenfreien Gesamtproteinmessung mit GAPDH-Immundetektion als Belastungskontrolle zur Normalisierung des Proteingehalts. (A) Fluoreszierendes westliches Blotbild. (B) Fleckenfreies Blotbild. (C) Normalisierter MCM-7-Proteinspiegel.
Klicken Sie hier, um ein größeres Bild anzuzeigen.
Diskussion
Das oben beschriebene V3-Buntfreie Protokoll ist für das Multiplexieren von fluoreszierendem Western-Blotting. Es kann auch in westlichen Blotting mit chemiluminescent Detektion angewendet werden. Im Multiplex-Fluoreszenz-Western-Blot-Protokoll werden die fleckenfreien Blot-Bilder an zwei Zeitpunkten aufgenommen: 1) direkt nach dem Proteintransfer; 2) bei der Multiplex-Fluoreszenz-Bildgebung nach der Antikörperinkubation. Das erste fleckenfreie Bild wird verwendet, um die Übertragungseffizienz zu berechnen und das zweite fleckenfreie Bild wird als Ladesteuerung verwendet. Wenn die chemilumineszierende Methode angewendet wird, ist es nicht möglich, ein Multiplexbild für die fleckenfreien und Zielproteinsignale zu nehmen, da das chemilumineszierende Signal auch im fleckenfreien Kanal angezeigt wird. In diesem Fall empfehlen wir, das fleckenfreie Bild, das direkt nach dem Proteintransferschritt aufgenommen wurde, zur Belastungskontrolle und Normalisierungsanalyse zu verwenden.
Der V3-Western-Workflow bietet die folgenden einzigartigen Vorteile im Vergleich zum herkömmlichen Western-Blot-Workflow, der Housekeeping-Proteine als Ladesteuerung verwendet:
Erstens bietet der V3-Workflow eine praktische, komfortable und zuverlässigere Ladekontrolle, um die Veränderungen im Niveau des Proteins von Interesse zu validieren. Das V3-Protokoll verwendet eine Total-Protein-Ladekontrolle, um den Interessenkonfliktin in jeder Probe zu normalisieren. Es vermeidet zwei Fallstricke bei der Verwendung der Haushaltsproteine als Ladekontrolle: gesättigte Immunerkennung und inkonsistente Housekeeping-Proteinexpressionsniveaus unter den Proben unter bestimmten experimentellen Bedingungen. Stripping und Reprobing Schritte mit Antikörpern gegen die Hauswirtschaft sind nicht mehr notwendig. Mit der fleckenfreien Technologie ist es nicht notwendig, einen Fleck mit Flecken wie Coomassie oder Sypro Ruby für die gesamte Proteinmessung zu färben und zu entfärben. Es dauert nur ein paar Sekunden, um ein Blot-Bild zu erfassen und etwa 5 min, um die totale Proteinnormalisierung mit Image Lab Software zu tun.
Zweitens ermöglicht der V3-Workflow Wissenschaftlern eine bessere Kontrolle über das westliche Verfahren, da er das Verfahren transparenter macht und mehrere Kontrollpunkte für die Qualitätskontrolle einführt. Mit Hilfe der fleckenfreien Technologie können Forscher ihre Proteinproben sowohl auf dem Gel als auch auf dem Fleck visualisieren. Wissenschaftler können die Proteinprobenintegrität (degradiert oder nicht), die Trennungsqualität (gefällt oder nicht), die Übertragungseffizienz und die Übertragungsqualität (auch Transfer oder nicht) bewerten. Diese Checkpoints helfen Den Forschungen, das Experiment zu beenden, wenn große Fehler im Prozess zu sehen und vermeiden, Zeit für schlechte Proben und Flecken zu verschwenden. Diese Technologie hilft Wissenschaftlern auch zu beurteilen, ob es eine signifikante Menge an Proteinverlust nach dem Entfernen der Membran gibt und ob der Fleck für das Reprobing eines anderen Ziels 4geeignet ist.
Hier sind ein paar Tipps, um eine gute Erfahrung und Qualität der Daten mit V3 Western Workflow zu gewährleisten.
- Stellen Sie das Gel unmittelbar nach dem Gellauf ab. Das Gel vor der ersten Bildgebung im Verfahren nicht in einen Puffer einweichen, da es die Fleckenverbindung wegwaschen kann.
- Verwenden Sie denselben Bildbereich, um alle Bilder im Protokoll zu erfassen. Dies ermöglicht es der Software, Bilder für die Datenanalyse wie die totale Proteinnormalisierung zu überlagern.
- Halten Sie die Belichtungszeit konsistent, wenn Sie die Vortransfer- und Post-Transfer-Gele abbilden. Auf diese Weise kann die Software die Übertragungseffizienz quantitativ messen.
- Halten Sie die Membran mit ein paar Tropfen Wasser oder TBST nass, wenn Sie das Blot-Bild erfassen. Dadurch werden mögliche schmutzige Hintergrundprobleme für die Zielproteinerkennung vermieden.
- Verwenden Sie eine fluoreszierende PVDF-Membran mit niedrigem Fluoreszenz für multipleszierendes Fluoreszenz-Western-Blotting.
Es ist wichtig zu beachten, dass das fleckenfreie Molekül nach UV-Aktivierung irreversibel an Tryptophan-Rückstände gebunden ist. Diese irreversible Modifikation kann sich möglicherweise auf die Antigenerkennung bei der Verwendung monoklonaler Antikörper auswirken, wenn das Epitop Tryptophan enthält. Polyklonale Antikörper sind unwahrscheinlich, da sie mehrere Epitope auf dem Antigen erkennen. Ungebundene fleckenfreie Moleküle lassen sich leicht vom Gel und der Membran abwaschen und stören daher nicht die Wechselwirkungen zwischen Antikörpern und Antigen.
Zusammenfassend lässt sich sagen, dass der V3-Western-Workflow den Western Blot-Prozess schneller, transparenter, quantitativer und zuverlässiger macht. Forscher können nun leicht die totale Proteinbelastungskontrolle in einem westlichen Blot-Experiment anwenden, um ihre Daten vertrauenswürdiger zu machen. Der V3-Workflow wurde von einer Reihe von Labors übernommen, und ihre Veröffentlichungen haben gezeigt, dass Zeitschriften fleckenfreie Daten als Ladekontrolle im westlichen Blot22,17,7,8,5,23,18,15akzeptieren.
Offenlegungen
Die Autoren Anton Posch, Jonathan Kohn, Kenneth Oh, Matt Hammond und Ning Liu sind Mitarbeiter von Bio-Rad Laboratories, Inc.
Danksagungen
Die Autoren danken Dr. Wolf-Dieter Stalz, Dr. Arnaud Remy, Dr. Anton Posch, Dr. Patricia Piatti, Tom Davies, Kris Simonyi und Jeff Durban für ihre kritische Rezension und Bearbeitung dieses Manuskripts. Die Autoren danken auch Allison Schwartz für die technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| 4-20% Criterion TGX Stain-Free Precast Gel | Bio-Rad | 567-8093 | Choose a gel size and percentage that meet the specific need in a experiment |
| Trans-Blot Turbo Midi PVDF Transfer Packs | Bio-Rad | 170-4157 | Choose either PVDF or nitrocellulose and match the membrane size to the gel size |
| Clarity Western ECL Substrate, 500 ml | Bio-Rad | 170-5061 | |
| EQUIPMENT | |||
| Criterion Cell | Bio-Rad | 165-6100 | |
| Trans-Blot Turbo Transfer Starter System | Bio-Rad | 170-4155 | |
| ChemiDoc MP System | Bio-Rad | 170-8280 | |
Referenzen
- Aldridge, G. M., Podrebarac, D. M., Greenough, W. T., Weiler, I. J. The use of total protein stains as loading controls: an alternative to high-abundance single-protein controls in semi-quantitative immunoblotting. J. Neurosci. Methods. 172 (2), 250-254 (2008).
- Bauer, D. E., Haroutunian, V., McCullumsmith, R. E., Meador-Woodruff, J. H. Expression of four housekeeping proteins in elderly patients with schizophrenia. J. Neural. Transm. 116 (4), 487-491 (2009).
- Castaño, Z., Kypta, R. M. Housekeeping Proteins: Limitations as References During Neuronal Differentiation. Open Neurosci. J. 2, 36-40 (2008).
- Colella, A. D., Chegenii, N., Tea, M. N., Gibbins, I. L., Williams, K. A., Chataway, T. K. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal. Biochem. 430 (2), 108-110 (2012).
- Cully, T. R., Edwards, J. N., Friedrich, O., Stephenson, D. G., Murphy, R. M., Launikonis, B. S. Changes in plasma membrane Ca-ATPase and stromal interacting molecule 1 expression levels for Ca2+ signaling in dystrophic mdx mouse muscle. Am. J. Physiol. Cell Physiol. 303 (5), (2012).
- Dittmer, A., Dittmer, J. Beta-actin is not a reliable loading control in Western blot analysis. Electrophoresis. 27 (14), 2844-2845 (2006).
- Dutka, T. L., Lamboley, C. R., McKenna, M. J., Murphy, R. M., Lamb, G. D. Effects of carnosine on contractile apparatus Ca2+ sensitivity and sarcoplasmic reticulum Ca2+ release in human skeletal muscle fibers. J. Appl. Physiol. 112 (5), 728-736 (2012).
- Elliott, S., Busse, L., Swift, S., McCaffery, I., Rossi, J., Kassner, P., Begley, C. G. Lack of expression and function of erythropoietin receptors in the kidney. Nephrol. Dial. Transplant. 27 (7), 2733-2745 (2012).
- Eslami, A., Lujan, J., Western, Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), (2010).
- Ferguson, R. E., Carroll, H. P., Harris, A., Maher, E. R., Selby, P. J., Banks, R. E. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 5 (2), 566-571 (2005).
- Greer, S., Honeywell, R., Geletu, M., Arulanandam, R., Raptis, L. Housekeeping genes; expression levels may change with density of cultured cells. J. Immunol. Methods. 355 (1-2), 76-79 (2010).
- Gürtler, A., Kunz, A., Gomolka, M., Hornhardt, S., Friedl, A. A., McDonald, K., Kohn, J. E., Posch, A. Stain-Free Technology as Normalization Tool in Western Blot Analysis. Anal. Biochem. 433 (2), 105-111 (2013).
- Hagiwara, M., Kobayashi, K., Tadokoro, T., Yamamoto, Y. Application of SYPRO Ruby- and Flamingo-stained polyacrylamide gels to Western blot analysis. Anal. Biochem. 397 (2), 262-264 (2010).
- Heidebrecht, F., Heidebrecht, A., Schulz, I., Behrens, S. E., Bader, A. Improved semiquantitative Western blot technique with increased quantification range. J. Immunol. Methods. 345 (1-2), 40-48 (2009).
- Jensen, R. B., Ozes, A., Kim, T., Estep, A. Kowalczykowski SC BRCA2 is epistatic to the RAD51 paralogs in response to DNA damage. DNA Repair. , (2013).
- Lanoix, D., St-Pierre, J., Lacasse, A. A., Viau, M., Lafond, J., Vaillancourt, C. Stability of reference proteins in human placenta: general protein stains are the benchmark. Placenta. 33 (3), 151-156 (2012).
- Larkins, N. T., Murphy, R. M., Lamb, G. D. Influences of temperature, oxidative stress, and phosphorylation on binding of heat shock proteins in skeletal muscle fibers. Am. J. Physiol. Cell Physiol. 3 (6), (2012).
- Laurie, K. J., Dave, A., Straga, T., Souzeau, E., Chataway, T., Sykes, M. J., Casey, T., Teo, T., Pater, J., Craig, J. E., Sharma, S., Burdon, K. P. Identification of a Novel Oligomerization Disrupting Mutation in CRYΑA Associated with Congenital Cataract in a South Australian. , (2012).
- Li, X., Bai, H., Wang, X., Li, L., Cao, Y., Wei, J., Liu, Y., Liu, L., Gong, X., Wu, L., Liu, S., Liu, G. Identification and validation of rice reference proteins for western blotting. J. Exp. Bot. 62 (14), 4763-4772 (2011).
- Liu, N. K., Xu, X. M. Beta-tubulin is a more suitable internal control than beta-actin in western blot analysis of spinal cord tissues after traumatic injury. J. Neurotrauma. 23 (12), 1794-1801 (2006).
- Lowe, D. A., Degens, H., Chen, K. D., Alway, S. E. Glyceraldehyde-3-phosphate dehydrogenase varies with age in glycolytic muscles of rats. J. Gerontol. A Biol. Sci. Med. Sci. 55 (3), 160-164 (2000).
- Mollica, J. P., Dutka, T. L., Merry, T. L., Lamboley, C. R., McConell, G. K., McKenna, M. J., Murphy, R. M., Lamb, G. D. S-glutathionylation of troponin I (fast) increases contractile apparatus Ca2+ sensitivity in fast-twitch muscle fibres of rats and humans. J. Physiol. 590, 1443-1463 (2012).
- Murphy, R. M., Dutka, T. L., Horvath, D., Bell, J. R., Delbridge, L. M., Lamb, G. D. . Ca2+-dependent Proteolysis of Junctophilin 1 and Junctophilin 2 in Skeletal and Cardiac. 591, 719-729 (2012).
- Neill, U. S. All Data are not created Equal. J. Clin. Invest. 119, 224 (2009).
- Pérez-Pérez, R., López, J. A., García-Santos, E., Camafeita, E., Gómez-Serrano, M., Ortega-Delgado, F. J., Ricart, W., Fernández-Real, J. M., Peral, B. Uncovering suitable reference proteins for expression studies in human adipose tissue with relevance to obesity. PLoS One. 7 (1), (2012).
- Rocha-Martins, M., Njaine, B., Silveira, M. S. Avoiding Pitfalls of Internal Controls: Validation of Reference Genes for Analysis by qRT-PCR and Western Blot throughout Rat Retinal Development. PLoS One. 7 (8), (2012).
- Romero-Calvo, I., Ocón, B., Martínez-Moya, P., Suárez, M. D., Zarzuelo, A., Martínez-Augustin, O., de Medina, F. S. Reversible Ponceau staining as a loading control alternative to actin in Western blots. Anal. Biochem. 401 (2), 318-320 (2010).
- Said, H. M., Polat, B., Hagemann, C., Anacker, J., Flentje, M., Vordermark, D. Absence of GAPDH regulation in tumor-cells of different origin under hypoxic conditions in-vitro. BMC Res. Notes. 13 (2), 8 (2009).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative western blots. Exp. Anim. 60 (2), 193-196 (2011).
- Welinder, C., Ekblad, L. Coomassie staining as loading control in Western blot analysis. J. Proteome Res. 10 (3), 1416-1419 (2011).
- You, J., Hodge, C., Wen, L., McAvoy, J. W., Madigan, M. C., Sutton, G. Using soybean trypsin inhibitor as an external loading control for Western blot analysis of tear proteins: application to corneal disease. Exp. Eye Res. 99, 55-62 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten