Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die
In diesem Artikel
Zusammenfassung
Die aufgeschnittenen Vaseline Lücke Ansatz werden geringe Geräuschaufnahmen von ionischen und Anschnittströme von spannungsabhängigen Ionenkanälen in Xenopus-Oozyten mit hoher Auflösung von schnellen Kanal Kinetik ausgedrückt zu erhalten. Mit geringen Modifikationen können Spannungsklemm Fluorometrie an den aufgeschnittenen Oozyte Protokoll gekoppelt werden.
Zusammenfassung
Die aufgeschnittenen Oozyte Vaseline Spalt (COVG) Voltage-Clamp Technik erlaubt die Analyse der elektrophysiologischen und kinetischen Eigenschaften von heterologen lonenkanäle in Oozyten. Aufnahmen aus der aufgeschnittenen Setup sind besonders nützlich für die Lösung geringer Größe Gating Strömungen, schnelle Ionenstrom-Aktivierung und Deaktivierung. Die Hauptvorteile gegenüber der Zwei-Elektroden-Spannungsklemme (TEVC)-Technik sind eine erhöhte Klemmgeschwindigkeit, verbessertes Signal-Rausch-Verhältnis, und die Fähigkeit, die intrazelluläre und extrazelluläre Milieu modulieren.
Hier verwenden wir die menschlichen kardialen Natriumkanals (HNA V 1.5), ausgedrückt in Xenopus-Oozyten, die aufgeschnittenen und Setup-Protokoll sowie Änderungen, die erforderlich sind, um Spannungsklemme Fluorometrie Fähigkeit hinzufügen demonstrieren.
Die Eigenschaften der schnellen Aktivierung von Ionenkanälen, wie z. B. 1,5 V HNA, nicht vollständig in der Nähe von Raumtemperatur gelöst werden mit TEVC in which die Gesamtheit der Eizelle Membran eingespannt ist, wodurch Spannungssteuerung schwierig. In der aufgeschnittenen Technik, Isolierung von nur einem kleinen Teil der Zellmembran ermöglicht jedoch für den Schnellspann erforderlich, genau zu erfassen, während verhindert schnelle Kinetik Kanal Auslauf mit Patch-Clamp-Techniken verbunden sind.
In Verbindung mit der COVG Technik Ionenkanal Kinetik und elektrophysiologischen Eigenschaften können durch Verwendung von Spannungsklemm Fluorometrie, wo Proteinbewegung wird über Cystein Konjugation von extrazellulär aufgebracht Fluorophore, Insertion von genetisch kodierten fluoreszierenden Proteinen oder den Einbau von unnatürlichen Aminosäuren getestet werden verfolgt in der Region von Interesse 1. Diese zusätzliche Daten liefert kinetische Informationen über spannungsabhängige Konformationsänderungen des Proteins über Veränderungen in der Mikroumgebung des fluoreszierenden Moleküls.
Einleitung
Specialized Spannungsklemmtechniken erlauben die Aufzeichnung von Ionenströmen bei kontrollierten Membranpotentialen. Weit verbreitet Zwei-Elektroden-Spannungsklemme (TEVC) und Patch-Clamp-Techniken liefern zuverlässige Informationen über die elektrophysiologischen Eigenschaften vieler Ionenkanäle. Jedoch haben beide Verfahren Nachteile, die den Erwerb von zuverlässigen Daten für schnellen spannungsabhängigen Natriumkanäle und andere schnell aktivierenden Kanäle in den Membranen, wie sie von Xenopus Oozyten zu verhindern. Die Bezanilla und Stefani Laboratorien entwickelt folglich die aufgeschnittenen Spalt Vaseline Voltage-Clamp Technik (COVG) für Oozyten 2. Die Technik wurde häufig angewendet, um aufzuzeichnen, Na +, K + und Ca 2 +-Kanäle 3-8.
COVG während der Aufzeichnung wird ein heterologes Protein-exprimierenden Oozyten Membran in drei Bereiche unterteilt. Die Ionenstrom-Daten von dem oberen Bereich der Eizelle als die aufgezeichneteBad um den oberen Bereich auf einen Befehl Potential, das leicht und schnell geändert werden kann, eingespannt ist. Der mittlere Bereich schützt gegen Leckströme, indem sie auf dem gleichen Potential wie der Kopfbereich 9 eingespannt. Der Bodenbereich ist, wo Eizelle Öffnung (aufgeschnittenem) durch die Verwendung eines Saponin-Lösung oder einer Kanüle erfolgt. Chemische oder manuelles Öffnen der Membran im Bodenbereich ermöglicht die Steuerung der internen Potential, das an Masse geklemmt ist, und damit ist das Zellinnere angrenzend an die untere Kammer Lösung. Perfusion von Lösungen in die untere Kammer können die Eigenschaften der inneren Umgebung anzupassen, während Lösungsaustausch in der oberen Kammer verändert die äußere Umgebung. 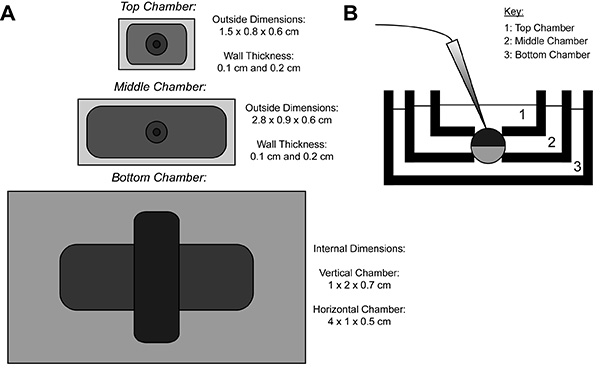
Fig. 1 ist. Eizellen Cut-Voltage-Clamp Öffnen Bad Setup-Übersicht. (A) TopSicht auf den drei Bädern voneinander getrennt. Die Abmessungen der Kammern für COVG sind in der Figur angezeigt. (B) Seitenansicht des Bäder-Setup in Testposition. Klicken Sie hier für eine größere Ansicht .
Die Vorteile der Technik COVG sind niedrige Stromrauschen (1 nA bei 3 kHz), Steuerung der Ionenzusammensetzung der externen Medien, die Fähigkeit, die internen Medien, schnelle Zeitauflösung (20-100 Mikrosekunden-Zeitkonstante des Zerfalls des modulieren Kapazität transient), und stabile Aufnahmen für mehrere Stunden 9. Die Nachteile sind, dass es erfordert spezielle Ausrüstung und es ist schwieriger durchzuführen, verglichen mit zwei Elektroden-Spannungsklemm (TEVC) 10.
Während die COVG Ansatz erfordert hoch spezialisierte Ausrüstung und komplizierte Verfahrenselemente, ist es für den Erwerb von wertvollen erlauben könnenkönnen elektrophysiologische Daten. Diese Daten, wie Anschnittströme mit schneller Kinetik und Schwanzströme 4, ohne einige der Fragen, mit anderen Klemmspannung Protokolle einschließlich Kanal heruntergekommenen verbunden aufgezeichnet werden. Kleinere Änderungen an der COVG Setup kann für den Einsatz von Temperaturregler und Spannungsklemme Fluorometrie (VCF) zu ermöglichen. Die Einbeziehung der Voltage-Clamp-Fluorometrie Elemente innerhalb der COVG Montage kann die Datenausgabe zu erhöhen durch die Übertragung die Möglichkeit, Protein Konformationsänderungen zu überwachen, während gleichzeitig Aufnahme von Strom 13.11.
Protokoll
1. Erste Geräte-Setup
- Legen Sie die Bühne und die Mikroelektrode Manipulator auf einer Schwingungsisolationssystem (zB eine Klimatabelle) mit einer umgebenden Faraday-Käfig, um elektrische und mechanische Störungen zu vermeiden.
- Löten sechs Ag / AgCl Pellets zu sechs-Zoll-Längen von 24 AWG. Für eine dieser Längen (bis zu P1 angeschlossen werden), Splice in einem zweiten Draht, ein "Y" bilden. An den Enden jedes Drahtes löten Gold BNC Stift, der mit dem Verstärker enthalten ist.
- Schließen Sie die fünf Ag / AgCl Pellets bis 24 AWG-Kabel gelötet, um das Bad / Wache heads (P1, P2, CC, GS1, GS2 und). Schließen Sie das "Ich" Ag / AgCl-Pellet auf die "I" heads und den zweiten Draht kommen aus der P1 zu der V2 heads.
- Verbinden Sie den Verstärker an die Datenerfassungseinheit gemäß den Anweisungen in den Gerätehandbüchern.
- Zeigen und Epoxy die Temperaturregler-Thermistoren. Fädeln Sie den Block Thermistor durch ein Loch in der Metallgerüsted direkt über der Mitte der Heiz / Kühlelement. Platzieren und Epoxid das Bad Thermistor in ein Loch in dem Körper des temperaturleitenden Bodenkammer sehr nahe aber nicht Inkontaktbringen der Lösung gebohrt.
2. Eizelle und vorläufige Vorbereitung
- Um eine heterologe Expression Kanal, wie HNA-V 1.5 aufzeichnen, synthetisieren mRNA (von hSCN5a abgeleitet) und injizieren sie in eine Xenopus Oozyten etwa 4-5 Tage vor der Durchführung des Protokolls Nr. 4. Für hSCN5a wird die Spitzen Expression nach Inkubation für 4-5 Tage bei 19 ° C erhalten Siehe Richards und Dempski 14 und Cohen et al. Für 15 detaillierte Anweisungen Eizelle, mRNA-Herstellung und Oocyteninjektion.
- Chlorid AgCl die Draht-und AgCl-Pellets vor Beginn des Protokolls Nr. 4. Um dies zu tun, setzen ein Ende des Drahtes und die Pellets in Bleichmittel für mindestens 20 min und solange O / N. Sobald die Pellets wurden Chlorided., befestigen Sie sie an den Verteiler unter Verwendung von Klebstoff.
Hinweis: Strom durch die Drähte können auch verwendet werden, um den Draht und Pellets Chlorid. Diese Technik wird die Geschwindigkeit erhöhen, sondern auch chloridation erfordern mehr Ausrüstung. Siehe Techniken für Chloriding Silber Drähte für weitere Anweisungen 16.
3. Agar-Brücke Vorbereitung
- Mindestens sechsmal Agar Brücken durch Erhitzen eines Endes eines Kapillarrohrs in Borosilikat mittlerer Flamme. Stellen Sie sicher, dass das Ende der Kapillarröhre in dem oberen Teil der blauen Flamme. Machen zusätzliche Brücken im Falle von Schäden an den Originalen.
- Sobald die Kapillare aufgeheizt hat, zu verwenden, um eine Zange 90 ° Biegung in dem Rohr bilden. Ziel ist ein Bogen mit einer glatten Krümmung anstatt einer abrupten Winkel oder es kann der Innendurchmesser des Glas, das Füllen erschwert und erhöht den Widerstand der Brücke erheblich reduzieren.
- Einen zweiten 90 °-Bogenin der gleichen Richtung 25 mm entlang der Kapillarröhre aus der ersten Kurve unter Verwendung der gleichen Schritte.
Anmerkung: Die genaue Länge der Brücke keine Rolle, solange die Brückengröße ist konsistent, aber letztlich die Längen sollte für die Anlage werden sie weiter verwendet werden können. Beachten Sie, dass Brückenwiderstand ist proportional zu seiner Länge und sollte minimiert werden. - Sobald die Kapillaren abgekühlt sind, verwenden Sie einen Diamantglasschneider, um die "Beine" der Brücke auf ca. 5 mm schneiden.
- Legen Längen von Platindraht in die Kapillaren der drei "Stromzuführungs" Brücken Leistung durch Verringern der Widerstand in der Agar-17 zu verbessern. Schneiden Sie überPlatinDraht, so dass es keinen Draht außerhalb der Röhre ausgesetzt ist.
Hinweis: Aufgrund der hohen Kosten von Platin, abzurufen und wiederverwenden keinen Draht aus zerbrochenen Brücken. - Schieben Sie den Platindraht weiter in die Kapillare mit einem feinen spitzen Gegenstand, wie einer Mikropipette tip so daß der Draht 1 mm kürzer ist als die Glas an beiden Enden der Kapillare.
- Von 100 ml von 1 M NMDG mit 1,2 g HEPES gepuffert. Verwenden Sie einen pH-Meter und fügen MES Hydratpulver bis ein pH-Wert von 7,4 erreicht wird (~ 10 g). Sobald ein pH-Wert von 7,4 erreicht wurde, entfernen Sie die pH-Elektrode. Beiseite 40 ml der Lösung als Storage-Lösung zu halten.
- In Agar granuliert, um eine 2-3% Agar-Gemisch zu erzeugen. Stir und erhitzen, bis der Agar-Lösung gelöst und klar. Nicht überhitzen oder kochen Sie die Lösung, da es übermäßig viskos und Füllen der Brücken wird schwierig sein, zu werden.
- Bewegen Sie den Agar-Lösung zu einer neuen Becherglas stellen und einen kleinen Rührstab. Weiter Erhitzen und Rühren bei mäßiger Geschwindigkeit.
- In der Kapillare Brücken ein zu einer Zeit mit den Beinen nach oben. Im Laufe der Zeit werden die Brücken mit Agar zu füllen. Alternativ füllen die Brücken, indem Agar-Lösung durch eine Spritze zu einer kleinen Pipettenspitze befestigt.
- Einmal gibt es keine Blasen in der briDGES, rufen Sie die Brücken von der Agar-Lösung und setzen Sie die Brücken auf einem Papiertuch zu trocknen. Alle Brücken mit Restblasen können mit einer Pinzette zu erleichtern Blasenaustritts gerührt werden.
Hinweis: Ausgewertet Agar mit Blasen können durch Eintauchen der Brücken in kochendes Wasser vollständig entfernt werden. Sobald der Agar entfernt wird, verwenden Sie eine Unterdruckleitung, um Restwasser zu entfernen. Bridges können dann für Agar-Behandlung wiederverwendet werden. - Überschüssiges Agar von den Brücken, wenn trocken. 60 ml Wasser zu dem 40 ml Reservelösung und legen Sie die Brücken in der Speicherlösung.
4. Cut-open Rig Vorbereitung
- Schalten Sie die Wasserquelle für die Temperatursteuerung und dann den Netzschalter an den Temperaturregler. Warten Sie, bis die Bad-Temperatur die angegebene Temperatur (19 ° C) erreicht.
- Ziehen Mikroelektroden aus Borosilikat Kapillarrohr mit einer Mikroelektrode Abzieher einem Widerstand von 0,2-0,5 M &OHgr;.
Hinweis: Tieferlegung pipette Beständigkeit verbessert Spanngeschwindigkeit. Allerdings sind die geringeren Widerstand Pipetten eher die Eizelle beschädigen. Experimentieren ist erforderlich, um die besten Pipette Widerstandswert für die jeweilige Anwendung zu bestimmen. - Bereiten Sie die Saponin-Lösung durch Mischen von 0,125 g Trocken Saponin mit 50 ml interne Lösung. Dies wird zu einer 0,25% igen Lösung. Kehren Sie zum Mischen leicht.
- Unter einem Binokular eine kleine Menge Vaseline um den Rand des Loches auf der Oberseite der mittleren Kammer und der unteren Seite der oberen Kammer mit einem sehr spitzen Gegenstand.
Hinweis: Der "Donut" von Vaseline wird helfen, die Eizelle an der Stelle über das Loch und in der Bildung der Dichtung zu unterstützen. Allerdings wird zu viel Vaseline Falle Blasen und die Lösungen verhindern, dass das Erreichen der Eizelle Oberfläche. - Add 3 M KCl-Lösung in die Verteilerschlitze Halte Ag / AgCl-Pellets, so daß kein Überlauf von den Schlitzen, aber die Pellets und Brückenschenkelenden Buchtrot. Bereinigen Sie zusätzliche KCl Tröpfchen, um unerwünschte elektrische Verbindungen zwischen den Schlitzen zu verhindern.
- Fügen Sie externe Lösung für die unteren und mittleren Kammern Bad.
- Platzieren Sie die Agar Brücken in die Schlitze in der AgCl-Pellet Verteiler, so dass ein Bein pro Brücke ist in jedem Schlitz. Das andere Bein der Brücken wird später in die jeweiligen Kammern platziert werden (P1, P2, CC oben; GS1, GS2 Mitte (Wache), ich unten). Stellen Sie sicher, dass Platindraht Brücken sind in der GS2, P2, und ich Slots.
Hinweis: Stellen Sie sicher, Brücken werden mit destilliertem Wasser und trocken, bevor Sie in die Kammer Bad gewaschen. - Einschalten des Datenerfassungssystems und dem PC. Starten Sie die Aufnahme-Software.
5. Cut-offenen Verfahren
- Installieren Sie die obere und mittlere Eizelle Kammern ohne eine Eizelle. Schieben Sie die obere Kammer außermittig, so daß die Löcher in den beiden Kammern nicht überlappen. Füllen Sie alle Kammern mit externen Lösung und legen Sie alle Elektroden in ihren jeweiligen Kammern.
Hinweis: die obere Kammer Drücken Sie nicht den ganzen Weg nach unten, wenn die Installation der Kammern. Stellen Sie sicher, ein sehr kleiner Spalt zwischen den beiden Kammern bleibt. Die außermittige Anordnung erhöht den Widerstand des Kammersystems besser zu simulieren, das Vorhandensein einer Zelle. Dieser Prozess, der als "Ausgleich der Brücken", entschädigt für die Offset-Potentiale, die von Inhomogenität zwischen den Agar-Brücken entstehen können.- Schalten Sie den externen Befehl und beide Klemmen. Überprüfen Sie die aktuelle Lesung am Verstärker. Stellen Sie mit einem kleinen Schraubendreher die P-Offset auf der Rückseite des Bad / Schutz Kopf-Bühne, um Null-Strom.
- Schalten Sie das Bad / Schutzschalter am Verstärker auf aktive und passen Sie die GS-Offset auf Null Strom zu erhalten.
- Wiederholen Sie zwischen "aktiv" und "passiv", bis beide sind recht nahe Null (<100 nA).
- Entfernen Sie die obere Kammer und übertragen eine Eizelle in die Mitte Bad Kammer mit einer Pipette Pumpe. Stellen Sie sicher, dass der oocyTE ist über dem Loch in der Mitte der Wanne angeordnet ist.
Hinweis: Bei der Ausarbeitung einer Eizelle für VCF, legen Sie die markierten Zell in die Kammer mit dem Tier Pol (dunkle Seite) nach oben. Handy Orientierung spielt keine Rolle, wenn VCF nicht durchgeführt wird. - Entfernen überschüssiger Lösung von der externen Unterseite Bad unter Verwendung eines Gebläses, um eine Dichtung zwischen der Eizelle und Badoberfläche zu erzeugen.
- Legen Sie die Top Bad Kammer über die Eizelle so dass das Loch in der Kammer wird auf der Oberseite der Eizelle zentriert. Mit einem Daumen und Mittelfinger, Druck langsam gelten unten an der Kammer, bis es fest gegen die Eizelle gedrückt, so daß nur ein kleiner Teil der Membran an der oberen Wanne durch die Öffnung freizulegen.
Hinweis: Die Eizelle kann unter dem Druck der oberen Kammer wölben. Nicht mit Gewalt in die obere Kammer gelten, da dies dazu führen, die Eizelle zu Bruch. Pinzetten Tipps, diagonalen Ecken der oberen Kammer platziert werden können als Alternative zu den Fingern appl verwendet werdeny Druck nach unten. - Fügen Sie externe Lösung für die oben und unten mit WC, bis sie fast voll sind.
- Zeigen die freien Schenkel der Agar Brücken in die externe Lösung von jedem Bad, wie in 2 (Brückenplatzierung) gesehen. Stellen Sie sicher, dass jede Brücke ist in der richtigen Lage Bad ruht. (Ich überbrücken in der Bodenwanne, GS1 und GS2 Brücken in der Mitte Bad und P1, P2, und CC Brücken im oberen Bad). Schalten Sie das Bad / Schutzschalter am Verstärker auf aktiv.
Hinweis: Stellen Sie sicher, es gibt keine 3 M KCl Verbindungen zwischen den Brücken, ihre Brunnen und den Aufnahmekammern. Darüber hinaus stellen Sie sicher, Brücken werden so ausgebildet, dass sie über die Aufnahme Kammer Lösungen erhoben werden.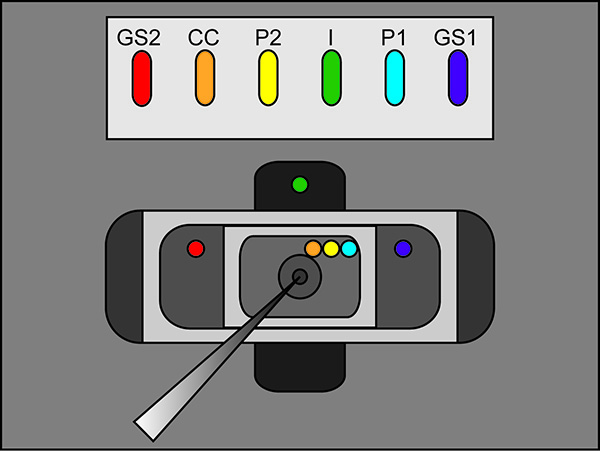
2. Agar-Brücke Setup-Location-Diagramm. Placement Standorte der freien Enden der Agar-Brückenin den verschiedenen Bädern. Klicken Sie hier für eine größere Ansicht . - Starten Sie ein Testprotokoll in der Recording-Software. Wenn der Puls zeigt vertikale Verschiebung der horizontalen Abschnitt zwischen den zwei Spitzen bei Anlegen einer 100 mV Puls, die größer als 100 nA (entsprechend 0,3 MOhm mit Bad / Wache in passiv) dann erhöhen Sie die Dichtheit der Badabdeckung ist. Abbildung 3 zeigt ein Beispiel eines idealen Testimpuls.
Hinweis: Das Testprotokoll gibt einen Spannungsimpuls zu sehen, ob das Bad Abdeckung ist fest genug, und alle Komponenten richtig montiert sind. Alternativ kann die Testfunktion des Verstärkers verwendet werden.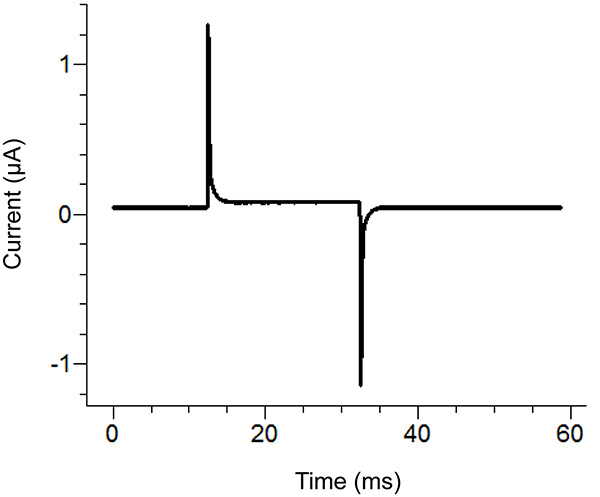
3. Ideal Testimpuls von der Recording-Software. Die Testimpulssollte ähnlich der oben Impuls in Abhängigkeit von der Anwendung Protokoll zu suchen. Der Haltestrom (zentrale Lage) sollte nahe Null sein. Klicken Sie hier für eine größere Ansicht . - Entfernen Sie die externe Lösung in der unteren Wanne und ersetzen mit Saponin-Lösung. Seien Sie vorsichtig, um zu vermeiden, Blasen während der Zugabe des Saponin. Um maximale Ersatz gewährleisten unter Absaugen auf der gegenüberliegenden Seite des unteren Bades während der Zugabe der Lösung.
- Nachdem die Saponin-Lösung wurde hinzugefügt, beobachten die sich wiederholenden Testimpuls. Wenn die Spitze des Testprotokolls verringert oder verschwindet, dann ist dies ein Zeichen, dass es eine Blase unter der Eizelle entfernt. In diesem Fall vollständig zu entfernen, die Saponin-Lösung und dann ersetzen.
Hinweis: Die Permeabilisierung ist in der Regel innerhalb von 30 Sekunden komplett mit frischen Saponin-Lösung. Die Lösungen können Schwierigkeiten bei der Ansprache der Zelle haben, wenn es eingefangene Luftblasenoder wenn die follikulären Schicht auf einem schlecht verdaut Eizelle bleibt. Die Oozyten wurden permeabilisiert (geöffnet), wenn die Steigung der Spannungsspitze sinkt (Erhöhung der Zeitkonstante des Zerfalls).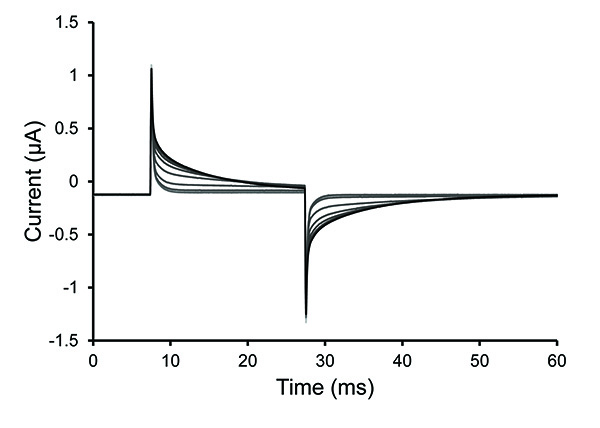
4. Testimpuls Traces Während Eizelle Permeabilisierungs. Ausgewählte Spuren aus der Testpulsprotokoll nach einer 0,25% Saponin-Lösung wurde in den Boden Eizelle Kammer eingebracht. Die Erhöhung der Zeitkonstante des Zerfalls in den Spuren gesehen zeigt eine Steigerung von Eizelle Permeabilisierung. Klicken Sie hier für eine größere Ansicht . - Sobald die Zelle durchlässig gemacht, entfernen Sie die Saponin-Lösung und füllen Sie die Badewanne mit interne Lösung. Stoppen Sie das Testprotokoll.
Hinweis: Auch wenn Saponin ermöglicht den Zugriff auf dieInnere der Zelle durch Permeabilisierung der Membran ist Äquilibrierung der Ionenkonzentrationen zwischen der unteren Wanne und dem Zytoplasma der Oozyte durch Diffusion ein sehr langsamer Prozess. Dieser Vorgang kann je nach den Bedingungen (Fig. 5) zehn Minuten benötigen. - Prüfen Sie, ob hohe Lösung in den Bädern und kristallisiert KCl zwischen den Vertiefungen der vielfältig wie diese können Kurzschlüsse und fehlerhaftes Verhalten verursachen.
- Verwenden Sie die modifizierte Spritze zu 3 M KCl in einer Mikroelektrode zu injizieren. Flick das Mikroelektrodenmehrmals mit einem Finger während Verspannung mit den anderen Fingern.
Hinweis: Dieser Schritt ist erforderlich, um eingeschlossene Luftblasen in der Mikroelektrode zu entfernen. - Montieren Sie die KCl-gefüllten Elektrode auf dem Mikromanipulator Arm durch Einsetzen der Drahtfaden in das offene Ende Mikroelektroden. Drücken Sie das Ende der Mikroelektrode in die Fadenhalter und stellen Sie sicher, dass die Elektrode nicht locker. Ziehen Sie die Elektrode Verschluss.
Hinweis: Make sicher, dass der Draht eine gleichmäßige Beschichtung der AgCl-Elektrode, normal zu funktionieren. - Schwingen Sie den Arm in Position über den Eizelle Bäder und ziehen Sie die Klemmen zu weiteren Arm Bewegung zu verhindern.
- Mit den Manipulator Knöpfe, gehen die Elektrode nach unten in der Badewanne. Stellen Sie sicher, dass kein Testimpuls angelegt wird, und dass die Membran Testfunktion wird an dieser Stelle nicht aktiviert.
Anmerkung: Vor der Elektrodenspitze in die Flüssigkeit eingeführt, V1-V2 von dem Spannungsklemme wird eine positive Spannung zu lesen. Sobald die Elektrodenspitze in die Flüssigkeit eingeführt wird, sollte der Spannungsmesser auf dem Spannungsklemme auf einen Wert nahe Null zu ändern. VCF für Aufnahmen, muss die Elektrode, um die Zelle bei einem relativ flachen Winkel zu nähern, um Platz für das Ziel verlassen. Aufspießen der Zelle mit der Elektrode zentriert, hilft näher an der Kante des isolierten Membranscheibe auch die Kollision des Objektivs mit der Elektrode zu vermeiden. - Stoppen Sie zu Fuß die Elektrode nach unten. Stellen Sie die Elektroden-OffsetPotential auf Null, indem Sie die V1-Taste und dann die Verringerung der V1 Spannung auf Null, indem die V1 ausgeglichen. Darüber hinaus führen die gleiche Einstellung für V2. Die Potentialdifferenz V1-V2 lesen sollten 000 mV.
- Wechseln Sie zurück zu V1 und drehen Z-Test auf den Elektrodenwiderstand zu messen. Der Wert allmählich sinken und sich der tatsächliche Widerstand. Ziel für einen Widerstandswert von 0,2 bis 0,5 MOhm.
- Gehen Sie weiter nach unten in Richtung der Elektrode sichtbaren Patch der Eizelle in der Badewanne. Sobald die Mikroelektroden ist sehr nah an der Eizelle, beobachten Sie die V1-V2 lesen, um zu sehen, wenn die Elektrode die Eizelle gelangt, die V1-V2 Spannung negativ werden, wenn die Mikroelektrode in die Zelle gelangt.
Hinweis: Die an diesem Punkt angezeigte Wert ist das Membranpotential der Zelle und wird durch die Kanäle exprimiert und die verwendeten Lösungen beeinträchtigt. Einsetzen der Mikroelektrode zu weit wird die Zellmembran beschädigt werden. - Öffnen Sie die Datensammlung Protokoll in dieRecording-Software.
- Flip auf der Klemme-Schalter auf der Spannungsklemme und stellen das Potenzial, den Befehl (z. B. -100 mV) durch Anpassung der Drehknopf auf der "I" befindet heads entsprechen.
- Flip auf der Kapazitäts-und Widerstandskompensationsschalter.
- Klappen Sie den "Test"-Schalter auf der "Befehle" Region der Spannungsklemme. Verwenden Sie das Oszilloskop, um das Signal zu visualisieren. Stellen Sie die Cm Entschädigung Knöpfe in der Signalanlage Segment, die kapazitiven Transienten auf dem Oszilloskop zu reduzieren. Nicht zu kompensieren, die Spitzen bis zu dem Punkt, wo zusätzliche Umkehrspitzen auftreten oder die Spitzen beginnen, einen S-förmigen Krümmung zu entwickeln, die Artefakt in die Aufnahme einführen können.
- Sobald die Kapazität wurde manuell mit einem zufriedenstellenden Niveau reduziert, schalten Sie den Testschalter.
- Beginnen Sie den Datenaufzeichnungsprotokoll in der Recording-Software.
6. Cleanup
- Bei Aufnahmen haben been abgeschlossen, schalten Sie die verschiedenen Schalter an der Spannungsklemme mit der Klemme und Bad / Schutzschaltern.
- Verwenden einer Pinzette, um die Agar-Brücken aus den verschiedenen Bädern zu entfernen.
- Entfernen Sie die obere Bad und saugen Sie alle Lösungen und Eizelle von allen Bädern.
- Verwenden Sie eine Flasche VE-Wasser, um alle Bäder spülen und dann saugen die Bäder mit einem Vakuum. Wiederholen Sie diesen Schritt 3-5x.
- Wischen kristallisierten KCl aus den Brücken und legen Sie die Brücken in der Speicherlösung. Brücken können viele Wochen, solange sie richtig gelagert werden wiederverwendet werden.
- Saugen Sie den KCl-Lösung aus den vielfältigen Quellen und spülen Sie den Verteiler mit VE-Wasser mehrmals.
- Schalten Sie alle Geräte, einschließlich der verschiedenen Temperatursteuerung und Aufnahmesoftware.
7. Die Zugabe von Voltage Clamp Fluorometrie
- Folgen Sie den Schritten in Abschnitt 1 bis 6 in einer zuvor veröffentlichten JoVE Protokoll 16 Examining die Konformationsänderungen Dynamics von Membranproteinen in situ mit Site-directed Fluoreszenzmarkierung: Klicken Sie hier, um die Seite anzuzeigen.
- Führen Sie die Schritte in Abschnitt 4 bis 5.22 des oben genannten COVG-Protokoll mit einem VCF-Mikroskop bei 4X Fokus zu setzen.
Hinweis: VCF-Aufnahmen erfordern größere Eizelle Bad Kammern als in COVG Messungen erforderlich. (Die Abmessungen der benutzerdefinierten VCF Kammern in der Materialliste entfernt.) Dieses größere VCF Kammer muss in der Lage gleichzeitig die Aufnahme der Objektivlinse, Mikroelektroden-und Brücken-Agar sein. Zusätzlich ist die Tier Pol (dunkle Seite der Eizelle) muss nach oben zeigen in der Kammer für geringe Hintergrund VCF-Aufnahmen. - Bringen Sie den oberen Teil der Eizelle in den Fokus mit einem Wasser-Immersions 40X-Objektiv.
Hinweis: Das Umschalten von der 4X auf die 40X-Objektiv erfordert eine spezifische geGeometrie des aufgeschnittenen Komponenten und Aufmerksamkeit um nicht die Elektrode Brücken oder Kammern schlagen beim Absenken des 40X Ziel. Außerdem ist es aufgrund des erhöhten Volumens in der oberen Wache, sicherzustellen, dass Bad Volumen von oben Schutz ist nicht mit der mittleren Garde verbunden, wenn die 40X-Objektiv wird in Kraft gesetzt. - Konzentrieren sich auf einem Ring um den Umfang der freigelegten Oberfläche Eizelle, so dass die Spitze der Eizelle ist etwas oberhalb der Ebene des Fokus.
Hinweis: Justierung in der xy-Ebene kann notwendig sein, damit das Blickfeld ist meist mit Membran und nicht die Kammer gefüllt. XY Übersetzung wird am einfachsten durch die Platzierung des Mikroskops auf einem Verschiebetisch erreicht. - Bewegen Sie die Filterwürfel in den optischen Pfad und schalten Sie den Lichtpfad vom Okular zum Detektor (Diode).
- Schalten Sie die VCF-Lichtquelle.
- Schalten Sie die Deckenbeleuchtung, die Faser Lichtbeleuchtung und andere Lichtquellen.
Anmerkung: Im Idealfall VCFAufnahmen sollten in einem völlig dunklen Raum durchgeführt werden. - Führen Sie einen Fluoreszenz-Protokoll in der Recording-Software.
Ergebnisse
Figur 4 zeigt die Veränderung der Durchlässigkeit der Eizelle als Saponin-Lösung wird auf den Bodenabschnitt der Eizelle aufgebracht. Fig. 5 zeigt die Geschwindigkeit der intrazellulären Lösungsaustausch durch Diffusion folgenden Saponin Permeabilisierung. 20-40 Minuten sind erforderlich, um zu einem steady-state 2,18 kommen.
6A zeigen Spuren von der Aufnahmeprotokoll erzeugt. Die Figur zeigt, Ionenströme (nach P/-8 Lecksubt...
Diskussion
Die aufgeschnittenen Eizelle Vaseline Spaltspannung Clamp-Technik ermöglicht eine schnelle Auflösung der Daten, geringes Rauschen, mehr Kontrolle über interne und externe Lösung Lösung Zusammensetzung und stabile Aufnahmen über längere Protokolle 19. Diese Vorteile setzen diese Technik abgesehen von der Standard-Zwei-Elektroden-Voltage-Clamp-und Patch-Clamp-Technik. Obwohl spezielle Ausrüstung erforderlich ist, und das Protokoll ist relativ schwierig, treten sehr wenige Probleme, sobald das System opt...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Alle Mitglieder der Washington University in St. Louis Herz Molecular Engineering Lab. Ein Burroughs Willkommen Fund Career Award in der Scientific Schnittstelle - 1010299 (JS).
Materialien
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Referenzen
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten