Method Article
Minimal Invasive Gründung von murinen orthotopen Blasen Xenografts
In diesem Artikel
Zusammenfassung
Die etablierte Technik, um primäre invasive orthotopen Blasenkrebs Xenografts impfen erfordert Laparotomie und Mobilisierung der Blase. Dieses Verfahren verursacht eine signifikante Morbidität auf Mäuse, ist technisch anspruchsvoll und zeitaufwendig. Wir haben deshalb eine hohe Präzision, die perkutane Ansatz verwendet Ultraschallkontrolle.
Zusammenfassung
Orthotopen Blasenkrebs Xenografts sind der Goldstandard, um molekulare Zellmanipulationen und neue therapeutische Wirkstoffe in vivo zu untersuchen. Geeignete Zelllinien werden entweder durch intravesikale Instillation (Modell Nonmuscle invasives Wachstum) oder intra-Injektion in den Blasenwand (Modell von invasiven Wachstum) geimpft. Beide Verfahren sind sehr aufwendig und zeitraubend. Zusätzlich hat die Oberflächen-Modell seine Mängel aufgrund des Fehlens von Zelllinien, die nach Applikation tumorigenen sind. Intramurale Injektion, andererseits wird durch die Invasivität des Verfahrens und der damit verbundenen Morbidität für den Host-Maus getrübt.
Mit dieser Mängel im Auge modifizierten wir den bisherigen Methoden, um eine minimal-invasive Ansatz für die Erstellung von orthotopen Blasenkrebs Heterotransplantate zu entwickeln. Mit Ultraschall-Führung haben wir erfolgreich perkutanen Inokulation der Blasenkrebszelllinien UM-UC1, UM-UC3-und UM-geführtUC13 in 50 athymischer. Wir konnten zeigen, dass dieser Ansatz ist zeitsparend, präzise und sicher. Mit dieser Technik wird zunächst ein Raum unter der Blasenschleimhaut mit PBS erstellt, und die Tumorzellen werden dann in diesen Raum in einem zweiten Schritt eingespritzt. Das Tumorwachstum wird in regelmäßigen Abständen mit Biolumineszenz-Bildgebung und Ultraschall überwacht. Die durchschnittlichen Tumorvolumina stetig zugenommen in allen, aber in einem unserer 50 Mäuse im Verlauf der Studie.
In unserer Einrichtung, diese neuartige Ansatz, der Blasenkrebs Xenotransplantat Impfung in einem minimal-invasive, schnelle und sehr präzise Weise ermöglicht, hat das traditionelle Modell ersetzt.
Einleitung
Die Krebsforschung ist abhängig von Tiermodellen für menschliche Krebszelllinien mit Hilfe von Patient Tumoren in Ordnung abgeleitet, um unser Verständnis der Tumorbiologie zu vertiefen. Für die in vivo Wachstumsanalyse unter verschiedenen Behandlungsstrategien murinen orthotopen Blasenkrebs Modelle bleiben der Referenzstandard 1,2. Die Impfung der menschlichen Blasenkrebszellen in immungeschwächten Mäusen (Xenograft-Modell) basiert auf intravesikale Instillation ("intravesical-Modell") 3,4,5 oder direkte Injektion in die Blasenwand ("intra-Modell") 6,7. Beide Verfahren können auch in Ratten 8,9 durchgeführt werden.
Intravesikale Instillation induziert die Bildung von Tumoren auf der Oberfläche Urothelzellen der Blase, die dann Gegenstand einer späteren intravesikale Instillation des erfindungsgemäßen Behandlungsmitteln. Jedoch ist die Anzahl von Zelllinien, die, wenn sie über diesem Verfahren geliefert zuverlässig tumorigenen beschränkt eind eine dieser Zellinien KU7, wurde kürzlich gezeigt, um HeLa 4,10 sein. Intravesikale Instillation ist auch zeitaufwendig aufgrund der notwendigen Verweilzeiten und induziert häufig Tumorwachstum in benachbarten Elementen der Harnwege, einschließlich der Harnröhre, Harnleiter und Nierenbecken 11. Darüber hinaus führt die intravesikale Instillation oft das Tumorwachstum auf dem Boden der Blase, wo die Harnleiter in die Blase, und dies kann der oberen Atembehinderung und die gleichzeitige Nierenversagen verursachen.
Primären invasiven Blasenkrebs-Xenotransplantaten, die sich für systemische Behandlungen werden durch direkte Injektion von Tumorzellen in die Blasenwand 12 geschaffen. Obwohl zahlreiche Zelllinien wachsen angemessen in diesem Modell ist die Beschränkung der Invasivität des Modells auf die Notwendigkeit für einen Bauchschnitt 13 zusammen. Das Modell ist auch eine Herausforderung, aufgrund der technischen Schwierigkeiten bei der Injektion von Zellen genau in die Muskelwand lernender Blase.
Ein neuer Ansatz zur orthotopen primären invasiven Blasenkrebs Xenografts bei Mäusen zu errichten, hat in unserer Abteilung, um die bestehenden Mängel der "intra-Modell" entwickelt, anzugehen. Wir waren in der Lage, die perkutane, Ultraschall-gesteuerte Injektion von Blasenkrebszellen in die vordere Blasenwand, was zu dieser neuen Technik zu optimieren, um die etablierte invasive Modell erfolgreich zu ersetzen. Außerdem haben wir möglicherweise verbessert die Genauigkeit und Reproduzierbarkeit der "intra-Modell".
Protokoll
Alle Tier Verfahren wurden nach den Richtlinien des Canadian Council on Animal Care (CCAC) durchgeführt. Das Protokoll wurde von der Tierpflege-Ausschuss der Universität von British Columbia (: A10-0192-Protokoll-Nummer) zugelassen.
1. Herstellung von Zelllinien
- Bestätigen Sie die Identität der jeweiligen menschlichen Blasenkrebszelllinien durch DNA-Fingerprinting 7.
- Wachstumsanalyse Xenograft durch Biolumineszenz, Transfektion von Zelllinien mit einem lentiviralen Konstrukt trägt die Leuchtkäfer-Luciferase-Gen 3.
- Auftau-und Ausbau der bestehenden Zelllinien in Dulbeccos modifiziertem Eagle-Medium (DMEM) mit 10% fötalem Rinderserum (FBS) bei 37 ° C in einer befeuchteten 5% CO 2-Atmosphäre. Passage die Zellen mindestens 3x aber mal Kultur als 3 Monate zu vermeiden.
2. Herstellung der Zellsuspension
- Matrigel auftauen. Halten Sie die Temperatur unter4 ° C zu einer erhöhten Viskosität des Gels zu vermeiden.
- Trypsinize der Zellen bei einer Konfluenz von 70% und Aussetzung in normalem Wachstumsmedium.
- Zählen Sie die Anzahl von Zellen mit einer Zählkammer oder automatische Zellzähler.
- Drehen die Zellsuspension für 5 min bei 200 x g. Entfernen Sie den Überstand.
- Fügen Sie die entsprechenden Volumen DMEM (10% FBS) und Matrigel (1:1), um die gewünschte Zellkonzentration, die abhängig von der verwendeten Zelllinie und gewünschten Wachstums Kinetik (8-15 x 10 6 / ml) ist zu erreichen. Das injizierte Volumen der Tumorzellsuspension werden mit 40 &mgr; l sein.
- Gut mischen durch Pipettieren von oben und unten (P1000), vermeiden, Luftblasen in der Suspension.
3. Vorbereitung der Tiere
Hinweis: Aufgrund der möglichen Notwendigkeit zur transurethralen Katheterisierung in Schritt 4.7, sind weibliche Mäuse die bevorzugte Geschlecht in diesem Tiermodell.
- Hausmäuse nach institutionellen und nationalen Tierpflege guidelines. Erhalten Ethik-Kommission Zulassung für alle Experimente mit Mäusen.
- Betäuben die Mäuse mit 3% Isofluran / Sauerstoff-Gemisch. Überprüfen Sie die Betäubung von Tieren (zB Teilnahmslosigkeit bis Fuß drückt).
4. Versuchsaufbau
- Schneiden Sie die Blase Stabilisierung von jeder Art von Flach starren Kunststoffmaterial [2 I]. Überprüfen Sie sorgfältig den Gurt und keine scharfen Kanten vor der Anwendung auf den Mäusen zu entfernen.
- Montieren Sie das Tier auf der beheizten Bildgebungstisch [Bild 1 I] der Kleintierbildgebung Plattform mit kontinuierlicher Überwachung der Vitalfunktionen. Befestigen Sie die unteren Gliedmaßen mit einem Gummiband [Abb. 1 III].
- Desinfizieren Sie den Bauch mit 2% Chlorhexidin und wischen Sie die Haut mit einem sterilen Wattestäbchen.
- Immobilisieren die Blase mit der Blase Stabilisierungsgurt [Bild 2 II]. So ein Ausweichender Blase während intramurale Injektion in Schritt 5.6 wird vermieden.
- Bewerben sterilen Ultraschall-Gel auf den unteren Bauch.
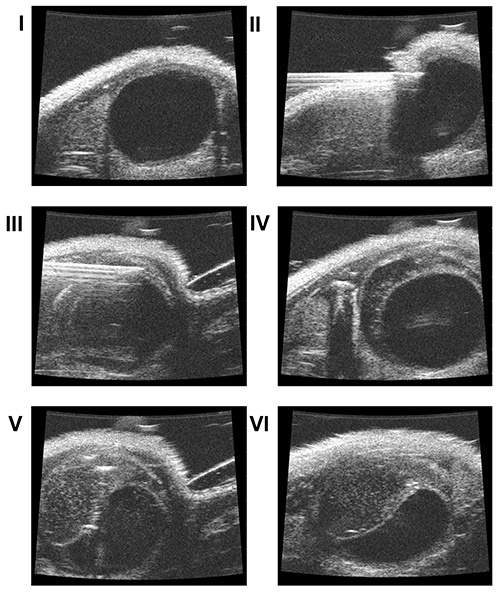
- Langsam nähern sich der Ultraschall-Schallkopf (Frequenz 40 MHz) [Bild 1 IV], um die Haut (Längs mit einem Schädel Winkel von 45-70 °) und zu visualisieren, die Blase auf dem Ultraschallbildschirm [3 I].
- Wenn die Blase leer ist, füllen Sie es mit 50 ul sterile, warme phosphatgepufferter Kochsalzlösung (PBS) über einen transurethralen 24 G Angiokatheter.
5. Trennung von Blasenwandschichten
- Bringen Sie ein 1,0-ml-Spritze mit PBS gefüllt und mit einer 30 G verbunden, ¾ in Nadel (Fase vorn gerichtet) an die Klemme der Spritze.
- Position die Nadel gegen die Haut unmittelbar oberhalb des Schambeins in einem 30-45 °-Winkel (80-90 ° relativ zur Längsachse des Ultraschall-Abtastkopf [1]).
- Erkennen Sie die Nadelauf dem Ultraschallbildschirm.
- Langsam durchbohren die Haut und die Bauchmuskulatur [Abbildung 3 II].
- Drehen Sie die Abschrägung der Nadel 180 (jetzt hinten gerichteten) °.
- Legen Sie die Spitze der Nadel in die Blasenwand durchdringen, ohne die Schleimhaut [Abb. 3 III]
- Langsam injizieren 50 ul PBS zwischen der Muskelschicht und der Schleimhaut, um einen künstlichen Raum [Abbildung 3 IV] erstellen.
Hinweis: Wenn die Schleimhaut versehentlich während der Stufe 5.6 perforiert, langsam ziehen Sie die Nadel injizieren und 50 ul PBS nach der Schleimhautschicht zurück über die Nadelspitze umgedreht. - Ziehen Sie die Nadel.
6. Interne Inokulation von Blasenkrebszellen
- Bringen Sie eine zweite 1,0-ml-Spritze (mit Krebszellen in Matrigel ausgesetzt gefüllt) mit einer 30-G, in ¾ Nadel an der Spritze Klemme.
- Führen Sie die Spitze der Nadel auf den gleichenPBS gefüllten Raum, der in Schritt 5.7 erstellt wurde.
- Injizieren 40 ul der Zellsuspension in diesem Raum [Fig. 3 V und VI].
- Ziehen Sie die Nadel.
7. Post-interventionellen Supportivtherapie
- Demontieren Sie die Maus aus der Imaging-Plattform.
- Halten Sie das Tier in einer warmen und angenehmen Umgebung unter ständiger Überwachung während der Genesung von der Narkose.
- Nach wieder bei Bewusstsein und Wiederaufnahme des normalen Gehfähigkeit, legen Sie das Tier wieder in seine Heimat Käfig.
Ergebnisse
Intramurale Injektion von drei unterschiedlichen Tumorzelllinien (UM-luc UC1, UM-UC3 luc und UM-luc UC13) wurde in 50 Tieren unter Ultraschall-Führung an drei aufeinander folgenden Tagen durchgeführt. Die Impfung wurde effizient durchgeführt (mittlere Zeit 5,7 min / Tier) und wurde nicht mit intra-oder post-interventionelle Komplikationen verbunden.
Überwachung des Tumorwachstums wurde durch Ultraschallbildgebung und Biolumineszenz durchgeführt. Am Tag Nr. 3 ein Tumor konnte durch Ultraschall in der vorderen Blase aller 50 Tiere [Abbildung 4 I] nachgewiesen werden. 98% der Mäuse zeigten konstant Tumorwachstum während des Follow-up-Periode [4 und 5]. Nach der Impfung von UM-UC3-luc, entwickelt eine Maus intraperitoneale Tumorausbreitung und der Tumor nach Tag Nr. 7 gebildet in einem zweiten Tier [Tabelle 1]. Dies war die erste Gruppe von Mäusen, die mit dieser neuen Technik inokuliert.
nt "> Die Mäuse wurden am Tag # 24, # 28 getötet und # 37 nach der Inokulation der UM-UC3 luc, UM-UC1 luc und UM-UC13 luc sind. Xenograft-Tumoren wurden mit Hämatoxylin und Eosin geerntet und untersucht (H & E ) Abschnitte. Alle Tumoren waren Muskel-invasive und einige in die perivesikalen Fett durchzogen, aber keine Invasion in benachbarte Organe beobachtet [Abbildung 6 I]. 60% der Mäuse, die UM-UC13 luc Tumoren und 20% der Mäuse, die UM-UC3 luc Tumoren entwickelt retroperitoneale Lymphknotenmetastasen, die von H & E-Färbung [Abbildung 6 II] bestätigt wurden.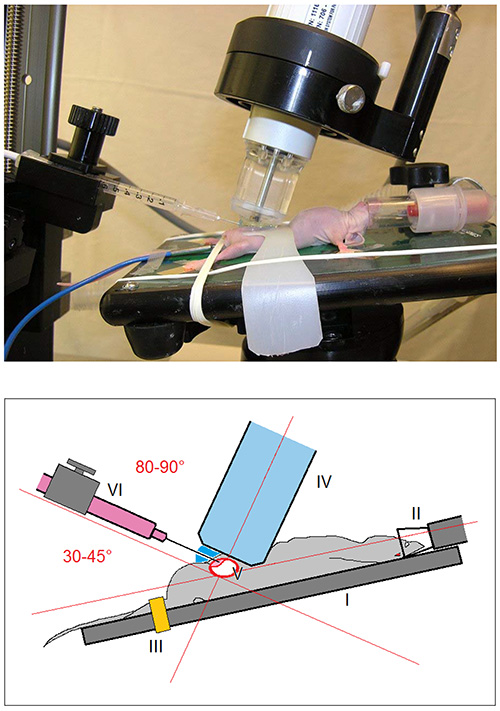
Fig. 1 ist. Bild und schematische Darstellung des experimentellen Aufbaus. Die Maus wird auf der beheizten Operationstisch (I) angebracht ist und unter Narkose gehalten ( II) mit 3% Isofluran / Sauerstoff-Gemisch. Die unteren Gliedmaßen werden mit einem Gummiband (III) befestigt sind. Nach Erreichen der Ultraschall-Abtastkopf (IV) auf die Haut (Längsausrichtung mit einem Winkel von 45-70 Schädel °) die Blase (V) auf dem Ultraschallbild sichtbar gemacht. Eine Spritze mit einer 30 G-Nadel (VI) wird auf die Haut in einem Winkel von 30-45 ° (80-90 ° relativ zur Längsachse des Ultraschall-Schallkopf) geführt ist.

2. Immobilisierung der Blase. Abmessungen und Illustration, die Blase Stabilisierungsriemen (I)-Konstrukt Das Band ist auf den unteren Bauch gebunden und immobilisiert die Blase (II). So ein Ausweichen der Blase während intra-Injektion wird vermieden.
3. Intramuralen Inokulation von Tumorzellen. Visualisierung der Blase auf dem Ultraschallbild (I). Perforation der Haut und Bauchmuskulatur (II). Einführen der Nadel in die Blasenwand ohne Durchdringung der Schleimhaut (III). PBS (50 ul), die zwischen der Muskelschicht und die Schleimhaut nach langsamer Injektion (IV). Tumorzellen in Matrigel in der intra künstlich geschaffenen Raum (V, VI) suspendiert.
1123fig4.jpg "/>
4. . Follow-up durch Ultraschall Dauerverfolgung durch Ultraschall zeigte eine signifikante Zunahme des Tumorvolumens (I: Tag # 3, II: Tag # 7, III: Tag # 13).
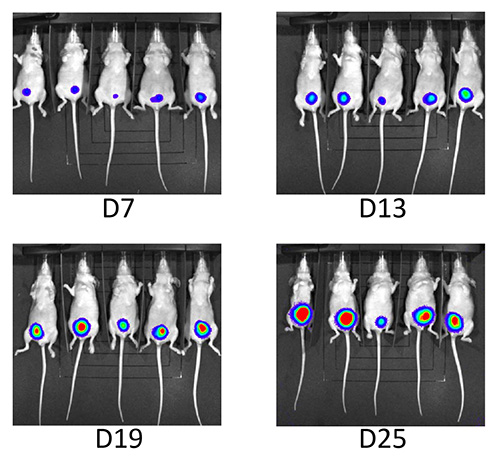
5. Follow-up durch Biolumineszenz. Dauerverfolgung durch Biolumineszenz zeigte konstante Zunahme der Lumineszenz über den Studienzeitraum.

6. Histologie der Xenograft-Tumor-und Lymphknotenmetastasen. In toto H & E Schnitt einer repräsentativen Xenotransplantat tu mor demonstrieren invasive Wachstum in den Muskel, ohne Invasion in benachbarte Organe (I). 60% der Mäuse, die UM-UC13 luc Tumoren und 20% der Mäuse, die UM-UC3 luc Tumoren präsentiert retroperitoneale Lymphknotenmetastasen (II).
| Beimpften Zelllinie | UM-UC1 luc | UM-UC3 luc | UM-UC13 luc | |
| Anzahl der Mäuse | 20 | 15 | 15 | |
| Einspritzvolumen, ul | 40 | 50 | 50 | |
| Zellzahl, absolute | 3,6 x 10 5 | 6 x 10 5 | 5,5 x 10 5 | |
| Zeit pro Tier, min | 3,4 (± 1,6) | 7,7 (± 3,7) | 6,8 (± 2,9) | |
| Tumorinzidenz | 49 (98%) | |||
| 20 (100%) | 14 (93%) | 15 (100%) | ||
| Lymphknotenmetastasen | 0 | 3 (20%) | 9 (60%) | |
| Follow-up (Tage) | 28 | 22 [vor der Behandlung] | 28 [vor der Behandlung] | |
| Das Tumorvolumen (ul) | Tag 4 | 11,6 (± 1,3) | 12,5 (± 1,7) | 14,4 (± 1,3) |
| Ende | 394,6 (± 72,4) | 288,7 (± 66,1) | 78,3 (± 13,4) | |
| Follow-up- | ||||
| Tumor Lumineszenz (Photonen / sec) | Tag 4 | 4,6 x 10 8 | 2,0 x 10 8 | 5,8 x 10 8 |
| (± 9,4 x 10 7) | (± 3,7 x 10 7) | (± 1,3 × 10 8) | ||
| Ende | 1,9 x 10 10 | 1,4 x 10 10 | 1,5 x 10 10 | |
| Follow-up- | (± 4,0 x 10 9) | (± 2,3 x 10 9) | (± 1,9 x 10 9) | |
Tabelle 1. Ultraschall-gesteuerte Injektion der Tumorzellen - Verfahren und Ergebnisse.
Diskussion
Fast alle großen Fortschritte in der Krebstherapie werden die Tests in Tiermodellen benötigen vor Beginn der klinischen Studien. Tiermodellen für Krebs sind wesentliche Instrumente, die Forscher ermöglichen, Tumorbiologie in vivo zu untersuchen. Orthotopische Xenotransplantatmodellen bleibt der Goldstandard 1,2 und weiterhin die größte Flexibilität (hinsichtlich der Auswahl der Zelllinien) bieten und haben die meisten praktischen Nutzen.
Das dargestellte Verfahren ist ein minimal-invasives Änderung der orthotopen Modell zuvor von Dinney et al. Beschrieben 12 Wir haben festgestellt Xenotransplantattumoren durch Ultraschall gesteuerte perkutane Injektion von drei verschiedenen Zelllinien mit einer technischen Erfolgsrate von 100%. Während der kontinuierlichen Follow-up, 98% der Mäuse zeigten konstante Zunahme des Tumorvolumens.
Mit der Durchführung einer minimal-invasiven Technik konnten wir die bestehenden Grenzen der intra-Modell anzugehen. Neben respefesselndes Tierschutz, die reduzierte Invasivität des Verfahrens trägt zur Reproduzierbarkeit in vivo-Experimente durch Verringern der Anzahl von chirurgischen Komplikationen. Es ist höchst Zeit, um eine effektive Bauch Laparotomie und der damit verbundenen Notwendigkeit für den Wundverschluss zu vermeiden. Wir waren in der Lage, signifikant die Verfahrenszeit pro Tier 3,4 min (± 1,6) zu verringern. Allerdings ist der Hauptvorteil der neuartigen Ansatz deren Richtigkeit. Hochauflösendes Ultraschall ermöglicht es uns, den Raum unter der Schleimhaut der Blasenwand erstellt von Kochsalzinjektion visualisieren. Dieser erste Schritt ermöglicht Injektion der Tumorzellinjektion in einem zweiten Schritt und das Risiko von Tumorzell Verschütten minimiert. Dies steht im Gegensatz zu der Technik der intramuralen Injektion nach Laparotomie, wo es unmöglich ist, Nadelplatzierung visualisieren und es gibt immer eine gewisse Unsicherheit über die genaue Tiefe der Injektion. Auch, wie wir Impfen Tumorzellen streng in die vordere Blasenwand, Tumor growth an der Hinterwand der Blase vermieden wird. Anschließend wird die Geschwindigkeit der obstruktiven Komplikationen aufgrund von Tumorwachstum in der Nähe der Ureterenmündungen ist äußerst selten. Dieser Effekt ermöglicht Begleit mehr Wachstum und Behandlungszeiten.
Die wichtigste Einschränkung der Ultraschall-gesteuerte Tumorimpfung ist die Notwendigkeit für eine angemessene technische Ausrüstung. Daher ist die Leistung dieser Verfahren wird wahrscheinlich Zentren, die in Tiermodellen von Krebs beim Menschen spezialisiert sind, eingeschränkt werden. Dies sollte die Zusammenarbeit zwischen den Forschungsgruppen außerhalb dieser Institutionen und Gruppen mit Erfahrung in solchen neuen Tier-Modellierung zu fördern.
Obwohl abhängig von Vertrautheit mit der Ultraschall-Bildgebung und etwas Fingerfertigkeit, ist dieses Modell einfach unter kompetenter Anleitung zu lernen. Der entscheidende Schritt im Verfahren ist die Schaffung eines künstlichen Raum submukosal in der Blasenwand mit Kochsalzlösung. Sobald dieser Raum ohne Perforation o erstelltf der Schleimhautschicht, bleibt es für mehrere Minuten stabil. Die Führung des zweiten Nadel in diesen Raum, um die Tumorzellen zu impfen ist relativ einfach. Die Hauptkomplikation bei der Erstellung des submukösen Raum Perforation der Nadel in das Blasenlumen. Die Schaffung eines submukösen Raum bleibt jedoch möglich. Die Nadel langsam in die Blasenwand zurückgezogen werden, und die nur Kochsalzlösung injiziert, wenn die Schleimhautschicht über der Spitze der Nadel dreht. Nach diesem Manöver das submucosale Raum ist weniger stabil (Kochsalzlösung wird das Blasenlumen innerhalb 30-60 sec entweichen) und der Injektion der Tumorzellen zu schnell durchgeführt werden. Verschütten von Tumorzellen in das Blasenlumen kann in diesen Fällen mit Perforation der Schleimhaut auftreten. Obwohl der Verlust von Tumorzellen aus dem intra-Raum könnte zu einer verminderten Tumorvolumen während des Follow-up zu führen, haben wir nie beobachtet jede intravesikale Tumoraufnahme.
Ein weiterer potenzieller complication das Verschütten von Tumorzellen in die Bauchhöhle durch den Einspritzkanal. Wir beobachteten nur eine intraperitoneale Tumorzell Verbreitung in 50 Tieren, und dies geschah in einem unserer ersten Versuche. Wir führen dies auf die Injektion einer zu großen Tumorzellsuspensionsvolumen. Dies wurde durch die Tatsache, daß die Verringerung des Volumens von 50 bis 40 ul führte zu keiner weiteren intraperitoneale Auslaufen unterstützt.
Diese minimal-invasive Impfung von murinen orthotopen Blasenkrebs Xenotransplantat stellt eine innovative Änderung der bestehenden "intra-Modell", profitiert sowohl die Prüfer und die Tiere gleichermaßen. Die Vorteile dieses Modells fördern die Anpassung an andere Organe wie Nieren-, Prostata-und Leber um orthotope Xenograft-Tumoren in einem minimal-invasive Art und Weise herzustellen.
Offenlegungen
Offener Zugang zu diesem Video-Artikel wird von FUJIFILM Visualsonics, Inc. gesponsert
Danksagungen
Die Autoren bedanken sich für die Durchführung Eliana Beraldi virale Transduktion von Tumorzelllinien und Ben Deeley für seine Anweisung zum Gebrauch des Kleintier-Ultraschall-Bildgebungsplattform bestätigen.
Dieses Projekt wurde von der Deutschen Stiftung-System unterstützt (DFG; JA 2117/1-1: 1), der kanadischen Krebsgesellschaft Forschungsinstitut und ein Mentored Physician Scientist Award von Vancouver Coastal Health Research Institute. Die Ultraschall-Bildgebungsplattform wurde von der kanadischen Stiftung für Innovation gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Chlorhexidine gluconate (2%) | Aplicare | 82-319 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Thermo Scientific | SH3008101 | |
| Fetal bovine serum (FBS) | Thermo Scientific | SH3007103 | |
| Isoflurane | Baxter Corporation | 402-069-02 | |
| Trypsin (0.25%) | Thermo Scientific | SH3004202 | |
| Syringe (1 ml) | BD Bioscience | 309659 | |
| Hypodermic needle (30 G; ¾ in) | Kendall | 830340 | |
| Angiocatheter (24 G) | BD Bioscience | 381112 | |
| Vevo 770 small animal imaging platform | VisualSonics | ||
| RMV 706 ultrasound scanhead | VisualSonics | ||
| IVIS Lumina III | Caliper Life Science |
Referenzen
- Chan, E., Patel, A., Heston, W., Larchian, W. Mouse orthotopic models for bladder cancer research. BJU Int. 104, 1286-1291 (2009).
- Kubota, T. Metastatic models of human cancer xenografted in the nude mouse: the importance of orthotopic transplantation. J. Cell. Biochem. 56, 4-8 (1994).
- Hadaschik, B. A., et al. A validated mouse model for orthotopic bladder cancer using transurethral tumour inoculation and bioluminescence imaging. BJU Int. 100, 1377-1384 (2007).
- Kang, M. R., et al. An Orthotopic Bladder Tumor Model and the Evaluation of Intravesical saRNA Treatment. J. Vis. Exp. (65), (2012).
- Dobek, G. L., Godbey, W. T. An Orthotopic Model of Murine Bladder Cancer. J. Vis. Exp. (48), (2011).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Fu, C., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse Bladder Wall Injection. J. Vis. Exp. (53), (2011).
- Xiao, Z., et al. Characterization of a novel transplantable orthotopic rat bladder transitional cell tumour model. Br. J. Cancer. 81, 638-646 (1999).
- Iinuma, S., Bachor, R., Flotte, T., Hasan, T. Biodistribution and phototoxicity of 5-aminolevulinic acid-induced PpIX in an orthotopic rat bladder tumor model. J. Urol. 153, 802-806 (1995).
- Jäger, W., et al. Hiding in plain view: Genetic profiling reveals decades old cross-contamination of bladder cancer cell line KU7 with HeLa. J. Urol. (13), (2013).
- Horiguchi, Y., Larchian, W. A., Kaplinsky, R., Fair, W. R., Heston, W. D. Intravesical liposome-mediated interleukin-2 gene therapy in orthotopic murine bladder cancer model. Gene Ther. 7, 844-851 (2000).
- Dinney, C. P., et al. Isolation and characterization of metastatic variants from human transitional cell carcinoma passaged by orthotopic implantation in athymic nude mice. J. Urol. 154, 1532-1538 (1995).
- Black, P. C., et al. Validating bladder cancer xenograft bioluminescence with magnetic resonance imaging: the significance of hypoxia and necrosis. BJU Int. 106, 1799-1804 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten