Method Article
Anti-Atom-Antikörper Screening mit HEp-2-Zellen
In diesem Artikel
Zusammenfassung
Indirekte Immunfluoreszenz (IIF)-Assays wurden traditionell für den Nachweis von antinukleären Antikörpern (ANA) in Humanserum verwendet. Das Vorhandensein dieser Antikörper können bei der Diagnose von rheumatischen systemischen Autoimmunerkrankungen (SARD) unterstützen. Dieses Protokoll zeigt, wie die IIF-Technik effektiv durchzuführen, um diese Autoantikörper genau zu erfassen.
Zusammenfassung
Das American College of Rheumatology Positionspapier auf ANA-Test sieht vor, die Verwendung von IIF als Goldstandard-Methode für ANA-Screening ein. Obwohl IIF ist ein ausgezeichneter Screening-Test in erfahrenen Händen, die technischen Schwierigkeiten bei der Verarbeitung und Lese IIF gleitet - wie die arbeitsintensive Dia Verarbeitung, manuelle Lesen, die Notwendigkeit für erfahrene, geschulte Techniker und die Verwendung von dunklen Raum - machen das IIF-Methode schwierig, in den Workflow des modernen, automatisierten Labors passen.
Der erste und entscheidende Schritt in Richtung hohe Qualität ANA-Screening ist eine sorgfältige Dia-Verarbeitung. Dieses Verfahren ist arbeitsintensiv und erfordert volle Verständnis des Prozesses, sowie die Liebe zum Detail und Erfahrung.
Schieber Lesen wird durch Fluoreszenzmikroskopie in dunklen Räumen durchgeführt wird, und wird durch geschulte Techniker, die mit den verschiedenen Mustern vertraut sind, im Rahmen der Zellzyklus getanund die Morphologie der Interphase und teilende Zellen. Vorausgesetzt, dass IIF ist die erste Zeile Screening-Tool für SARD, das Verständnis der Schritte, um diese Technik korrekt durchzuführen, ist kritisch.
Vor kurzem haben Digital-Imaging-Systemen für die automatisierte Lesen von IIF Folien entwickelt. Diese Systeme, wie dem NOVA anzeigen Automatische Fluoreszenzmikroskop, sind entworfen, um die Routine IIF Arbeitsabläufe zu optimieren. NOVA anzeigen erwirbt und speichert hochauflösende digitale Bilder von den Brunnen, damit die Bildaufnahme der Trennung von Interpretation; Bilder werden auf eine hochauflösende Computer-Monitore ausgelegt angesehen. Es speichert Bilder für die Zukunft und unterstützt Interpretation des Betreibers durch Fluoreszenzlichtintensität Daten auf die Bilder. Es ist auch vorläufig kategorisiert Ergebnisse als positiv oder negativ, und stellt Mustererkennung für die positiven Proben. Zusammenfassend, beseitigt die Notwendigkeit für die Dunkelkammer, automatisiert und rationalisiert die IIF-Bereitschaftng / Interpretation Workflow. Am wichtigsten ist, erhöht es die Konsistenz zwischen Leser und Lesungen. Darüber hinaus mit dem Einsatz von Barcode-Dias, Übertragungsfehler werden durch die Bereitstellung Probe Rückverfolgbarkeit und positive Patientenidentifikation eliminiert. Dies führt zu erhöhten Patientendatenintegrität und Sicherheit.
Das übergeordnete Ziel dieses Videos ist es, die IIF Verfahren demonstrieren, einschließlich Rutsche Verarbeitung, Identifizierung gemeinsamer IIF Muster und die Einführung von neuen Entwicklungen zu vereinfachen und zu vereinheitlichen diese Technik.
Einleitung
Der Begriff antinukleäre Antikörper (ANA) beschreibt eine Vielzahl von Autoantikörpern, die mit Bestandteilen der Zellkerne, einschließlich DNA, Proteinen und Ribonukleoproteine 1, 2 reagieren. Die HEp-2-Zelle, ein natives Protein-Array mit Hunderten von Antigenen, stellt ein ideales Substrat für die Detektion von ANA 1. Der Nachweis von ANA im menschlichen Serum ist ein wichtiger Screening-Tool für Erkrankungen des Bindegewebes, und IIF ist die Referenzmethode für ANA Testen ein. Kürzlich IIF auf HEp-2-Zellen wurde in einigen Laboratorien mit Antigen-spezifischen Immunassays und Multiplex-Verfahren ersetzt. Aus Sorge um falsch-negative Ergebnisse und der fehlenden Transparenz für Kliniker, das American College of Rheumatology bildeten eine Task Force, die dem Schluss, dass IIF mit HEp-2-Zellen sollte der "Goldstandard" für die ANA-Screening 1 sein.
Durch die subjektive Natur der ANA-Screening, ist die Qualität der HEp-2-Zellen inintegraler, genaue und vertrauliche Meldung der Ergebnisse. Die Anwesenheit einer hohen Anzahl von mitotischen Zellen, optimale Zellmorphologie ausreichend Konfluenz und Expression der entsprechenden Antigene sind besonders wichtig. IIF Mustererkennung dient als ein wichtiges Instrument, um in der Patientendiagnose zu unterstützen. Das Verständnis der Bedeutung der verschiedenen Muster ermöglicht es, die Ärzte und Laborpersonal, um die entsprechende Follow-up-Tests durchführen, um die Diagnose zu bestätigen. Zum Beispiel können homogene ANA Muster in der Gegenwart von Anti-dsDNA-Antikörpern auftreten oder Chromatin und kann mit systemischem Lupus erythematodes (SLE) 3 zugeordnet werden. Von der anderen Seite wurde kürzlich beschrieben, dass das so genannte dichte feine Fleckenmuster (DFS), die üblicherweise bis zu 12% der anfallenden Proben zu sehen ist, hat sich vor allem mit Anti-DFS70 Antikörpern assoziiert. Diese Autoantikörper, wenn sie isoliert (ohne andere krankheitsspezifische ANA) vorhanden sind, nicht mit systemischen Autoimmunrheumatischen Erkrankungen 9.4. Dabei Bestätigungstests für Anti-DFS70 Antikörper kann dazu beitragen, unnötige Reflextests, bieten erhebliche Kosteneinsparungen und erleichtern Patienten Angst.
Da IIF ist die erste Zeile Screening Methode für Autoantikörper erkennen, ist es wichtig, dass der Anwender weiß, wie die Auswahl der Reagenzien und Gewebesubstrate können die Ergebnisse beeinflussen. Da die IIF-Technik ist von Natur aus subjektiv, ist es wichtig, dass die verwendeten Reagenzien bieten die höchste Qualität der Ergebnisse.
Das Ziel dieses Video-Protokoll ist, den Benutzer mit den richtigen Schritte, um das IIF-Methode, die gemeinsamen Muster mit ANA, verknüpften Aufgaben vertraut zu machen und neue Entwicklungen, die die Arbeitsabläufe im Labor zu rationalisieren und zu standardisieren, Ergebnisse vorzustellen.
Protokoll
1. Probenvorbereitung und Substratauswahl
- Reagenzien aus der Verpackung und lassen Sie jedes Element auf Raumtemperatur kommen. Bereiten Reagenzien und Patientenproben entsprechend der Richtung Einsatz. Hinweis: NOVA Lite Folien werden mit Strichcode und kann leicht in automatisierte Systeme in Verbindung mit dem Laborinformationssystem LIS integriert werden. Dieses Verfahren zeigt Handschiebe Verarbeitung; Hochdurchsatzlabors, können jedoch für die automatisierte Verarbeitung Ausrüstung Rutsche entscheiden.
2. Zugabe von Kontrollen und Proben
- 1 Tropfen positive Kontrolle und 1 Tropfen Negativkontrolle zu den entsprechenden Schiebe Brunnen. Pipette 20-25 ul verdünnten Patientenserum an die übrigen Brunnen. Prozess einer Folie zu einer Zeit.
- Setzen Sie den Schieber (s) in einer Färbung Behälter mit einem feuchten Papiertuch auf dem Boden. Decken Sie die Behälter und inkubieren Sie die Folie (n) für 30 min. Hinweis: Die feuchten Bedingungen wirdverhindern, dass das Substrat vor Austrocknung. Die Trocknung der Brunnen könnte Artefaktfärbung führen. Während dieser Inkubationszeit werden die anti-nukleäre Antikörper im Serum des Patienten auf die Antigene von den Zellen, die gut auf jede fixiert binden.
- Nach der Inkubationszeit, spülen Sie das Serum mit einem sanften Strom von Waschpuffer. Um zu vermeiden, das Substrat zu beschädigen und Cross-over von Proben zwischen Brunnen, Winkel der Schieber verhindern, leicht zu vermeiden, die Leitung der Strom direkt auf den Brunnen. Tippen Sie überschüssiges Waschpuffer und legen Sie die Folie in eine Glasküvette mit Waschpuffer für ca. 5 min.
3. Zugabe von Leuchtstoff-Konjugat
- Einer nach dem anderen, entfernen Sie die Folien aus der Waschpuffer und klopfen Sie leicht, um das überschüssige Waschpuffer zu entfernen. 1 Tropfen fluoreszierendes Konjugat (FITC-markierten Anti-Human-IgG) auf jede Vertiefung. Die Objektträger 30 min in der Feuchtekammer, und sicher sein, um die Färbung zu ersetzenBehälterdeckel. Anmerkung: Für ANA-Test ist die Verwendung eines IgG-Fc-spezifischen Konjugat empfohlen. Das Konjugat ist lichtempfindlich, und der Deckel wird die Folien vor Licht neben der Erhaltung der befeuchteten Umwelt zu schützen. Während dieser Inkubationszeit wird das Konjugat des Patienten anti-nukleäre Antikörper, die an die Antigene gebunden haben, zu binden. Dieses Konjugat-Bindungsergebnisse in Gegenwart von Fluoreszenz in den Vertiefungen.
- Spülen und waschen Sie die Folie wie oben beschrieben.
- Legen Sie ein Deckglas auf einem Papiertuch und gelten Montagemedium in einer durchgehenden Linie bis zum unteren Rand des Deckglases.
- Entfernen Sie jede Folie aus der Waschpuffer und tippen Sie die Folie vorsichtig, um den überschüssigen Waschpuffer zu entfernen. Berühren Sie den unteren Rand der Folie an den Rand des Deckglases.
- Senken Sie den Schlitten auf dem Deckglas in einer Weise, dass das Einschlussmittel auf dem Deckglas fließt zu dem oberen Rand der Folie ohne Luftblasenbildung. Hinweis: Coverslipping, einschließlich der Verwendung der optimalen Menge an Eindeckmedium, ist eine Technik, Praxis nimmt zu perfektionieren.
4. Identifikation von positiven und negativen Ergebnissen
Manuelle Interpretation
- Blick gleitet mit einem Fluoreszenz-Mikroskop, in einem dunklen Raum. Führen Abtasten der gesamten gut mit einem 20X oder 25X Ziel, Zellverteilung und Einheitlichkeit der Fluoreszenz beurteilen
- Wechseln Sie zu einem 40X-Objektiv, um die endgültige Auslegung hinsichtlich Positivität und Muster zu machen.
- Schauen Sie sich die positiven und negativen Kontrollen. Grade Positivität mit einer Reaktivität Notenskala von 1 + bis 4 +. Hinweis: Die Negativkontrolle nicht vollständig dunkel erscheinen, wird aber oft geringe unspezifische Fluoreszenz anzuzeigen. Die positive Kontrolle wird hell apfelgrüne Fluoreszenz im Zellkern (Abbildung 1) anzuzeigen.
Automatische Interpretation
Hinweis: In additiauf manuelle Interpretation, Last-und Scan-Folien von NOVA anzeigen Automatisierte Fluoreszenz-Mikroskop oder andere automatisierte digitale Bild Instrument; keine Dunkelkammer erforderlich. Nach dem Erstellen eines Projekts durch Auswahl der entsprechenden Folientyp, erwirbt das Gerät und speichert hochauflösende digitale Bilder von Zellen in jede Vertiefung. Zusätzlich misst NOVA anzeigen Fluoreszenzlichtintensität, und kategorisiert Ergebnisse als positiv oder negativ, und stellt Mustererkennung für die positiven Proben. Die Bilder werden durch den Betreiber auf einem hochauflösenden Computer-Monitor betrachtet, so dass für endgültige Interpretation, Revision und Bestätigung der Ergebnis NOVA View. Berichte können auf bestätigten Ergebnisse erzeugt werden. Digitale Mikroskopie sind in Verbindung mit einem erfahrenen Labortechniker verwendet werden, wie es beabsichtigt ist, bei der Interpretation der Ergebnisse zu unterstützen.
Ergebnisse
Bei der Bewertung der Zellfärbung Ergebnisse für HEp-2, sind fünf großen Kernmuster am häufigsten berichteten: homogen, gesprenkelt, Zentromer, nukleolären und Kernpunkten. Diese Muster sind das Ergebnis der Autoantikörper-Bindung an spezifische Bestandteile des Kerns. Obwohl ANA-Test ist spezifisch für Kernstrukturen können cytoplasmatischen Muster mit Autoantikörpern gegen cytoplasmatische Strukturen verbunden zu beachten. In einigen Fällen können mehrere Autoantikörpern in einer Probe vorhanden sein, und das Bild kann als ein gemischtes Muster.
Es gibt auch andere, weniger häufig beobachtet, und oft Zellzyklus spezifische Muster, die von der IIF Verfahren nachgewiesen werden kann; zuletzt wurde eine so genannte dichte feine Fleckenmuster mit besonderen klinischen Bedeutung in einigen ANA-positiven Seren beschrieben.
Homogene Muster
Um eine homogene Muster zu identifizieren, scannen Sie die gut und identifizieren mitotischen oder TrennZellen. Der kondensierte Chromatin der mitotischen Zellen (Abbildung 2, orange Pfeil) weist festen, einheitlichen Fluoreszenz, die oft stärker ausgeprägt als in der Ruhezelle nuclei.In homogenen Muster, die ruhenden Zellen zeigen einheitlich, diffuse Fluoreszenz des gesamten Zellkern (Abbildung 2, weißer Pfeil). Dieses charakteristische Muster ist häufig die Folge von anti-dsDNA-Antikörper 10.
Fleckenmuster
In der Grobfleckenmuster, die mitotischen Zellen zeigen keine Färbung des verkürzten Chromosomenregionen (Abbildung 3, orange Pfeil). Die ruhenden Zellen zeigen körnige Fluoreszenz über den gesamten Kern. Die Atomrauschen kann als grob oder fein definiert werden. Die Grob Sprenkeln Muster ist oft das Ergebnis von Anti-Sm-und Anti-RNP-11.
Bei der Feinfleckenmuster, die ruhenden Zellen zeigen feine oder diffuse Rauschen in den Kernen, in der Regel in Uniform distribution (Abbildung 4, weißer Pfeil). Die feine Fleckenmuster ist oft das Ergebnis von Anti-Anti-SSAand SSB 12.
Dichtes fein gefleckte Muster
Es wird nun erkannt, dass die dichte fein gefleckte Muster (DFS) ist häufig bei Routineuntersuchungen, und so viel wie 12% der Proben positiv für anti-DFS70 Autoantikörper. Allerdings sind diese Autoantikörper, wenn sie in Isolation gefunden werden, werden nicht mit systemischen Autoimmunrheumatischen Erkrankungen 4 -6 verbunden. Diese Antikörper sind bei gesunden Personen und Patienten, die nicht mit Lagerkrankheiten SARD 6 weit verbreitet. Bestätigungstests für Anti-DFS70 Antikörper kann dazu beitragen, unnötige Reflex-Tests, ermöglichen erhebliche Kosteneinsparungen und erleichtern Patienten Angst.
Da die DFS-Muster ist schwer zu identifizieren und ANA-Positivität kann Angst um Patienten und Ärzte zu verursachen, ist es sehr empfehlenswert, um ein Bestätigungstest durchführen, nachdem identifiziert fying ein Muster hindeuten DFS70 Anti-Antikörper, um die klinische Bedeutung von ANA klären positivty 5,6.
In diesem Muster mitotischen Zellen (Abbildung 5, orange Pfeil) zeigen positive fleckige Verfärbung des Metaphase Chromatin, während Ruhe Zellkerne (Abbildung 5, weißer Pfeil) weisen gleichmäßig verteilt feine Flecken in der gesamten Kern.
Zentromer-Muster
Um das Zentromer-Muster zu identifizieren, scannen die Brunnen und identifizieren mitotischen oder teilenden Zellen. In mitotischen Zellen (Abbildung 6, orange Pfeil), diese diskrete Flecken eng geworden in dem, was oft als "Metaphase bar" beschrieben verbunden. In der Zentromer-Muster, ruhenden Zellen (Abbildung 6, weißer Pfeil) zeigen etwa 40-60 diskrete Flecken in den Kernen verteilt. Zentromer-Muster ist das Ergebnis der anti-CENP A, B, C 13-Antikörper.
Schritt "> Nucleolar MusterEinige nukleolären Muster werden mit einer diffusen zytoplasmatischen Färbung in mitotischen Zellen (Abbildung 7, orange Pfeil) und negativen chromosomalen Region zugeordnet sind, während andere nucleolear Muster zeigen positive Färbung der chromosomalen Region. Die nukleolären Muster mit homogener oder gesprenkelt Färbung der Kernkörperchen (Abbildung 7, weißer Pfeil) verbunden sind, zusammen mit schwachen gesprenkelt oder homogene Färbung der Kernplasma. Diese Muster werden mit anti-RNA-Polymerase-III verbunden sind, anti-Fibrillarin, anti-Th/To und anti-PM/Scl Antikörper 14,15.
Nuclear-Punkt-Muster
Die Kernpunktmuster mit negativen mitotischen Metaphase-Zellen (Abbildung 8, orange Pfeil) und mit wenigen diskrete Flecken in den Ruhezellkerne (Abbildung 8, weißer Pfeil) verbunden. Diese charakteristische Muster ist häufig die Folge von sp-100, PML oder p80-Autoantikörper colin. Diese Antikörper sind als mit primär biliäre Zirrhose und Autoimmunhepatitis 16 sociated.
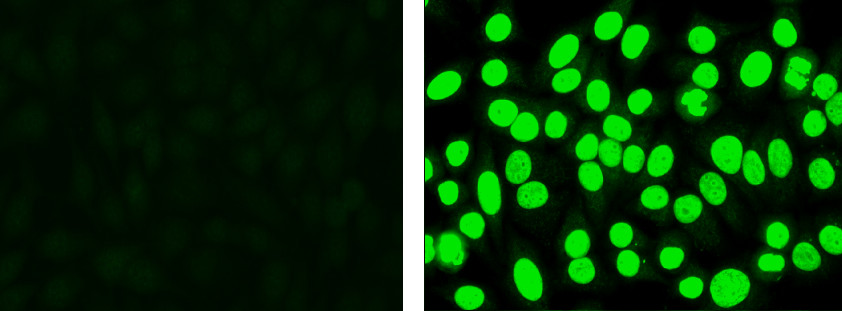
. Abbildung 1 Negativkontrolle (links): Die Zellen zeigen geringe unspezifische Fluoreszenz, aber keine spezifische Kernfärbung Positive Kontrolle (rechts):. Cells anzuzeigen Apfelgrün Kernfluoreszenz.
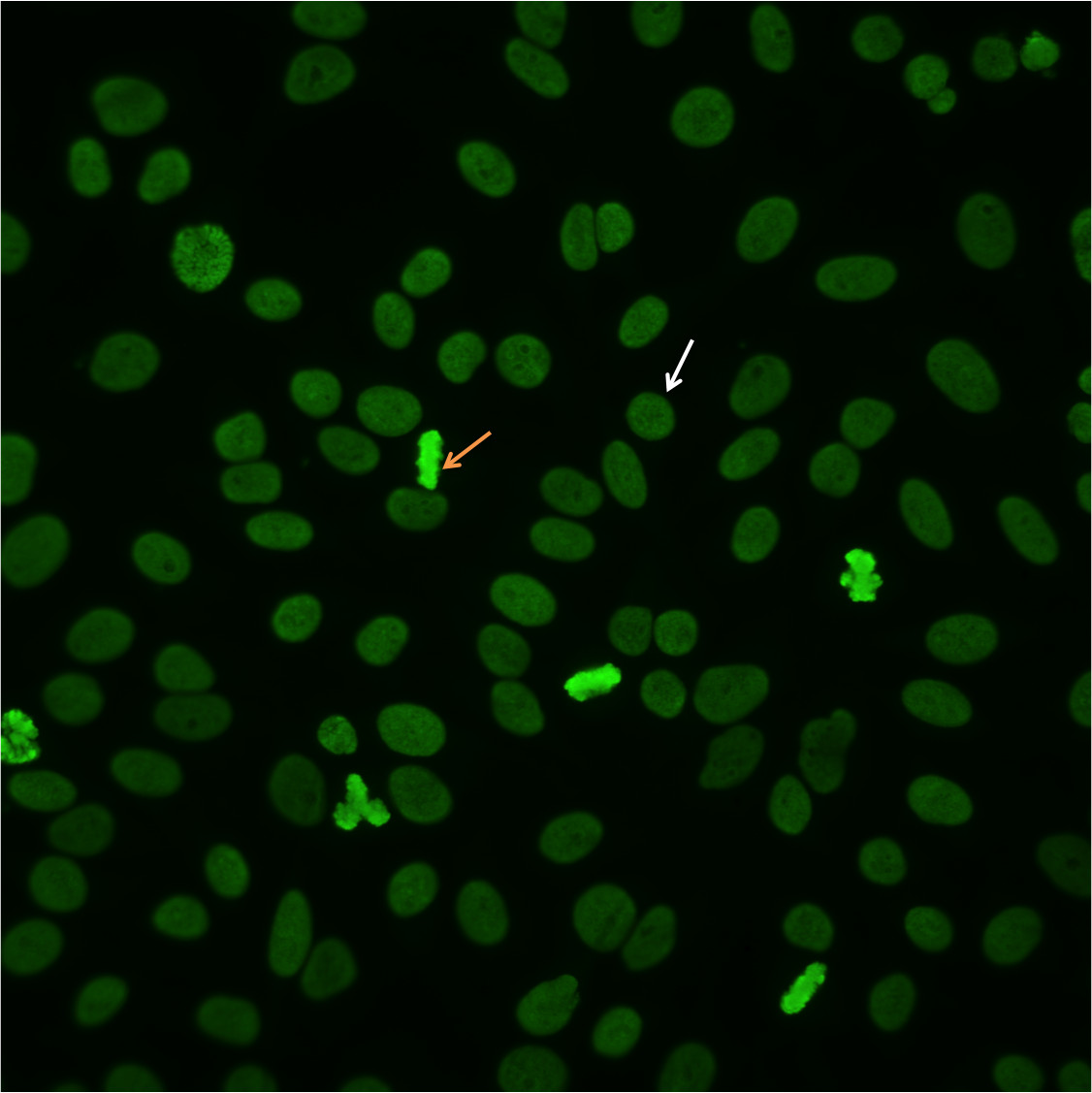
Abbildung 2. Homogene Muster. Mitotische Zellen (orangearrow) zeigen feste Fluoreszenz. Ruhende Zellen zeigen auch, diffuse Färbung (whitearrow).
"Breite =" 500 "/>
Abbildung 3. Grobfleckige Muster. Mitotische Zellen (orange Pfeil) zeigen eine negative Färbung. Ruhende Zellen zeigen eine deutliche Flecken gesprenkelt (weißer Pfeil).

Abbildung 4. Feine Fleckenmuster. Mitotische Zellen (orange Pfeil) zeigen eine negative Färbung. Ruhende Zellen zeigen eine deutliche fein gefleckte Färbung (weißer Pfeil).

Abbildung 5. Dense fein gefleckte Muster. Mitotische Zellen (orange Pfeil) zeigen eine feinkörnige Fest Färbung. Ruhende Zellen zeigen eine sehr feine, diffuse Flecken gesprenkelt (whitearrow).

Abbildung 6. Zentromer-Muster. Mitotische Zellen (orangearrow) zeigen einheitlich, diskrete Flecken. Ruhende Zellen (whitearrow) zeigt 40-60 diskrete Flecken pro Zellkern.
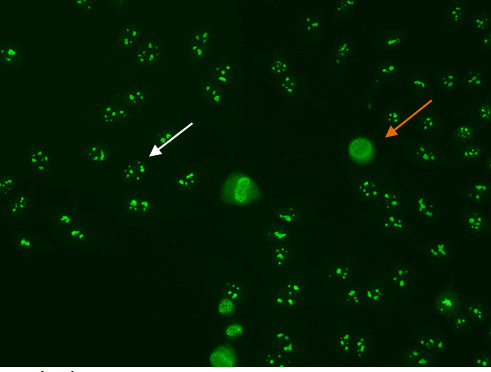
Abbildung 7. Nucleolar Muster. Mitotische Zellen (orangearrow) erscheinen als große Cluster von körnigen Färbung. Ruhen Zelle nucleishows Fluoreszenz in den Kernkörperchen (whitearrow).
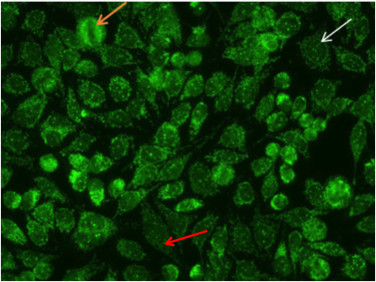
Abbildung 8. Nuclear Punktmuster. Mitotische Zellen (orangearrow) negativ erscheinen. Ruhende Zellen zeigen ein paar discrete Flecken im Nukleus (whitearrow). Zusätzlich wird die Nucelar Punktmuster mit Zytoplasma-Färbung mit Autoantikörpern gegen mitochondriale Antigene (roter Pfeil) verbunden nebeneinander existieren.
Diskussion
Screening by HEp-2 cells is a critical first step in the diagnosis of patients with SARD. However, IIF methods lack harmonization. Sources of variability include preparation of slides, conjugate specificity, and efficiency of the fluorescent microscope and experience of the reader. Despite these concerns, IIF remains the “gold standard” for ANA testing. HEp-2 cells contain a large variety of autoantigens, and provide the ideal substrate for the detection of these autoantibodies. In some laboratories, IIF has been replaced with solid phase screening methods such as multiplex assay or ELISA. The shortcoming of such tests is that they do not display the full range of antigens to be sufficiently sensitive. As a consequence, true positive patients may be missed which can have deleterious consequences In addition to the issues of treatment delay and wrong diagnosis, additional healthcare costs may occur due to the repetition of confirmatory tests or unnecessary diagnostic investigations. Given the inherent challenges to IIF, it is paramount to perform this technique properly to avoid subjectivity in results.
To ensure accurate interpretation and reporting of results for ANA screening, it is vital to use the highest quality substrate. When selecting a HEp-2 substrate, it is critical that the cells be optimized to express clinically relevant epitopes in their native protein state. Transfected or otherwise modified HEp-2 cell lines may not allow proper antibody-antigen binding. In addition, when several different autoantibodies are present simultaneously, recombinant cells may mask one or more patterns. High number of mitotic cells should also be present in the substrate. Adequate number of mitotic cells allows quick and accurate identification of patterns.
In addition to the attributes of the substrate, the objective of this video protocol is to describe the IIF technique by showing critical steps such as the addition of sample, slide washing, addition of conjugate, cover slipping, and determination of positive and negative results. Results can be compromised if proper technique is not used for each of these steps. Proper washing is important to remove all unbound antibody. Some patients display very high amounts of autoantibodies and in these cases it is important to wash the serum from the wells such that it does not contaminate other wells.
Although IIF has traditionally been a very labor intensive and subjective laboratory method, new technologies such as slide processors, barcoded slides and automated digital microscopy can greatly simplify the workflow, increase the consistency and reduce the sources of variability of interpretation.
Offenlegungen
Die Autoren Gabriella Lakos, Cassandra Bryant, Carol Buchner, Anna und Eslami sind Mitarbeiter von INOVA Diagnostics.
Danksagungen
Wir danken Cassandra Bryant für die Durchführung der IIF Experiment und Carol Buchner für ihre kompetente technische Bewertung.
Materialien
| Name | Company | Catalog Number | Comments |
| NOVA Lite HEp-2 IgG (DAPI conjugate) | INOVA Diagnostics | 708102 | |
| NOVA View Instrument | INOVA Diagnostics | NV2000 | |
| QUANTA Link Workstation | INOVA Diagnostics | LINK010 | |
| QUANTA Link Workstation License | INOVA Diagnostics | LINK001 | |
| Barcode Scanner | INOVA Diagnostics | LINK019 |
Referenzen
- Meroni, P. L., Schur, P. H. ANA screening: an old test with new recommendations. Ann Rheum Dis. 69 (8), 1420-1422 (2010).
- Tan, E. M. Autoantibodies to nuclear antigens (ANA): Their immunobiology and medicine. Advances in immunology. 33, 167-240 (1982).
- Sack, U., et al. Autoantibody detection using indirect immunofluorescence on HEp-2 cells. Ann NY Acad Sci. 1173, 166-173 (2009).
- Watanabe, A., et al. Anti-DFS70 antibodies in 597 healthy hospital workers. Arthritis Rheum. 50 (3), 892-900 (2004).
- Mahler, M., et al. Importance of the dense fine speckled pattern on HEp-2 cells and anti-DFS70 antibodies for the diagnosis of systemic autoimmune diseases. Autoimmun Revi. 11 (9), 642-645 (2012).
- Mahler, M., Fritzler, M. J. The clinical significance of the dense fine speckled immunofluorescence pattern on HEp-2 cells for the diagnosis of systemic autoimmune diseases. Clin Dev Immunol. , (2012).
- Miyara, M., et al. Clinical phenotypes of patients with anti-DFS70/LEDGF antibodies in a routine ANA referral cohort. Clin Dev Immunol. , (2013).
- Mariz, H., et al. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum. 63 (1), 191-200 (2011).
- Muro, Y., et al. High concomitance of disease marker autoantibodies in anti-DFS70/LEDGF autoantibody-positive patients with autoimmune rheumatic disease. Lupus. 17 (3), 171-176 (2008).
- Agmon-Levin, N., et al. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 73 (1), 17-23 (2014).
- Craft, J., et al. The U2 small nuclear ribonucleoprotein particle as an autoantigen. J Clin Invest. 81 (6), 1716-1724 (1998).
- Salomonsson, S., et al. A serologic marker for fetal risk of congenital heart block. Arthritis Rheum. 46 (5), 1233-1241 (2002).
- Miyawaki, S., et al. Clinical and serological heterogeneity in patients with anticentromere antibodies. J Rheumatology. 32 (8), 1488-1494 (2005).
- Raijamkers, R., et al. PM-Scl-75 is the main autoantigen in patients with the polymyositis/scleroderma overlap syndrome. Arthritis Rheum. 50 (2), 565-569 (2004).
- Yang, J. M., et al. Human scleroderma sera contain autoantibodies to protein components specific to the UC small nucleolar RNP complex. Arthritis Rheum. 48 (1), 210-217 (2003).
- Granito, A., et al. Antinuclear antibodies as ancillary markers in primary biliary cirrhosis. Expert Rev Mol Diagn. 12 (1), 65-74 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten