Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Lignin Herunterregulierung
In diesem Artikel
Zusammenfassung
Ein Doppelstrang-RNA-Interferenz (dsRNAi)-Technik wird eingesetzt, um nach unten zu regulieren den Mais Cinnamoyl Coenzym A-Reduktase (ZmCCR1)-Gen zu niedrigeren Pflanzen Ligningehalt. Lignin Down-Regulation aus der Zellwand wird durch mikroskopische Analysen visualisiert und durch die Klason Verfahren quantifiziert. Änderungen der Zusammensetzung in kristalliner Cellulose und Hemicellulose werden analysiert.
Zusammenfassung
Um die Verwendung von Lignocellulose-Biomasse als Alternative Bioenergie Ressource, bei der biologischen Umsetzungsprozesse zu erleichtern, ist eine Vorbehandlung erforderlich Schritt zu öffnen, die Struktur der Pflanzenzellwand, die Erhöhung der Zugänglichkeit der Zellwand Kohlenhydraten. Lignin, ein Polyphenol Material in vielen Zelltypen vorhanden Wand, ist bekannt, dass eine erhebliche Behinderung der Zugang Enzym sein. Reduzierung der Ligningehalt auf ein Niveau, das nicht mit der strukturellen Integrität und Verteidigungssystem der Anlage nicht stört könnte ein wertvoller Schritt, um die Kosten der Bioethanolproduktion zu reduzieren. In dieser Studie haben wir genetisch herunterreguliert einem der Lignin-Biosynthese-Genen, Cinnamoyl-CoA-Reduktase (ZmCCR1) über ein Doppelstrang-RNA-Interferenztechnik. Die ZmCCR1_RNAi Konstrukt wurde mit der Partikelbeschuss Verfahren in die Maisgenom integriert. Transgene Maispflanzen wuchsen in der Regel im Vergleich zu den Kontrollpflanzen Wildtyp ohne interfering mit Biomasse Wachstum oder Abwehrmechanismen, mit Ausnahme der Anzeige der Braunfärbung in transgenen Pflanzen Blattmittelrippen, Hülsen, und Stängel. Die mikroskopische Analysen in Verbindung mit der histologischen Test ergab, dass die Blatt Sklerenchymfasern wurden verdünnt, aber die Struktur und Größe der anderen Hauptgefäßsystemkomponenten nicht verändert wurde. Der Ligningehalt in der transgenen Mais wurde von 7-8,7% verringert wurde das kristalline Cellulosegehalt in Reaktion auf Lignin Reduktion erhöht und Hemicellulosen unverändert. Die Analysen können zeigen, dass der Kohlenstofffluss kann von Lignin-Biosynthese Cellulose-Biosynthese verschoben wurden. Dieser Artikel umreißt die zur Herunterregulierung der Ligningehalt in Mais via RNAi-Technik Verfahren und die Zellwandzusammensetzungsanalyse verwendet, um die Wirkung der Modifikationen auf der Zellwandstruktur zu überprüfen.
Einleitung
Die Produktion von Biokraftstoffen aus Lignocellulose-Biomasse ist aufgrund seiner Fülle gegenwärtig in den USA ein sehr wünschenswert, und im Fall der nachhaltigen Ernte von land-und forstwirtschaftlichen Rest, die Fähigkeit, nicht direkt konkurrieren um Ackerflächen für Lebensmittel-und Futtermittelproduktion verwendet. Doch im Gegensatz zu Mais Getreide, das die Hauptquelle der derzeit in den USA erzeugt Biokraftstoff ist, sind Lignocellulose-Materialien deutlich komplexer und schwieriger zu brechen. Zusätzlich zu dem langkettigen Kohlenhydrate, Cellulose und Hemicellulose, die während der Fermentation von Lignocellulose-Materialien sind die Hauptquellen für Zucker sind, viele Arten von Pflanzenzellwänden Lignin enthalten, ein Polymer, das Phenylpropanoid Stärke, Abwehr gegen Pathogenbefall bietet, und Hydrophobie an der Wand der Zelle. Während für das Pflanzenwachstum und Überleben notwendig, Lignin stellt auch ein ernsthaftes Hindernis für die erfolgreiche enzymatische Umwandlung von Cellulose und hemicelluverlieren, um lösliche Zucker. Materialien mit hoher Lignin Inhalte sind in der Regel weniger wünschenswert Materialien sowohl für die Biokraftstoff (durch biologische Umwandlung Wege) und der Zellstoff-und Papierindustrie aufgrund der negativen Auswirkungen auf die Verarbeitungseigenschaften und Produktqualität. Daher könnte die genetische Manipulation von Pflanzenmaterialien für Lignin Reduzierung auf einem Niveau, das nicht mit Pflanzen strukturelle Stärke und Verteidigungssysteme nicht beeinträchtigt wichtig für die Senkung der Produktionskosten sowohl für die Lignocellulose Biokraftstoff und der Zellstoff-und Papier-Industrie werden.
In Mais (Zea mays), Lignin kovalent vernetzt, um in der primären Zellwand und über ferulate Diferulat Brücken 2 Hemicellulose. Das Lignin-Hemicellulose Komplex bindet an Cellulosemikrofibrillen über Wasserstoffbrücken bilden eine komplexe Matrix, die Integrität und Stärke verleiht dem sekundären Zellwand. Die mechanische Festigkeit von Pflanzenzellwänden wird weitgehend durch die Art bestimmt lignin Untereinheiten 3-5. In früheren Studien, Veränderung der Anteile von Lignin-Untereinheiten hat keinen klaren Trend auf enzymatische Verdaulichkeit 6-11 gezeigt. Allerdings Senkungen in Ligningehalt zeigen in der Regel eine Verbesserung der Conversions 12,13 und kann ein Schlüssel zur Steigerung der Verdaulichkeit von Pflanzenmaterial durch hydrolytische Enzyme, einschließlich Endocellulasen, Cellobiohydrolasen und β-Glucosidasen 14 sein.
Gentechnik, um die Expression von Transkripten zu regulieren wurde ausgiebig geübt, um Pflanzenmerkmale zu verbessern. Erweiterte Techniken, einschließlich Anti-Sense-15 und Co-Suppression 16 Technologien, ermöglichen eine effektive Down-Regulation von Zielgenen. Komplette Gen Knock-Out wurde auch mit Gen-Konstrukte Intron-RNA gespleißt Codierung mit einer Haarnadelstruktur 17 erreicht. Weiterhin ist ein Doppelstrang-RNA-Interferenz (dsRNAi)-Technik, dh ein leistungsfähiges und effektives Gen-Expression Mediator, die entweder gezielt Transkript Abbau oder Übersetzung Repression funktioniert, stellt ein starkes Mittel, um eine breite Palette von Unterdrückung Auswirkungen auf die Ziel-mRNA 18 induzieren. Gen-Silencing-Techniken zeigen mehrere Einschränkungen. Diese Techniken nicht genau regeln die Ebene der Transkription und es kann zu unerwarteten Silencing Auswirkungen auf andere homologe Gene verursachen.
In diesem Verfahren beschäftigten wir Partikelbeschuss zu tragen dsRNAi die Konstrukte in das Maisgenom. Bis heute eine Vielzahl von Pflanzenarten wurden erfolgreich mit Partikelbeschuss, Agrobacterium vermittelte Transformation, Elektroporation und Mikroinjektion Verfahren transformiert. In Mais genetische Transformation ist die particle bombardment Methode gegenüber allen anderen Methoden vorteilhaft, weil es die effizienteste. Partikelbeschuss ist nicht abhängig von Bakterien, so daß das Verfahren frei von biologischen Einschränkungen wie der Größe des Gens oder Gen-Artenigin oder die Pflanze Genotyp. Die physikalische Transgen Abgabesystem ermöglicht hochmolekularen DNA und mehreren Genen in Pflanzengenomen und in bestimmten Fällen in Chloroplasten mit hoher Transformationseffizienz 19 eingeführt werden. Das Lignin Verringerung des Gefäßsystems der Blattmittelrippe über Rasterelektronenmikroskopie (SEM) dargestellt werden, die nützlich für die Untersuchung der Topographie und der Zusammensetzung der Proben ist.
In Maispflanzen, zwei der Cinnamoyl-CoA-Reduktase (ZmCCR1: X98083 und ZmCCR2: Y15069)-Gene wurden in das Maisgenom 20 gefunden. Cinnamoyl-CoA-Reduktase katalysiert die Umwandlung der Hydroxycinnamoyl-CoA-Ester in Cinnamyl Aldehyden. Wir wählten die ZmCCR1 Gens herunterregulieren, weil dieses Enzym das Gen in allen Geweben exprimiert verholzenden. Die 523 Nukleotide am 3'-Terminus des Gens wurden ZmCCR1 für eine dsRNAi Konstrukt gewählt, weil die Sequenzen zu sein schienvielfältiger als im Vergleich zu denen von ZmCCR2. So würde das Konstrukt genau dsRNAi nur ZmCCR1 binden, Vermeidung von Off-Target-Silencing-21. Ein ZmCCR1_RNAi Konstrukt wurde in der zytoplasmatischen Expressionssystems ImpactVector1.1-Tag konstruiert (IV 1,1), enthaltend das grüne Gewebe spezifischen Promotor, Ribulose-1 ,5-bisphosphat-Carboxylase-Oxygenase (RuBisCO).
Um die Auswirkungen der dsRNAi bauen auf transgene Pflanzen zu untersuchen, wurde das Lignin-Gehalt quantifiziert. Die Klason (säureunlösliche) Lignin Messung ist bekannt, genauer im Vergleich zu der sauren Detergens-Lignin Quantifizierungsverfahren, die ein Teil des Lignins 22 zu lösen. Daher wurde die Klason Lignin in transgenen Maisstengel gemessen. Dieses Verfahren besteht aus zwei Schritten, die saure Hydrolyse in lösliche polymere Kohlenhydrate Monosaccharide 23 umwandelt. Das hydrolysierte Biomasse wurde dann in Säure löslichen und unlöslichen Materialien fraktioniertALS und die Säure unlösliche Lignin wurde nach früheren Studien 23,24 gemessen. Idealerweise sollte Lignin Analyse Extraktionen mit Wasser und Ethanol vor der Hydrolyse, um lösliche Materialien, die mit dem Ergebnis stören können, und eine post-Hydrolyse Verbrennung des Lignin-Rest, für jede in dem Rückstand enthalten Asche ausmachen. Ohne diese Maßnahmen konnte die Lignin-Gehalt der Probe künstlich aufgebläht werden. Der vollständige Verfahren wird hier dargestellt, aber für unsere Versuche waren wir nicht in der Lage, diese beiden Schritte aufgrund der geringen Materialvolumens zum Testen durch
Zwei weitere Zellwandbestandteile, Cellulose und Hemicellulose wurden auch in der Lignin herunterreguliert transgenen Maislinien analysiert. Es wurde berichtet, dass transgene Pflanzen, die entweder in ihrer Phenylalanin-Ammoniak-Lyase (PAL) 25, 4-Coumarat herunterreguliert sind: CoA-Ligase (4CL) 26, ein oder Zimtalkohollcohol-Dehydrogenase (CAD) 27 zeigen einen Anstieg in anderen Zellwandstrukturkomponenten. Als ersten Schritt in unseren Studien wurde kristalline Cellulose nach dem Verfahren Updegraff 28 gemessen. Diese Methode wurde ursprünglich zur Bestimmung von Cellulose in einer großen Anzahl von cellulolytischen Bakterien und Pilze entwickelt. Kurz gesagt, wurden die gemahlenen Mais Aktien mit Updegraff Reagenz (: Salpetersäure: Essigsäure Wasser) behandelt, um Hemicellulose, Lignin und xylosans entfernen. Die kristalline Cellulose wurde vollständig durch Zugabe von H 2 SO 4 in Glucose über Saeman hydrolysiert. Die kristalline Cellulose wurde dann unter Verwendung der farbmetrischen Verfahren Anthron 29 untersucht. Um zu überprüfen, ob die Hemicellulose Inhalt geändert wurden, wurden die Extrakte aus Monosaccharid gemahlen Stiele mit Trifluoressigsäure hydrolysiert, derivatisiert mit dem Alditolacetat Verfahren und durch Gaschromatographie (GC) 30 analysiert dann. Die detaillierten Verfahren für kristalline celCellulose und den Matrixzusammensetzung Polysaccharide Analysen sind in Foster et al. (2010) 31.
Hier beschreiben wir die für Lignin verwendeten Verfahren Herunterregulierung in Mais über eine RNAi-Technologie, Partikelbeschuss Transformation und Lignin-Analyse für beschleunigte Dekonstruktion von Mais Lignocellulose in vergärbaren Zucker für Biokraftstoffe.
Protokoll
1. Vorbereitung der dsRNAi Konstrukte Wird für die Herunterregulierung von ZmCCR1
- Design-Gen-spezifischen Primer einschließlich der erforderlichen Restriktionsenzym für die Herstellung einer dsRNAi Konstrukt zur Knock-out die ZmCCR1 Gen. Zwei Primer-Sets wurden entwickelt, um zwei Segmente Fragment ZmCCR1 cDNA verstärken:. Ein 523 bp-Fragment von Nukleotid 748 bis 1271 und ein 285 bp-Fragment von Nukleotid 986-1271 ZmCCR1 Die cDNA wurde von der Arizona Genome Institute (AGI) zur Verfügung gestellt. Weitere Details sind in Fig. 1 beschrieben.
- Verstärken des großen Fragments durch Polymerasekettenreaktion (PCR) aus der ZmCCR1 cDNA-Matrize unter Verwendung der Primer ZmCCR1_748F_BglII (5'-AGATCTACATCCTCAAGTACCTGGAC-3 ') und ZmCCR1_1271R_NcoI (5'-CCATGGTTTACACAGCAGGGGAAGGT-3'). Verstärken das kleinere Fragment (285 bp) unter Verwendung der Primer ZmCCR1_986F_BglII (5'-AGATCTGGAAGCAGCCGTACAAGTTC-3 ') und einen ZmCCR1_1271R_SacI (5R17;-GAGCTCTTTACACAGCAGGGGAAGGT-3 ').
- Individuell ligieren die Fragmente in pGEM-T Easy folgenden Anweisungen des Herstellers.
- Führen Mini-Prep Plasmid-DNA-Isolierung aus einzelnen Trans, die jeweils das pGEM-T-Konstrukte mit einem handelsüblichen Mini-Prep Plasmid-Kit.
- Digest sowohl das pGEM-T :: ZmCCR1 (523 bp) und ImpactVector (IV) -1,1 (Zytoplasma Expressionsvektor) sowohl mit BglII und NcoI.
- Ligieren die große Faul Gel gereinigt ZmCCR1 Fragment (523 bp) in den verdaut Gel gereinigt IV-1.1.
- Verdauen die pGEM-T :: ZmCCR1 (285 bp) und IV-1.1 :: ZmCCR1 (523 bp) sowohl mit BglII und SacI, um die kleine Fragment in den IV-1.1 :: ZmCCR1 (523 bp) einfügen.
- Ligieren das kleine Faul Gel gereinigt ZmCCR1 Fragment (285 bp) in das verdaut Gel gereinigt IV-1.1 :: ZmCCR1 (523 bp).
- Klonen sowohl 523 bp und 285 bp Fragmentierungts in IV-1.1, um die ZmCCR1 RNAi-Konstrukt, das ein 285 bp invertierten Wiederholungssequenz mit einem 238 bp Abstandshalter in der Mitte der invertierten Repeat-Fragmente (siehe Fig. 1) hat.
- Übertragen Sie dieses Konstrukts in Escherichia coli (E. coli), wachsen sie und führen Sie eine Midi-Prep-Größe Plasmid-DNA-Isolierung, genügend Plasmid-DNA für Mais genetische Transformation erhalten.
2. Mais, Genetische Transformation
- Herstellung von Wolfram-Teilchen
- Platz 60 mg Wolframkügelchen (M10) in einem 1,5-ml-Röhrchen vereinigt und mit 1 ml 70% Ethanol für 2 Minuten gevortext. Inkubation für 10 min bei 23 ° C, dann bei 18.894 xg zentrifugieren für 2 min und den Überstand verwerfen.
- Waschen 3x mit 1 ml 100% Ethanol, Zentrifugieren für 2 min und Überstand verwerfen. 1 ml steriles 50% Glycerin, um die Mikropartikel-Konzentration auf 60 mg / ml zu bringen.
- Herstellung von DNA für die Bombardierung
- Place die 50 ul (3 mg) von Wolfram-Perlen in 50% Glycerin in ein 1,5-ml-Röhrchen vorbereitet. Werden 5 ul (1 ug) der IV-1.1 :: ZmCCR1 RNAi-Plasmid-DNA, 50 &mgr; l 2,5 M CaCl 2 und 20 &mgr; l 0,1 M Spermidin. Wirbel kurz zwischen jeder Zugabe der obigen Reagenzien.
- Vortex die Wolfram-Wulst-DNA-Gemisch kurz und Zentrifuge bei 18.894 g für 30 Sekunden. Abgießen des Überstandes und Resuspendieren des Pellets in 140 ul 70% Ethanol. Entfernen Sie die Flüssigkeit und entsorgen. Add 140 &mgr; l 100% Ethanol. Entfernen Sie die Flüssigkeit und entsorgen.
- Add 48 &mgr; l 100% Ethanol. Verwenden oder lagern Sie sofort auf Eis für bis zu 4 Stunden vor der Bombardierung.
- Beschuss
- Legen Sie eine 3-5 cm Durchmesser Hallo-II embryo Mais Kalli (von Mais Transformation Center of Iowa State University zur Verfügung gestellt) in der Mitte des 100 mm Petrischalen mit 32 N6OSM Medien (wie osmotium) mindestens vier Stunden vor dem Bombardement.
- Prepare die PSD-1000/He Partikelliefer Gerät gemäß den Anweisungen des Herstellers 33.
- Sterilisieren Kammerwand mit 70% Ethanol. Legen Sie sterile 650 psi Berstscheibe in sterile Haltekappe. Verbreiten Sie 5-6 ul der M10-DNA-Lösung auf die Oberfläche eines Macrocarriers, kurz antrocknen. Last Macrocarrier und Stoppen Bildschirm in Mikroeinführung Montage.
- Zeigen Mikroeinführung Montage und Mais Kalli in Kammer in einem gewählten Abstand von dem Stop-Bildschirm (L2 = 6 cm) und Tür schließen. Beschleunigen in einem Vakuum von 27 psi gegen einen Drahtgitter.
- Drücken Sie die Feuer-Taste, bis Berstscheibe platzt und Helium-Druckmesser auf Null fällt. Lassen Sie den Feuerknopf.
- Inkubieren bombardiert Kalli in eine Petrischale mit N6OSM (osmotischem Medium) 32 für 16 Stunden im Dunkeln bei 27 ° C. Brechen Sie die Kalli in etwa zehn Stücke und Transfer zum N6E (Kallus) 32 in Petrischalen und Inkubation für 5 Tage in Dunkeln bei 27 ° C.
- Auswahl
- Nach 5 Tagen auf N6E, übertragen Sie die Kalli auf N6S Medium (Auswahl Medien) 32. Subculture alle Kalli auf Selektionsmedium alle 30 Tage für 8-12 Wochen ohne die Kalli-Struktur zu stören.
- Nach etwa 8-10 Wochen wird weiß schnell wachsenden Sektoren aus dem nicht-proliferativen und teilweise nekrotischen Mutter Kalli wachsen. Verbrauchsteuern die weißen schnell wachsenden Geweben und Subkultur ihnen an die frische Selektionsmedium (N6S) 32 und weiter wie oben inkubiert.
- Regeneration
- Übertragen Sie die weißen und schnell wachsenden embryonalen Kalli auf Regenerationsmedium und Inkubation 32 wie oben für 1 Woche. Schalten Sie die regenerierende embryogene Kalli auf einen Zeitraum von 16 Stunden Tageslicht und 8 Stunden Dunkelheit bei 25 bis 27 ° C
- Übertragen Sie die Regenerations schießt auf das Wurzelmedium 32 in einem Reagenzglas nach 3-4 Wochen, weiter wie oben inkubiert. Nach umfangreichen rRoot Entwicklung erscheint, waschen Wurzeln vorsichtig unter Wasserhahn, dann verpflanzen die Pflänzchen zu 4 "Töpfe mit Erde. Decken Sie die Töpfe mit Plastiktüten feucht zu halten. Nach 2 Tagen machen kleine Löcher die Kunststoffbeutel. Nach 5-6 Tagen entfernen Sie die Plastiktaschen. Fahren Sie wie oben für weitere 5-6 Tage inkubiert.
- Gewächshaus
- Übertragen Sie die Jungpflanzen in 18 "Töpfe mit Erde und halten in voller Sommersonne oder im Gewächshaus Licht. Die ersten regenerierten Pflanzen werden als T 0, während die ersten Samen gehören zu den T 1-Generation.
3. Histologische Assay
- Beheben die Maisblatt Mitte Rippen in 5 ml 10% igem neutral gepuffertem Formalin.
- Prozess-und Vakuum infiltrieren mit Paraffin auf einer Gewebeprozessor mit einem Gewebe-Prozessor.
- Betten Sie das Gewebe in Paraffin mit einem Histocentre III Einbettung Station.
- Entfernen Sie das überschüssige Paraffin von den Rändern einmal blocks gekühlt.
- Abschnitt Probe bei 4-5 &mgr; m mit einem Mikrotom mit einem Mikrotom.
- Zeigen Abschnitte auf Objektträgern und trocken in einer 56 ° C-Inkubator für 2-24 Std. Stellen Sie sicher, Abschnitte sind komplett auf den Objektträger geklebt.
- Entparaffinieren Abschnitte in zwei Änderungen Xylol für 5 min bei 23 ° C.
- Hydrat gleitet durch zwei Änderungen von 100% igem Ethanol für 2 min und zwei Wechsel von 95% Ethanol für 2 Minuten bei 23 ° C.
- Spülen Sie die Abschnitte in fließendem Leitungswasser für 2 min.
- Färben mit 0,05% Toluidinblau O für 1-2 min und rasch mit ddH 2 O.
- Legen Sie ein Deckglas auf den Proben mit Immersionsöl und Visualisierung mit Lichtmikroskopie.
- Rasterelektronenmikroskopie (SEM)
- Beheben die geschnittene Maisblatt Mitte Rippen in 4% Glutaraldehyd und 0,1 M Natriumphosphatpuffer (pH 7,4) bei 4 ° C für 1-2 Stunden.
- Die Proben in dem Puffer kurz abspülen, dehydratisiert sie in eineEthanolreihe (25%, 50%, 75% und 95%) für 10-15 Minuten bei jeder Abstufung und 100% Ethanol für 10 min, 3x.
- Trocknen der entwässerten geschnittene Maisblatt Mitte Rippen in einem kritischen Punkt Trockner unter Verwendung von flüssigem Kohlendioxid als Übergangsfluid.
- Montieren Sie die getrockneten Proben auf Aluminium Stubs mit Hochvakuum-Kohlenstoff Registerkarten
- Bestreichen Sie die Maisblatt Mitte der Rippen auf Aluminium-Stubs in einem Sputter-Coater mit Argongas gespült montiert mit Gold (ca. 20 nm Dicke).
- Untersuchen Sie die beschichteten Proben in einem JEOL JSM-6400V (Lanthanhexaborid Elektronenemitter) Rasterelektronenmikroskop.
- Digitale Bilder wurden mit einer Analyse Pro-Software (Version 3.2) abgebildet.
4. Klason Lignin Mess
- Mühle die Proben durch ein 2-mm-Sieb.
- Verwenden Sie ein Feuchtemessgerät, um den Feuchtigkeitsgehalt jeder Probe zu bestimmen und notieren Sie den Wert.
- Abwiegen ~ 1,5 g jeder Probe und notieren Sie die Masse. Extract die Proben unter Verwendung von Wasser für die erste Extraktion, für die zweite Extraktion unter Verwendung entweder eines automatischen Lösemittelextraktion (3 Zyklen pro Extraktion ~ 14 min pro Zyklus) oder Soxhlet-Apparat (8 hr pro Extraktion) gefolgt von Ethanol. (Anmerkung: Dieser Schritt entfernt Extraktstoffe, die bei der sauren Hydrolyse kondensieren und beeinträchtigen die genaue Messung von Lignin, die Erhöhung der scheinbaren Klason Lignin.)
- Trocknen Sie die extrahierten Proben bei 45 ° C über Nacht, dann ist es ihnen ermöglichen, im Exsikkator abkühlen und wieder wiegen.
- Einen Brutschrank auf 30 ° C Messen Sie 0,3 g jeder trockenen, extrahierten Probe in Schraubverschluss-Hochdruckrohre (dreifach pro Probe wird empfohlen) und notieren Sie die Gewichte auf 0,1 mg. 3 ml 72% H 2 SO 4 zu jeder Druckrohr.
- Mischen Sie die Probe mit einem Glas-oder Teflon-Rührstab. Lassen Sie den Rührstab in der Röhre, bis Wasser nach Inkubation aufgenommen.
- Zeigen Fläschchen in einem Inkubator set auf 30 º C und 150 Upm für 60 min. Nach 1 Stunde hinzuzufügen 84 ml entionisiertem Wasser, um die Säurekonzentration auf 4% verdünnt und mit dem Rührstab gemischt. Seien Sie vorsichtig, nicht zu große Probenmengen an den Seiten der Flasche über der Wasserlinie zu verlassen.
- Dicht verschließen Sie die Verschlüsse an allen Fläschchen und legen Sie sie in eine Metallstange oder große Becher. Autoklaven bei 121 ° C unter Verwendung eines flüssigen Sterilisationszyklus für 1 Stunde. Lassen Sie sie auf Raumtemperatur vor dem Öffnen kühlen.
- Pre-ash die Filtertiegel in einem Ofen bei 575 ° C für mindestens 4 Stunden. Lassen Tiegel einen Exsikkator für mindestens eine Stunde abkühlen in.
- Vakuumfilter die Lösung von jedem Röhrchen durch einen separaten Tiegel mit Hilfe einer Gummiadapter, um den Tiegel zu sichern. Verwenden VE-Wasser, um alle verbleibenden Partikel aus dem Rohr spülen.
- Trocknen des Lignins Rückstand bei 105 ° C für mindestens 4 Stunden. Das Gewicht der trockenen und Tiegel und Rückstand.
- Bei Verwendung eines 575 ° C, vorgeFeuer die Proben über einen Bunsenbrenner, bis es keinen Rauch oder Asche und legen Sie dann in den Ofen für 24 Stunden, oder wenn mit einem programmierbaren Ofen, nicht vor, Asche und verwenden Sie das folgende Programm:
- Rampe von Raumtemperatur bis 105 ° C und Halten für 12 min.
- Rampe bis 250 ° C bei 10 ° C / min und halten für 30 min.
- Rampe bis 575 ° C bei 20 ° C / min und halten Sie für mindestens 180 min.
- Entfernen Sie die Tiegel aus dem Ofen und kühlen in einem Exsikkator. Abwiegen und Asche.
- Berechnen der Säure unlöslicher Rückstand unter Verwendung der folgenden Gleichung:
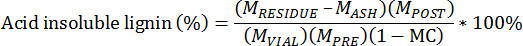
PRE M = Masse der Pre-extrahierte Biomasse
POST M = Masse der Post-extrahierte Biomasse
M = Masse der PHIOLE extrahierte Biomasse in das Fläschchen gegeben
M = Masse der RESIDUE Tiegel und Rückstand Ligninue
ASH M = Masse der Tiegel und Asche
MC = Feuchtigkeitsgehalt des vorextrahierten Biomasse, Gesamtgewichtsbasis
5. Analyse von Kohlenhydraten
- Führen Zellwandkohlenhydratanalysen auf der Basis der Foster et al. (2010) Protokoll 31. Kurz gesagt, Vorbereiten Alkohol unlösliche Rückstand aus gefriergetrockneten Pflanzenmaterial. Dann hydrolysieren das Material mit Trifluoressigsäure und entsprechen den gelösten Monosaccharidderivate zu ihren entsprechenden Alditolacetate. Analysieren diese flüchtigen Derivate durch Gaschromatographie (GC) zu einem Vierfach-Massenspektrometer verbunden.
Ergebnisse
Wir haben eine Verringerung der Ligningehalt in Maispflanzen durch RNAi gezeigt. Die Partikelbeschuss-Transformationsverfahren ergab rund 30% trnasformation Effizienz. Die Gen-Silencing von ZmCCR1 wurde konsequent in T0-T2 Generationen beobachtet. Die Lignin reduziert transgenics wuchs ähnlich wie Wildtyp-Mais-Pflanzen, außer für die Anzeige von Braunfärbung in der Blattmittelrippe, Schale und Schaft. Die histologischen Test hat gezeigt, dass die Mutantenlinien zeigen eine signifikante Reduktion der Zellwan...
Diskussion
Die Zugänglichkeit mikrobieller Cellulasen Zellwandpolysacchariden Anlage ist weitgehend abhängig von dem Grad, in dem sie mit phenolischen Polymeren 23 verbunden. Die Umwandlungsrate aus Lignocellulose vergärbaren Zucker ist negativ mit Lignin-Gehalt in der Pflanzenzellwänden abgelagert secondadry korreliert. Dieser Zusammenhang wird auf die physikalischen Eigenschaften von Lignin, wie Hydrophobizität 24. chemischen Heterogenität zugeschrieben, und das Fehlen von regelmäßigen hydrolysierba...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die mikroskopische Bildgebung wurde über die Dienste der Michigan State University Center for Advanced Microscopy durchgeführt. Mais Kallus wurde von der Mais Zentrum für Transformation der Iowa State University erworben. Die Autoren bedanken sich bei Jeffrey R. Weather der MSU Plant Research Laboratory für seine technische Unterstützung bei der Kohlenhydratanalyse danken. Diese Forschung wurde großzügig von der Mais-Marketing-Programm von Michigan (CMPM) und die Arbeitsgemeinschaft für Forschung Pflanzenbiotechnologie (CPBR) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
Referenzen
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten