Method Article
Nicht-invasive Bildgebung und Analyse der zerebralen Ischämie in lebenden Ratten mit Hilfe der Positronen-Emissions-Tomographie mit
In diesem Artikel
Zusammenfassung
Brain damage resulting from cerebral ischemia may be non-invasively imaged and studied in rats using pre-clinical positron emission tomography coupled with the injectable radioactive probe, 18F-fluorodeoxyglucose. Further, the use of modern software tools that include volume of interest (VOI) brain templates dramatically increase the quantitative information gleaned from these studies.
Zusammenfassung
Schlaganfall ist die dritthäufigste Todesursache unter den Amerikanern war 65 Jahre alt oder älter 1. Die Lebensqualität der Patienten, die einen Schlaganfall erleiden nicht normal in einer großen Mehrheit der Patienten 2, die vor allem auf derzeitige Mangel an klinischen Behandlung von akutem Schlaganfall ist zurück. Dies macht das Verständnis der physiologischen Wirkungen von zerebraler Ischämie auf Hirngewebe über die Zeit und ist ein wichtiger Bereich aktiver Forschung. Zu diesem Zweck hat experimentelle Fortschritte erzielt mit Ratten als präklinischen Modell für Schlaganfall, insbesondere mit nicht-invasiven Methoden wie 18 F-Fluorodesoxyglukose (FDG) in Verbindung mit der Positronen-Emissions-Tomographie (PET) Bildgebung 3,10,17. Hier präsentieren wir eine Strategie zur Induktion zerebraler Ischämie bei Ratten durch mittleren Hirnarterie Okklusion (MCAO) imitiert fokaler zerebraler Ischämie beim Menschen, und Abbildung ihrer Auswirkungen über 24 h mit FDG-PET in Verbindung mit Röntgen-Computertomographie (CT) mit einem Albira PET-CT-Gerät. Ein VOI Vorlage Atlas wurde anschließend zu den zerebralen Rattendaten verschmolzen, um eine unvoreingenommene Analyse des Gehirns und ihre Teilbereiche 4 zu ermöglichen. Darüber hinaus wird ein Verfahren zur 3D-Visualisierung der FDG-PET-CT-Zeitverlauf dargestellt. Zusammenfassend stellen wir ein detailliertes Protokoll für die Einleitung, Quantifizierung und Visualisierung eines induzierten ischämischen Schlaganfall-Ereignis in einem Wohn Sprague-Dawley-Ratten in drei Dimensionen mit FDG-PET.
Einleitung
Schlaganfall ist eine der häufigsten Todesursachen in den Industrieländern, und ist direkt verantwortlich für den Tod von 1 von 19 Amerikanern 1 verantwortlich. Es wurde geschätzt, dass ungefähr 795.000 Amerikaner Erfahrung Hub jedes Jahr, von denen 87% von ihnen in der Natur ischämischen 5 sind. Während eines ischämischen Ereignisses ist eine kontinuierliche Versorgung mit Sauerstoff und Glucose zu der kortikalen Neuronen stark beeinträchtigt Induzieren einer hypoxischen Umgebung, die zu einer verminderten Zellfunktion in den betroffenen Hirnregionen führt. Abhängig von der Schwere des Schlaganfalls, variieren cerebralen Durchblutung und die Glukoseaufnahme räumlich und zeitlich.
Schäden durch Schlaganfall kann durch nicht-invasive Methoden identifiziert werden, wie zum Beispiel 18 F-Fluorodesoxyglukose (FDG) Positronen-Emissions-6. FDG ist ein Glucoseanalog wo die Hydroxylgruppe an der 2'-Position durch die Positronenemissions 18 F-Isotop ersetzt worden ist. 18 F ist advantageous aufgrund seiner langen, 110 Minuten-Halbwertszeit, so dass sie verwendet werden, um Glukoseverbrauch im Gehirn zu detektieren. FDG PET erzeugt eine quantitative hochauflösende Karte Desoxyglucose Verbrauch im Gehirn 7 als 18 F neigt dazu, in Bereichen mit hoher Glucoseverbrauch zu akkumulieren, was darauf hinweist, daß solche Gewebe sehr metabolisch aktiv 8. Die 18 F-Kern erfährt beta-Zerfall, die Freigabe einer Positronen, die rasch vernichtet mit einem nahe gelegenen Elektrons Herstellung von Gammastrahlen, die von dem Gerät erfaßt werden. FDG PET-Scans können in demselben Individuum mit mindestens 10 18 F-Halbwertszeiten, oder etwa 18 Stunden lang wiederholt werden, zwischen den Abtastungen, so dass ein Weg, um Veränderungen in der Hirnaktivität im Laufe der Zeit in dem gleichen Individuum zu untersuchen.
Präklinischen Tiermodellen, wie Ratten, werden oft verwendet, um die Auswirkungen von Schlaganfällen und die Wirksamkeit von Behandlungen von Schlaganfall bewerten. Da FDG PET ist nicht-invasiv, kann es verwendet werden, um zu messen,die Auswirkungen von Schlaganfällen im Laufe der Zeit ohne Beeinträchtigung der Physiologie des Tieres. Je nach dem Schlaganfall Lage, unterschiedliche Regionen des Gehirns beeinflußt werden. Jedoch mit kleinen Tieren wie Ratten, manuell Definieren und Quantifizieren Aktivität in spezifischen Regionen des Rattengehirns kann schwierig sein. Zur Glukosemetabolismus in spezifischen Regionen des Rattengehirns mit der Zeit zu vergleichen, müssen Volumina von Interesse (VOI) quantifiziert werden durchweg abgegrenzt werden. Eine präzise Atlas der Rattenhirn wurde entwickelt, um dieses Problem zu lindern, 9, und ist in digitaler Form für den Einsatz in Quantifizierung der präklinischen FDG-PET-Daten umgewandelt. Hier präsentieren wir eine Methode, um Schlaganfall Gewebeschädigung in einem konsistenten, methodisch zu klassifizieren. Das Verfahren beschreibt die chirurgische Prozedur zum Einleiten zerebraler Ischämie in einem Tiermodell, Quantifizierung spezifischen Gehirnunterregionen, die von Schlaganfall, und erzeugen eine dreidimensionale Visualisierung der Maße und Lage eines SchlaganfallsGewebeschäden mit Hilfe geeigneter Techniken und Werkzeuge. Unter Verwendung der in dieser Studie beschriebenen Methode können die Forscher konsequent einzuleiten zerebraler Ischämie bei Ratten, führen PET-Bildgebung und Quantifizierung von Veränderungen in der FDG-Aufnahme mit definierten Gehirnregionen in präklinischen Taktmodelle im Laufe der Zeit.
Protokoll
Tierbehandlung und alle Experimente mit ihnen wurden streng nach den Protokollen, die von der Institutional Animal Care und Verwenden Ausschuss der University of Notre Dame (Protokollnummer 14-086) genehmigt wurden durchgeführt.
1. Tiere
- Tiere und Hubauslösung: Verwendung männliche Sprague-Dawley-Ratten mit einem Gewicht zwischen 220 und 270 g für alle Schlaganfallstudien.
- Anesthetize Ratten mit 2,5% Isofluran (2 l / min in 100% O 2) mit einem Nasenkegel.
- Legen Sie das Tier in Rückenlage auf einem Heizkissen. Band nach unten den Vorderbeinen.
- Rasur ventralsurface der Hals. Bereiten Sie die rasierte Fläche mit 70% EtOH, gefolgt von 10% Providon Jodlösung.
- Sterile Instrumente werden für dieses Verfahren verwendet werden; Handschuhe nach der prep des Tieres ersetzt. Sterile Tip-Techniken eingesetzt.
- Mit einer Schere, einen 2-2,5 cm Einschnitt parallel zu der Luftröhre, 0,5 cm nach rechts von der Luftröhre. Mit stumpfen DISSECTIOn suchen Sie die Halsschlagader.
- Verwenden Retraktoren helfen visualisieren die Behälter. Legen Sie eine Mikroklemme an der A. carotis communis (CCA).
- Suchen Sie nach dem ersten Verzweigungspunkt, der die A. carotis externa (ECA) und die A. carotis interna (ICA) sein wird. Cauterize kleinere Äste in die ECA, befestigt wie die A. occipitalis.
- Ligation der ECA an den Seitenweg nach Schilddrüsenarterie mit einem 4-0 Seidennaht. Die Nähte sollten zusätzliche Länge zu hemostats aktivieren, um die Naht zu halten haben.
- Cauterize der ECA über der Naht (kranial). Um den Faden mit der Gefäßklemme festklemmen, ziehen Sie den ECA kaudal und es wird parallel mit der CCA ist.
- Suchen Sie den ICA und eine andere Mikroklemme, diese Arterie zu verschließen.
- Machen Sie ein kleines Loch in die ECA mit kleiner Feder Schere. Legen Sie die Okkluder in die ECA und binden einen Faden um den Okkluder um den Blutfluss zu verhindern.
- Entfernen Sie die Mikroklemme am ICA und rückt den Okkluder, bis Widerstand zu spüren ist.
HINWEIS Stellen Sie sicher, dass die Verschluss Fortschritte in den ICA und nicht die pterygopalatin Arterie. Der Verschluss sollte reibungslos voranzubringen und die weiße Spitze sollte nicht gesehen werden, wenn der Okkluder richtig platziert ist. - Entfernen Sie die Mikroklemme von der CCA. Schneiden Sie das überschüssige Okkluder oder Naht.
- Zeigen 9 mm Auto-Clips, um den Hautschnitt zu schließen.
- Nehmen Sie das Tier von der Narkose und lassen Tier zu wecken. Nach 2 Stunden:
- Anesthetize Ratte mit Isofluran.
- Entfernen Sie die Wundklammern.
- Suchen Sie das Ende des Verschlusses und aus der mittleren Hirnarterie durch leichtes Ziehen darauf, bis die weiße Spitze des Verschlusses in Kontakt mit den Fäden kommt. Ziehen Sie nicht den ganzen Weg aus, wird dies zu Blutungen führen.
- Ersetzen Sie die Wundklammern, um den Schnitt.
- Nehmen Sie das Tier von der Narkose und lassen Tier zu wecken.
2. Bildaufnahme
Führen Sie drei PET- und CT-sDosen für jede Ratte. Nehmen Sie sich ein Pre-Scan 1-2 Tage vor der Induktion von Schlaganfall, um eine Basis für die 18 F-FDG-Aufnahme bieten. Scannen jede Ratte 1,5 Stunden nach einem Schlaganfall, vor der Reperfusion wird (Bild im Tier mit Okkluder noch) durchgeführt. Scannen jede Ratte 26 Stunden nach Schlaganfall (24 h nach Reperfusion) die Hirngewebeschädigung infolge von Schlaganfall Verletzungen zu quantifizieren.
HINWEIS: Die in den Rest des Manuskripts genannten 24-Stunden-Zeitpunkt bezieht sich auf die Zeit, in der nach der Reperfusion wurden die Ratten gescannt.
- Betäuben Ratten unter 2,5% Isofluran Gaskammer in der Anästhesie.
- Spritzen Sie etwa 500 & mgr; Ci 18 F-Desoxyglucose (FDG) (200 ul Gesamtvolumen) in Schwanzvene der Ratte.
- Warten Sie 1 Stunde.
- Zeigen narkotisierten Ratte auf Standard-Ratten Bett, unter Bugnase Isofluoran Anästhesie. Messen Sie den Abstand in mm zwischen der Nase der Ratte und Rand der Ratte Bett für horizontalen Versatz.
3. Image Acquisition
- Öffnen Albira Suite software.
- Wählen Acquirer.
- Nennen neuen Studie.
- Unter PET oder SPECT auf Hinzufügen> Wählen PET-Protokoll. Klicken Sie auf Hinzufügen.
- Unter CT auf Hinzufügen> Wählen CT-Protokoll. Klicken Sie auf Hinzufügen.
- Klicken Sie auf Nummer, unter Anfängliche horizontale Position unter PET. Legen Sie die Anzahl zu mess Abstand in mm zwischen der Nase der Ratte und vor Ratte Bett. Wiederholen Sie dies für CT.
- Stellen vorbehalten Rat und geben Gewicht in Gramm.
- Stellen Sie die Verbindung zu FDG.
- Stellen Sie Einspritzzeit und Einspritz Datum und Dose.
- Klicken Sie auf Start Study Taste.
HINWEIS: Nach Beendigung des PET-CT-Scan Daten werden automatisch gespeichert. - Öffnen Albira Reconstructor.
- Change Pending to Last 10 oder Alle.
- Wählen Sie Scan-Dateinamen.
- Klicken Sie auf Hinzufügen.
- Klicken Sie auf Start Wiederaufbau. HINWEIS: Die Datei wird in microPET Format gespeichert werden.
4. Bildanalyse
- Führen Sie die Bildanalyse mit dem PMOD-Analyse-Software in Verbindung mit dem W. Schiffer-Gehirn-Atlas.
- Öffnen PMOD> Fusion.
- Navigieren Sie zur Registerkarte Koregistrierung Vorverarbeitung am oberen Rand des Bildschirms.
- Öffnen Sie das Dropdown-Menü, laden Referenz in der Mitte des Bildschirms und wählen Sie NIfTI. Navigieren Sie zu C: //PMOD3.2/resources/templates/usertemplates. Wählen Ratte (W.Schiffer) -FDG.nii und klicken Sie auf Öffnen.
- Öffnen Sie das Dropdown-Menü, laden Eingang an der rechten Seite des Bildschirms, und wählen Sie microPET. Navigieren Sie zum gewünschtenMicroPET Datei. Wählen Sie es aus und klicken Sie auf Öffnen.
- Navigieren Sie zu dem Hand Koregistrierung Register am oberen Rand des Bildschirms.
- Wählen Sie das vierte Reiter in der Mitte Gruppe von Tabs auf der rechten (Reslice).
HINWEIS: Zwei Tasten werden auf den microPET Scans angezeigt. - Verwenden Sie den offenen weißen Rechteck, um die microPET Scans und die gefüllte weiße Rechteck drehen, um die microPET Scans bewegen. Richten Sie die beiden Scans. Dazu suchen Sie Sehenswürdigkeiten wie der Harderschen Drüse sowie oberen und hinteren Hirnfunktionen, die verwendet werden können, um die microPET Scan mit Gehirn-Modell entsprechen. Dann stellen Sie die microPET Scan, bis es übereinstimmt mit den Hirnatlas (W. Schiffer).
HINWEIS: Zum Beispiel scheinen die Harderschen Drüse hell auf beiden microPET Scans und den Hirnatlas (W. Schiffer) und kann als Referenz für die Ausrichtung verwendet werden. - Falls erforderlich, drehen Sie den microPET Scannen um 180 ° in der Frontalansicht deutlich zu erhöhen und den Scan in the Sagittalansicht, zusammen mit anderen kleineren Orientierungsänderungen.
- Navigieren Sie zur Registerkarte Vollbild-Fusion (VOIs) am oberen Rand des Bildschirms.
- Wählen Sie Quelle A in der oberen rechten Bildschirmrand.
- Navigieren Sie im unteren Bereich der Seitenvorlage> Atlas.
- Wählen Ratte (W. Schiffer) aus dem Dropdown-Menü.
HINWEIS: (Optional) Zurück zur Hand Koregistrierung Registerkarte, wo der Atlas sollte auf Gehirnatlas (W. Schiffer) überlagert erscheinen. Der Atlas kann verwendet werden, zum Ausrichten des microPET Scan und die Hirnatlas (W. Schiffer). Nach der Ausrichtung auf die Registerkarte Vollbild-Fusion (VOIs) zurückzukehren. Eine Vorlage wird auf das Gehirn, was anzeigt, welche Teile des Gehirns werden für die VIO Statistik gemessen werden. - Wählen Quelle B in der oberen rechten Bildschirmrand.
- Wählen Sie das VOI Statistik Button oben right des Bildschirms.
ANMERKUNG: Eine Tabelle wird angezeigt. - Wählen Sie Speichern.
HINWEIS: Ein Write Als [VOI Statistik] Fenster wird angezeigt. - Wählen Sie Speichern, um System-Datei.
HINWEIS: Ein PMOD (speichern): Wählen Sie Komponenten-Fenster erscheint. - Im Feld Dateiname geben Sie den gewünschten Dateinamen ein.
- Wählen Sie Speichern.
- Führen Sie die Datenanalyse mit Microsoft Office Excel 2010.
- Öffnen Sie Excel.
- Wählen Sie Datei> Öffnen.
- Ändern Sie den Dateityp aus Alle Excel-Dateien auf Alle Dateien.
- Navigieren Sie zu den gespeicherten Dateien VIOSTAT. Wählen Sie die gewünschte Datei.
HINWEIS: Ein Import-Assistent wird angezeigt. - Wählen Sie Fertig stellen. Wenn Sie einen Mac, doppelklicken Sie auf die Datei VOISTAT und es wird direkt als Excel-Datei geöffnet.
- Wählen Sie die Spalte mit dem Feld VoiName (Region). Kopieren Sie die Informationen und fügen Sie ihn in eine neue Excel-Datei.
- Wählen Sie die Spalte, die die Felder gemittelt und [1/1]. Kopieren Sie die Informationen und fügen Sie ihn in das neue Excel-Datei.
- Wiederholen Sie diesen Vorgang für alle VOISTAT Dateien.
- Beginnen Sie eine neue Registerkarte für jeden Datensatz.
- Zurück zum ersten Registerkarte. Wählen Sie eine neue Zelle. Berechnen des Verhältnisses von der rechten Seite des Gehirns Abschnitt an der linken Seite des Gehirns Abschnitt, indem der Wert der rechten Seite des Gehirns, von der linken Seite des Gehirns. Das Gehirn Abschnitt an der rechten Seite des Gehirns gehör aufgeführt vor der an der linken Seite des Gehirns gehörSchnitt. Wiederholen Sie diesen Vorgang für alle Hirnschnitten.
- Wählen Sie eine neue Zelle. Verwenden die Funktion Mittelwert, den Mittelwert jeder der zuvor berechneten Verhältnisse in allen Mäusen zu berechnen.
- Wählen Sie eine neue Zelle. Berechnen Sie die SEM jedes Gehirn Abschnitt mit der Funktion STABW und Dividieren it durch die Quadratwurzel der Anzahl von Mäusen.
- Wiederholen Sie diesen Vorgang für jeden Datensatz.
5. Bildvisualisierung
- Konvertieren von Bildern in die Analyse-Dateiformat mit PMOD Analyse-Software.
- Öffnen PMOD> Ansicht.
- Navigieren Sie zu der Registerkarte Ansicht am oberen Rand des Bildschirms.
- Öffnen Sie das Dropdown-Menü Legen Sie auf der rechten Seite des Bildschirms, und wählen Sie microPET. Navigieren Sie zum gewünschten microPET oder CT-Datei. Wählen Sie es aus und drücken Sie Öffnen.
- Öffnen Sie das Dropdown-Menü Speichern auf der rechten Seite des Bildschirms, und wählen Sie Analysieren. Navigieren Sie zu dem gewünschten Ziel. Geben Sie den gewünschten Namen in das Feld Dateiname ein. Wählen Sie Speichern.
- Erstellen von Bildsequenzen mit VolView Imaging-Software.
- Öffnen VolView.
- Wählen Sie Datei öffnen an der linken Seite des Bildschirms.
- Navigieren Sie zu der Analyse Version des CT-Datendatei für die gewünschte Scan. Wählen Sie es aus und drücken Sie Öffnen.
HINWEIS: Ein Open File-Assistent wird angezeigt. - Verwenden Sie die Standardeinstellungen mit Weiter im Popup-Fenster.
- Wählen Sie die Registerkarte Plugins auf der linken Seite des Bildschirms.
- Öffnen Sie das Plugin im Dropdown-Menü und wählen Sie Dienstprogramm> Merge Volumes.
- Deaktivieren Rescale Components.
- Wählen Zweiten Assign Eingang.
- Navigieren Sie zu der Analyse Version des microPET Datendatei für die gleiche Scan. Wählen Sie es aus und drücken Sie Öffnen.
HINWEIS: Ein Open File-Assistent wird angezeigt. - Verwenden Sie die Standardeinstellungen mit Weiter in jedem Bildschirm.
HINWEIS: Die microPET Scan wird auf dem CT-Scan überlagert angezeigt. - Wählen Sie die Farbe / Opazität einstellens Register am linken Bildschirmrand.
- Öffnen Sie die Komponente im Dropdown-Menü unten rechts auf dem Bildschirm. Wählen Sie ein.
ANMERKUNG: Dies stellt sicher, dass der CT-Scan wird nur das Bild durch die folgenden Richtungen beeinflußt. - In der Scalar Color Mapping Abschnitt, wählen Sie den Mittelpunkt. Entfernen Sie es, indem Sie es aus der der Schieberbereich.
- Wählen Sie den linken Punkt.
ANMERKUNG: Eine Farbauswahl-Fenster erscheint. - Ändern Sie die Farbe des Punktes zu schwarz.
- Wählen Sie die richtige Stelle.
ANMERKUNG: Eine Farbauswahl-Fenster erscheint. - Ändern Sie die Farbe des Punktes auf weiß.
- In der Scalar Opazität Mapping Abschnitt, fügen Sie einen Punkt, indem Sie irgendwo in der Box.
- Stellen Sie den Abschnitt, bis das CT-Bild zeigt nur das Skelett der Ratte.
- Überprüfen Aktivieren Schattierung.
- Wählen Sie das Review Lasche an der linken Seite des Bildschirms.
- Ändern Sie Number of Frames 72.
- Ändern X Drehung um 360.
- Wählen Sie Create.
- Navigieren Sie zu dem gewünschten Ziel. Erstellen Sie einen neuen Ordner, um die Bilder mit einem Rechtsklick auf eine freie Stelle und wählen Sie Neu> Ordner speichern.
- Geben Sie den gewünschten Namen in das Feld Dateiname ein. Wählen Sie Speichern.
ANMERKUNG: Eine Rahmengröße Fenster wird angezeigt. - Wählen Sie OK.
- Volview die Bilder zu generieren. Wenn es fertig ist, wird ein Fenster angezeigt, die besagt "Ihr Film wurde erfolgreich angelegt!" Klicken Sie auf OK.
- Zur Registerkarte Color / Deckkraft-Einstellungen.
- Unter Komponente Gewicht (n), stellen Sie den Schieberegler für die Komponente 1, damit es die wertvolle hate von 0.
HINWEIS: Nur der microPET Scan wird angezeigt. - Die Schritte 5.2.21-28 um eine zweite Bildfolge zu schaffen.
- Zur Registerkarte Color / Deckkraft-Einstellungen.
- Unter Komponente Gewicht (n), stellen Sie den Schieberegler für die Komponente 2 so den Wert 0 hat.
HINWEIS: Nur der CT-Scan wird angezeigt. - Die Schritte 5.2.21-28 um einen dritten Bildsequenz zu erstellen.
- Genedreh Filme (in Video gezeigt) mit dem ImageJ Software.
- Öffnen ImageJ.
- Wählen Sie Datei> Importieren> Bildsequenz.
- Navigieren Sie zu der Datei mit den Bildern, die nur die CT-Daten für die Pre-Scan anzuzeigen. Wählen Sie das erste Bild aus und drücken Sie auf Auswählen.
HINWEIS: Ein Fenster Sequence Options wird angezeigt. - Wählen Sie OK.
- Wählen Sie Datei &# 62; Importieren> Bildsequenz.
- Navigieren Sie zu der Datei mit den Bildern, die nur die microPET Daten für die Pre-Scan anzuzeigen. Wählen Sie das erste Bild aus und drücken Sie auf Auswählen.
HINWEIS: Ein Fenster Sequence Options wird angezeigt. - Wählen Sie OK.
- Wählen Sie Datei> Importieren> Bildsequenz.
- Navigieren Sie zu der Datei mit den Bildern, die sowohl die CT und microPET Daten für die Pre-Scan anzuzeigen. Wählen Sie das erste Bild aus und drücken Sie auf Auswählen.
HINWEIS: Ein Fenster Sequence Options wird angezeigt. - Wählen Sie OK.
- Wählen Sie Bild> Stapel> Extras> Verbinden.
ANMERKUNG: Eine Combiner-Fenster erscheint. - Wählen Sie das Dropdown-Menü Stack1. Wählen Sie den Stapel mit den CT-Daten enthält.
- Wählen Sie das Dropdown-Menü Stack2. Wählen Sie den Stapel, die die Mi enthältcroPET Daten. Wählen Sie OK.
HINWEIS: Ein neuer Stapel mit beiden Scans angezeigt. - Wählen Sie Bild> Stapel> Extras> Verbinden.
ANMERKUNG: Eine Combiner-Fenster erscheint. - Wählen Sie das Dropdown-Menü Stack1. Wählen Sie den Stapel mit den kombinierten Stapel enthält.
- Wählen Sie das Dropdown-Menü Stack2. Wählen Sie den Stapel, die sowohl die CT-Daten und die microPET Daten enthält. Wählen Sie OK.
HINWEIS: Ein neuer Stapel mit allen drei Scans wird angezeigt. - Halten Sie die kombinierten Stapel geöffnet. Wiederholen Sie die Schritte 5.3.2-16 für die 1,5 Stunden nach dem Scannen und der 24 Stunden nach der Scan-Bildstapeln.
- Wählen Sie Bild> Stapel> Extras> Verbinden.
ANMERKUNG: Eine Combiner-Fenster erscheint. - Wählen Sie das Dropdown-Menü Stack1. Wählen Sie den Stapel, das alle Pre-Scan-Daten enthält.
- Wählen Sie das Stack2 Dropdown-Menü. Wählen Sie den Stapel, der alle 1,5 Stunden nach der Scan-Daten enthält.
- Überprüfen Sie Kombinieren Vertikal.
- Wählen Sie OK.
HINWEIS: Ein neuer Stapel sowohl mit dem Pre-Scan und 1,5 Stunden nach dem Scannen wird angezeigt. - Wählen Sie Bild> Stapel> Extras> Verbinden.
ANMERKUNG: Eine Combiner-Fenster erscheint. - Wählen Sie das Dropdown-Menü Stack1. Wählen Sie den Stapel mit den kombinierten Stapel enthält.
- Wählen Sie das Dropdown-Menü Stack2. Wählen Sie den Stapel, die alle 24 Stunden nach der Scan-Daten enthält.
- Überprüfen Sie Kombinieren Vertikal.
- Wählen Sie OK.
HINWEIS: Ein neuer Stapel mit allen neun Scans wird angezeigt. - Wählen Sie Datei> Speichern unter> AVI.
- Wählen Sie OK.
- Navigieren Sie zu dem gewünschten Ziel. Geben Sie den gewünschten Namen in das Dateinamen- Feld. Wählen Sie Speichern.
Ergebnisse
Zerebrale Ischämie wurde in lebenden Sprague-Dawley-Ratten durch Okklusion der mittleren Gehirnarterie ausgelöst, mit anschließender nukleare Bildgebung durchgeführt, um seine Wirkungen zu detektieren. Live-Ratten wurden 24 Stunden vor Schlaganfall Induktion sowie 1,5 Stunden und 24 Stunden nach der Ischämie, jedes abgebildet mit unabhängigen Injektionen von etwa 500 & mgr; Ci 18 F-FDG, die vollständig innerhalb von 18 Stunden zerfällt. Der für diese Studien verwendete drei Detektorring Albira System hat eine Empfindlichkeit von 9%, was 500 & mgr; Ci eine bestimmte Dosis für den Ratten. Repräsentative Bildgebungsdaten für PET und Röntgen-CT-Scans für eine Ratte an der 24 h vor und 24 Stunden nach der Reperfusion Zeitpunkten in Figur 1 oberen und unteren Reihe dargestellt. Die Quer (Platten A und E), sagittal (Platten B und F) und koronale (Platten C und G) Scheiben für jeden Scan werden mit FDG-PET-Daten in ein & # farbig dargestellt8220, Regenbogen "Intensitätsskala, auf der CT überlagert in Graustufen. Man beachte, dass CT für anatomische Koregistrierung von PET-Daten in dem Tierschädel verwendet und keine Röntgendichte Veränderungen im Hirngewebe wurden bei diesen Experimenten festgestellt. Nach 24 Stunden gab es einen dramatischen Rückgang der Glukoseaufnahme in die ipsilaterale Hemisphäre, was weit verbreitete Gewebeschäden aufgrund der induzierten ischämischen Schlaganfall. Ein 3D-Rendering des Overlay-Daten wird in 1D und H vorgestellt. Wenn auf dem Bildschirm gedreht, diese wieder Daten liefern eine verbesserte Visualisierung der Schlaganfall-induzierte Abnahme der FDG-Aufnahme.
Um die Veränderungen im zerebralen Glukoseaufnahme durch Schlaganfall in einem Raum-Zeit-Weise zu quantifizieren, wurde ein VOI Hirnatlas angewandt, um für jeden Scan vor, eine Baseline Hub, 1,5 h und 24 h (nach der Reperfusion). Dies wurde mit der PMOD Softwarepaket in Verbindung mit der W. bewerkstelligt Schiffer Rattenhirn-Vorlage und atlas. Zuerst PMOD wurde verwendet, um jede der Rattenhirn PET-Datensätze an den entsprechenden Raum und Geometrie über manuelle Koregistrierung mit dem Verschieben und Drehen von Werkzeugen auf der Registerkarte Reslice zu verwandeln. Beachten Sie, dass die Skala Tool ist auch für die allgemeine Gehirngröße anpassen, wenn nötig. Während die Verwendung der Schiffer Atlas überlegen manuelles Zeichnen VOIs im Gehirn Raum kann es experimentelle Fehler durch ungenaue Gehirn Fusion induziert. Somit kann in einigen Fällen eine Erhöhung der Anzahl der Tiere erforderlich sein, um eine statistische Signifikanz zu erreichen. Als nächstes wurde die W. Schiffer VOI Gehirnatlas automatisch die FDG Akkumulation in Standardaufnahme-Einheiten, in definierten Teilbereichen des Rattenhirns (Abbildung 2) zu messen aufgebracht. Die Gehirn VOI Atlas kann auch iterativ mit dem Standard-Gehirn-Modell verwendet werden, um eine weitere Optimierung der manuellen Mischung aus den experimentellen Daten werden. Da die stoke Veranstaltung wurde in jedem Tier zu der rechten Gehirnhälfte getrennt, der Schaden to Jede Region wurde durch Berechnen eines Verhältnisses der Glukoseaufnahme der Aktivität zwischen kontralateralen Bereiche (Figur 2) quantifiziert. Die Verwendung dieser Verhältnisse bietet eine bequeme Normalisierung zwischen rechten und linken Hemisphäre und entfernt Variabilität, die beim Vergleich von PET Signalintensitätswerte in verschiedenen Scans auftreten können. Bei 1,5 Stunden nach einem Schlaganfall, wurden 18 F-FDG Aufnahmen nicht in den ischämischen Bereich betroffen. Daher wurden keine quantitativen Veränderungen der Glucoseaufnahme zwischen den kontralateralen und ipsilateralen Hälften (3, blaue und grüne Balken) beobachtet. Dies könnte auf die Hyper Aufnahme von Glukose durch die peri-ischämischen Region oder erhöhte Glucosemetabolismus zu diesem Zeitpunkt werden, um den Verlust der zellulären ATP 10,11 kompensieren. Jedoch wurde eine signifikante Abnahme der Glucoseaufnahme in bestimmten Regionen der ipsilateralen Hemisphäre über mehrere Tiere (n = 5) nach 24 h nach der Reperfusion (Abbildung 3, rote Balken) beobachtet. Other Hirnregionen angezeigt wenig oder gar keine Schäden in der ipsilateralen Hemisphäre.
Speziell wurden die Regionen der ipsilateralen Hemisphäre, die konsistent zeigten verminderte FDG uptakes: Amygdala caudatus Putamen, der akustische, entorhinalen, Insellappens Parakortex und somatosensorischen Regionen der Cortex. Kortikalen Läsionen aufgrund von Schlaganfall verursacht werden mit dem Verlust der neuronalen Verbindungen und veränderte Funktionskarten verbunden. Strukturelle Anomalien in der Amygdala durch Schlaganfall führen zu Psychopathologie und kognitive Dysfunktion 12. Es ist nicht verwunderlich, dass der Nucleus caudatus-Putamen Region wurde für FDG-Aufnahme beeinflusst die Hirndurchblutung in den seitlichen Teil der Region wird durch den verschlossenen A. cerebri media 13 zugeführt. Die Pathologie in dieser Region von Nagetier Gehirn führt zu einer Beeinträchtigung der Unterscheidungs Lernen, kognitive Verarbeitung und nicht-motorischen Funktionen 14. Unfähigkeit zu nehmen FDG wurde auch im entorhinalen Kortex eine beobachteted Hörrinde im medialen Temporallappen des ischämischen Hemisphäre. Im Jahr 2001, Davis et al. Berichteten, dass entorhinalen Kortex Schäden bei Ratten führt zu einer Beeinträchtigung der sensorischen Integration und anhaltend räumlichen Lernen deificits 15. Hörstörungen ist bekannt, dass in der Schlaganfall bei Menschen auftreten, wenn auch selten 16. Jedoch wurde die Aufnahme von FDG Colliculus inferior, die eine der wichtigsten Hörbahnen nicht durch Schlaganfall in unserem Modell beeinflusst. Es hat sich gezeigt, dass MCAO-induzierten Schlaganfall Ratten erhöht Adrenalin, Noradrenalin und sympathischen Nervenaktivität aufgrund Infarkt in der Inselrinde, eine der Regionen, in unserem Modell, das schlechte FDG-Aufnahme 17 gezeigt. Dies kann Veränderungen der autonomen Funktion beeinflussen die Herzsystems führen. Schlechte FDG-Aufnahme wurde im somatosensorischen Bereich des frontoparietal Kortex beobachtet. Ischämischen Infarkt in diesem Bereich wurde berichtet, dass strukturelle Anomalien und den Verlust der Thalamus-Verbindungen verursachen18. Begrenzte FDG-Aufnahme wurde auch im visuellen Kortex, die zu einer Beeinträchtigung der Okulardominanz Plastizität führen könnte, wie in Ratten Neugeborenen bis hypoxische Ischämie 19 ausgesetzt berichtet beobachtet. Allerdings verringerte sich FDG-Aufnahme wurde in den Colliculus superior beobachtet ein Gebiet, das in der bildenden Motorführung 20 beteiligt ist. FDG-Aufnahme in der Hippocampus-Bereich wurde ebenfalls beeinträchtigt, ein Gebiet, das in das räumliche Gedächtnis und die Navigation wichtig ist. Es wurde konsequent beobachtet, daß Teilbereiche des Mittelhirns, wie der colliculus superior und inferior, den ventralen tegmentalen Bereich (VTA), sowie den Riechkolben des Vorderhirns und des tiefsitz Thalamus nicht durch Okklusion beeinflußt Mitte der Halsschlagader (Bild 3).
Zusammengenommen zeigen diese Ergebnisse, dass die FDG-PET mit CT bietet eine praktikable, reproduzierbare und nicht-invasive Bildgebungs Strategie, mit der auf zerebrale Ischämie bei Ratten in einer longitudinalen Mode zu überwachen.
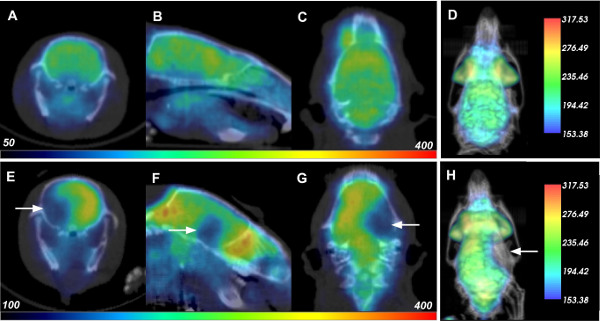
Abb. 1: PET-CT-Daten des Rats vor und nach zerebraler Ischämie Jede Zeile wird die jeweilige Quer (A, E), sagittale (B, F), koronalen (C, G) und 3D (D, H) PET -CT Daten einer Ratte 24 h vor (obere Reihe) und 24 Stunden nach der Reperfusion (oder 26 Stunden nach der Induktion von zerebraler Ischämie, unten). Weiße Pfeile zeigen Lage des verringerten FDG-Aufnahme durch Schlaganfall Schaden. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
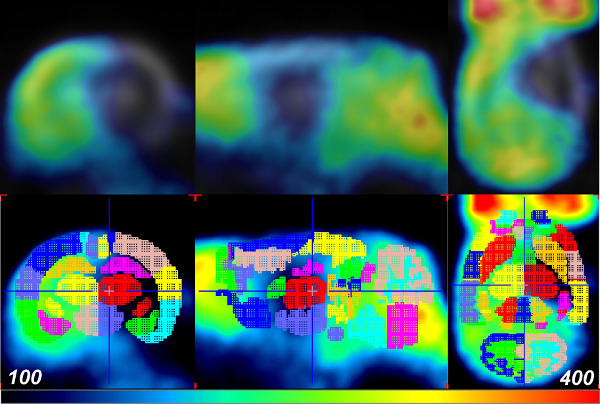
Abbildung 2: PET-Daten mit den W. Schiffer Rat Brain Atlas mit PMOD ausgerichtet Die FDG-PET Daten.eine Ratte 24 Stunden nach Reperfusion (oder 26 Stunden nach der zerebrale Ischämie, obere Reihe) mit den VOI Gehirnatlas Vorlage für die Analyse (untere Reihe) fusioniert. Farben zeigen die separaten VOIs der Gehirnatlas Vorlage. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

. Abbildung 3: Vertreter Quantitative Analyse der Glukoseaufnahme in Rattenhirn nach § Verhältnisse von rechts nach links Hemisphäre FDG-PET-Signal in Standard-Aufnahme-Einheiten aus jeder Region des W. Schiffer Rat Brain Atlas berichtet für Scans vor dem ischämischen Schlaganfall-Ereignis (vor genommen; blau), 1,5 Stunden (grün) und 24 Stunden (rot) nach der Reperfusion (oder 26 Stunden nach der Reperfusion). Fehlerbalken stellen Standardfehler für n = 5 Rattenhirn Schlaganfall Ereignisse, die zu jedem Zeitpunkt. ** P ≤ 0,01, * p≤ 0,05 (gepaarter t-Test). Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abb. 4: Darstellung der MCAO Chirurgie Die rote Linie ist der Okkluder, die in die äußere Halsschlagader eingeführt wird. Das blaue Oval repräsentiert den Bereich des Gehirns.
Diskussion
Hier präsentieren wir eine detaillierte Strategie für Schlaganfallinduktion, PET-Bildgebung und standardisierte Gehirn Subregion Messung der Gewebeschädigung in Sprague-Dawley Ratten. Abbildung kleiner Tiermodellen, insbesondere im Bereich von Schlaganfall ist vorteilhaft, da die Behandlung von Schlaganfall wirksam zu sein, hängt von einer extrem kurzen Therapiezeit. Hier präsentieren wir eine Verletzung-Reperfusion-Modell, bei dem Schlaganfall wurde über eine Okklusion der mittleren Hirnarterie induziert und mittels FDG-PET, neben einer Röntgen-CT für anatomische Referenz Bildgebung durchgeführt. Reglementiert Messungen der FDG-Aufnahme im Gehirn Subregionen wurde möglich durch präzise Abbildung der VOI Vorlage Atlas auf den Rattenhirn im PMOD Bildanalyse-Software. Ratiometrische FDG-Werte wurden durch Division entsprechenden Gehirn Subregionen in gegenüberliegenden Hemisphären gesammelt, die eine einfache Messung der Schäden ermöglicht, während eine Normalisierung Schwankungen der globalen FDG-PET-Signal zwischen verschiedenen Tieren und Zeit punkte. Diese Messungen sind im Einklang mit der erwarteten Wirkung der Strich auf dem Rattengehirn, demonstriert konsistent erheblichen Verlust von Gehirngewebe Glukoseaufnahme in bestimmten Regionen der ipsilateralen Hemisphäre. Diese Methode hat das Potential, unsere Fähigkeit FDG PET Datensätze von Tieren unterzogen viele Arten von Gehirntrauma, einschließlich Schlaganfall vergleichen erweitern. Durch die Standardisierung der Mengen, über Hemisphären des Gehirns und in mehreren Tieren quantifiziert werden, erzeugt diese Methode konsistente Messungen der verringerten Gewebeglukoseaufnahme. Beachten Sie, dass andere PET-Tracer mit Aufnahme in das Gehirn, wie 11 C-Racloprid für D2-Rezeptoren, kann mit diesem Protokoll und 21 verwendet werden. Schließlich beschreiben wir ein Verfahren, um einen ischämischen Schlaganfall im Gehirn einer Ratte in seinem Skelett mit hoher anatomischen Genauigkeit in drei Dimensionen zu visualisieren. Da könnte Schlaganfall-induzierten physiologischen und funktionellen Störungen vorübergehend oder bleibend sind, diese nicht-invasive Bildgebungsverfahren seinForscher können mit Hirnschäden im gleichen Tier über einen Zeitraum zu beurteilen. Es bietet eine Möglichkeit, neurologisch punkten die Ratten, aber auch zu bewerten kurz- und langfristigen neurologischen Defiziten im gleichen Tier. Die Template-Funktion des PMOD Software ermöglicht es den Forschern mit einer gewissen Präzision den Verletzungen Bereich zur Karte und vielleicht neurologische Folgeschäden und Verhaltensmustern zu korrelieren.
Für eine genaue Quantifizierung von Schlaganfall Beschädigung durch Gehirnteilbereich ist der Schlüsselschritt Ausrichtung der PET-Daten mit den Rattenhirnatlas innerhalb PMOD. Inkonsistenzen in Ausrichtung kann zu falschen Quantifizierung Gehirn Subregionen durch Ischämie betroffen führen. Wie in dem Protokoll Schritt 4.1.7 beschrieben, ist es möglich, die Harderian Drüsen als Landmarken zum Ausrichten der Gehirnatlas mit experimentellen PET-Daten zu verwenden. Partialvolumeneffekte (PVE) sind ein Problem bei dieser Art von Analyse, und die Gesamtauflösung der Gehirnstruktur zu begrenzen, dasskann abgebildet werden. Signal Greifen zwischen benachbarten Volumina auftreten oder das VOI selbst könnte zu klein in Bezug auf die Auflösung des Instruments sein, wodurch die quantitative Genauigkeit des Verfahrens 22 zu reduzieren. Die in diesen Studien verwendeten Albira PET-System ist mit drei Detektorringen versehen und liefert eine Auflösung von 1,1 mm, die aus entsprechenden Ein-Ring-System, das 1,5 mm 23 erreicht entwickelt. Buvat etal beachten PVE werden Messungen von Tumoren mit einem Durchmesser von weniger als 2-3 x die Auflösung des Systems mit voller Breite halbem Maximum (FWHM), die zu einem Kugelvolumen von 5,6 bis 18,9 mm 3 für die 3- entsprechen würde beeinflussen Ring Albira. Casteels et al. Vor kurzem erklärt, dass Volumes größer als 8 mm 3 minimal Partialvolumeneffekte für moderne präklinische PET-Scanner mit einer Auflösung im Bereich von 1,1 bis 1,3 mm 24 haben. Die Schiffer Atlas wurde sorgfältig mit diesen Parametern im Auge gebaut und nutzt 58 VOIs, davon 13 fallen unter die Schwelle 8 mm 3. Dazu gehören die VOIs für rechte und linke Hemisphäre des medialen präfrontalen Kortex (6,3 mm 3, R / L), die Par A Cortex (7,6 mm 3, R / L), den Colliculus superior (7,1 mm 3, R / L) Die VTA (5,5 mm 3, R / L), Colliculus inferior (5,7 mm 3, R / L), Hypophyse (5,9 mm 3) und die CB Blutfluß (5,1 mm 3). Darüber hinaus werden Messungen des frontalen Cortex (1,4 mm 3 R / L) am meisten anfällig für PVE aufgrund seiner geringen Größe.
Untersuchungen in größeren Tieren wie Ratten, die eine entsprechende Zunahme der Grße der Anatomie haben, eine größere Anzahl von Gehirnunterregionen, die im Vergleich zu Mäusen zuverlässig quantifiziert werden kann. Dennoch sind diese Methoden für Brain Imaging bei Mäusen, die ihre eigenen Gehirnatlas in PMOD, die von 18 Unterbereiche, die es zusammengesetzt ist, habenso bemessen, dass PVE zu minimieren. Ferner wurde unter Verwendung PET, noch kleinere Hirnregionen als in dieser Studie kann verlangen, den Einsatz alternativer Methoden beschrieben, zu identifizieren. Die hier beschriebene Methode ermöglicht reglementiert und effiziente Quantifizierung von Hirngewebe Schaden über Zeit, segmentiert durch Gehirnteilbereich, in lebenden Ratten. Verletzungen aufgrund von Ischämie ist hier als Beispiel gezeigt, aber die Methode zur Quantifizierung von Veränderungen in der Hirnaktivität dargestellt kann in eine andere Bedingung, die die Rattenhirn angewendet werden.
Abschließend kann FDG-PET-CT-Daten von kleinen Tieren in einer nicht-invasiven und wirtschaftlicher Weise gewonnen werden, und können leicht für Kleintierbildgebung in einer quantitativen Art und Weise verwendet werden. Verwendung der Schiffer Schablonenwerkzeug des PMOD Programm können ischämischen Bereiche des Gehirns, abgegrenzt werden, und die PET-Daten gemessen. Dies ist ein leistungsfähiges Werkzeug für die zukünftige Untersuchung der Reorganisation des Gehirns, Reparatur und Neurogenese nach zerebraler Ischämie, die dynamisch entwickelnden fördernnt der Neurotherapien behinderter Schlaganfall-Patienten. Diese Visualisierung wird auch besonders nützlich bei der Bewertung der anderen Fälle von Gehirntrauma, wobei die Gewebeschädigung kann aus getrennten bildgebenden Verfahren ausgerichtet werden können.
Offenlegungen
WML is a consultant for Bruker Molecular Imaging
Danksagungen
This study was supported by a grant from Bruker Molecular Imaging (to WML) and from the NIH (Grant HL019982 to FJC).
Materialien
| Name | Company | Catalog Number | Comments |
| Albira PET SPECT CT | Bruker | 3D molecular imaging equipment | |
| Sprague Dawley Rats | Charles River Laboratories | 400 | Animal Subjects |
| 18-F-D-Glucose | Spectron | PET compound | |
| micro clamp | FST | 18055-03 | artery clamp |
| occluder #4037 | Doccol Corp. | 403712PK10 | surgical stroke induction |
Referenzen
- Minino, A. M., Murphy, S. L., Xu, J., Kochanek, K. D. Deaths: final data for 2008. Natl Vital Stat Rep. 59, 1-126 (2011).
- Niemi, M. L., Laaksonen, R., Kotila, M., Waltimo, O. Quality of life 4 years after stroke. Stroke. 19, 1101-1107 (1988).
- Ter-Pogossian, M. M., Phelps, M. E., Hoffman, E. J., Mullani, N. A. A positron-emission transaxial tomograph for nuclear imaging. 114, 89-98 (1975).
- Schiffer, W. K., et al. Serial microPET measures of the metabolic reaction to a microdialysis probe implant. J Neurosci Methods. 155, 272-284 (2006).
- Roger, V. L., et al. Heart disease and stroke statistics--2012 update: a report from the American Heart Association. Circulation. 125, e2-e220 (2012).
- Heiss, W. D., et al. Progressive derangement of periinfarct viable tissue in ischemic stroke. J Cereb Blood Flow Metab. 12, 193-203 (1992).
- Foster, N. L., et al. Alzheimer's disease: focal cortical changes shown by positron emission tomography. Neurology. 33, 961-965 (1983).
- Bustamante, E., Pedersen, P. L. High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase. Proc Natl Acad Sci U S A. 74, 3735-3739 (1977).
- Toga, A. W., Santori, E. M., Hazani, R., Ambach, K. A 3D digital map of rat brain. Brain Res Bull. 38, 77-85 (1995).
- Yuan, H., et al. Saptiotemporal uptake characteristics of [18]F-2-Fluoro-2-Deoxy-D-Glucose in a rat middle cerebral artery occlusion model. Stroke. 44, (2013).
- Nemoto, E. M., Hossmann, K. A., Cooper, H. K. Post-ischemic hypermetabolism in cat brain. Stroke. 12 (5), 666-676 (1981).
- Sachdev, P. S., Chen, X., Joscelyne, A., Wen, W., Brodaty, H. Amygdala in stroke/transient ischemic attack patients and its relationship to cognitive impairment and psychopathology: the Sydney stroke study. Am. J. Geriatr. Psychiatry. 15, 487-496 (2007).
- Nagasawa, H., Kogure, K. Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion. Stroke. 20, 1037-1043 (1989).
- Hauber, W., Schmidt, W. J. Differential effects of lesions of the dorsomedial and dorsolateral caudate-putamen on reaction time performance in rats. Behavioral Brain Research. 60, 211-215 (1994).
- Davis, A. E., Gimenez, A. M., Therrien, B. Effects of entorhinal cortex lesions on sensory integration and spatial learning. Nurs. Res. 50, 77-85 (2001).
- Hausler, R., Levine, R. A. Auditory dysfunction in stroke. Acta Otolaryngol. 120, 689-703 (2000).
- Cechetto, D. F., Wilson, J. X., Smith, K. E., Wolski, D., Silver, M. D., Hachinski, V. C. Autonomic and myocardial changes in middle cerebral artery occlusion: stroke models in the rat. Brain Res. 502, 5296-5305 (1989).
- Carmichael, S. T., Wei, L., Rovainen, C. M., Woolsey, T. A. New patterns of intracortical projections after focal cortical strike. Neurobiol. of Disease. 8, 910-922 (2001).
- Failor, S., et al. Neonatal cerebral hypoxia-ischemia impairs plasticity in rat visual cortex. J. Neurosci. 30, 81-92 (2010).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Ann. Rev. Neurosci. 3, 189-226 (1980).
- Kuhn, F. P., et al. Comparison of PET template-based and MRI-based image processing in the quantitative analysis of C11-raclopride PET. EJNMMI Res. 4 (1), 7 (2014).
- Soret, M., Bacharach, S. L., Buvat, I. Partial-Volume Effect in PET Tumor Imaging. J. Nuc. Med. 48, 932-945 (2007).
- Sanchez, F., et al. ALBIRA: A Small Animal PET/SPECT/CT Imaging System. Med. Phys. 40 (5), 051906 (2013).
- Casteels, C., et al. Construction and Evaluation of Quantitative Small-Animal PET Probabilistic Atlases for [18F]FDG and [18F]FECT Functional Mapping of the Mouse Brain. PLOS One. 8 (6), e65286 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten