Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gentransfektion in Richtung Spheroid Zellen auf mikrostrukturierten Kulturplatten für genetisch veränderte Zelltransplantation
In diesem Artikel
Zusammenfassung
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Zusammenfassung
Zur Verbesserung der therapeutischen Wirksamkeit der Zelltransplantation wurde ein Transplantationssystem von gentechnisch veränderten, injizierbare Sphäroiden entwickelt. Die Zellkügelchen werden in einem Kultursystem über mikroPlatten mit einer wärmeempfindlichen Polymer überzogen hergestellt. Eine Anzahl von Sphäroiden werden auf den Platten gebildet sind, entsprechend den Zelladhäsion Bereiche von 100 um Durchmesser, die regelmäßig in einer zweidimensionalen Weise angeordnet sind, die von nicht-klebenden Bereiche umgeben, die von einem Polyethylenglykol (PEG) Matrix beschichtet sind. Die Sphäroide können leicht als eine flüssige Suspension durch Absenken der Temperatur der Platten wiederhergestellt werden, und ihre Struktur ist gut, indem sie durch Injektionsnadeln mit einer ausreichend großen Kalibers (über 27 G) gehalten. Genetische Modifizierung durch Gentransfektion unter Verwendung des ursprünglichen nicht-virale Gen-Träger polyplex nanomicelle, die geeignet ist zur Einführung von Genen in Zellen ohne Störung des Sphäroids Struktur erreicht wird. Für primary Hepatozyten-Sphäroiden mit einem Luciferase-exprimierenden Gen transfiziert wird die Luciferase nachhaltig in transplantierten Tieren erhalten, zusammen mit erhaltenen Hepatozyten-Funktion, wie Albumin Ausdruck angegeben. Dieses System kann auf einer Vielzahl von Zelltypen, einschließlich von mesenchymalen Stammzellen angewendet werden.
Einleitung
Zell-Transplantation Therapie hat große Aufmerksamkeit für die Behandlung von verschiedenen hartnäckigen Krankheiten angezogen. Die Aktivität und die Halbwertszeit des biologisch aktiven Faktoren, die durch die transplantierten Zellen sezerniert werden, sind essentiell für eine verbesserte therapeutische Wirksamkeit eines Zelltransplantationssystem. Genetische Modifikation der Zellen vor der Transplantation ist eine positive Technik zu regulieren und zellulären Funktionen, einschließlich der Sekretion der bioaktiven Faktoren manipulieren. Es ist auch wichtig, um eine günstige Mikroumgebung für die Zellen zur Vermeidung Zelltod oder den Verlust von Zellaktivität aufrechtzuerhalten. Dreidimensionale (3D) Sphäroid Zellkultur, in der Zell-zu-Zell-Wechselwirkungen sind gut erhalten, ist vielversprechend für diesen Zweck, zum Beispiel zur Verbesserung der Albumin-Sekretion aus primären Hepatozyten und Förderung Multilinien-Differenzierung von mesenchymalen Stammzellen (MSCs ) 1-7.
In dieser Studie wurde eine neue Kombination System spheroid Kultur und Gentransfektion wird verwendet, um als Plattform für gentechnisch veränderte Zelltransplantation dienen. Für die Erstellung von Sphäroid-Zellen wird ein Sphäroid Kultursystem auf mikrostrukturierten Kulturplatten verwendet. Auf diesen Platten sind die Zelladhäsion Bereiche Durchmesser von 100 um regelmäßig in einer zweidimensionalen Weise angeordnet und werden durch nicht-klebenden Bereiche mit einem PEG-Matrix 3 beschichtet umgeben. Durch Animpfen einer ausreichenden Zahl von Zellen, Anordnungen von 3D Sphäroiden von 100 um im Durchmesser entsprechend dem Mikromuster Kulturbett gebildet.
Die Sphäroide werden, ohne ihre 3D-Struktur mit wärmeZellKulturPlatten, die mit einem wärmeempfindlichen Polymer, Poly (iso-propylacrylamid) beschichtet waren (PIPAAm) 8-10 gewonnen. Die mikro Architektur basiert auf den wärmeempfindlichen Platten aufgebaut (custom-built). Einfach durch Absenken der Temperatur der Platten werden die Sphäroide aus dem Kulturbett abgetrennt und zerstreuend in phosphatgepufferter Salzlösung (PBS). Somit kann eine große Anzahl von Sphäroiden mit einer einheitlichen Grße von 100 & mgr; m in der Form einer injizierbaren Suspension, erhalten werden.

Abbildung 1. Schematische Darstellung der Sphäroid-Kultur-System auf einem mikrostrukturierten Platte. Genetische Veränderung wird durch Gentransfektion unter Verwendung der ursprünglichen nicht-viralen Gen-Träger, polyplex nanomicelle erreicht. Es wird Plasmid-DNA (pDNA) und Polyethylenglykol (PEG) -polycation Blockcopolymere 11 zusammengesetzt ist. Diese haben eine charakteristische Kern-Schale-Struktur, die aus einer PEG-Hülle und einem inneren Kern aus kondensierter pDNA, so dass sichere und wirksame Gen Einführung in die Zellen für therapeutische Zwecke 11. Bitte klicken Sie hier, um eine größere Version zu sehen thiWert.
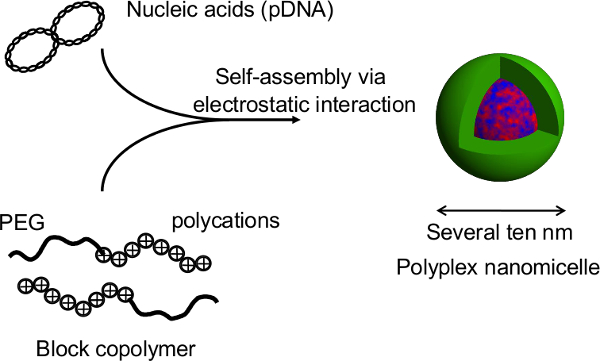
Figur 2. Die Struktur der polyplex nanomicelle durch den Komplex von Nukleinsäuren und PEG-Block-Polykation-Blockcopolymeren gebildet ist. In dieser Studie ist der primäre Vorteil dieses Verfahrens, daß die Sphäroid-Struktur wird während Gentransfektion durch die nanomicelles gestört. Nach nanomicelle vermittelte Transfektionen von primären Ratten Hepatocyten-Spheroiden, verlängert Transgen-Expression von mehr als einem Monat bei kontinuierlicher Albuminsekretion aus der Hepatozyten auf einem Niveau vergleichbar mit der von nicht-transfizierten Sphäroide 12 erhalten. Die Expression des Transgens und Albumin-Sekretion aus den Sphäroiden werden auch nach der Genesung von den wärmeempfindlichen Platten gehalten. Es ist offensichtlich, dass nanomicelles sicher Geneinführung ohne eigene Funktionen des hep beeinträchtigen erleichternatocytes. Somit ist die Kombination von Sphäroid Zellen auf mikrothermosensitiven Platten mit Gen-Einführung mit nanomicelles ist eine vielversprechende Plattform für gentechnisch veränderte Zelltransplantation kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protokoll
Alle tierexperimentellen Studien wurden mit der Zustimmung der Animal Care und Verwenden Committee der University of Tokyo, Tokyo, Japan durchgeführt.
1. Zellpräparation
- Für primären Hepatozyten, folgen Sie dem Protokoll zur Isolation von Hepatozyten der Ratte durch einen modifizierten zweistufigen Kollagenase Verdauung 13,14.
- Betäuben Sprague Dawley (SD) Ratten (männlich, 5 Wochen alt) unter Inhalationsnarkose mit Isofluran. Legen Sie eine Ratte in einer Kammer zu einer Anästhesiegerät angeschlossen, um Isofluran für die Kammer bereitzustellen. Nehmen Sie die Ratten nach dem Einschlafen, und legen Sie sie auf dem Operationstisch mit Lüftungs Verwendung einer Maske. Steuern Sie die Isofluran fließen etwa auf 0,4 bis 0,7 l / min, indem Sie die Bedingungen der Ratte. Perfusion der Leber von Sprague Dawley (SD) Ratten (männlich, 5 Wochen alt) von der Pfortader mit einer speziellen Lösung von 8 g / l Natriumchlorid zusammengesetzt ist (NaCl), 400 mg / l Kaliumchlorid (KCl), 78 mg / LNatriumdihydrogenphosphat Dihydrat (NaH 2 PO 4 · 2H 2 O), 151 mg / L Dinatriumhydrogenphosphat Dodecahydrat (Na 2 HPO 4 · 12H 2 O), 2,38 g / L 2- [4- (2-hydroxyethyl) -1 piperazinyl] ethansulfonsäure (HEPES), 190 mg / l Ethylenglykoltetraessigsäure (EGTA), 350 mg / L Natriumhydrogencarbonat (NaHCO 3) und 900 mg / l Glukose.
- Zirkulieren Collagenase-Lösung durch die Leber.
HINWEIS: Die Lösung von 500 mg / L Kollagenase, 9,8 g / L Hanks gepufferte Salz, zusammen 2,38 g / ml HEPES, 556 mg / ml Calciumchlorid-Hydrat (CaCl 2 · H 2 O), 350 mg / L NaHCO 3, und 50 mg / l Trypsin-Inhibitor, wobei der pH-Wert auf 7,2 eingestellt. - Entfernen Sie die Leber sorgfältig durch und Hackfleisch sie sanft auf einem Teller mit einem Skalpell, fügen Dulbecco-modifiziertem Eagle-Medium (DMEM) mit 10% fötalem Rinderserum (FBS) ergänzt, und filtern Sie die Zellsuspension durch ein 100 & mgr; mNylon-Mesh. Um zusätzliche Trümmer zu entfernen, zentrifugieren Sie die Zellsuspension bei 20 × g für 1 min. Bei diesem Schritt werden Hepatocyten im Überstand.
- Wiederholen Sie den Zentrifugationsschritt zweimal (insgesamt drei Zentrifugationen). Schließlich wird abzentrifugiert Hepatozyten bei 50 × g für 3 min, um sie in Form eines Pellets zu gewinnen.
- Re-suspendieren die Hepatocyten in einer Konzentration von 4 × 10 5 Zellen / ml in einem speziellen Nährmedium aus DMEM mit 10% FBS, 1% Pen-Strep-Glut (PSQ), 1% Dimethylsulfoxid (DMSO), 0,1 umol / L Dexamethason, 0,5 ug / ml Insulin, 10 mmol / L Nicotinamid, 0,2 mmol / L phosphorylierten Ascorbat (Asc-2P) und 10 ng / ml humaner epidermaler Wachstumsfaktor (hEGF) 15. Dieses spezielle Medium ist für die Erhaltung der Leberfunktion unter in vitro Bedingungen.
- Zum Erhalt Ratte MSCs, einschläfern Sprague Dawley (SD) Ratten (männlich, 5 Wochen alt) durch übermäßige Verabreichung von isoflurane. Resektion der Oberschenkelknochen und Schienbeine, und sammeln Sie die Knochenmark, indem ein 22 G Nadel in den Schaft des Knochens, um es zu spülen, mit 10 ml DMEM, ergänzt mit 10% FBS. Sammle die Zellen durch Filtration durch ein 100 um Nylonnetz.
- Saatgut der Zellen auf 10 cm-Kulturschalen mit DMEM, das 10% FBS und 1% Penicillin / Streptomycin. Für die Sphäroid Experimenten verwenden MSCs in 5 Passagen.
2. Herstellung von 3D-Zell Sphäroide
- Kommerziell zu erhalten mit Mikrokulturplatten, bei denen die Zellklebeflächen regelmäßig bei 100 & mgr; m Durchmesser in einer zweidimensionalen Weise angeordnet sind, durch nicht-klebenden Bereiche durch die PEG-Matrix beschichtet ist, umgeben.
HINWEIS: Bei Zelltransplantation notwendig, Zellablösung durch Abkühlen der Platten ermöglichen eine zusätzliche Beschichtung mit dem wärmeempfindlichen Polymer PIPAAm (siehe Schritt 5.1). Temperaturschwankungen können sich Änderungen in der Chemie des Polymers zu induzieren8-10. Bei 37 ° C ist PIPAAm etwas hydrophob, so dass die Zellen, die unter normalen Bedingungen gezüchtet werden. Eine Verminderung der Temperatur unter 32 ° C führt zu einer schnellen Hydratation des Polymers, was zur spontanen Ablösung der Zellen. - Samen der Hepatozyten oder MSCs auf 12-Well-Mikromuster Platten mit einer Dichte von 4 × 10 5 Zellen / Vertiefung bei 37 ° C andincubate sie in einer feuchten Atmosphäre, die 5% CO 2. Die Zellen werden auf den mikrostrukturierten Haft Bereichen ansammeln und nach und nach in 2 Tagen zu bilden runde Kügelchen.
HINWEIS: Für die Herstellung Kontrollzellen in einer Monokultur, benutzen normalen 12-Well-Platten und Samen der Zellen bei einer identischen Dichte, nach einem ähnlichen Verfahren wie oben beschrieben.
3. Herstellung von Polyplex Nanomicelles
- Synthese eines Blockcopolymers, PEG-PAsp (DET) (Poly [N '- [N - (2-Aminoethyl) -2-aminoethyl] aspartamid]) (PEG Mw = 12,000, Polymerisationsgrad (DP) von PAsp Segment (DET) = 59) und ein Homopolymer, das nur aus dem kationischen segment [PAsp (DET)] (DP = 55) zusammengesetzt ist, nach den Verfahren, die zuvor von den Autoren 11, 16, 17.
- Vorbereitung einer gemischten Lösung des PEG-PAsp (DET) Blockcopolymer und das PAsp (DET) Homopolymer in einem gleichen molaren Verhältnis von restlichen Aminogruppen in 10 mM HEPES-Puffer (pH 7,3) durch Einstellen der Polymer-Konzentration auf 33,3 ug / ml und 19,1 ug / ml.
HINWEIS: Die oben beschriebenen Polymerkonzentrationen sind repräsentative Werte für die Vorbereitung nanomicelles mit einer Rest molare Verhältnis der gesamten Aminogruppen in den beiden Polymeren zu den Phosphatgruppen der pDNA (N / P-Verhältnis) von 10 N / P-Verhältnis kann variieren je nach Zelltyp und dem Ziel (für Details siehe Diskussion). Der kombinierte Einsatz der beiden Polymere können sowohl wirksam PEG Abschirmung und Funktionsweise PAsp (DET), um die endosomale verbessern erreichenentkommen (Details siehe Diskussion) 18. - Bereiten Sie die pDNA kodiert Gaussia-Luciferase, GL4 Luciferase oder Erythropoietin durch Klonierung des Segments Expression der entsprechenden Gene in das pCAG-GS-Plasmid (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html ), um die Expression unter der CAG-Promotor / Enhancer mit einem kommerziellen Kit nach Herstellerprotokoll erhalten. Verstärken die pDNA in einem kompetenten Escherichia coli-Stamm und zu reinigen, es mit einem Endotoxin-freiem Plasmid-DNA-Reinigungssystem. Bestimmen die pDNA Konzentration bei einer Absorption von 260 nm, um eine 150 ug / ml-Lösung in 10 mM HEPES-Puffer (pH 7,3) zu erhalten.
- Die polyplex nanomicelles vorzubereiten gründliche Durchmischung der pDNA-Lösung (150 ug / ml in 10 mM HEPES-Puffer) und die vorgemischte Lösung der beiden Polymere in einem Verhältnis von 2: 1 (nach Volumen).
4. Gentransfektion in Spheroids
- Inkubieren der Zellen (Hepatozytenoder MSCs) 72 Stunden nach dem Aussäen auf die mit Mikroplatten, um die Bildung von reifen Sphäroiden erlauben. Zur Gentransfektion, werden 100 ul des polyplex nanomicelle Lösung (enthaltend 10 ug pDNA) in jede Vertiefung nach dem Ersetzen des Kulturmedium mit 1 ml frischem Medium. Fahren Sie mit der Inkubation mit dem nanomicelle Lösung für 24 Stunden.
- Für eine Steuerung unter Verwendung einer lipidbasierten Transfektionsreagenz mischen pDNA Lösungen mit dem Reagenz in einem Gewichtsverhältnis Reagenz / pDNA der 3. Justieren der endgültigen Dosis der pDNA gleich sowohl für die Lipid basierende Reagenz und nanomicelle Methoden sein.
5. Wiederherstellung und Transplantation von Zell Spheroids
- Ersetzen Sie das Kulturmedium mit 200 ul PBS gekühlt und legen Sie die Platten auf Eis.
HINWEIS: In der Regel können die Sphäroide in etwa 15 min zu lösen, und kann in Form einer Suspension für die Transplantation gewonnen werden. - Vorsichtig aspirieren der Zellen in 200 & mgr;Suspension mit einer Spritze mit einer 23 G oder 27 G-Nadel für die in vivo-Injektionen.
6. Auswertung der Transgen-Expression
- Für die in vitro-Bewertung der Expression von Gaussia-Luciferase in das Kulturmedium sezerniert, sammeln 50-100 ul des Mediums genau 24 Stunden nach dem Austausch mit frischem Medium. Schätzung der Luciferase-Expression unter Verwendung eines kommerziellen Renilla-Luciferase-Assay-System und ein Luminometer nach dem Protokoll des Herstellers.
HINWEIS: Die Gaussia-Luciferase bleibt in dem Kulturmedium für mehr als eine Woche stabil. So, um die Echtzeit-Wirkungsgrad der Expression des Transgens zu bewerten, das Medium mit frischem man das Sammeln der Probenmedium ersetzen vor. Der Zeitpunkt der Mediumwechsel kann flexibel sein. - Für die in-vivo-Bewertung der Expression des Transgens in Wirtstieren nach Zelltransplantation, betäuben BALB / c-Nacktmäusen (weiblich, 7 Wochenalt) unter Inhalationsnarkose mit Isofluran.
- Legen Sie eine Maus in einer Kammer zu einer Anästhesiegerät angeschlossen, um Isofluran für die Kammer bereitzustellen. Nehmen Sie die Maus nach dem Einschlafen, und legen Sie sie auf dem Operationstisch mit Lüftungs Verwendung einer Maske. Steuern Sie die Isofluran fließen etwa auf 0,2 bis 0,5 l / min, indem Sie die Bedingungen der Maus.
- Injizieren 200 ul der Zellsuspension, enthaltend Sphäroiden transfiziert mit den GL4 Luciferase-exprimierenden pDNA (wie in 4.1 beschrieben) in das subkutane Gewebe der Bauchgegend.
- Unmittelbar nach der Injektion von D-Luciferin (150 mg / kg; intravenöse Route) zu messen, die die Luciferase-Expression unter Verwendung IVIS Abbildungssystem nach dem Protokoll des Herstellers.
- Zur Bewertung der therapeutischen Wirkungen der Zelltransplantation, injizieren 200 ul der Zellsuspension, enthaltend Sphäroiden mit dem Erythropoietin kodierenden pDNA in die transfiziertesubkutane Gewebe der Bauchregion.
- Sammeln Blutproben durch Unterkieferspeichel Blutungen auf etwa 200 ul Blut 19 zu erhalten. Messen Sie die Hämoglobin und Hämatokrit mit Hilfe eines Blutprobenanalysator.
HINWEIS: Die Zellzahl für die Transplantation ist durch die Anzahl von den Platten ausgesät geregelt. Leider ist es schwierig, die genaue Anzahl von Zellen zu bestimmen, da die Anzahl innerhalb Sphäroide nicht gemessen werden kann.
- Sammeln Blutproben durch Unterkieferspeichel Blutungen auf etwa 200 ul Blut 19 zu erhalten. Messen Sie die Hämoglobin und Hämatokrit mit Hilfe eines Blutprobenanalysator.
- Nach Experimenten, legen Sie die Mäuse auf einem Heizkissen mit einem Temperaturregler verbunden, bis Erwachen aus der Narkose.
Ergebnisse
Gentransfektion der Gaussia-Luciferase-exprimierenden pDNA in den durch die Hepatozyten oder MSCs mit polyplex nanomicelles oder die Kontrolle auf Lipidbasis Transfektionsreagenz 12 gebildeten Sphäroiden geführt. Die nanomicelles induzierte fast keine Veränderung des Sphäroids Struktur im Vergleich mit nicht-transfizierten Sphäroiden auf die mikroPlatten, wohingegen das Kontrollreagens täglich erheblich gestört, die die Struktur nach der Transfektion (Abbildung 3). Nach der Transfektio...
Diskussion
In diesem Protokoll ist es kritisch, um die 3D-Struktur der Sphäroide während der Schritte zur Geneinführung und Sphäroid Erholung aufrechterhalten. Es ist wesentlich, um eine günstige Mikroumgebung aufrechtzuerhalten, dass die Zellen den Zelltod oder den Verlust von Zellaktivität zu vermeiden. Zum Beispiel Albuminsekretion, ein Vertreter angeborene Funktion der Hepatozyten, ist in den Hepatozyten-Sphäroiden erhalten, während die Hepatozyten in der herkömmlichen Monolayer-Kultur schnell ihre sekretorischen Kapa...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir schätzen Dr. Takeshi Ikeya und technisches Personal in Toyo Gosei, Tokyo, Japan für die Bereitstellung von thermosensitiven mikroKulturPlatten sowie wissenschaftliche Beratung. Wir danken auch Frau Satomi Ogura, Ms. Sae Suzuki, Frau Asuka Miyoshi und Frau Katsue Morii für die technische Unterstützung bei Tierversuchen. Diese Arbeit wurde zum Teil durch die JSPS KAKENHI Grant-in-Aid for Scientific Research unterstützt, das Zentrum der Innovation (COI) Programm und die S- Innovationsprogramm von der Japan Science and Technology Agency (JST) und der JSPS Core zu-Kern-Programm, A. Advanced Research Networks.
Materialien
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Referenzen
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten