Method Article
Analyse Cardiomyocyte Entwicklung mit Immunfluoreszenz in embryonalen Maus Herz
In diesem Artikel
Zusammenfassung
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Zusammenfassung
Während die Entwicklung des Herzens, die Erzeugung von Myokard-spezifischen strukturellen und funktionalen Einheiten einschließlich Sarkomeren, kontraktile Myofibrillen Glanzstreifen und Costameren erfordert die koordinierte Anordnung mehrerer Bauteile in Zeit und Raum. Störungen in der Montage dieser Komponenten führt zu Entwicklungsherzfehlern. Immunofluoreszenzfärbung Techniken werden allgemein in kultivierten Kardiomyozyten zur Myofibrille Reifung zu untersuchen, aber dieser ex vivo-Ansatz wird durch das Ausmaß beschränkt, auf die Myozyten vollständig differen in Kultur, Fehlen der normalen in vivo mechanische Eingaben, und in Abwesenheit von endokardialen Cues. Anwendung von Immunfluoreszenztechniken zur Untersuchung der Entwicklung der Maus Herz ist wünschenswert, aber technisch schwierigen und Verfahren mangelt es oft an ausreichender Empfindlichkeit und Auflösung zu Sarkomeren in den frühen Stadien der Entwicklung des Herzens zu visualisieren. Hier beschreiben wir ein robustes und reproduzierbares Verfahren zur Zusammenarbeit immunostain multiple Proteinen oder zur Zusammenarbeit zu visualisieren ein fluoreszierendes Protein mit Immunfluoreszenzfärbung in der embryonalen Maus Herz und diese Methode verwenden, um der Entwicklung Myofibrillen, Glanzstreifen und Costameren analysieren. Das Verfahren kann weiterhin verwendet werden, um Kardiomyozyten strukturellen Veränderungen durch Mutationen, die zu Entwicklungsherzfehlern führen verursacht zu bewerten.
Einleitung
Bei der Entwicklung beginnen Herzkontraktionen bald nach Kardiomyozyten wandern zur Mittellinie und bilden die lineare Herz Rohr 1,2. Die sarcomere ist die Grundeinheit in der kontraktilen Kardiomyozyten; Diese hochorganisierten Zytoskelettstruktur enthält Aktinfilamente zu der Z-Scheibe durch sarcomeric α-Actinin (n-α-Actinin) und Myosin Fasern zum M Leitung verankert (Figur 1) verankert ist. Wie der Kardiomyozyten reift, montieren Sarkomere in Reihe Myofibrillen, die über die Zelle zu verlängern bilden. Myofibrillen sind an den Enden der Kardiomyozyten durch interkalierten Scheibe verankert ist, die Zell-Zell-Junction-Struktur, die ein Übergangsverbindungsstelle mit einer Untergruppe von Z-Scheibenelemente wie S-α-Actinin 3, adherens enthält junction-Proteine, wie N-Cadherin und β-Catenin, Gap Junction-Proteine und Desmosomen (Abbildung 1) 4. Entlang der Längs Membran, der Z-Scheiben peripherer Myofibrillen auchheften sich an die Zellmembran über Costameren; diese spezialisierten fokalen Adhäsionen stellen ein Anker zwischen der Myofibrillen, Plasmamembran und die extrazelluläre Matrix, um eine zusätzliche strukturelle Unterstützung für die Herzmuskelzelle bereitzustellen (Figur 1) 4. Am frühen Herzentwicklung sind Kardiomyozyten in fingerartigen Projektionen Knochenbälkchen bekannt, die in den Raum ragen ventrikuläre und enthalten relativ ausgereift Myofibrillen 5 angeordnet. Da die Entwicklung des Herzens verläuft, die Kardiomyozyten in dem Teilbereich epikardialen proliferieren, um die kompakte Myokards, die die Herzkammerwände umfasst, aber sarcomere und Myofibrillen Anordnung verglichen mit trabekulären Myokard 5,6 verzögerten bilden.
Modelle von Sarkomer und Myofibrille Montage weitgehend stammen aus Immunfluoreszenzstudien an kultivierten Kardiomyozyten 7-10, die einfach sind, aber nicht über eine dreidimensionale Umwelt, Durchblutung, und Kontakte mit anderen kardialen Zells in vivo vorhanden. Hochauflösende Strukturuntersuchungen mittels Immunfluoreszenz in der Maus embryonalen Herzen sind technisch anspruchsvoll, und nur wenige Studien haben die Entstehung von Glanzstreifen und Costameren während Maus Herzentwicklung erforscht. Die adherens junction Protein β-Catenin scheint mit Glanzstreifen von embryonalen Tag (E) 17.5 11, lokalisiert N-Cadherin, lineare Strukturen, die Glanzstreifen von E18.5 12 im Vergleich zu postnatalen Tag 0 13 darstellen können, und Costameren haben bei erkannt lokalisieren E18.5 14, aber diese Proteine zeigen diffuse und kontinuierliche Membranverteilung bei früheren Entwicklungszeitpunkten 11-13.
Hier beschreiben wir eine einfache und reproduzierbare Methode zur Immunfärbung und Fluoreszenz-Mikroskopie von geschnittenen embryonalen Maus-Herzen, die für eine detaillierte Analyse von Myofibrillen und Kardiomyozyten Entwicklung, einschließlich der Entstehung intercala erlaubtted Discs bereits E12.5 und im Entstehen begriffenen Costameren bei E16.5. Dieses Protokoll kann nützlich für die Erforschung der Auswirkungen der Mutationen auf sarcomere Bildung sowie Myofibrillen und Kardiomyozyten Reifung sein.
Protokoll
HINWEIS: Alle experimentellen Verfahren wurden von der UCSF Institutional Animal Care und Verwenden Committee genehmigt.
1. Kryokonservierung und Fixierung von embryonalen Maus-Herzen.
1.1) Snap-Gefrier embryonalen Herzen
- Füllen Sie ein 3,5 cm Petrischale und 7 mm cryomolds mit optimalen Schneidtemperatur (OAT) Medium (siehe Werkstoff-Tabelle). In einer chemischen Haube abkühlen 2-Methylbutan in flüssigem Stickstoff.
- Verzichtet werden 30 ml phosphatgepufferter Salzlösung (PBS) in 10 cm-Petrischalen mit 10 ml PBS in 3,5 cm-Petrischalen, und legen alle Petrischalen auf Eis. Bereiten Sie eine 10 cm-Schale und mehrere 3,5 cm-Schalen pro schwangere Maus.
- Isolieren Embryonen wie zuvor beschrieben 15, die Durchführung der Präparation in eiskaltem PBS.
- Kurz gesagt, einschläfern die schwangere Frau mit CO 2 Narkose und Genickbruch.
- Einen Einschnitt in den Bauch, sezieren die Gebärmutter, indem die Gefäße along der Innenwölbung der Gebärmutter, und übertragen Sie die Gebärmutter zu einer 10 cm Petrischale mit eiskaltem PBS.
- Schneiden Sie die Gebärmutter zwischen jedem Embryo und den Transfer zu einem einzelnen 3,5 cm Petrischale mit eiskaltem PBS. Isolieren jedes Embryo wie beschrieben 15.
- Öffnen Sie die Perikardhöhle mit feinen Pinzette, entfernen Sie das Herz von den Lungen und Blutgefäße, indem an der Aorta, untere Hohlvene und Lungenvenen und übertragen in die 3,5 cm Petrischale mit Oktober
- Lassen Sie das Herz ins Gleichgewicht im Oktober für einige Sekunden, dann in den 7 mm Form, die OCT übertragen das Herz. Ausrichten der vorderen Wand des Herzens zu dem Boden der Form.
- Legen Sie vorsichtig die Form, in flüssigem Stickstoff gekühlten 2-Methyl. Achten Sie darauf, nicht zu erlauben, 2-Methyl Flüssigkeit des OAT oder Herz berühren. Einfrieren, bis die Oktober stetig weiß, übertragen Sie dann die Form, um ein Eis Eimer mit Trockeneis. Fahren Sie mit dem nächsten Embryo.
- Wrap cryomolds in Folie und bei -80 ° C, bis sie zur Kryoschneiden.
1.2) Alternative: Paraformaldehyd (PFA) Befestigungs, Gefrierschutz und Oktober Einbettung embryonalen Herzen
- Füllen Sie die Vertiefungen einer 12-Well-Gewebekulturplatte mit 4% PFA in 1x PBS.
- Präparieren Sie die embryonalen Herzen wie in 1.1.3 beschrieben. Legen Sie jedes Herz in einen Brunnen mit 4% PFA und fixieren bei 4 ° CO / N.
- Kryoschutz: Verwendung eines Kunststoffüberführungspipetten Bewegen jedes Herz zu einem 1,5 ml Mikrozentrifugenröhrchen, das 1,5 ml 15% Saccharose in PBS und sanft zu rühren bei 4 ° C, bis das Herz sinkt auf den Boden des Röhrchens (mehrere Stunden bis zu O / N ). Übertragen jedes Herz in ein 1,5 ml Mikrozentrifugenröhrchen, das 1,5 ml 30% Saccharose in PBS und sanft zu rühren bei 4 ° C wieder, bis das Herz sinkt auf den Boden des Röhrchens (mehrere Stunden bis zu O / N).
- Mit einem Kunststofftransferpipette, legen Sie die kryogeschützt Herz in Oktober und lassen Sie es ins Gleichgewichtfür einige Minuten, um überschüssige Saccharose zu entfernen, dann übertragen Sie die Herzen in die 7 mm enthaltende Form Oktober Ausrichten der vorderen Wand des Herzens zu dem Boden der Form.
- Frieren Sie das Herz im Oktober, indem die Form entweder in flüssigem Stickstoff gekühlten 2-Methyl oder Trockeneis.
- Wickeln Sie cryomolds in Folie und bei -80 ° C, bis sie zur Kryoschneiden.
2. Kryoschneiden
- Eingestellt Kryostattemperatur bis -17 ° C.
- Platz cryomolds in die Kryostatkammer und ins Gleichgewicht zu Temperatur für 15-20 min.
- Kehren Sie die cryomold und verwenden sanften Druck auf das Herz-Block aus der Form zu vertreiben. Ausrichten der vorderen Wand des Herzens an die Spitze des geformten Gewebeblock.
- Platzieren Sie einen großen Tropfen Oktober auf das Futter, und montieren Sie die AV-Block auf den Oktober Drop auf das Futter einfrieren. Halten der Ausrichtung, so dass die vordere Wand des Herzens ist die am weitesten von der Spannvorrichtung.
- Laden Sie das Spannfutter und bestieg erKunst Block auf dem Kryostaten Objektträger. Einzustellen, so dass der Winkel der Klingen 3-5 ° relativ zu der Probe ist.
- Sammeln Sie 10 um Schnitte auf Objektträger, die mit einer positiv geladenen Beschichtung vorbehandelt wurden (siehe Werkstoff-Tabelle). Lassen Sie vor der Lagerung bei -80 ° C vollständig trocknen.
3. Immunfluoreszenz
- Für Snap-Gefrierschnitten und gezielt durchlässig Gewebe in Aceton für 10 min in einem Abzug bei RT.
- Zur schockgefroren und PFA-fixierten Schnitten, Inkubation in PBS-0,1% Triton X-100 für 20 min OCT zu entfernen und PFA-fixierten Schnitten permeabilisieren.
- Block für 45 min in 1 × Blockierungspuffer in PBS verdünnt.
- Bei Verwendung eines primären Antikörpers in der Maus erzeugt, Inkubation in Esel oder Ziegen-Anti-Maus-IgG (H + L) einwertige Fab-Fragment 1: 100 verdünnt in PBS-0,1% Tween 20 für 45 min bei RT (siehe Diskussion).
- Inkubieren in primären Antikörper oder Antikörper in 1x Blockierungspuffer für 2 h bei RT oder verdünntO / N bei 4 ° C (siehe Tabelle der Materialien / Ausrüstung für bestimmte Verdünnungen).
- Auswaschbereiche in 1x PBS dreimal für 10 min bei RT.
- Inkubiere in Alexa Fluor-konjugierten sekundären Antikörper, verdünnt 1: 500 in Blockierungspuffer für 2 h bei RT, vor Licht geschützt.
- Auswaschbereiche in 1x PBS dreimal für 10 min bei RT, vor Licht geschützt.
- Optional: Inkubieren in Hoechst-Farbstoff verdünnt 1: 2000 in PBS bei Raumtemperatur (lichtgeschützt) an Kernen beschriften, dann mit PBS spülen.
- Post-Lösung für 1 min bei RT markierte Abschnitte in 1% PFA.
- Halterung gleitet in anti-fade Medium, indem zwei Tropfen des Mediums an jedem Ende des Schiebers und Abdecken mit einem Deckglas (mit DAPI wenn Kerne nicht bereits beschriftet). Seal Deckgläser mit Nagellack. Shop von Licht bei 4 ° C bis zu seiner Bild geschützt.
4. Die konfokale Bildgebung und Bildanalyse
- Schalten Sie den entsprechenden Laserwellenlängen, die Kamera und Konfokalmikroskop incLuding Bühnenmaschine und z-Motor. Starten Sie die Imaging-Software-Programm. Verwenden Sie die 405, 488 und 561 Laserwellenlängen zur Abbildung Hoechst-, Alexa 488- und Alexa 568-gefärbten Schnitten auf.
HINWEIS: Siehe Werkstofftabelle für unsere Hard- und Software-Spezifikationen. - Montieren Sie den Steuerschieber (Deckglas nach unten für ein inverses Mikroskop) auf der Folie der Bühne.
- Mit dem Ziel, 4X (siehe Werkstoff-Tabelle), finden die Probe und Bereich von Interesse. Nehmen Sie das Bild als eine Karte zu verwenden, wenn die Abbildung bei hoher Vergrößerung.
- Entfernen Sie die Folie, so dass minimale Anpassungen an der Rutsche Bühne. Wechseln Sie in das 60x Ölimmersionsobjektiv (siehe Werkstoff-Tabelle), legen Sie einen kleinen Tropfen Öl auf das Ziel, und ersetzen Sie den Schieber (Deckglas nach unten) auf den Objektträger Bühne.
- Finden Probe wieder. Stellen Sie die Laserleistung, Belichtungszeit und Binning auf die gewünschten Werte für jeden Kanal.
HINWEIS: Wir verwenden im Allgemeinen Laserleistung von 0,8, Kamera Belichtungszeit von 100 ms und Binning von 2 (seE-Werkstoff-Tabelle für die Hardware- und Software-Spezifikationen); optimalen Einstellungen müssen empirisch für jedes Experiment ermittelt werden.- Sobald die optimalen Einstellungen festgelegt sind, die gleichen Einstellungen für alle Gewebeschnitte innerhalb des Experiments. Verwenden Sie das Intensitätshistogramm, um die optimale Intensitätsbereich für jeden Kanal beachten (diese Informationen werden für die Analyse verwendet werden).
- Gene az Stapel der Erwerbsfunktion: Wählen Sie die entsprechenden Laserkanäle, wählen Sie die obere und untere Grenze des Z-Stack. Wählen az Stapelschrittweite, die der Hälfte des Wertes der optischen Schichtdicke durch die Software bereitgestellt wird. Klicken Sie auf "Ausführen", um die Bilder zu sammeln.
- Verwenden Fiji 16 oder ein vergleichbares Programm für die Bildanalyse. Innerhalb Fiji, öffnen Sie die Stapeldatei z mit benutzerdefinierten Farbmodus und den Kanälen in separate Fenster unterteilt. Öffnen Sie das "Anpassen von Helligkeit / Kontrast" Werkzeug aus dem Bild Pulldown-Menü; innerhalb jedes Kanals, set in 4.5.1 die optimale Histogramm Intensitätsbereich bestimmt. Übernehmen Sie diese Kanalbereiche für alle z Stapel analysiert.
- Zusammenführen der einzelnen Kanäle zu einem einzigen zusammengesetzten Bild mit Bild-> Farbe Pulldown-Menü.
- Erstellen Sie eine abgeflachte z Stapel aus dem zusammengesetzten Bild mit dem Image-> Stacks-> z Projektmenü. Dieses Bild deutlich heller als das 3D-Bild ist; stellen Sie die Histogramm-Intensitätsbereich für die Kontrollprobe eine Übersättigung zu vermeiden, und die gleichen Einstellungen auf die experimentelle abgeflacht z-Stack.
- Um ein 3D-Bild zu erzeugen, verwenden Sie zuerst die Image-> Stacks-> 3D-Projekt-Menü 17. Wählen entweder der x-Achse oder y-Drehachse. Stellen Sie die Schnittabstand als die gleiche Anzahl von Mikrometern, wie z Stapelschrittweite. Wählen Sie die gewünschte Gesamtdrehung und stellen Sie den Drehwinkel-Schritten, um 1. Öffnen Sie dann das Bild J 3D Viewer von den Plugins Pulldown-Menü. Wählen Sie die in 4.8 erzeugt zusammengesetzte Bild, Display Lautstärke, und stellen Sie die ReSampling-Faktor 1 oder 2.
Ergebnisse
Die Figuren 2 bis 6 zeigen typische Ergebnisse für die Co-Färbung von verschiedenen Proteinen in einem schockgefroren und Aceton-fixierte Herz. Der Antikörper gegen S-α-Actinin reproduzierbar markierten Z-Scheiben und Glanzstreifen mit hoher Spezifität und minimaler Hintergrund (2A, 3A, 4A, 5A, 6A und 6C), Figur 6 zeigt, daß die Anti-Maus-IgG (H + L) monovalenten Fab-Fragment blockiert effektiv endogenen Maus-IgG-Bindung von Anti-Maus Sekundärantikörper. Der Antikörper gegen adherens Junction Protein β-Catenin gebunden Membran beider Kardiomyozyten und nicht-Kardiomyozyten-Zellen, und die Co-Lokalisierung mit S-α-Actinin trat bei vermuteten Glanzstreifen an E16.5 (2C und D), wie aus der erwartete β-Catenin-Färbungsmuster im erwachsenen Herzen 18. β1 Integrin Immunfluoreszenz in der embryonalen Herz ist besonders anspruchsvoll und oft nicht fokalen Adhäsionen 14 zu identifizieren, aber β1-Integrin-Färbung in diesen Studien zeigten Signal mit der gleichen Periodizität wie n-α-Actinin-markierten Z-Scheiben, was möglicherweise entstehenden Costameren Bilden E16.5 (Figur 3D).
Bei E12.5, S-α-Actinin und Tropomyosin (Sarkomer dünnen Faden Protein) Immunfluoreszenz ergab eine Färbungsmuster mit regelmäßigen Periodizität in trabekulären Kardiomyozyten, die mit reifen Myofibrillen in diesen Zellen (4A und 5A für s-α-Actinin; 4B für Tropomyosin). N-Cadherin-Färbung in trabekulären Kardiomyozyten bei E12.5 Herzen neigten, mit Gebieten mit hohen S-α-Actinin-Färbung (5B - D und 6A - C) kolokalisiert möglicherweise, Glanzstreifen. InIm Gegensatz zum trabekulären Myozyten, S-α-Actinin im kompakten Zone war punctata als linear, und Tropomyosin Färbung war diffus und nicht linearen (4A und 4B). So kann Sarkomer Montage später in kompakter auftreten, verglichen mit trabekulären Myokard. Weiterhin Differenzmustern von S-α-Actinin und Tropomyosin in der kompakten Zone zeigen, dass S-α-Actinin organisiert in puncta und unreife Z-Scheiben früh, während Tropomyosin Einbau in den dünnen Faden kann ein späteres Ereignis in Myofibrillen Anordnung sein.
7, Film 1 und Video 2 zeigen typische Ergebnisse aus einer PFA-Fest E12.5 embryonalen Herzen. In diesen Beispielen wurde ein LifeAct-RFPruby transgenen Embryo zur Bildgebung verwendet wird; die LifeAct-RFPruby Transgen 19 Etiketten filamentösen Aktin erfordert aber PFA Fixierung. Z-Discs mit s-α-Actinin-markiert waren leicht in den meisten Bereichen sichtbar, aber das Signal-Rausch-Verhältnis betrug Decre ASED gegenüber schockgefroren Herzabschnitte (7A); dieses Signal typisch für s-α-Actinin Immunofluoreszenz in PFA-fixiertem Gewebe, in denen Epitope können durch Proteinquervernetzungen maskiert war. 7B zeigt Co-Visualisierung von polymerem Aktin und immun s-α-Actinin innerhalb Myofibrillen (Pfeilspitzen) und polymerem Aktin in endokardialen Zellen benachbart trabekulären Myozyten (Pfeile). Dreidimensionales Bildrekonstruktions ergab zusätzliche Details: einzelne Kardiomyozyten leichter erkennbar, Myofibrillen innerhalb eines Kardiomyozyten wurden in etwa parallel zueinander, aber einzelne Kardiomyozyten wurden in unterschiedlichen Winkeln zueinander (7C und D, Video 1 und Video 2 orientierten ). Die Annäherung zwischen endokardiale Zellen und Kardiomyozyten wurde besser in die dreidimensionale Ansichten schätzen auch.
">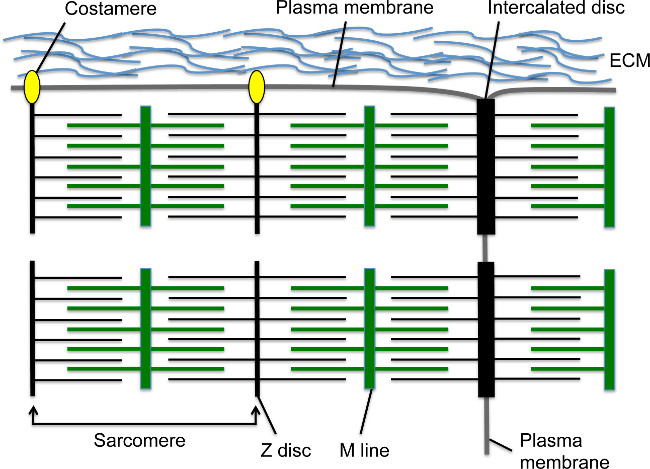
Abbildung 1. Cardiomyocyte Sarkomere, Glanzstreifen und Costameren. Die Z-Scheibe verankert Aktinfilamente, während die M-Linie verankert Myosin-Fasern, die die Aktin-Filamente überlappen. Das Sarkomer besteht aus einer Z-Scheibe - M Linie - Z-Platteneinheit. Mehrere Sarkomere in Serie schaffen eine Myofibrille. Das Seitenende des Myofibrille fügt in den Querrand des Kardiomyozyten zu einem spezialisierten Zell-Zell-Junction-Struktur, die als das interkalierte Scheibe. Periphere Myofibrillen eine Verbindung mit dem Längs Kardiomyozyten Plasmamembran über Costameren, der fokalen Adhäsionen mit der extrazellulären Matrix zwischen Herzmuskelzellen zu bilden. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
pload / 52.644 / 52644fig2.jpg "/>
Abbildung 2. s- α und β-Catenin -actinin Immunfluoreszenz an embryonalen Tag 16,5. Das Herz wurde herausgeschnitten, Schnappeingefroren, gefriergeschnitten, mit Aceton fixiert und immunhistochemisch mit (A) monoklonalen Maus-Antikörper, der gegen Klon EA53 s-α-Actinin, die beschriftet Kardiomyozyten Z-Scheibe und Glanzstreifen, und (B) Kaninchen polycloncal Antikörper gegen das adherens junction Protein β-Catenin. (C) zusammengeführt Bilder zeigen n-α-Actinin und β-Catenin-Färbung. (D) des vergrößerten Bereichs von Interesse von Feld C ; Sternchen markieren vermutet Glanzstreifen mit Co-Lokalisierung von e-α-Actinin und β-Catenin. Bilder wurden aus dem peripheren linksventrikuläre Wand oder kompakten Myokard erhalten, mit der epikardialen Schicht an der oberen linken Ecke des Panels AC. Intensity Histogrammanzeige Bereich 460-1600 (aus of möglich 0-65535) für sowohl die n-α-Actinin / 488 nm und β-Catenin / 561 nm Laserkanäle. Maßstabsbalken 10 um. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
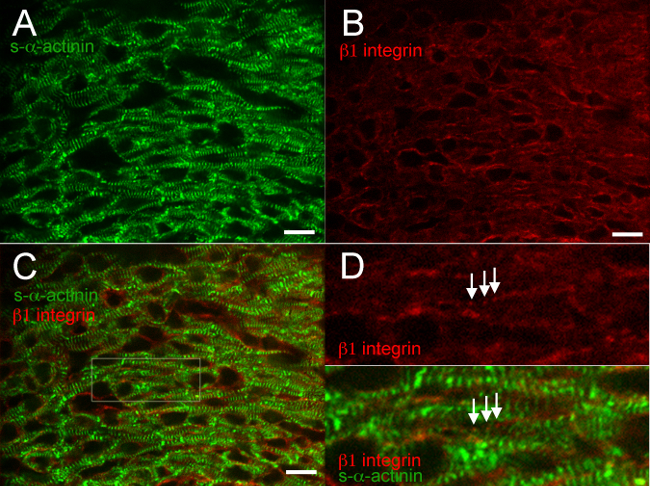
Abbildung 3. s- α -actinin und β 1 -Integrin Immunofluoreszenz bei Embryonaltag 16,5. Das Herz wurde herausgeschnitten, schockgefroren, gefriergeschnitten, Aceton-fixiert und immunhistochemisch unter Verwendung von (A) monoklonalen Maus-Klon EA53 Antikörper gegen S-α-Actinin (B) Ziegen polyklonalen Antikörpers gegen die Brenn Adhäsionsprotein β1 Integrin. (C) zusammengeführt Bilder zeigen β1 Integrin in Kardiomyozyten als auch nicht-Kardiomyozyten Zellen. Beachten Sie, sowohl diffus undpunctata β1-Integrin-Signal in Kardiomyozyten (D) des vergrößerten Bereichs von Interesse von Feld C Hinweis punktförmige, periodische β1-Integrin-Färbung (Pfeile) mit ähnlichen Periodizität wie in der Nähe S-α-Actinin-Färbung in Z-Scheiben. diese Strukturen Costameren darstellen. Bilder wurden aus dem linksventrikulären kompakte Myokard erhalten. Intensity Histogrammanzeige Bereich 460-1200 (außerhalb der möglichen 0-65535) des n-α-Actinin / 488 nm Laser-Kanal und 460 bis 600 für die β1 Integrin / 561-nm-Laserkanal. Maßstabsbalken 10 um. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
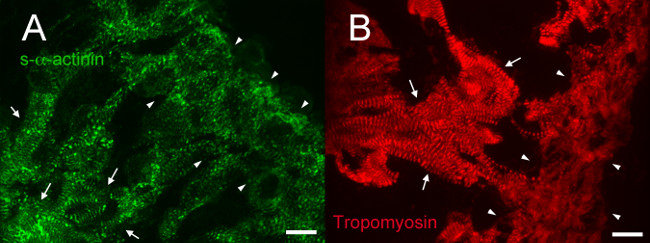
Abbildung 4. s- α -actinin und Tropomyosin Immunfluoreszenz an embryonalen Tag 12,5: Myofibrille Organisation trabekulären und kompakt Myokard. Herzen von littermate Embryonen wurden herausgeschnitten, schockgefroren, gefriergeschnitten, Aceton-fixiert und immunhistochemisch unter Verwendung von (A) monoklonaler Maus-Klon EA53 Antikörper gegen S-α-Actinin (B) monoklonaler Antikörper der Maus gegen den Myofibrillen dünnes Filament Protein Tropomyosin (Developmental Studies Hybridoma Banküber CH1). Trabecular (Pfeile) und kompakte Myokard (Pfeilspitzen) werden angezeigt. Anmerkung lineare S-α-Actinin-Färbung mit regelmäßiger Periodizität in der trabekulären Myokard im Vergleich zu einem Bereich von Färbungsmustern einschließlich puncta sowie lineare Färbung in der Kompaktschicht (A). Beachten Sie auch, lineare Tropomyosin Färbung mit regelmäßigen Periodizität in der trabekulären Myokard aber diffuse Färbung in kompakter Myokard. Intensity Histogrammanzeige Bereich 460-1,400 (von möglichen 0-65535) des n-α-Actinin-Kanal und 460-1,000 für die Tropomyosin Kanal. Maßstabsbalken 10 um."Https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" target = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
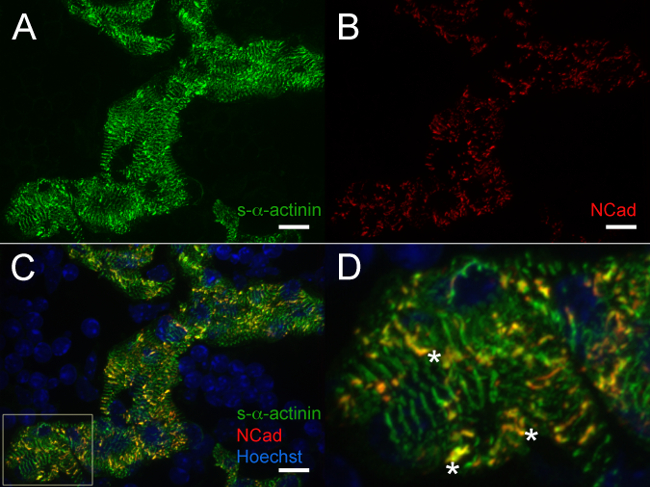
Abbildung 5. s- α -actinin und N-Cadherin-Immunfluoreszenz an embryonalen Tag 12,5:. Myofibrillen und Glanzstreifen in trabekulären Kardiomyozyten Das Herz wurde herausgeschnitten, Schnappeingefroren, gefriergeschnitten, Aceton-fixierten und immun mit (A) monoklonalen Maus-Klon EA53 Antikörper gegen das S-α-Actinin (B) Kaninchen-polyklonalen Antikörpers gegen den Brenn Adhäsionsprotein N-Cadherin. 0,2 um optische Scheiben wurden als az Stapel gesammelt und z Stapel wurden abgeflacht, um die Bilder zu erzeugen. (C) verschmolzen abgeflacht Stapeln sowohl N-Cadherin und S-α-Actinin-Färbung im trabekulären Kardiomyozyten als well als Kerne mit Hoechst-Farbstoff markiert (D) des vergrößerten Bereichs von Interesse von Feld C. Sternchen kennGlanzStreifen mit Colokalisierung s-α-Actinin und N-Cadherin. Intensity Histogrammanzeige Bereich 470-1,200 (von möglichen 0-65535) des Hoechst / 405 nm Laser-Kanal und 470-2,000 sowohl für den S-α-Actinin / 488 nm und N-Cadherin / 561 nm Laser-Kanälen. Maßstabsbalken 10 um. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
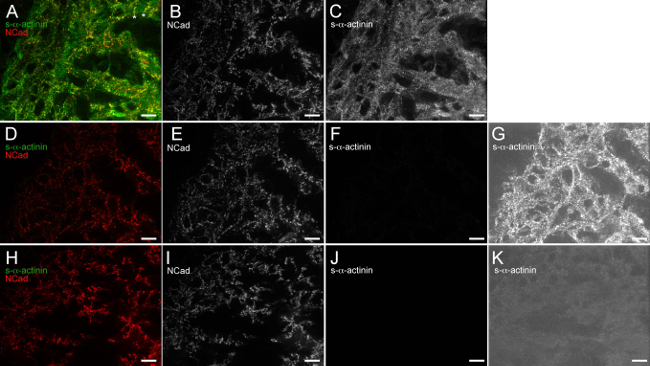
Abbildung 6. Anti-Maus-IgG (H + L) einwertige Fab-Fragment wirksam blockiert endogenen Maus-IgG-Bindung durch anti-Maus-Sekundärantikörper. Die E12.5 embryonalen Herzens wurde ausgeschnitten, schockgefroren, gefriergeschnitten, Aceton-fixiert und immunhistochemisch. (AC) Schnitte wurden mit 1x Blockierungspuffer, gefolgt von Anti-Maus-IgG einwertige Fab-Fragment blockiert, um monoklonale Maus-Klon ausgesetzt EA53 primären Antikörper gegen S-α-Actinin und Kaninchen polyklonalen primären Antikörper gegen N-Cadherin, gewaschen und exponierten Alexa Fluor 488-anti-Maus und Alexa Fluor 586 Anti-Kaninchen-Sekundärantikörper. (A) verschmolzen Bild mit Intensitätshistogramm Anzeigebereich von 480 bis 2500 (von möglichen 0-65535). Sternchen note Regionen, in denen N-Cadherin-Signal wird dem Querende des trabekulären Kardiomyozyten, die wahrscheinlich darstellt naszierenden Glanzstreifen (C) S-α beschränkt. (B) N-Cadherin-Kanal nur mit Intensitätshistogramm Anzeigebereich 480-2,500. -actinin geschützten Kanal mit Intensitätshistogrammanzeige Bereich 480-2,500. (DG) Die Schnitte wurden mit 1x Blockierungspuffer (keine anti-Maus IgG monovalenten Fab-Fragment Blockierungsschritt) blockiert, um polyklonalen Kaninchen ausgesetztBild primären Antikörper gegen N-Cadherin (keine Maus monoklonaler primärer Antikörper), gewaschen, und Alexa Fluor 488-Anti-Maus und Alexa Fluor 586-anti-Kaninchen Sekundär-Antikörper ausgesetzt wird. (D) verschmolzen mit Intensitätshistogramm Anzeigebereich von 480 bis 2500. (E) N-Cadherin-Kanal nur mit Intensitätshistogramm Anzeigebereich von 480 bis 2500. (F) S-α-Actinin-Kanal nur mit Intensitätshistogrammanzeige Bereich 480-2,500. (G) S-α-Actinin-Kanal nur mit Hochempfindlichkeit Intensitätshistogramm Anzeigebereich 480 bis 530, die Hintergrunderkennung von endogenem Maus-IgG in Abwesenheit des Anti-Maus-IgG-Fab-Fragments einwertigen Blockierungsschritt offenbart. (HK) Schnitte wurden mit 1x Blockierungspuffer, gefolgt von Anti-Maus-IgG blockiert einwertige Fab-Fragment von Kaninchen polyklonalen primären Antikörper gegen N-Cadherin (keine Maus monoklonaler primärer Antikörper), gewaschen ausgesetzt und Alexa Fluor 488-Anti-Maus und eine freiliegendeLexa Fluor 586 Anti-Kaninchen-Sekundärantikörper. (H) Bild verschmolzen mit Intensitätshistogrammanzeige Bereich 480-2,500. (I) N-Cadherin-Kanal nur mit Intensitätshistogrammanzeige Bereich 480-2,500. (J) S-α-actinin- einzige Kanal mit Intensität Histogrammanzeige Bereich 480-2,500. (K) n-α-Actinin-Kanal nur mit hochempfindlichen Intensitätshistogramm Anzeigebereich von 480 bis 530, die das Fehlen von Hintergrund endogenen Maus-IgG-Nachweis zeigt, wenn die anti-Maus IgG monovalenten Fab-Fragment Blockierungsschritt verwendet wird. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
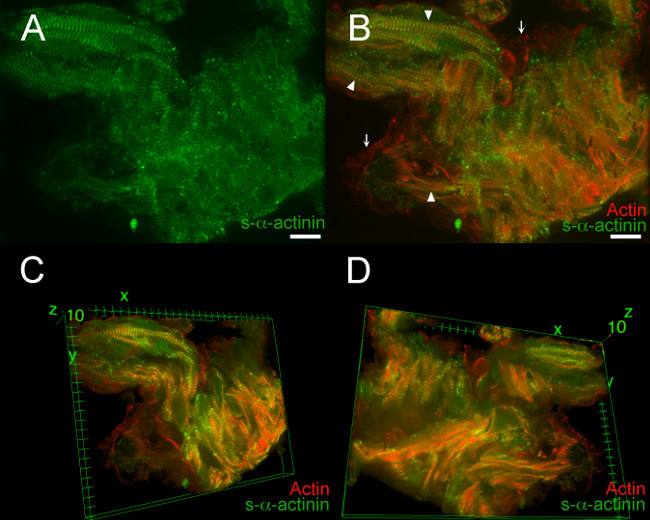
Abbildung 7. s- α -actinin und Aktin-Organisation in trabekulären cardiomyocytes am Embryonaltag 12,5. Die LifeAct-RFPruby transgene Mauslinie wurde verwendet, um polymerem Aktin 19 sichtbar zu machen, während die monoklonalen Maus-Klon EA53 Antikörper gegen S-α-Actinin wurde verwendet, um Z-Scheiben und Glanzstreifen zu beschriften. Die Embryonen wurden PFA-fixiert. 0,2 um optische Scheiben wurden als az Stapel gesammelt (A) abgeflacht z Stapel zeigt, daß S-α-Actinin-Färbung war in PFA-fixiertem Gewebe diffuser als in schockgefroren und Aceton fixiert Abschnitte (Figuren 2-5).. (B ) Abgeflachte z Stapel zeigt sowohl filamentösen Aktin und S-α-Actinin. Filamentösen Aktin Fluoreszenz zwischen Z-Scheiben in Myofibrillen (Pfeilspitzen) lokalisiert. Polymerem Aktin Fluoreszenz wurde auch in Zellen, die die endokardiale trabekulären Myozyten (Pfeile) Linie gesehen. (C), dreidimensionale Darstellung des trabekulären Kardiomyozyten, wie von der Spitze des Stapels betrachtet. (D) Dreidimensionale AnsichtDas trabekuläre Kardiomyozyten, wie aus dem unteren Ende des Stapels betrachtet. Intensitätshistogramm Anzeigebereich 470 bis 900 (von möglichen 0-65535) sowohl für den 488-nm-Laserkanal und für den 561-nm-Laserkanal in A und B; Anzeigebereich 460-800 für beide Kanäle in C und D Maßstabsbalken 10 um. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Film 1. 360 ° Dreh 3D-Ansicht der s- α -actinin und Aktin-Organisation in trabekulären Kardiomyozyten an embryonalen Tag 12,5. Der Bildstapel von 6 wurde in drei Dimensionen mit dem Bild J 3D Viewer Plugin im Fiji Bildanalyseprogramm gemacht. Intensitätshistogramm Anzeigebereich von 470 bis 800 (von 0 bis 65.535 möglich) sowohl für die 488 nm und 561 nm Laserkanäle.
Film 2. Ausgewählte 3D-Ansichten von s- α -actinin und Aktin-Organisation in trabekulären Kardiomyozyten an embryonalen Tag 12,5. Der Bildstapel von 6 wurde in drei Dimensionen mit dem Bild J 3D Viewer Plugin im Fiji Bildanalyseprogramm gemacht. Kleine Drehungen um die x, y und z-Achse ausgerichtet ist, zeigten relativ Myofibrillen innerhalb Kardiomyozyten aber schlechte Ausrichtung zwischen den meisten Kardiomyocyten. Kleine Drehungen demonstriert auch die Annäherung der endokardialen Zellen ohne s-α-Actinin Umgebung Kardiomyozyten. Intensitätshistogramm Anzeigebereich von 470 bis 800 (von 0 bis 65.535 möglich) sowohl für die 488 nm und 561 nm Laserkanäle.
Diskussion
Die optimale Gewebefixierung Technik und Verdünnung müssen empirisch für jeden Antikörper bestimmt werden. In unseren Händen, Schnapp Einfrieren überlegen ist PFA Fixierung für mehrere Herzmuskelantigene, einschließlich e-α-Actinin, β-Catenin, β1-Integrin, Tropomyosin, Talin (nicht dargestellt) und N-Cadherin; Dagegen ergibt PFA Fixation legene Ergebnisse für focal adhesion kinase (nicht gezeigt). Die Protein-Quervernetzungen von PFA gebildete Epitope und Grenze Antikörperbindung zu maskieren; Antigen-Retrieval kann in solchen Fällen erforderlich sein, und Methoden für die Antigen-Retrieval an anderer Stelle 20 zu finden. PFA-Konzentration oder die Länge der Fixierung kann verringert werden, um Epitop Maskierung zu reduzieren, mit optimalen Bedingungen empirisch für jeden Antikörper und an jedem Entwicklungsstadium bestimmt. Entsprechenden Negativkontrollen bei der Charakterisierung eines neuen Antikörper oder Herz Mutante einschließlich Präimmunserum als primäre Antikörperkontrolle und ein "kein primärer Antikörper" gemeinsam genutzt werdenntrol. Die Verwendung von Knockout-Mäusen ist ein idealer Negativkontrolle aber frühe Letalität verhindert ihre Verwendung für viele der Genprodukte hier untersucht.
Verwendung ausreichender Mengen ein komplettes Abtauchen experimentellen und Kontrollobjektträger in der gleichen Immunfluoreszenz-Blockierung, Antikörper und Waschlösungen war wichtig, da war sanfte Schaukeln der Folien während der Inkubation, um eine gleichmäßige Belichtung der Abschnitte zu den Lösungen zu gewährleisten. Dieser Ansatz minimiert technische Variabilität in der Färbung zwischen den Abschnitten und gleitet in einem Experiment. Wenn Kosten begrenzt die Antikörperlösung Volumen, mit einem Pap-Stift, um den Fluss von Lösungen über die Gewebeabschnitte zu begrenzen und zu halten Objektträger in einer feuchten Kammer bei längeren Inkubationszeiten. Wenn ein monoklonaler Maus Primärantikörper - und damit eine anti-Maus-Sekundärantikörper - eingesetzt wird, wird eine zweite Sperrstufe auf endogene Maus-Immunglobuline Bedeckung notwendig (Schritt 3,4) zu sein, um die unspezifische Hintergrundsignal zu verringern.
Geeignete Mikroskopie und Bildverarbeitungstechniken sind kritisch, um biologisch genaue Informationen 21. Die Intensität Histogramm zeigt die Verteilung der Pixel für jede Intensitätsstufe (0 - 65535 Pegel für eine 16-Bit-Bild) für jede Farbe. Hintergrund, können Helligkeit und Kontrast, indem Sie eine Intensität Anzeigebereich, die das Histogramm Spitzenflanken eingestellt werden; aussagekräftige Vergleiche zwischen den Bedingungen zu machen, müssen die gleichen Einstellungen zwischen Steuerung und experimentellen Bedingungen verwendet werden.
Dieses Protokoll stellt eine zuverlässige Methode, um Kardiomyozyten Reifung und Entwicklung in der nativen embryonalen Mäuseherz analysieren. Während Immunfluoreszenz von Kardiomyozyten-spezifische Proteine wird häufig verwendet, um Herzmuskelzellen während der Entwicklung zu markieren, nur wenige Studien verwenden Techniken, die hochauflösende Analyse der Myofibrillen Struktur und die Entstehung von Glanzstreifen und Costameren 12-14,22,23 ermöglichen. Diese Technik kann in v verwendet werdenivo Beurteilung von Mutationen, die Entwicklungsherzfehler verursachen, als ein Mittel zur Ermittlung von Veränderungen in Kardiomyozyten Reifung, die Aufschluss über Mechanismen der strukturelle Anomalien zu vergießen kann.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Materialien
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Referenzen
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten