Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidischen Genipin Abscheidetechnik für Extended Kultur von mikrostrukturierten Vascular Muscular Thin Films
In diesem Artikel
Zusammenfassung
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Zusammenfassung
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Einleitung
Gefäßerkrankungen, wie zerebraler Vasospasmus 1,2, Bluthochdruck 3 und Atherosklerose 4 langsam entwickeln, sind in der Regel in der Natur chronischer und beinhalten dysfunktionalen Kraft Generation von vaskulären glatten Muskelzellen (VSMCs). Unser Ziel ist es, diese langsam fortschreitenden Gefäßstörungen unter Verwendung von in vitro-Methoden mit feinere Kontrolle der Versuchsbedingungen als in in vivo Modellen zu studieren. Wir haben früher entwickelten Gefäßmuskel Dünnschichten (vMTFs) zum Messen funktionellen Kontraktilität in vitro konstruiert kardiovaskulären Geweben 5, jedoch hat diese Methode auf relativ kurzen Zeitstudien wurde. Hier stellen wir ein Substrat Modifikationstechnik, die unsere früheren vMTF Technik zur langfristigen Messungen ausdehnt.
Während das Endothel ist auch in der Gesamtkreislauf-Funktion kritisch, entwickelt arteriellen Lamellen eine nützliche Modellsystem für die Beurteilung von Veränderungen in der GefäßKontraktilität während Fortschreiten der Krankheit. Um einen Funktionskreislauf-Erkrankungen Gewebemodell, sowohl die Struktur und Funktion des arteriellen Lamellen Ingenieur, die Grundkontraktionseinheit des Schiffes, muss mit hoher Wiedergabetreue rekapituliert werden. Arterielle Lamellen sind konzentrisch, in Umfangsrichtung ausgerichteten Blätter kontraktiler VSMCs durch Platten aus Elastin 6 getrennt. Mikrokontaktdrucken von extrazellulärer Matrix (ECM) Proteine auf Polydimethylsiloxan (PDMS) Substrate bereits verwendet wurde, um Führungssignale für die Gewebeorganisation bereitzustellen auszurichtenden kardiovaskuläres Gewebe 5,7-10 nachahmen. Allerdings gemusterte Gewebe mit Mikrokontaktdruck kann die Integrität nach 3-4 Tagen in Kultur zu verlieren, was ihre Anwendbarkeit in der chronischen Toxizität. Dieses Protokoll stellt eine Lösung für dieses Problem durch den Austausch vorherigen Mikrokontaktdruckverfahren mit einer neuen Mikrofluid-Abscheidungstechnik.
Genchi et al. Modifizierten PDMS Substraten mit Genipin und found verlängerte Lebensfähigkeit Muskelzellen bis zu einem Monat in der Kultur 11. Hier verwenden wir einen ähnlichen Ansatz zur Kultur von strukturierten glatten Gefäßmuskelzellen auf PDMS zu verlängern. Genipin, ein natürliches hydrolytische Derivat der Früchte Gardenie, ist ein wünschenswerter Kandidat für Substratmodifikation aufgrund seiner relativ geringen Toxizität gegenüber vergleichbaren Vernetzungsmittel und ihre zunehmende Verwendung als Biomaterial in den Gebieten der Gewebereparatur 12,13 und ECM-Modifikation 14, 15. In diesem Protokoll wird Fibronectin als Zellsignalstoff verwendet wird, wie in den vorangegangenen Mikrokontaktdruckverfahren; jedoch Genipin auf PDMS Substrate vor Fibronektin Strukturieren aufgebracht. Somit wird, wie Zellen verschlechtern die gemusterte Matrix neu synthetisierten ECM von angeschlossenen VSMCs können zur Genipin PDMS beschichteten Substrat zu binden.
Dieses Protokoll verwendet eine Mikrofluid-Abgabevorrichtung zur zweistufigen Genipin und ECM-Ablagerung. Das Design der mikrofluidischen Vorrichtung ahmt MicroCONTACT Druckmuster für hochentwickelte arteriellen Lamellen in früheren Studien 16 verwendet. Daher erwarten wir, dass dieses Protokoll, um arterielle Lamellen imitiert, die erfolgreich rekapitulieren die in vivo-Struktur und die Kontraktionsfähigkeit der arteriellen Lamellen hochausgerichtet zu erhalten. Wir evaluieren auch Gewebekontraktionsfähigkeit zu bestätigen, dass Genipin ist ein geeignetes Substrat Modifikationsverbindung für langfristige In-vitro-Kreislauf-Erkrankungen Modelle.
Protokoll
Anmerkung: Das Ziel des Protokolls ist es, zu konstruieren und zu nutzen eine Gefäßmuskel Dünnschicht (vMTF) mit der in Figur 1 gezeigt, um die Kontraktilität während ausgedehnter Kultur von vaskulären glatten Muskelzellen (VSMCs) an PDMS Substrate beurteilen Struktur. Um VSMC Lebensfähigkeit zu verlängern, nutzen wir die Vernetzerverbindung Genipin. Die Substrate für diese vMTFs sollen Gewebekontraktionsfähigkeit zu analysieren, wie durch Grosberg et al. 8 Weitere vMTF Verfahren 5 kann auch verwendet werden, wobei geringfügige Änderungen an den präsentierten Substratherstellungsprotokoll entwickelt.
1. Untergrund Fabrication
- Deckreinigung
- Zeigen Durchmesser von 25 mm Deckgläser in einem Deckfärbung Rack. Legen die Zahnstange in einen großen Becher oder Behälter (zB eine leere 100 -. 1000 ul Pipettenspitze Container).
- Hinzuzufügen 70% Ethanol, um den Behälter mit dem Deck vollständig einzutauchen. Beschallen sie für mindestens 30 min.
- Entfernen Sie das Deckglas Ständer aus dem Ethanol-Lösung. Lassen Sie die Deckgläser an der Luft trocknen durch Erhängen das Rack in einem sterilen Kulturhaube (auf Partikelansammlung auf Deckgläsern zu verhindern) für 1- 2 Stunden.
Hinweis: Die Deckgläser muss vollständig trocken, bevor die folgenden Schritte sein.
- Poly (N-iso-Propylacrylamid) (PIPAAm) Streifen Isolation auf Coverslip
- Mit Klebeband, Klebeband von den Seiten eines gereinigten Deckglas, so dass eine freiliegende Streifen auf dem Deckglas (1A) zentriert ist. Ändern Sie die Breite dieser exponierten Streifen basierend auf Anwendung und / oder Mikrofluid-Design.
- Markieren Sie die Kanten der Bandstreifen auf dem Deckglas mit Hilfe eines Labor-Marker zur späteren Referenz (Abbildung 1A).
- Um den Umfang des Deckglases geschnitten, um aus der Schale (1A, gestrichelte rote Linie) freizugeben.
- Poly (N-iso-Propylacrylamid) (PIPAAm) Beschichtung
- Mit einer Analysenwaage wiegen 1 g PIPAAm Pulver. Verwenden Sie keine nicht-polymerisierten N-iso-Propylacrylamid, die krebserregend ist.
- Übertragen die PIPAAm in ein 50 ml Zentrifugenröhrchen. 10 ml 1-Butanol in einer chemischen Haube, um eine 10% w / v-Lösung zu erhalten. ACHTUNG: Der Flammpunkt von 1-Butanol ist 37 o C. Bewahren Sie die resultierende Lösung in einer entflammbaren Schrank und Heizung zu vermeiden.
- Lassen Sie den PIPAAm zu 10 Minuten zu lösen. Wenn Pulver noch sichtbar ist, mischen Sie die Lösung unter Verwendung eines Vortex-Mischer, bis alle Pulver auflöst.
Anmerkung: Die folgenden Schritte erfordern die Verwendung einer Schleuderbeschichtungsvorrichtung. Für jedes Deckglas: - Legen Sie das Deckglas geklebt auf der Lackschleuder Spannfutter mit einer Pinzette.
- Übertragen 150 ul PIPAAm Lösung auf das Deckglas, indem Tröpfchen längs der freiliegenden Glas in der Mitte des Deckglases. Gewährleisten eine vollständige Abdeckung der exponierten Fläche.
- Schleuderbeschichtungs PIPAAm mit folgender Rezeptur:
- Rampe 10 s bis 3.000 Umdrehungen pro Minute. Wohnen 5 Sek.
- Ramp 10 s bis 6,000 min. Die Verweilzeit beträgt 60 s.
- Rampe 10 s bis 3.000 Umdrehungen pro Minute. Wohnen 5 Sek.
- Legen Sie das Deckglas in eine Petrischale überzogen mit dem PIPAAm nach oben zeigt. An der Luft trocknen für mindestens 15 min.
- Entfernen Sie vorsichtig das Klebeband von allen Deckgläser, so dass die volle Deckglas mit einer dünnen Schicht von PIPAAm Beschichtung in einem Mittelstreifen ausgesetzt.
- PDMS Coating
- Mischen Sie und entgast 15 g PDMS in einem 10: 1 Basis: Vernetzer-Verhältnis. Fügen Sie 7-8 Tropfen beschallt 0,2 um fluoreszierende Mikrokügelchen vor dem Mischen. Decken Sie die Tasse PDMS mit Aluminiumfolie, wenn nicht verwendet, um Staub und andere Partikel verunreinigen die PDMS zu verhindern.
Anmerkung: Die folgenden Schritte erfordern die Verwendung einer Schleuderbeschichtungsvorrichtung. Für jedes Deckglas: - Legen Sie eine PIPAAm beschichteten Deck auf der Lackschleuder Spannfutter mit einer Pinzette.
- Übertragen PDMS auf das Deckglas, die mindestens ein Drittel der Deckfläche.
- Schleuderbeschichtung, mit dem folgenden recipe:
- Rampe 5 sec bis 500 min. Wohnen 5 Sek.
- Rampe 5 sec bis 1.000 Umdrehungen pro Minute. Wohnen 5 Sek.
- Rampe 10 s bis 3.000 Umdrehungen pro Minute. Verweilzeit 10 sec.
- Rampe 10 s bis 4.000 Umdrehungen pro Minute. Wohnen 60 Sek.
- Rampe 10 s bis 2.000 Umdrehungen pro Minute. Verweilzeit 15 sec.
- Rampe 10 s bis 1.000 Umdrehungen pro Minute. Verweilzeit 10 sec.
- Rampe 5 sec bis 500 min. Wohnen 5 Sek.
- Legen Sie das Deckglas in eine überdachte Petrischale mit der PDMS nach oben zeigt. Aufzeichnung der Zeit, wenn das Deckglas wurde durch Schleuderbeschichtung. Dienen zur Überwachung der Zeit bei der Bestimmung des PDMS Substratdicke während des Experiments für die spätere Verwendung mit jedem Deckglas verbunden.
- Legen Sie die Petrischale mit die Deckgläser in einem 90 ° C Ofen für mindestens 1,5 Stunden, um die ordnungsgemäße PDMS Aushärtung zu gewährleisten. Wenn ein Ofen zur Verfügung steht, können die Deckgläser härten für mindestens 48 h bei RT.
- Entfernen Sie die Deckgläser aus dem Ofen und speichern sie in einer dunklen Schublade bis zum Gebrauch.
- Beiseite jeder vierte Deck foder höher Messung Substratdicke als Funktion der Spin-Coating-Zeit mit einem Profilometer.
- Mischen Sie und entgast 15 g PDMS in einem 10: 1 Basis: Vernetzer-Verhältnis. Fügen Sie 7-8 Tropfen beschallt 0,2 um fluoreszierende Mikrokügelchen vor dem Mischen. Decken Sie die Tasse PDMS mit Aluminiumfolie, wenn nicht verwendet, um Staub und andere Partikel verunreinigen die PDMS zu verhindern.
2. Mikrofluidik-Patterning für Ingenieur Tissues
- Herstellung von Mikrofluidiksystemen
- Design von Tissue Microfluidic Fotomasken
- Verwenden Sie einen geeigneten Computer-Aided-Design-Programm, um mikrofluidische Muster zu entwerfen. Arterielle Lamellen menschlicher Nabelschnurarterie vaskulären glatten Muskelzellen, benutzen ein alternierendes Muster von 10 um Kanäle mit 10 um Wänden.
- Verwenden binären Kanalverzweigung nach Möglichkeit 17, aber andere Verzweigungskonstruktionen verwendet werden. Verringern der Breite und Länge der Kanäle für jede Verzweigungs Iteration bis zum Erreichen des gewünschten Gewebeanordnungsintervall (Wände und Kanäle, 1B).
- Gestalten Sie das Gerät an einen einzigen Einlass für Oberflächenbehandlungslösung Platzierung und einem einzigen Ausgang für Anlegen von Vakuum zu haben.
- Fabricate einer Photomaske, die das mikrofluidische Gestaltung (en), wie zuvor beschrieben 18.
- Photolithographie Wafer Fabrication
Hinweis: Führen Sie die Photolithographie in einem geeigneten Reinraum oder ähnliche Anlage. Auf Silizium-Wafern mit Mustern für weiche lithographische Herstellung von Gewebemikrofluidvorrichtungen (~ 20 bis 25 & mgr; m Kanalhöhe) stellen mittels Photolithographie:- Reinigen eines Siliziumwafers in Aceton, Methanol und Isopropylalkohol für jeweils 1 min. Trocknen des Wafers mit einer Stickstoffpistole.
- Vorbacken des Wafers auf einer Heizplatte 5 min bei 115 ° C, um überschüssige Feuchtigkeit zu entfernen.
- Schleuderbeschichtung der Wafer mit SU-8 3025 Photolack mit folgender Rezeptur zu ergeben verfügt 20-25 & mgr; m in der Höhe:
- Rampe 5 sec bis 500 min. Wohnen 5 Sek.
- Rampe 15 sec bis 4.000 Umdrehungen pro Minute. Verweilzeit 15 sec.
- Weichbacken der Wafer auf einer heißen Platte bei 95 ° C für 15 min.
- Legen Sie eine Fotomaske, und setzen ter Wafer für 16 Sekunden unter Verwendung einer Vakuumkontakt-Programm auf einem Kontaktbelichtungs.
- Ausbacken des Wafers auf einer Heizplatte bei 95 ° C für 4 min.
- Entwickeln des Wafers 6 min in developer. Dann waschen den Wafer zweimal für 2 Sekunden in frischen Entwickler und spülen Sie die Wafer mit Isopropylalkohol.
- Silanate die strukturierten Wafer O / N, indem Sie 2 - 3 Tropfen Tridecafluor-Trichlorsilan in einem leeren Teller in einem Vakuumtrockenschrank. Prop den Wafer unter Verwendung Petrischalen, so daß auf der Unterseite und Oberseite des Wafers ausgesetzt.
ACHTUNG: Tridecafluro-Trichlorsilan ist eine brennbare und ätzende Flüssigkeit. Persönliche Schutzausrüstung und örtliche Absaugung ist für den Einsatz notwendig.
- Tissue Mikrofluidikvorrichtung Fabrication
- Legen Sie eine silanisiert, strukturierten Wafer Feature-Seite nach oben in einer Petrischale.
- Mischen Sie und entgast 100 g PDMS mit einem 10: 1 Basis: Vernetzer-Verhältnis. Gießen Sie die PDMS in die Schüssel, den Wafer vollständig und gleichmäßig abdecken.
- Die Schale im Vakuumtrockenschrank bis alle Luftblasen aus den nicht ausgehärteten PDMS entfernt, ca. 30 min. Härten des PDMS im Teller bei 90 ° C für mindestens 1,5 Std. Zeit und Temperatur eingestellt werden kann, wie durch die Herstellung Leitlinien vorgegeben, um eine vollständige Heilung zu erhalten.
- Sobald das PDMS ausgehärtet ist, schneiden Sie die PDMS um die Wafer mit einer Rasierklinge und vorsichtig lassen Sie die PDMS-bedeckten Wafer aus der Schale. Entfernen Sie überschüssiges PDMS unter Wafer und langsam schälen PDMS weg von der Spitze des Wafers.
- Legen Sie die PDMS Platte Feature-Seite nach oben in eine saubere Schüssel und speichern die Wafer weg von Licht nach dem Gebrauch.
- Schneiden Sie die überschüssigen PDMS aus rund um die Muster mit einer Rasierklinge. Cut-Geräte in rechteckige Formen (1C) zu erleichtern Ablösen Gerät von Substraten in späteren Schritten. Präzise Schnitte sind nicht erforderlich, sofern ausreichend Platz für den Ein- und Ausgang und Gewebemusterbereich (1C) vorhanden ist.
- SchlagenEin- und Austrittsöffnungen (1C) unter Verwendung eines 1 mm chirurgische Biopsie Punsch.
- Design von Tissue Microfluidic Fotomasken
- Mikrofluidik-Vorrichtung Deposition
Anmerkung: In diesem Protokoll wird mikrofluidischen Abgabe verwendet, um gemusterte Genipin, den Schlüssel Vernetzungsmittel für langfristige Gewebekultivierung sowie Fibronektin abzuscheiden. Schritte vor der Penicillin / Streptomycin Sterilisation (2.2.3) müssen nicht in sterilen Bedingungen zu nehmen, aber die Begrenzung Verschmutzung und Staubsammlung ist im gesamten Protokoll gefördert. Alle Schritte nach Deck Sterilisation mit Penicillin / Streptomycin (2.2.3) auftreten sollten sterile Technik zu nutzen. Anmerkung: Dieser Abschnitt des Protokoll muß einen Tag vor der Zellaussaat gestartet werden.- Substrat und mikrofluidischen Vorrichtung Vorbereitung
- Beschallen die Mikrofluidik-Vorrichtungen in 70% Ethanol für mindestens 30 min.
- Trocknen Sie die beschallte Mikrofluidvorrichtungen mit Druckluft oder Stickstoff, und legen Sie sie in einer Petrischale witen Kanal bietet die offene, um unnötigen Verschleiß zu den Funktionen zu verhindern.
- Platzieren Sie bis zu 10 vMTF Substratdeckgläser in einer UVO Reiniger (Deckel auf Schale entfernt, so dass die Oberfläche funktionalisiert) für 8 min.
- Entfernen Sie die UVO-behandelten Deckgläsern, und legen Sie die mikrofluidischen Vorrichtungen Feature-Seite nach unten auf jede Rutsch ein zu einer Zeit (Orientierung sollte ähnlich 1C Abbildung sein). Drücken Sie fest auf den Geräten eine gute Abdichtung zu den PDMS-beschichtete Deckgläser zu gewährleisten.
- Ablagerung von Genipin und Fibronectin
- Eine 5 mg / ml Genipin Lösung durch Zugabe von 1 ml sterilem ddH 2 O zu einer 5 mg Behälter lyophilisierter Genipin. Mischen Sie die Lösung unter Verwendung eines Vortex-Mischer. Beiseite bei RT für mindestens 30 min.
Hinweis: Das Pulver ist schwierig, bei RT für mindestens eine Minute zu solubilisieren, so wiederholende Mischung ist notwendig. - Schnell, einen Tropfen von 70% igem Ethanol bei Einlaß jedes Gerät zur Geräte Ansaugen. Hinweis: Der ETH-anol sollte durch die Geräte Wick.
- Nach 5 - 10 min vorsichtig absaugen überschüssige Ethanol am Einlass unmittelbar ersetzen mit 1X phosphatgepufferter Kochsalzlösung (PBS) am Einlass. Von diesem Punkt an ist, lesen Sie nicht zulassen, dass Einlass vollständig trocknen, um die Einführung von Luft in das Gerät zu vermeiden werden.
- Platzieren eines Vakuums Saugspitze am Austritt der einzelnen Geräte. Zeichnen 1X PBS durch Geräte zu Ethanol wegspülen. Lassen Sie eine kleine Menge von 1 × PBS am Einlass. Hinweis: Wenn Einlass fast trocken erscheint, fügen Sie mehr 1X PBS.
- Aspirieren überschüssige 1X PBS, so dass nur eine kleine Menge, die Anwendung Genipin Lösung bleibt am Einlass vor.
- Platzieren 60 ul 5 mg / ml Lösung Genipin an jedem Einlass (Figur 1D). Zeichnen Sie die Genipin Lösung durch die Geräte, indem ein Vakuum Saugspitze am Ausgang (1D). Achten Sie darauf, nicht auf die gesamte Lösung durch zu ziehen, so dass eine kleine Menge der Lösung am Einlaß.
- Platz Tropfen (ungefähr Dime-Größe) 1X PBS sowohl am Einlass und Auslass um die Benetzung während der Inkubation zu halten. Bewegen Sie die Schale, die Geräte an einem befeuchteten Ofen oder Inkubator (sterile Umgebung ist nicht notwendig) auf 37 ° C eingestellt, und Inkubation für 4 Stunden. Die Schale muss nicht abgedeckt werden.
- Während der Inkubation resuspendieren Fibronektin zu einer Konzentration von 50 ug / ml in sterilem ddH 2 O auf Eis für mindestens 30 min vor der Aufbringung auf Mikrofluidikvorrichtung.
- Nach der Inkubation von Genipin absaugen alle verbleibenden 1X PBS bei den Geräte Steckdosen. Weiterhin eine Vakuumstrahlpumpe bei jedem Geräteausgang gelten, zieht durch den verbleibenden 1X PBS am Einlass.
- Gibt man 100 ul 50 ug / ml Fibronektin-Lösung bei jedem Einlass, zusätzlich zu einer minimalen Menge an restlichen 1X PBS bei Einlass (Figur 1D).
- Zeichnen Sie die Fibronektin-Lösung durch die Geräte unter Verwendung einer Vakuumsaugerspitze am Ausgang ( 1D). Achten Sie darauf, nicht zeichnen die gesamte Lösung durch. Hinweis: Fibronectin Abfall wird anders sein als der 1X PBS und Genipin aussehen aufgrund von Unterschieden in der Oberflächenspannung.
- Bewegen Sie die aufgedeckt Gericht die Geräte an einem Ofen oder Inkubator auf 37 ° C eingestellt enthält, und Inkubation für 24 Stunden. Hinweis: Das Fibronectin Schritt nicht Benetzen der Einlass und Auslass mit 1X PBS erforderlich. Der verbleibende Pool von Fibronektin an der Einlass austrocknen. Dies ist zu erwarten.
- Eine 5 mg / ml Genipin Lösung durch Zugabe von 1 ml sterilem ddH 2 O zu einer 5 mg Behälter lyophilisierter Genipin. Mischen Sie die Lösung unter Verwendung eines Vortex-Mischer. Beiseite bei RT für mindestens 30 min.
- Sterilisation und Vorbereitung für die Zellaussaat
- Es wird eine Lösung von Penicillin / Streptomycin für die Sterilisation von gemusterten vMTF Deckgläser. 5 ml Penicillin / Streptomycin (10.000 Einheiten / ml; 10.000 & mgr; g / ml) zu 500 ml sterilem PBS 1X.
- Die Schale der Geräte in einem sterilen Biosicherheit Haube enthalten.
- Die Geräte von den Deckgläser vorsichtig entfernen durch langsames Abziehen des Gerätes an einer Ecke, während leichtes Greifen der Deckglas in der anderen Hand.Hinweis: Dieser Schritt erfordert Übung, um Schäden in der Deckentfernungsprozess zu reduzieren. Eine Alternative mit einer Spritze auf 1X PBS am Einlaß und / oder Auslaß zu injizieren, um in Trennvorrichtung zu erleichtern.
- Legen Sie die Deckgläser in sterile Sechs-Well-Gerichte. Fügen mindestens 5 ml Penicillin / Streptomycin-Lösung in jede Kammer. Die Schalen werden in einem sterilen Inkubator bei 37 ° C für mindestens 30 min.
- Nach der Sterilisation absaugen Penicillin / Streptomycin-Lösung, und Samen die Deckgläser mit kultivierten menschlichen Nabelschnurarterie der glatten Gefäßmuskulatur cells19 (1D). Die Setzung Konzentration für VSMCs ist ~ 80.000 Zellen pro cm 2. Um die Anzahl der Zellen für jede Probe benötigt, reduzieren, verwenden Sie ein Druckminderer, um die Aussaat Bereich zu verringern. Ein Beispiel eines Getriebes ist der Schnitt der Spitze eines konischen 15 ml-Rohr mit dem Deckglas mit steriler Vakuumfett vor der Aussaat befestigt.
- Die Deckgläser ausgesät in einem sterilen Inkubator bei 37 ° C und 5% CO 2 und damit die angesiedelten Zellen ausgerichtet arteriellen Lamellen imitiert befestigen und bilden O / N (2A-B).
- Langfristige vMTF Tissue Culture
- Einen Tag nach der Aussaat, entfernen Sie das Zellmedium und Reduzierungen. Spülen Sie das Gewebe mit 1X PBS. 4 ml serumfreies Medium, um ein Zell kontraktilen Phänotyp im VSMCs 20 induzieren.
- Wiederholen 1X PBS spülen und Zugabe von frischem Serum-freien Medium jeden zweiten Tag für die Langzeitkultur gewünscht.
- Substrat und mikrofluidischen Vorrichtung Vorbereitung
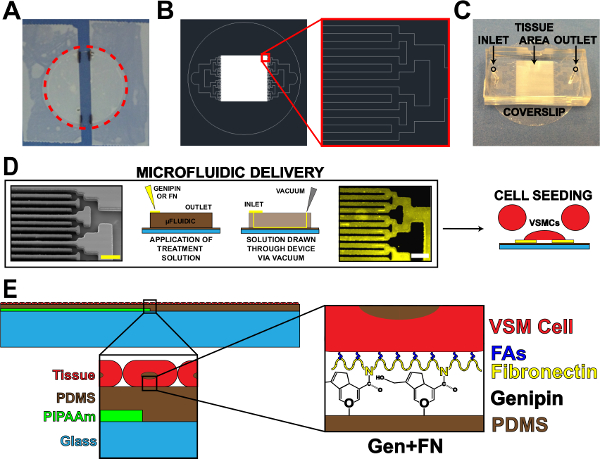
Abbildung 1. Microfluidic Protein-Abgabevorrichtung. (A) aus Deck gegurtet für PIPAAm Beschichtung. Red gestrichelten Kreis: Schneiden Pfad zur Deck lösen (B) Repräsentative AutoCAD-Zeichnung von Gewebemikrofluid-Maskenmuster.. Einschub: Detail des binären Verzweigung zu alterntriebs 10 um x 10 um Gewebemuster. (C) Platzierung von Mikrofluidik-Vorrichtung auf einem Decksubstrat mit Ein- und Ausgang angezeigt. (D) Schematische Darstellung der mikrofluidischen Proteinmusterbildung und Lieferung. Von links nach rechts: Rasterelektronenmikroskopische Aufnahme von mikrofluidischen Kanälen (Maßstab: 50 & mgr; m); Detaillierte schematische Methode zur Proteinablagerung; Immunhistochemie gefärbt Fibronektin (Maßstab: 50 & mgr; m); Zellaussaat mit glatten Gefäßmuskelzellen. (E) Schematische Darstellung der hergestellten Gewebe. 1. Einschub: Detail des Schichtaufbaus. 2. Einschub: Detail des Genipin Änderung der PDMS-Substrat nach mikrofluidischen Abscheidung. © IOP Publishing. Vervielfältigt und / oder mit Genehmigung modifiziert. Alle Rechte vorbehalten. 19 Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
3. Die Gewebefunktionsanalyse mit vMTF Kontraktilität Assay
Anmerkung: Die MTF-Kontraktionsassay hier vorgestellt wird, nachdem die in Grosberg et al entwickelte Technik modelliert 8.
- vMTF Kontraktilität Experiment
- Legen Sie eine Gewebeprobe in einer 100 mm-Schale. In sterile 1X Tyrode-solution8 bei pH 7,4 auf 37 ° C, um die Probe zu bedecken.
- Verwenden einer Rasierklinge, um mehrere parallele Schnitte senkrecht zur PIPAAm Kante zu machen. Machen Sie Schnitte in einer Weise, die breiter Gewebeschnitten, die die vMTFs (mit Breite ~ 2 mm) im Wechsel mit dünnen Streifen (3A, Seitenschnitte) sein wird, ergibt. Um saubere Schnitte zu machen, legen Sie eine Rasierklinge in Kontakt mit der Probe und fest ziehen, um der Seite.
- Drehen Sie die Schale 90 und machen zwei gerade, parallele Schnitte in der Mitte des Gewebes, parallel zu dem Streifen aus PIPAAm (3A, Ende Schnitte). Entfernen und entsorgen Sie die losen Streifen von Gewebe zwischen diesen Schnitts und die dünne Streifen zwischen vMTFs (Schnitt im vorherigen Schritt), um neben Filmen aus den Kontakt zu vermeiden.
- Die Probe wird bei RT für 10 Minuten ruhen, oder bis der gesamte PIPAAm aufgelöst hat. Hinweis: Wenn PIPAAm bleibt in Zukunft Schritten kann Probe in die Schneidschüssel wieder auf Rest PIPAAm aufzulösen. Eine sanfte Kratzen der Unterseite vMTF können in PIPAAm Entfernung zu unterstützen, je nach Bedarf.
- Setzen Sie einen kleinen Punkt von Vakuumfett in einem sauberen 35 mm Petrischale. 5 ml frische, sterile 1X Tyrode-Lösung bei 37 ° C. Übertragen Sie das Deckglas mit geschnittenen Filme aus der 100-mm-Schale in die 35 mm-Schale, und drücken Sie auf Vakuumfett, um die Bewegung des Deckglases zu verhindern.
- Die Schale in einem temperaturgesteuerten Plattform auf dem Stereomikroskop Bühne.
- Capture Zeitraffer übertragen und Fluoreszenzlicht Bilder in gewünschten Intervallen (z. B. 30 s) während der gesamten Behandlung Assay.
- Seriell behandeln vMTFs mit 50 nM Endothelin-1 für 20 min (induzierte Kontraktion) und 100 & mgr; M HA-1077 für 30 min (Gewebe Entspannung). Konzentrierte Lösungen von jeder Behandlung auf die Versuchsschale mit 5 ml sterile 1X Tyrodelösung zu bestimmten Zeitpunkten, wodurch die gewünschte Behandlungskonzentration in der 5 ml-Volumen. Machen Behandlung Ergänzungen während des Intervalls zwischen Bildzeitraffernahmen zu vermeiden Erfassung Pipette in Bildern.
- vMTF Kontraktilität Analysis
- Verwenden von Deckgläser beiseite in 1.4.8 festgelegt, zu messen PDMS Substratdicke mit einem profilometer21. Erstellen Sie eine Dicke vs. Spin-Zeit-Kurve für jeden Satz von Deckgläsern. Verwenden Sie diese, um die Kurve vMTF Dicke für jedes Deckglas in einer Kontraktions Experiment verwendet zu schätzen.
- Messung der vMTF Projektionslängen für jeden Zeitpunkt während des Experiments, und die Berechnung der zugehörigen Krümmungsradien (3B) unter Verwendung von zuvor beschriebenen Verfahren 8.
- Berechnen vMTF Stress zu jeder Zeit point mit bisherigen Methoden vMTF 5.
Hinweis: Verwenden Sie die geschätzte vMTF Dicke von 3.2.1 berechnet. Messen Sie VSMC Dicke mittels konfokaler Bilder, wie bereits berichtet 9. Erhalten PDMS Elastizitätsmodul von Unternehmen zu Rate ziehen.
Ergebnisse
Das primäre Ziel dieser Arbeit war es, die Überlebensfähigkeit der mikro VSMCs auf hydrophoben PDMS Substrate erstrecken. Dies wurde durch Einbringen eines Mikrofluidabgabesystem, um gemusterte Genipin und Fibronektin auf PDMS (Abbildung 1) abzuscheiden bewerkstelligt. Ablagerung von ECM Proteinen unter Verwendung von Mikrofluid-Liefer ergab High Fidelity Übertragung des Kanalmuster mit bloßen PDMS zwischen Zeilen Genipin und Fibronektin (1D). Die anhaftenden Zellen (1E) fo...
Diskussion
Hier präsentieren wir ein Protokoll, das auf zuvor entwickelten vMTF Technologie aufbaut, so dass die erweiterte Experiment mal typisch für chronische Gefäßerkrankungen Wege 1,23,24. Um dies zu erreichen, wir Mikro Genipin, die zuvor gezeigt wurde, daß langfristige Funktionalisierung von PDMS Substrate 11 bereitzustellen, unter Verwendung einer Mikrofluid-Abscheidungstechnik Engineered arteriellen Lamellen mit verbesserten vaskulären Gewebelebensfähigkeit zur Verwendung in MTF Kontraktilitä...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Materialien
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Referenzen
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G., ed, B. e. r. n. e. ,. R. .. ,. Architecture of the vessel wall. Physiol. Rev. , (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005 (2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten