Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Orthotopen Implantation und der peripheren Immunzellenüberwachung in der II-45 Syngene Rat Mesotheliom Modell
In diesem Artikel
Zusammenfassung
Die Erzeugung eines orthotopischen Rattenmodell der pleuralen malignes Mesotheliom durch Implantation von II-45 Mesotheliomzellen in die Pleurahöhle von immunkompetenten Ratten dargestellt. Eine durchflusszytometrische Verfahren zu sieben Immunzelluntergruppen in diesen Tieren aus einem 25 & mgr; l Blutprobe zu analysieren, wird ebenfalls beschrieben.
Zusammenfassung
Die enorme Zunahme des Interesses an immun-basierte Behandlungsmethoden für Krebs wie Impfstoffe und Immun Checkpoint-Inhibitoren und einem besseren Verständnis der Rolle der Tumor-Mikroumgebung in Ansprechen auf die Behandlung, die gemeinsam auf den Bedarf an immunkompetenten orthotopen Modelle zur präklinischen Versuchsreihen zeigen dieser neuen Therapien. Dieses Papier zeigt, wie Sie eine orthotope immunkompetenten Ratten-Modell von Pleura malignen Mesotheliom zu etablieren. Verlaufskontrolle in orthotopische Modell wird durch die interne Anordnung der Tumoren confounded. In Längsfortschreiten der Krankheit und ihre Wirkung auf zirkulierende Immunzellen in dieser und anderen Rattenmodellen von Krebs zu überwachen, ein einziges Rohr Durchflusscytometrieassay erfordert nur 25 ul Vollblut beschrieben. Dies stellt eine genaue Quantifizierung von sieben Immunparameter: Gesamt Lymphozyten, Monozyten und Neutrophile, sowie die T-Zell-Untergruppen CD4- und CD8, B-Zellen und natürliche Killerzellen. Verschiedene U-Booteets dieser Parameter sind nützlich bei verschiedenen Umständen und Modelle mit Neutrophilen Lymphozytenverhältnis mit dem größten Nutzen für die Überwachung der Progression der Erkrankung in der Mesotheliom Modell. Analysieren zirkulierenden Immunzellen Ebenen mit diesem einzigen Röhre Verfahren kann auch bei der Überwachung der Reaktion auf immunbasierten Behandlungen und das Verständnis der zugrundeliegenden Mechanismen, die den Erfolg oder Misserfolg der Behandlung zu unterstützen.
Einleitung
Malignes Mesotheliom (MM) ist eine aggressive Krebserkrankung, die aus transformierten Zellen in der Membran (Mesothel) entsteht, die Linien der Lunge und der Bauchhöhle, des Herzens und inneren Geschlechtsorgane, und ist die häufigste primäre Tumor der Lunge Hohlraum oder Pleura 1,2 . Die Exposition gegenüber Asbestfasern einen Anteil von 80% der MM, und während Verbote Asbest Verwendung wurden vor Jahrzehnten in den meisten westlichen Ländern eingeführt wurde, hat seine weit verbreitete Verwendung in der Gemeinschaft ein tödliches Erbe hinterlassen. Die Weltgesundheitsorganisation schätzt, dass 107.000 Menschen weltweit sterben jedes Jahr an asbestbedingten Krankheiten, mit Sterblichkeit weiter zu. Eine neue Nichtberufseinfallswelle wird auch Schwellen- und gibt es wenig Verständnis bei, und auf welcher Ebene dies 3 Höhepunkt erreichen.
Die Mehrheit der Menschen mit MM spät diagnostiziert, wenn eine systemische Chemotherapie ist eine der einzige praktikable Möglichkeiten 4. Die effective Chemotherapie und aktuelle "Standardtherapie" (zusammen mit Cisplatin 5 Pemetrexed) wurde vor über 10 Jahren identifiziert. Allerdings Scheitern dieser Behandlung ist unvermeidlich, und es gibt keine bewährten zweiten Zeilenoptionen, so dass Patienten mit einem grimmigen Prognose und mediane Überlebenszeit von nur 12 Monate 2. Daher besteht ein dringender ungedeckten Bedarf nach effektiveren Behandlungen. Trotz der Untersuchung einer Reihe von neuartigen Therapien in klinischen Versuchen keine entsprechen Veränderungen in der Praxis geführt. Dies ist zum Teil auf den niedrigen (5%) Übertragung der vorklinischen Ergebnissen, im allgemeinen in Xenotransplantat-Mausmodellen durchgeführt, um die klinische Einstellung 6-8. Solche Modelle nicht getreu rekapitulieren die komplexen Aspekte der Tumor-Mikroumgebung in unphysiologischen Orten auftreten, häufig in Abwesenheit eines funktionierenden Immunsystems 9.
Syngenen orthotopen Modelle schaffen eine deutlich realistischere Tumorumgebung als die commonly verwendet subkutane Xenograft-Modellen als die Tumoren in der korrekten physiologischen Ort mit einem intakten Immunsystem 10,11 erfolgen. Der größere Umfang der Ratte erhöht seine Verwendung als Nagetierkrankheitsmodell, vor allem in der Arzneimittelstudien, in denen serielle Blutabnahmen erforderlich sind, um die Behandlung angesprochen und Toxizität 12 zu bewerten. Ferner ist in Modellen, in dem Verlaufskontrolle schwierig ist aufgrund der Lage der Tumoren (wie zum Beispiel in der Pleurahöhle), die Fähigkeit zur Überwachung Krankheitsprogression über Faktoren im Blutkreislauf gefunden ist äußerst attraktiv. Die Erzeugung eines syngenen orthotopen Modell des Pleuramesotheliom mit immunkompetenten Ratten beschrieben. Darüber hinaus ist eine einfache und relativ nicht-invasive Verfahren zur Überwachung pleuralen Fortschreiten der Krankheit durch Messen zirkulierenden Immunzellen beschrieben.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Verfahren, die Tiere wurden in Übereinstimmung mit den Empfehlungen in der australischen Code of Practice für die Pflege und Verwendung von Tieren zu wissenschaftlichen Zwecken durchgeführt. Das Protokoll für diese Studie wurde von der Royal North Shore Hospital Animal Care und Ethik-Kommission genehmigt. Weiblich Fischer 344 Ratten (F344, 150-200 g) wurden am Kearns Einrichtung gepflegt, Kölling Institute unter Standardbedingungen (12 Stunden Licht / Dunkel-Zyklen und den freien Zugang zu Nahrung und Wasser).
Hinweis: Ein Flussdiagramm für alle experimentellen Verfahren ist in Abbildung 1 dargestellt.
1. Herstellung von Zellen zur Implantation
- Kultur die Ratte Mesotheliom II-45-Zelllinie (auch als IL-45 bekannt, durch peritoneale Einführung von Krokydolith Asbest abgeleitet) in RPMI 1640 (RPMI) Medien mit 10% fötalem Rinderserum (FBS) ergänzt und wachsen in Standardbedingungen (37 ° C befeuchteten Inkubator mit 5% CO 2). Maintain von Passagieren und Sub-Kultur bei etwa 01.50 zweimal in der Woche in einem 75 cm 2-Kolben.
- Vorbereitung Reagenzien für die Zellkultur und warme Aliquots bei 37 ° C. Erforderlichen Reagenzien umfassen serumfreiem RPMI-Medium (SFM), RPMI mit 10% FBS, phosphatgepufferter Salzlösung (PBS) und 0,5% Trypsin-EDTA.
- Kulturzellen für die Implantation auf etwa 70-80% Konfluenz. Dies gewährleistet, die sie in der linearen Wachstumsphase befinden.
- Ernten der Zellen durch Verwerfen der Medien, einmaliges Waschen mit 5 ml steriler PBS und dann Zugabe von 3 ml 0,5% Trypsin-EDTA.
- Zurückzukehren Kolben in den Inkubator für ungefähr 5 min, bis alle Zellen sich nicht haft.
- Sobald Zellen nicht adhärente, 3 ml RPMI mit 10% FBS, um das Trypsin zu inaktivieren. Sammeln und Zentrifuge Zellen bei 300 × g für 3 min.
- Waschen Sie das Zellpellet in 10 ml SFM und Zentrifuge wieder bei 300 × g für 3 min.
- Wash Zellpellet wieder mit 10 ml SFM und Zentrifuge wie oben.
- Resuspendieren der Zellen in 10 ml SFM und führen eine Zellzahl unter Verwendung eines Hämozytometers oder ähnliche Instrumente.
- Verdünnte Zellen, so dass 100 & mgr; l der Menge an zu implantierenden Zellen enthält.
Hinweis: Das Tumorwachstum wurde in einer Dosis von nur 100 Zellen in 100 & mgr; l, aber eine Standarddosis beträgt 500.000 Zellen in 100 & mgr; l nachgewiesen. - Eine ausreichende Zellen in Medien für die Anzahl der Ratten, implantiert werden (dh 100 ul / Ratte), plus mindestens 0,5 ml zusätzliches, um Verluste aus Grundierung und das Totvolumen der Nadel zu kompensieren.
- Bereiten Sie ausreichend SFM (ohne Zellen), um in den Kontrollratten (dh 100 & mgr; l / Ratte) implantiert werden, plus mindestens 0,5 ml Kosten.
Hinweis: Die Zellen und SFM sind nun bereit für die Implantation. Sie sollten bei 37 ° C gelagert und innerhalb von 2 h nach der Ernte implantiert, um die Lebensfähigkeit aufrechtzuerhalten.
2. In-vivo-Implantation von Zellen
- Setzen Sie den F344-Ratte (> 13 Wochen alt) in die Induktionskammer und betäuben mit 1,4% Isofluran Einatmen (oder das Verfahren im Einsatz in der Anlage). Sobald die Ratte scheint eingeschlafen verschieben Sie es von der Kammer auf einen Nasenkegel (mit 1,4% Isofluran fließt) zu sein, legen Sie es auf seiner Rückseite mit der Brust nach oben (ventral). Dies ermöglicht der inneren Organe von Brustkorb zu regeln. Überprüfen Reflexe nach institutionellen Protokolle, um die Ratte zu gewährleisten ist vollständig betäubt.
- Rasieren sich das Recht regio costalis (Brust) Bereich, um den Pelz zu entfernen.
- Reinigen Sie den rasierten Bereich mit 80% v / v Ethanol.
- Identifizieren Sie die Injektionsstelle: auf der rechten Seite, finden Sie die 2. Drüse starting Schädel. Die Injektionsstelle ist 0,5 cm proximal dazu, zwischen der 3. und 4. Rippe vom kaudalen Ende des Brustkorbs. (2A).
- Vorsichtig mischen die II-45-Zellen zu resuspendieren. Langsam ziehen die Zellsuspension (oder SFM für Kontrollratten) in ein 1 ml &# 160; Spritze ohne Nadel auf. Wenn eine Nadel für die Erstellung von Zellen angebracht gibt es das Potenzial für die Zellen entlang des Nadeleinspritzleitung zu wachsen. Befestigen Sie eine 23G x 1¼ Nadel. Prime die Nadel, und entfernen Sie alle Luftblasen.
- Sobald die Spritze und Nadel grundiert sind, legen Sie eine 20 mm lange und 5 mm Durchmesser Distanzstück über den Nadelschaft. Dies wird verwendet, um die Nadel zu tiefes Eindringen in die Pleurahöhle während der Injektion zu verhindern. Ca. 5 mm-12 mm der freiliegende Nadel ist ausreichend für Penetration durch die Rippen ohne Beschädigung keine Organe.
- Langsam die Nadel zwischen den Rippen, zurückziehen auf der Spritze, um sicherzustellen, ein Blutgefäß gestochen haben (kein Blut sollte in der Spritze angezeigt) dann spritzen 100 ul Zellen oder SFM. (2B).
- Entfernen Sie die Nadel und sanft rollen die Ratte von Seite zu Seite, um Zellen in der Brusthöhle zu verbreiten.
- Legen Sie die Ratten in einen Käfig und überprüfen Sie für die Wiederherstellung. The rat sollte wach innerhalb von 1 min und Starten zu bewegen sein.
- Wiederholen Sie für jede Ratte mit einer neuen Nadel. Wiederverwendung der gleichen Nadel wird in das Zellwachstum entlang der Einspritzleitung der Nadel führen.
- Überwachen Sie das Wohlbefinden der Tiere täglich.
- Euthanize Tiere auf ethisch definierten Endpunkten, wie durch die institutionelle Tierethikkommission geregelt. Die ethischen Endpunkte für die Ratten in diesen Experimenten waren Gewichtsverlust von mehr als 10% oder Atemnot.
3. Schwanzvene Blutentnahme
- Wenn Blut sofort nach der Zellimplantation gesammelt werden, halten Sie die Ratten betäubt. Wenn Blutentnahme zu einem anderen Zeitpunkt, zu betäuben die Ratten mit 1,4% Isofluran Einatmen. Überprüfen Reflexe nach institutionellen Protokolle, um die Ratte zu gewährleisten ist vollständig betäubt.
- Legen Sie die Ratte auf die Seite und suchen Sie eine laterale Schwanzvene.
- Sterilisieren Sie den Schwanz mit 80% Ethanol und kennzeichnen einen 0,5 ml EDTA collection Rohr.
- Um Blut zu sammeln, immer an der kaudalen Ende des Schwanzes zu starten (etwa ein Drittel des Weges entlang). Hierdurch lassen sich weitere Versuche näher an dem kranialen Ende des Schwanzes, falls der erste Versuch fehlgeschlagen ist. Resample nie kaudal, da dies ein Blutgerinnsel verursachen.
- Positionieren Sie eine 23G x 1¼ Nadel parallel zur Seiten Vene und schieben Sie sie in die Vene in einem flachen Winkel, damit es etwa dringt 10 mm (3A).
- Hinweis: Wenn die Vene wurde erfolgreich punktiert Blut wird in der Anlage Ende der Nadel (3B) zu sehen sein.
- Ein Tropfen Blut wird auf dem Schwanz an der Stelle der Punktion zu bilden. Sammeln Sie diese Blut mit einer Pipette und Transfer in den markierten 0,5 ml (oder kleiner) EDTA Sammelröhrchen. Für die Immunzelltest 25 ul ausreichend. Bewerben Gaze mit Druck, um vor Ort, bis die Blutung aufhört zu punktieren.
- Flick das Blutröhrchen, um das Blut und EDTA zu mischen, um prVeranstaltung Blutgerinnung. Halten die Zeit zwischen Blutentnahme und Mischen mit dem EDTA so kurz wie möglich, um ein Gerinnen zu verhindern.
- Beim Sammeln von Blut von mehreren Ratten store EDTA-Blutproben in einem Rack bei RT bis zur Analyse. Prozess Blut innerhalb von 2 h der Sammlung.
4. Probenvorbereitung für die Immunzell-Profiling Mit dem Bead-basierte Verfahren
Anmerkung: Diese Plattform Verfahren beruht auf der Verwendung von kommerziell erhältlichen absoluten Zählrohre, die eine bekannte Anzahl von Kügelchen für jede Probe zu haben. Diese Röhren enthalten lyophilisierte Pellets, die während der Probenvorbereitung zu lösen, die Freigabe der Perlen. Die Perlen werden fluoreszenzmarkierte und durch Gating auf dem Beadpopulation können absolute Zählungen berechnet werden.
- Stellen Sie sicher, das EDTA Vollblut-Probe ist, indem sie auf eine langsame Rotationsmischer für mehrere min gut gemischt. Beschriften Sie eine absolute Zählrohr für jede Probe. Ein Pellet, das die Kügelchen sollten unter t sichtbar seiner Metallwulst Halter an der Unterseite des Rohres.
- Übertragen Sie 25 ul EDTA-Vollblut in ein beschriftetes absolute Zählrohr. Der Wulst Pellet wird nach Zugabe des Blutes zu lösen.
- Zu jedem Röhrchen werden 20 ul Anti-Ratten-T / B / Natural Killer (NK) Cocktail wurden 10 ul Anti-Ratten-CD8a PE, 10 ul anti-Ratten-CD4 (Domäne 1) FITC und 10 ul Anti-Ratten CD45 PE / Cy7 (4A). Fluorophore sind in Tabelle 1 definiert.
- Zentrifugieren Sie das Röhrchen kurz (300 × g), um sicherzustellen, dass die Antikörper und Zellen in der Unterseite des Rohres und nicht auf die Seite der Röhre stecken. Vortex mischen und Inkubation für 15 min bei RT.
- Lyse der roten Blutzellen werden 400 ul 10 mM Tris, 0,15 M Ammoniumchloridpuffer (pH 7,5) und Vortex gemischt. Lyse abgeschlossen ist, wenn die Probe wird durchlässig und nicht trübe (4B und C). Nichtbeachtung Lyse die Probe vollständig führen wird zunehmend Hintergrund und falsch erhöhten zählt bei der Analyse mittels Durchflusszytometrie.
5. Durchflusszytometrische Verarbeitung von Proben
Hinweis: Führen Sie auf einem Farb 4 Durchflusszytometer.
- Öffnen Sie die Software im Erfassungsmodus und eine neue Vorlage mit 8 Parzellen, wie in Abbildung 5 dargestellt.
- Anpassen von Geräteeinstellungen mit den in Tabelle 1 aufgelistet sind und bis Gate R1 gesetzt (FITC [FL-1] gegenüber APC [FL-4]), Abbildung 5Ai), um die fluoreszierende Kügelchen zählen. Die anderen Tore sind nicht so wichtig in dieser Erfassungsstufe wird aber für die Analyse erforderlich. Die absolute Zählung mit Beads in diesem Protokoll verwendet werden, enthalten fluoreszierende Farbstoffe und kann in jedem Kanal erkannt werden, obwohl schwächsten im Blaukanal sind.
- Mit Hilfe eines vorbereiteten Steuer Blutprobe, Wirbel und dann auf das Zytometer laden und bei niedriger Geschwindigkeit (12 & mgr; l / min) auf Setup-Modus laufen, so dass die Datenerfassung Gates eingestellt werden kann.
- Stellen Sie die Übernahme zusammeln 10.000 Veranstaltungen in der R1-Wulst Tor.
- Einen Ordner, um Daten aufzuzeichnen und setzen Dateinummer und Label Beispieldatei in Nahme-Menü eingestellt.
- Legen Sie die Probe auf die Durchflusszytometer analysiert werden und stellen Sie die Durchflussrate bis mittel (35 & mgr; l / min). Ausführung jeder Probe bei der gleichen Fließgeschwindigkeit. Die Durchflussmenge muss möglicherweise zu niedrig (12 & mgr; l / min) oder hohe (60 & mgr; l / min) variiert werden, aber im allgemeinen Medium geeignet ist. Bei diesem Tempo etwa 90 bis 120 Sekunden dauert es bis zu 10.000 Wulst Ereignisse für jede Probe zu erwerben.
- Sobald die Probe geladen beobachten Sie die Streudiagramme, um sicherzustellen, Ereignisse werden in der R1-Wulst-Gate erscheinen. Ursprünglich es kann einige Instabilität in der Probendruck verursachen Drift der Streudiagramme können. Warten auf diese zu stabilisieren.
- Einmal stabilisiert, klicken Sie erwerben und ermöglichen Probe zu laufen. Sobald das Zytometer Erwerb 10.000 Wulst Veranstaltungen in R1 beendet das Zytometer stoppt den Erwerb und speichern Sie alle Daten.
- Entfernen Sie die Probe und entsorgen fließen tusein. Das Durchflusszytometer ist nun bereit für die nächste Probe. Führen Sie alle Proben und dann den Analysemodus gehen.
6. Immune Cell Analysis
Hinweis: Gating Strategien und Boolesche Algebra werden verwendet, um jede Zellpopulation zu definieren. Boolesche Algebra ist ein Logik-Analyseverfahren, die für mehrere Operationen in einer einzigen Definition erlaubt. Die Analysesoftware des Durchflusszytometers (zB BD Cellquest) ermöglicht die Verwendung der Booleschen Algebra. Die Gleichungen werden verwendet, um aktiv für die erheblichen negativen Reaktivität, die bei der Definition der Zelle, um genauer zu identifizieren jede Zellpopulation unterstützt Konto. "Regionen" werden verwendet, um ein "Tor" zu definieren. Regionen definieren einen 2-dimensionalen Raum in der Erwägung, Tore können aus zahlreichen Regionen, die von algebraischen Operatoren verbunden zusammengesetzt sein (+, *, -, die in Tabelle 2 definiert ist).
- Schalten Sie die Software den Analysemodus. Eine Analyse Vorlage sollte erzeugt werden, um zu entsprechen Abbildung 5 mit den gezeigten Grundstücke und Tore.
- Analyse jede einzelne Datei (dh jeder einzelnen Probe) getrennt. Richten Toren R1 bis R9 und dann die Algorithmen für jeden Zelltyp festgelegt, wie in Tabelle 2 definiert ist (auch in 5 gezeigt).
- Verwenden Sie den Zellstatistikzähler, um einzelne Zellpopulationen durch Tore und Algorithmen (Tabelle 2 und Abbildung 5) definiert berechnen. Die Algorithmen werden Zellzahlen automatisch in der Zelle Statistikzähler einzustellen.
- Berechnen Zell-Untergruppen unter Verwendung der folgenden Gleichung:
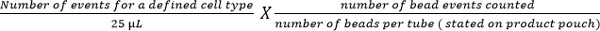
Hinweis: Die Anzahl der Zellereignisse gezählt wird (zB CD4 T-Zell-Ereignisse) wird unter Verwendung der obigen Gleichung auf die Zellzahl pro Mikroliter Blut zu geben zählt. Beispiele sind in Abbildung 5 dargestellt.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die in dieser Studie für die Erzeugung eines orthotopische Modell Pleuramesothelioms mit II-45-Zellen verwendete Verfahren resultierte in Tieren erliegen Mesotheliom auf reproduzierbare und schnelle Zeitrahmen, wobei keine Ratten sterben aufgrund der Implantationsverfahren. Titration der Anzahl der Zellen bestimmt, dass implantierte 1x 10 3 Zellen war die Mindestanzahl für eine vollständige Penetranz Modell (100% Verpflanzung) nötig. Die unterschiedliche Anzahl von Zellen in den Ratten implantiert veränd...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Papier Details eines Verfahrens zur Erzeugung eines Ratten syngenen orthotopische Modell Pleuramesothelioms und ein einfaches Verfahren zur Überwachung der Krankheitsfortschritt durch Längs Blutentnahme.
Der II-45-Modell wurde durch Aussetzen Fischer 344 Ratten, die Asbestfasern 13 entwickelt. Obwohl diese Exposition stellt die wahre Dynamik der Host-asbest Immunsystem Wechselwirkungen für Mesotheliom Pathogenese, hat es eine lange Verzögerungszeit (unter Jahre zur Erze...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
Referenzen
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten