Method Article
Ein Markierungsfreie Technik für die Raum-zeitliche Imaging von Single Cell Sekrete
In diesem Artikel
Zusammenfassung
Interzellulären Kommunikation ist wichtig für die Steuerung verschiedener physiologischer Aktivitäten innerhalb und außerhalb der Zelle. Dieser Aufsatz beschreibt ein Protokoll zum Messen der räumlich-zeitliche Art der Einzelzellsekrete. Um dies zu erreichen, ist ein multidisziplinärer Ansatz verwendet, der markierungsfreien nanoplasmonische Erfassung mit Live Cell Imaging integriert.
Zusammenfassung
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Einleitung
Interzellulären Kommunikation ist wichtig für die Regulierung von vielen physiologischen Aktivitäten innerhalb und außerhalb der Zelle. Eine Vielzahl von Proteinen und Vesikel können ausgeschieden werden, daß anschließend auslösen komplexen zellulären Prozessen wie Differenzierung, Wundheilung, Immunantwort, Migration und Proliferation. 1-5 Störungen des interzelluläre Signalwege sind bei zahlreichen Erkrankungen einschließlich Krebs, Atherosklerose in Verbindung gebracht und Diabetes, um nur einige zu nennen.
Die optimale Zellsekretion Test sollte in der Lage, räumlich und zeitlich Kartierung des sekretiertes Protein von Interesse ohne Beeinträchtigung der entsprechenden Signalwege sein. Auf diese Weise kann kausalen Beziehungen zwischen den Konzentrationsprofilen und der Reaktion der Aufnahmezellen ableiten. Leider sind viele der am häufigsten verwendeten fluoreszierenden basierende Techniken nicht diese Kriterien erfüllen. Fluoreszierende Fusionsproteine können verwendet werden, um den Analyten zu markieren, werden wnnerhalb die Zelle kann aber den sekretorischen Weg zu stören, oder sezerniert wird, ergibt sich ein diffuses Glühen außerhalb der Zelle, die schwierig zu quantifizieren ist. Fluoreszenz immunosandwich basierende Tests sind die am häufigsten verwendeten Techniken zum Erfassen der Zellabsonderungen aber typischerweise die Isolation einzelner Zellen 6-11. Darüber hinaus ist die Einführung des Fühl Antikörper typischerweise anhält oder endet, das Experiment und die Größe der Antikörper markiert, 150 kDa für IgG ist ein Hindernis für die nachgeschalteten Signal.
Wegen dieser Hindernisse ist es vorzuziehen, dass eine markerfreie Technik zur Bild Protein Sekreten und unter den bestehenden Label-freie Technologien verwendet werden, Oberflächenplasmonresonanz (SPR) und lokalisierte Oberflächenplasmonenresonanz (LSPR) Sensoren sind ausgezeichnete Kandidaten. 12-17 Diese Sensoren sind in großem Umfang für Analyt-Bindungsstudien von Proteinen, Exosomen und andere Biomarker verwendet. 18-24 Bei LSPR, das Plasmonen nanostructures können lithographisch auf Deckgläser strukturiert und aufgeregt mit sichtbarem Licht über Standard-Weitfeldmikroskopie Konfigurationen werden. Aufgrund ihrer nanoskaligen Platz, ist der Hauptteil des Glassubstrats für gemeinsame Abbildungstechniken wie Hellfeld- und Fluoreszenzmikroskopie Herstellung dieser Sonden gut für die Integration mit Lebendzell-Mikroskopie geeignet erhältlich. 25-28 Wir haben die Echtzeitmessung nachgewiesen Antikörpersekrete aus Hybridomzellen funktionalisierte Gold plasmonic Nanostrukturen mit räumlichen und zeitlichen Auflösung von 225 msec und 10 um betragen. Der grundlegende Chip-Konfiguration ist in 1 veranschaulicht. 28 die Ausgangsstrahlengang des Mikroskops zwischen einer CCD-Kamera zur Bild verwendet und ein faser optisch gekoppelten Spektrometer für die quantitative Bestimmung von fraktionale Besetzung einer gegebenen Anordnung von Nanostrukturen (Abbildung 2 aufgeteilt ).
Die Protocol in diesem Papier wird die Versuchsanordnung zur Echtzeitmessung von Einzelzellsekrete, während gleichzeitig die Kontrolle der Reaktion der Zellen unter Verwendung des Standardhellfeldmikroskopie. Der multidisziplinäre Ansatz umfasst die Herstellung von Nanostrukturen, Funktionalisierung der Nanostrukturen für die hochaffine Bindung von Analyten, Oberflächenoptimierung sowohl für die Minimierung nicht-spezifische Bindung und Charakterisierung von Geschwindigkeitskonstanten unter Verwendung eines kommerziellen Oberflächenplasmonenresonanz (SPR) Instrument, die Integration von Zelllinien auf das Substrat, und die Analyse der Bilder und Spektraldaten. Wir erwarten, dass diese Technik, um eine Technologie für die räumlich-zeitliche Zuordnung der Zellsekrete und ihrer kausalen Beziehungen mit Aufnahmezellen sein.
Protokoll
1. Nanostrukturen
- Wählen, Durchmesser 25 mm Glasdeckgläsern mit einer ungefähren Dicke von 170 (No. 1,5) & mgr; m als Substrate zur Nanofabrikation.
- Tauchen Sie die Deckgläser in Piranha-Lösung (3: 1 Verhältnis von Schwefelsäure und Wasserstoffperoxid) für mindestens 6 Stunden. Mit reichlich Reinstwasser 18,2 MOhm entionisiertes destilliertes Wasser (DDW) Waschen Sie den piranha getränkt Deckglas.
ACHTUNG: Piranha-Säure reagiert heftig mit organischen Materialien und müssen mit äußerster Vorsicht gehandhabt werden. - Beträgt 10 nm Chrom-Dünnfilm auf den Deckgläschen durch Elektronenstrahlverdampfung, um Ladungseffekte während der Strukturierung und Abbildung von Nanostrukturen zu vermeiden.
- Drehen die erste Schicht der Doppelschicht Resist, bestehend aus Ethyllactat Methylmethacrylat (MMA_EL6) -Copolymer bei 2.000 rpm für 45 sec, und dann bei 150 ° C backen. Spin der zweiten Schicht aus Poly-Methylmethacrylat (950PMMA_A2) bei 3000 Upm für 45 sec bei 180 ° C backen.
- Prasselnn die Doppelschicht Resist unter Verwendung des Elektronenstrahl-Lithographie (EBL) bei 25 kV mit einer Fläche von 300 & mgr; C-Dosis / cm 2. Entwickeln Sie in Isopropylalkohol (IPA) / Methylisobutylketon (MIBK): 2/1 und spülen in IPA.
- Ablagerung Ti (5 nm) / Au (80 nm) auf dem Substrat unter Verwendung eines E-Strahl-Verdampfer.
- Nach der Goldabscheidung, heben Sie das Copolymer-Doppelschicht zu widerstehen durch Eintauchen des Substrats in Aceton 4 Stunden.
- Überprüfen Sie das Substrat mit dem Rasterelektronenmikroskop (SEM), um Nanostruktur Form und Größe zu bestätigen, nehmen Sie das übrige Chrom aus dem Substrat über Nassätzung mit CR-7 Ätzmittel für 60 Sekunden bei Raumtemperatur und dann in DDW ausspülen.
- Entwerfen Sie ein Mitte-zu-Mitte-Array-Abstand von 33 & mgr; m, um Platz für Cell Imaging zwischen Arrays zu verlassen. Pattern die Nanostrukturen in 20 x 20 Muster für jedes Feld mit einem Abstand von 300 nm unter Verwendung eines E-Strahl-Schriftsteller. Jeder Chip enthält 300 Arrays mit einer typischen Nanostrukturdimension von 80 ± 2,5 nm Höhe und 70 ± 2,5 nm Durchter.
- Inspizieren eine Untermenge von Anordnungen unter Verwendung des Atomkraftmikroskops (AFM) zur Überprüfung der Größe und Gleichförmigkeit.
- Bringen Sie einen Stützring, in der Regel Silizium, auf der Rückseite des Deckglases mit einem UV-härtenden Epoxy.
2. Chip Reinigung und Anwendung von selbstorganisierten Monoschicht
- Zum Reinigen und Regenerieren der Chips, Plasma Asche bei einer Leistung von 40 W in einem 300 mTorr Gemisch aus 5% Wasserstoff, 95% Argon für 45 sec nach dem Reinigen der Kammer für 5 min unter den gleichen Bedingungen.
- Funktionalisieren die Gold-Nanostrukturen unmittelbar nach Plasmaveraschung durch Eintauchen des Chips in einem Zweikomponenten-ethanolische Thiollösung bestehend aus einem 3: 1-Verhältnis von SH- (CH 2) 8 -EG 3 -OH (SPO) und eine Komponente mit entweder einem Amin oder carboxylfunktionelle Gruppe, nämlich SH- (CH 2) 11 -EG 3 -NH 2 (SPN) oder SH- (CH 2) 11 -EG 3 -COOH (SPC).
- Verlassen Sie die Chip-in die Thiollösung O / N, um eine selbstorganisierte Monoschicht (SAM) zu bilden.
- Spülen Sie den Chip mit Ethanol und mit Stickstoffgas trocken.
- Falls erforderlich, speichern Sie die funktionalisierten Chip für bis zu 2 Wochen bei 4 ° C.
- Wenn Sie bereit sind für den Einsatz reagieren die SPN oder SPC-Komponente mit dem Liganden unter Verwendung einer Chemie in Abhängigkeit von der Ligand der Wahl (siehe unten).
Anmerkung: Die Chips können regeneriert und re-funktionalisierten Dutzende Male. Eine gegebene Chip kann für Zeiträume, die von 6 Monaten bis zu einem Jahr reichen eingesetzt werden. Die Spektren, gemessen an einem bestimmten Array werden zuverlässig nach wiederholten Regenerationen durch Plasmaveraschung, gefolgt von Biofunktionalisierung wiedergegeben. 29
3. Oberflächenfunktionalisierung und kinetische Charakterisierung
Hinweis: Mit der funktionalisierten Chip in das Handels SPR Instrument, um die Geschwindigkeitskonstanten zwischen dem Liganden und dem Analyten zu charakterisieren, als auch um den Widerstand der SAM, um unspezifische b studiereninding. Es gibt eine Vielzahl von Durchflussraten und mikrofluidischen Designs, die für eine effiziente Oberflächenfunktionalisierung ermöglichen. Da haben wir einen im Handel erhältlichen SPR wir standardisiert um seine empfohlene Durchflussmengen. Wir stellen fest, dass diese Flussraten sind typisch für alle SPR Instrumente und so sind nicht einschränkend. Die SPR-Gerät ist nicht notwendig, da alle Funktionalisierung kann direkt auf der LSPR-Chip durchgeführt werden, aber es hat zu reduzieren unsere Arbeitsbelastung, weil es ein Multiplex-Instrument ist, während unsere LSPR Mikrofluidik-Setup nicht.
- Funktionalisieren Kommerzielle blanken Goldchip mit dem SAM wie in Abschnitt 2 beschrieben.
- Bei Verwendung eines SPC anhand SAM Aktivieren der Carboxylgruppe mit einem 1: 1-Mischung aus 133 mM 1-Ethyl-3- (3-dimethylaminopropyl) carbodiimid (EDC) und 33 mM N-Hydroxysuccinimid (NHS) in DDW 10 Minute
- Konjugieren des aktivierten Carboxylgruppe mit dem Antikörper / Liganden von Interesse für 300 Sekunden mit einer Fließgeschwindigkeit von 30 ul / min. Bereiten Sie die Liganden inpH 6 Phosphatpuffer, typischerweise, aber dies kann in Abhängigkeit von dem Molekül variieren.
- Nach der Liga Konjugation, fließen 0,1 M Ethanolamin in phosphatgepufferter Salzlösung (PBS) als ein Desaktivator für den Schritt 300 sec mit einer Rate von 30 ul / min. Ethanol hilft bei der Minimierung der nicht-spezifischen Bindung.
- Präsentieren den interessierenden Analyten mit einer Fließgeschwindigkeit von 100 ml / min mit einem Bereich von Konzentrationen und berechnen Sie die Geschwindigkeitskonstanten mit einer kinetischen Analyse-Software.
- Wenn nicht-spezifische Bindung ist problematisch, erhöhen das Verhältnis der SPO zu SPC oder SPN.
4. LSPR Allgemeine Einstellungen
- Mikroskopeinstellungen:
- Verwenden Sie ein 100-W-Halogenlampe zu Koehler beleuchten die Probe. Verwenden Sie einen Langpassfilter (typischerweise 593 nm cutoff) in den Strahlengang, um Wellenlängen, die nicht auf die Resonanzverschiebung (Abbildung 2) beitragen, zu eliminieren.
- Für die LSPRi Datensammlung, verwenden Sie ein inverses Mikroskop mit einem 40x Öl Immersion Ziel (1,4 NA) und einem thermoelektrisch gekühlten 16-Bit-CCD-Kamera.
- Legen Sie einen Strahlteiler am Ausgang des Mikroskops zu Imagery und Spektren gleichzeitig zu erhalten.
- Stellen Sie die Temperatur gesteuert Mikroskoptisch bis 37 ° C ins Gleichgewicht für 4 Stunden.
- Beinhalten eine zusätzliche Inkubation Anordnung auf dem Mikroskop, um die CO 2 -Konzentration und der Feuchtigkeit auf 5% bzw. 95% zu regeln.
- Chip-Herstellung und Montage:
- Funktionalisierung der LSPR-Chip, wie in Abschnitt 2 mit den optimalen Zweikomponenten-SAM-Verhältnisse aus den SPR-Experimente bestimmt beschrieben.
- Laden Sie den Chip in einem maßgeschneiderten mikrofluidischen Halter wie folgt. Platzieren Sie den Chip auf einer Aluminiumunterteil. Sandwich den Chip zwischen diesem Unterteil und einem Silikondichtung und einem durchsichtigen Kunststoff-Oberteil. Verwenden Sie 4 Schrauben, um die Montage zu klemmen.
- Für eine typische SPC-basierte Anwendung Thiol, Tropfenlack 300 ul einer 1: 1-Mixtur von 133 mM EDC und 33 mM NHS in DDW die Carboxylgruppen des SPC Thiolkomponente zu aktivieren.
- Warten Sie 10 min und die Oberfläche mit 10 mM PBS Hand spülen.
- Konjugieren des aktivierten Carboxylgruppe mit dem Liganden (üblicherweise ein Antikörper oder Antikörper-Fragment) von Interesse durch Tropfbeschichtung 300 ul Ligandenlösung.
- Warten Sie 30 Minuten und von Hand mit 10 mM PBS spülen.
- Drop Mantel 300 ul 0,1 M Ethanolamin in PBS auf dem Chip nicht-spezifische Bindung zu minimieren. 10 Minuten warten.
- Mit PBS, enthaltend 0,005% Tween 20 (PBS-T20), waschen Ethanolamin.
- Legen Sie ein Quarzstück oberhalb des Chips, um Schwankungen in den Daten zu einem Wechsel Meniskus Verwandte reduzieren.
- Halten Sie die Chip-nass mit PBS-T20-Puffer, während die Montage auf Mikroskop.
- Setzen Sie den LSPR Chip-Montage fest in den beheizten Bühne Probenhalter und befestigen mikrofluidischen Schläuche.
- Befestigen Sie den Schlauch an die Mikrofluidik Montage und Strömungs buffer (oder serumfreie Medien für Zellstudien), bis ein Gleichgewichtszustand erreicht ist.
- Ermöglichen die Montage und Mikroskops, für mindestens 2 Stunden äquilibrieren.
- Ausrichten der Chips mittels Joystick so dass der Zentralanordnung mit dem Lichtleiter zur Spektroskopie ausgerichtet sind. Spektroskopiedaten unter Verwendung eines Spektrometers und Spektralanalyse Software übernommen.
- Halten Sie Arrays im Fokus während des gesamten Experiments unter Verwendung von Software-Autofokus, Zeiss Definite Focus oder gleichwertige Autofokuseinrichtung.
5. LSPR Imaging von Anti-c-myc Sekrete aus 9E10 Hybridomzellen
Anmerkung: Die Hybridomzellinie für diese Studie verwendete Ausdruck anti-c-myc-Antikörper konstitutiv und daher keine chemische Auslöser erfordern
- Funktionalisieren der Nanostrukturen mit c-myc-Peptid. Dies hat einen K D -Wert von 1,77 nM für die Anti-c-myc-Antikörper, die von Klon 9E10 Hybridom-Zellen sezerniert.
- Kultur die Hybridomzellen in complete Wachstumsmedium mit 10% fötalem Rinderserum (FBS) und 1% Antibiotikum in einem T75-Kolben bei 37 ° C unter 5% CO 2. Aufrechterhaltung einer Zelldichte von 4 × 10 5 Zellen / ml.
- Für die Zellsekretion Studien Pellet Zellen von der T75-Flasche durch Zentrifugation, wasche zweimal mit RPMI-1640-serumfreiem Medium (SFM), um die sekretierten Antikörper zu entfernen, und Einstellen der Zelldichte auf 4 x 10 6 Zellen / ml.
- Ernten Sie die Zellen und Test für die Lebensfähigkeit vor der Einführung sie an die LSPR-Chips.
- Einzuführen 50 ul der Zelllösung von Hand auf den LSPR Chips mit einer Mikropipette. Nach wenigen Minuten 25 bis 50 Zellen haften an der Oberfläche der LSPR Chips.
- Wegwaschen die restlichen Zellen in Lösung mit frischem SFM mit dem mikrofluidischen Perfusionssystem.
- Wählen Sie die LSPR-Arrays für die Bildgebung, die in der Nähe sind, innerhalb von 10 & mgr; m, aber nicht mit den Zellen überlappen.
- Um sicherzustellen, dass das Signal spezifisch auf die sekretierten anti-c-myc ANTIB istodies Einführung der Zellkulturmedien mit und ohne die vorliegende Antikörpern sowie mit den Antikörpern, aber mit ihren Bindungsstellen durch die Anwesenheit einer sättigenden Konzentration von c-myc-Peptid in der Lösung blockiert.
- Kalibrieren der Sensoren am Ende jedes Durchlaufs mit einer sättigenden Lösung von anti-c-myc-Antikörper (250 nM). Dies hilft bei der Normierung der Antwort der Sensoren und bestimmen fraktionale Besetzung bezogen auf die Biofunktionalisierung Profil von jedem Lauf.
- Korrektur der Drift in der X- und Y-Richtung unter Verwendung der Bildausrichtung Software.
Ergebnisse
In einem typischen Live Zellsekretion Studie gibt es mehrere Betriebsarten der Datensammlung stattfindet, Fig. 3 zeigt eine Überlagerung von einer LSPRi Bild, das die quadratische Anordnungen herausstellt, und ein übertragenes Lichtbild belichtet, die die Zelle an der linken unteren hervorhebt. Daten werden typischerweise über eine 3-Stunden-Periode, gefolgt von der Einführung einer sättigenden Lösung des Analyten für den unten beschriebenen Normalisierungsberechnung gesammelt. Fluoreszenzbilder können auch durch das automatische Schalten eines Filterwürfel in die Datensammelroutine integriert werden. In Figur 4 eine Zelle mit dem fluoreszierenden Membranfarbstoff Rhodamin DHPE gefärbten aufweist Lamellipodia artigen Verlängerungen (Pfeile). Wenn solche Erweiterungen sollten mit den Arrays überlappen sie ein falsch-positiv für Protein-Sekretion geben würde. Nachdem mehrere Modi der Bildsprache kann dazu beitragen, solche Vorkommnisse.
Figur 5 zeigt Spektrometrie Daten vor und achterner die Einführung einer sättigenden Lösung (400 nM) von kommerziell erworben anti-c-myc-Antikörper gegen den c-myc-funktionalisierten Arrays. Es wurden keine Zellen in diesem Versuch vor. Das Spektrum zeigt sowohl eine Rotverschiebung und eine Zunahme der Intensität. Die Differenz der Flächen unter den beiden Kurven führt zu einem Anstieg in der Anordnung der Bildintensität in LSPRi Modus auf der CCD-Kamera. Eine nichtlineare Kleinste-Quadrate-Datenanalyseansatz wurde entwickelt, um fraktionale Besetzung der Oberfläche gebundenen Liganden aus der Spektren herzuleiten. 30,31
Am Ende des Experiments wurden die gesättigten Intensitätswerte (dh fraktionale Besetzung ≈ 1) verwendet werden, um eine normierte Antwort für jedes Feld unter Verwendung der folgenden Formel berechnet:
Wo sind die normierte Intensität zum Zeitpunkt t, Anfangsintensität zu Beginn des Versuchs, endgültige gesättigte Intensität und gemessene Intensität des Arrays zum Zeitpunkt t sind.
Normalisierte Werte von zwei Anordnungen sind in Fig. 6 gezeigt ist eine Anordnung innerhalb von 10 & mgr; m der Zelle in Untersuchung während der andere, als Kontrolle verwendet wurde, war ein Abstand von 130 um aus der Zelle. Der plötzliche Anstieg der normalisierten Antwort der Anordnung am nächsten an der Zelle relativ zu dem flachen Verlauf der Steueranordnung ist ein Hinweis auf eine lokalisierte Explosion der sekretierten Antikörper.
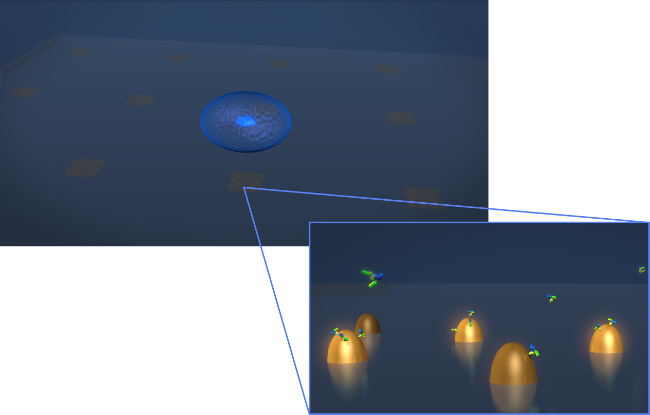
Abbildung 1. Sensor-Design. Eine Zeichnung, die die Geometrie eines typischen Live-Cell-Sekretion Experiments. Die Zelle (blau Sphäroid) wird an den LSPR-Chip, der Arrays von biofunktionalisierten Gold-Nanostrukturen enthält, abgeschieden. In der vergrößerten Ansicht der Zelle Sekretion von Interesse, in diesem wie Y-förmige Moleküle gezeigten Fall Antikörper, wird gemessen, wie sie an die Oberfläche bindender funktionalisierten Nanostrukturen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
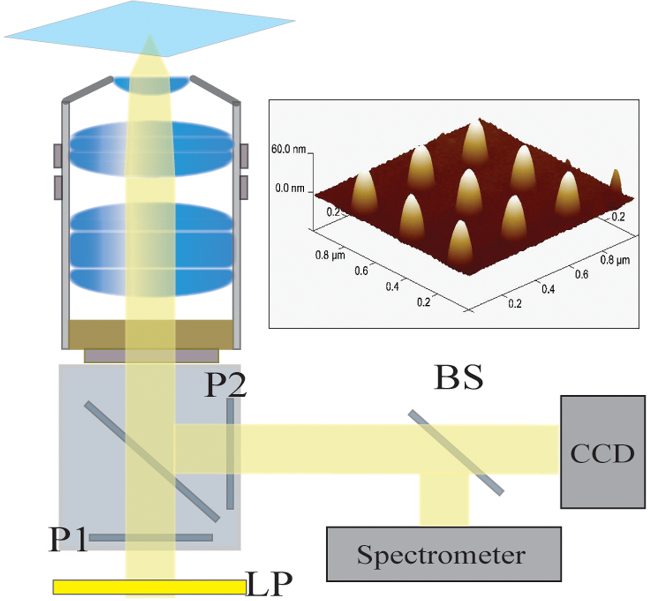
Abbildung 2. Optical-Setup. Das beleuchtete Licht aus einer Halogenlampe wird zunächst durch einen Langpassfilter (LP) filtriert. Das Licht wird linear polarisiert (P1) und beleuchtet die Probe über ein 40X / 1,4 NA-Objektiv. Das gestreute Licht wird durch das Objektiv durch einen gekreuzten Polarisator (P2) gesammelt und weitergeleitet. Eine 50/50 Strahlteiler (BS) in den gesammelten Lichtpfad zum gleichzeitigen spektroskopischen und Bildanalyse eingesetzt. Oben rechts:. Ein Rasterkraftmikroskopie Bild von 9 individuellen Nanostrukturen mit einem Abstand von 300 nm abgetrennt Bitte klicken Sie hierum eine größere Version dieser Figur zu sehen.
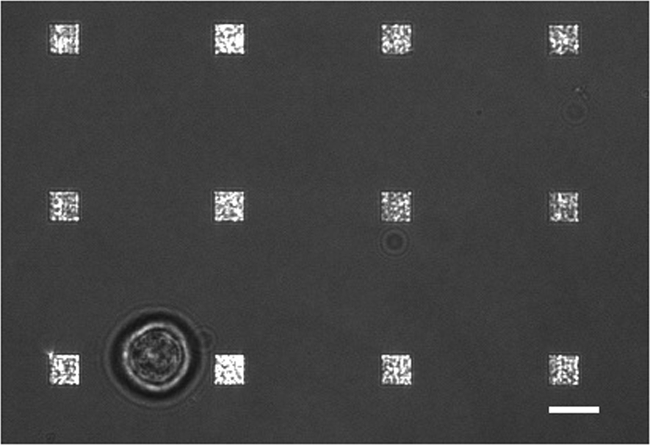
Abbildung 3. Live Cell LSPRi Study. A verschmolzen Durchlicht und LSPRi Bild, das einen einzigen Hybridomzelllinie (unten links) um 12 Arrays umgeben. Dies ist eine kontrastverstärkten Bild. Maßstabsbalken ist 10 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
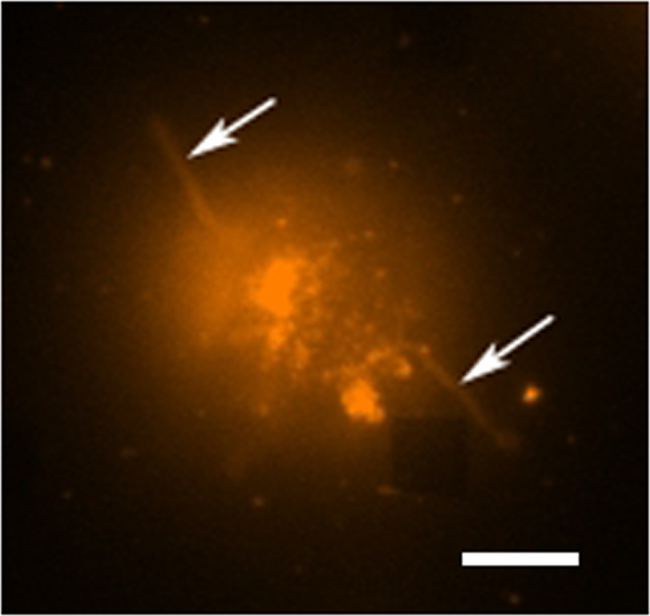
Abbildung 4. Live Cell Fluorescence Studie. Eine Leuchtstofffalschfarbenbild eines einzelnen Hybridomzelllinie mit Rhodamin DHPE, die eine Membran-Farbstoff angefärbt. In Fluoreszenz-Imaging-Modus die Arrays sind im Allgemeinen nicht sichtbar ist, ist jedoch ein in der Nähe Array hier beobachten, wie abfehlt Quadrat in der rechten unteren Ecke. Die Zelle kann gesehen werden, aus dem Array obwohl tentakelartige Verlängerungen (möglicherweise Filopodien oder Lamellipodia) nach außen von den Zellen (Pfeile), die sich trennen. Maßstabsbalken ist 10 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
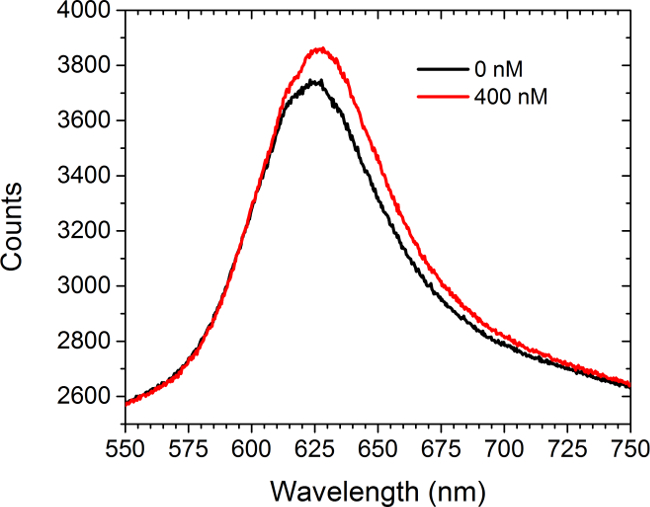
Figur 5. Spectral Modalität. Die von einem c-myc-funktionalisierten Array vor und nach der Einführung von 400 nM Lösung von anti-c-myc-Antikörper erhaltenen Spektren. Keine Zellen in dieser Studie vor. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 6. Single Cell-Sekretion. Die Antwort eines Arrays innerhalb von 15 & mgr; m aus einer einzigen Zelle und eines sich 130 & mgr; m entfernt (Kontrolle) entfernt. Maßstabsbalken ist 10 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Offenlegungen
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Danksagungen
The authors have nothing to disclose.
Materialien
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
Referenzen
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten