Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Stabile und effiziente genetische Veränderung von Zellen in der erwachsenen Maus V-SVZ für die Analyse von Neural Stem Cell Autonome und Nicht autonome Effekte
In diesem Artikel
Zusammenfassung
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
Zusammenfassung
Relativ ruhig unterstützen somatische Stammzellen lebenslang die Zellerneuerung in den meisten adulten Geweben. Neurale Stammzellen im erwachsenen Gehirn von Säugetieren sind zwei spezifische neurogenen Nischen eingeschränkt: die Subgranularzone des Gyrus dentatus des Hippocampus und der ventrikulären-Subventrikularzone; in den Wänden der seitlichen (V-SVZ auch subependymale Zone oder SEZ bezeichnet) Ventrikel. Die Entwicklung von In-vivo-Gentransfer-Strategien für die adulte Stammzellpopulationen (dh diejenigen des Säugetiergehirns), die sich in langfristige Expression des gewünschten Transgene in den Stammzellen und deren abgeleiteten Nachkommen ist ein wichtiges Instrument in der aktuellen biomedizinischen und biotechnologischen Forschung. Hier wird eine direkte in vivo-Verfahren für die stabile genetische Veränderung von erwachsenen Maus V-SVZ Zellen präsentiert, die den Vorteil des Zellzyklus-unabhängig Infektion durch LVs und dem hoch spezialisierte Zellarchitektur des V-SVZ Nische findet. Insbesondere beinhalten die aktuelle Protokolls die Injektion von Leer LVs (Kontrolle) oder LVs kodiert bestimmten Transgen-Expressionskassetten entweder in die V-SVZ selbst, für den in-vivo-Targeting von allen Arten von Zellen in der Nische oder in die lateralen Ventrikel Lumen zum Targeting von ependymalen Zellen, die nur. Expressionskassetten werden dann in das Genom der transduzierten Zellen und fluoreszierende Proteine integriert, die ebenfalls von dem LVs kodiert, erlauben die Detektion der transduzierten Zellen für die Analyse der Zelle autonom und nicht autonomen, Nische abhängige Effekte in den markierten Zellen und ihre Nachkommen.
Einleitung
Die Maus-ventrikulären-Subventrikularzone (V-SVZ), in den Wänden des lateralen Ventrikel des Striatum zugewandt ist, ist eine sehr aktive Keimbereich, in dem ein kontinuierlicher Prozess der Vorläuferzellreplikation und Differenzierung ergibt sich die anhaltende Produktion von Riechkolben (OB ) Inter und Corpus callosum Oligodendrozyten 1. Die lebenslange Erzeugung dieser Zellen wird durch die Anwesenheit in diesem Bereich von neuralen Stammzellen (NSC; auch als B1-Zellen) unterstützt werden, die die astrozytären Antigen glial fibrillary acidic protein (GFAP) und Stammzellmarker wie Nestin, Id1 auszudrücken und Sox2 2. GFAP-exprimierenden B1 Zellen erzeugen Transit Verstärken Vorläufer (TAP) Zellen (C-Zellen), die die Transkription DLX2 auszudrücken Faktoren (distal losen homeobox 2) und ASCL1 (mammalian Achaete-Schute homolog 1) und schnell zu einem mehrmals teilen, bevor sie Anlaß geben zu migrieren Neuroblasten (A-Zellen) oder oligodendroblasts 3. Neu generierten prolifoperativen Neuroblasten Migration nach vorn, die rostralen Migrationsstrom (RMS) an den OB bildet, wo sie in dem körnigen und glomeruläre Schichten wie differenziert inhibitorischen Inter integrieren. Migrieren von jungen oligodendroblasts zur CC bewegen, wo sie unreif NG2-positive Zellen werden, die lokal oder differenzieren zu reifen myelinisierenden Oligodendrozyten 1,4 weiter zu unterteilen.
B1-Zellen, die aus fötalen radialen Gliazellen ableiten, behalten die langgestreckte und polarisierte Morphologie ihrer Vorgänger und weisen eine hoch spezialisierte Beziehung zu ihrer Nische. Sie erstrecken sich zwischen dem Ependyms welche Linien der Herzkammer und dem Netzwerk von Blutgefäßen, die die V-SVZ Nische bewässern. Die kleine apikale Prozess der B1-Zellen lagert sich unter multiciliated ependymocytes und endet in einem unbeweglichen primären Zilien, während ihre basalen Prozess lange Strecken erweitert die planare Gefäßplexus zu nähern, die diese Nische Ende in der b bewässertasal Lamina des Plexus Kapillaren 2,5-8.
Der zuverlässigste Weg B1-NSC aus nicht-neurogenen Astrozyten, die auch GFAP +, in der intakten V-SVZ Nische zu unterscheiden, basiert auf ganze Montage Zubereitungen der Ventrikel Seitenwand und deren Analyse durch 3-D konfokale Mikroskopie nach für GFAP Immunfärbung des dünnen B1-NSC apikalen Verfahren, β-Catenin zu beschriften Zellmembranen abzugrenzen, und entweder γ-Tubulin als Marker für cilial Basalkörpern oder acetyliertes α-Tubulin die Ausdehnung jeder cilium 5,8 zu beschriften. Beobachtungen dieser Ganz Halterungen von der ventrikulären Oberfläche haben gezeigt, dass B1 und Ependymzellen in "pinwheels" 5 angeordnet sind, in denen die uniciliated apikale Prozesse eines oder mehrerer GFAP + B1-Zellen von einer Rosette aus multiciliated Ependymzellen umgeben sind.
Die charakteristische Morphologie von B1-Zellen korreliert mit experimentellen Beweis iRückenmarksflüssigkeit (CSF) bilden geregelt Quellen von löslichen Signale ndicating die Blutgefäße / Endothelzellen und ventrikuläre auf NSCs wirkenden 2,6,9-11. An der ventrikulären Oberfläche, homotypische und hetero apikal-lateralen Wechselwirkungen zwischen ependymal und B1-Zellen gehören tight junctions und Adhärenzverbindungen 5,12. Außerdem impliziert Adhäsionsmolekülen in den junctional Komplexen zwischen B1 und Ependymzellen, wie N-Cadherin und V-CAM, wurden in der V-SVZ Nische, sondern auch ihre Ruhe 12 die hoch organisierten Positionierung von B1 nicht nur gezeigt, zu regulieren , 13. Die ependymalen-B1 Zellmonoschicht erscheint als eine Diffusionsbarriere zu wirken, um den geregelten Fluss von Wasser und kleinen Molekülen aus der CSF erlaubt, aber den Durchgang von großen interzellulären Proteinen 10,11 einzuschränken. Experimentelle Daten zeigen, dass die einzigartig positioniert, B1 Zelle apikal Zilien eine Rolle als Sensor von Signalisierungs Polypeptide 2 in der CSF spielen könnte,7.5. Ependymzellen sind an sich auch eine Quelle von löslichen und membrangebundenen Signale mit einer Rolle bei der Regulation von NSC Verhalten 14,15.
Rückverfolgbar Nucleoside, wie Brom-desoxyuridin (BrdU) oder Retroviren sind weit zu beschriften Vorläuferzellen, einschließlich NSC, in vivo verwendet. Jedoch sind diese Methoden nicht optimal für die Rückverfolgung langfristige Schicksal weil BrdU Signale durch wiederholte Zellteilungen und Retroviren verdünnen erscheinen vorzugsweise vorübergehend an Zielzellen aufgrund ihrer Erfordernis der Zellproliferation zur Transduktion 16,17 verstärken. NSC Physiologie in vivo, auch der Wechselwirkungen mit Nischen Komponenten zu untersuchen, ist es entscheidend, ein Verfahren zu etablieren selten teilende Zellen zu kennzeichnen und Spuren, als B1-NSCs weitgehend ruhig sind und deren Nachbar Ependymzellen nie 3 unter physiologischen Bedingungen unterteilen. Hier zeigen wir, dass lentivirale Vektoren (LVs) ermöglichen eine hocheffiziente Gen ZeichenIng und langfristige Änderung der Erwachsenen NSC und nicht teil Ependymzellen aufgrund meisten angemessen ihrer Fähigkeit zu transduzieren und in das Genom der Zielzellen in einer Zellzyklus-unabhängigen Weise zu integrieren. Darüber hinaus zeigen wir, wie die Route der Lieferung und virale Titer Hilfe speziell Ependymzellen transduzieren, aber nicht B1-Zellen wodurch die Analyse der Nische abhängig, ependymal Auswirkungen auf NSCs.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Ethikerklärung: Dieses Protokoll folgt die Tierpflege-Richtlinien von der Universität von Valencia in Übereinstimmung mit den europäischen Richtlinie 2010/63 / EU.
1. Erzeugung von LV für In-vivo-Studien-Kennzeichnung (siehe 1A)
ACHTUNG: Die hier beschriebene Verfahrensweise ist Biosicherheitsstufe 2, also alle die folgenden Verfahren in einem Biohazard Haube zuführen. Stellen Sie sicher, dass die Mitarbeiter in der Forschung entsprechend qualifiziert sind und in allen Verfahren geschult. Persönliche Schutzausrüstung tragen, einschließlich Kleid, Doppelhandschuhe und geeignete Schutzbrille. Schließlich dekontaminieren gründlich alle Werkzeuge und Oberflächen, die in Kontakt mit Viren nach zugelassenen Einrichtung Desinfektion Praktiken gewesen sein könnte (nach mit 70% Ethanol, 10% Bleichmittel und / oder Autoklavieren Abwischen).
- Die Produktion der LV in menschliche embryonale Nierenzellen 293T
- Starten Sie dieses Protokoll durch die Vorbereitung reine DNA für die Transfektion. Vorbereiten und reinigen jedes Plasmid durch doppelte CsCl gradient Zentrifugation oder andere im Handel erhältliche Säulenverfahren Endotoxin-freie DNA ergibt. In diesem Protokoll haben wir den Transfer-Vektor-Plasmid pRRL-SIN-PPT.PGK.EGFP.Wpre verwendet. Empfohlen Kern Verpackung Plasmide sind pMDLg / pRRE und pRSV.REV und Umschlag Plasmid pMD2G 13,18,19.
- Vierundzwanzig Stunden vor der Transfektion Platte 5 x 10 6 293T-Zellen in Iscove modifiziertem Dulbecco-Medium (IMDM) in einem 10 cm Kunststoffschale, um eine etwa 1/4 bis 1/3 konfluente Kultur (Tabelle der Materialien sehen) zu erhalten für Transfektion. Bei 37 ° C inkubieren in einem befeuchteten Inkubator in einer Atmosphäre von 5-7% CO 2.
- Ersetzen Sie das Medium mit frischem Medium 2 Stunden vor der Transfektion.
- In einem sterilen 1,5 ml Mikrozentrifugenröhrchen Mischung 10 & mgr; g Plasmid-Transfervektor (der cDNA des Transgens oder shRNA enthält geliefert werden) mit 2,5 ug des pRSV.REV und 5 ug der pMDLg / pRRE Verpackungs Plasmide und 3,5 & #181; g des Umschlags Plasmid pMD2G. Make-up, die das Plasmid-Lösung auf ein Gesamtvolumen von 450 ul mit 0,1 x TE-Puffer (siehe Tabelle der Materialien) / dH 2 0 (2: 1). Dann fügen Sie 50 ul 2,5 M CaCl 2.
- Bilden den Niederschlag durch tropfenweise Zugabe von 500 ul des 2x HEPES-gepufferte Saline (HBS, siehe Tabelle of Materials) Lösung für das 500 & mgr; l DNA-TE-CaCl 2 -Mischung, während bei voller Geschwindigkeit Vortexen.
- In den Niederschlag zu den 293T-Zellen sofort. Vorsichtig schwenken die Platte zu mischen. Bringen Sie die Zellen in den Inkubator und ändern Sie das Medium 14-16 Stunden nach der Transfektion.
- Sammeln Sie die Zellüberständen 30 Stunden nach den Medienwechsel. Filtern Überstand durch ein 0,22 um Porennitrocellulosefilter und fahren Sie mit Konzentration.
- Die Konzentration von LVs
- Konzentriere das konditionierte Medium durch Ultrazentrifugation bei 50.000 · g (19.000 rpm mit SW-28-Ultrazentrifuge Rotor) für 2h bei Raumtemperatur (RT) in einem 30 ml Polypropylen transparent konischen Rotor Röhre.
Hinweis: Verwenden Sie Ultrazentrifuge Adapter für konische Rotor Rohre (siehe Tabelle der Materialien). - Verwerfen des Überstandes durch Dekantieren und Resuspendieren der Pellets in einem kleinen Volumen (200 & mgr; l oder weniger, wenn nur eine Zentrifugation durchgeführt wird) Phosphatpuffer-Salzlösung (PBS, siehe Table of Materials). Dann Pipette auf und ab etwa 20-mal.
- Pool der Suspensionen und konzentrieren sich wieder durch Ultrazentrifugation, auch bei 50.000 x g (23.000 rpm mit SW-55-Ultrazentrifuge Rotor) für 2 Stunden bei Raumtemperatur. Verwenden Polypropylen transparent Rotorrohre mit einem Nennvolumen von 5 ml (siehe Tabelle der Materialien).
- Das endgültige Pellet resuspendieren in einem sehr kleinen Volumen (1/500 oder 1 / 1.000 des Ausgangs Volumen des Mediums) steriler PBS und Schütteln auf einem rotierenden Rad für 1 h bei RT. Geteilt in kleinen Portionen (5-20 ul) und fReeze sie bei -80 ° C.
- Behandeln Sie alle Leerrohre mit 10% Bleichmittel vor der Entsorgung.
- Konzentriere das konditionierte Medium durch Ultrazentrifugation bei 50.000 · g (19.000 rpm mit SW-28-Ultrazentrifuge Rotor) für 2h bei Raumtemperatur (RT) in einem 30 ml Polypropylen transparent konischen Rotor Röhre.
- Lentivirale Titration unter Verwendung von Durchflusszytometrie
- Am Tag zuvor Platte 5 x 10 4 HeLa-Zellen pro Well in 6-Well-Gewebekulturplatten in 2 ml Dulbecco-modifiziertem Eagle-Medium (DMEM) (siehe Tabelle der Materialien). Bei 37 ° C inkubieren in einem befeuchteten Inkubator in einer Atmosphäre von 5-7% CO 2 für 24 Std.
- Am Tag der Titration eines Aliquots der Virusstamm auftauen und Verdünnungsreihen vorbereiten, von 10 -3 bis 10 -8, in DMEM.
- Um dies zu tun, nehmen Sie eine 24-Well-Platte und 2 ml DMEM in die erste Vertiefung und 1,8 ml auf die folgenden Mulden. Dann fügen Sie in die erste Vertiefung 2 ul der konzentrierten Virusstamm (bis zu einer endgültigen Verdünnung von 1: 1000 oder 10 -3).
- Nach dem Pipettieren mehrmals gründlich die Lösung, ändern Spitze zu mischen und 200 ul der 10 -3 Verdünnung übertragenauf der zweiten Wanne. Wiederholen Sie den Vorgang in Serie in den folgenden Brunnen, bis die 10 -8 Verdünnung hergestellt wird.
- Nehmen HeLa-Zellen am Vortag aus dem Inkubator überzogen. Entfernen Sie vorsichtig Medium aus Brunnen. 1 ml jeder Virusverdünnung zusammen mit 1 & mgr; l von 8 mg / ml Hexadimethrinbromid den HeLa Zellen enthaltenden Vertiefungen. Vorsichtig schwenken die Platte zu mischen.
Anmerkung: Hexadimethrinbromid zugegeben, um die Virusadsorption an den Zellen in der Kultur zu erhöhen. - Bringen Sie die Zellen in den Inkubator und erlauben die Infektion für 72 h ablaufen. Danach wird das Medium zu entfernen, um die Zellen einmal mit PBS waschen und 200 ul Trypsin-EDTA in den jeweils gut (Tabelle der Materialien sehen).
- Nach 5 min bei 37 ° C, 2 ml PBS in jede Vertiefung und Ernte Zellen in der Durchflusszytometrie Rohre.
- Zentrifuge bei 300 x g für 5 min bei RT und Absaugen des Überstandes.
- Das Pellet mit 1 ml Befestigungs solutiauf (1% Formaldehyd Elektronenmikroskopie Grad und 2% fötalem Rinderserum in PBS), dann die Rohre vortexen.
- Analysieren der Zellen in einem Durchflußzytometer eine 488 nm Argon-ionlaser bei 15 mW Leistung verwendet wird.
- Stellen Sie das Gerät mit der Standardkonfiguration: Vorwärtsstreu (FS), Seitenstreuung (SS) und Fluoreszenz für GFP (525/40 nm). Markieren Sie die Zelle Bevölkerung Gating in einem FS vs. SS Punktauftragung auszuschließen Zellaggregate und Schutt. Sammeln Fluoreszenz in logarithmischen Skala. Berechnen der Anzahl der GFP + -Zellen in jeder Probe.
- Berechnen Vektor-Titer unter Verwendung der folgenden Formel:% GFP + / 100 x Anzahl der Zellen infiziert x Verdünnungsfaktor (DF) = transduzierenden Einheiten (TU) / ml.
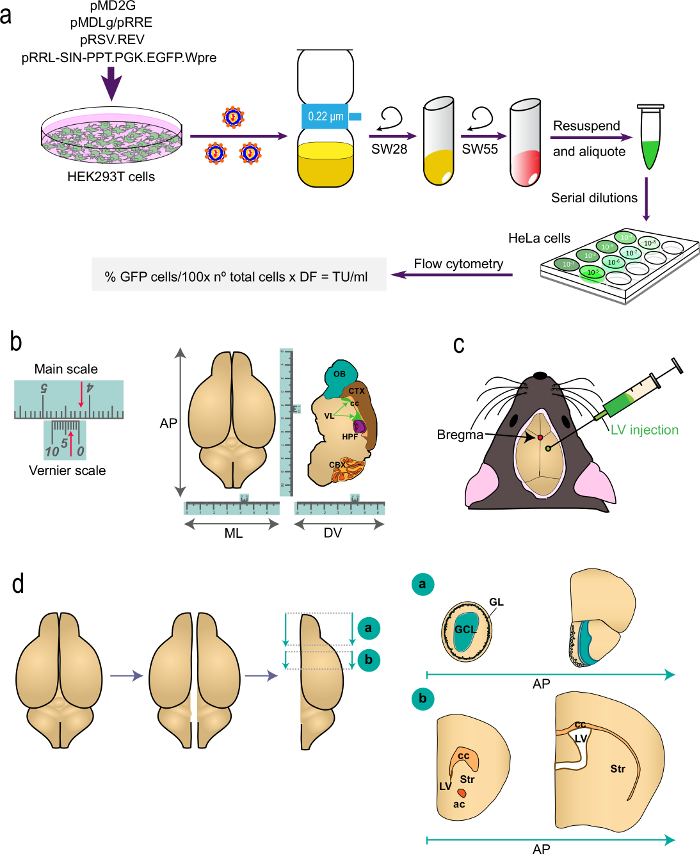
Abbildung 1: Schematische Darstellung der verschiedenen Teile des Verfahrens (a) Teil 1 von t.er Protokoll: Erzeugung von LVs für in vivo Markierungsstudien von der Transfektion von HEK293T-Zellen mit geeigneten Plasmiden, die LVs zur Bestimmung des Virustiters durch Durchflusszytometrie unter Verwendung der angegebenen Formel zu erzeugen. Die Namen der Plasmide und der Zentrifugenrotoren sind angegeben. (B und c) Teil 2 des Protokolls: stereotaktische Injektion von LVs. "B" zeigt ein Beispiel für eine Vernier-Skala, ein Gerät, das Teil des stereotaktischen Instrumente und dient zur Feinmessungen. Als Beispiel zeigen die Pfeile 4,23 cm. Ein Nonius wird verwendet, um die Koordinaten in der von vorne nach hinten (AP), mediolaterale (ML) und dorsoventrale (DV) Achse wie gezeigt für eine Draufsicht (links) und nach einem Sagittalschnitt zu bestimmen (rechts ) des Gehirns. "C" zeigt die Position des Bregma als Schnittpunkt zwischen den sagittalen und koronalen Naht. LVs werden unter Verwendung einer Spritze eingespritzt. (D) Schematische Zeichnung zeigt, wie das Gehirn is für die Analyse aufbereitet. Die beiden Hemisphären aufgeteilt und jedes ist in zwei Blöcke aufgeteilt. Block "a", mit den OBs, wird durch einen koronalen Schnitt an der AP-Ebene erzeugt unmittelbar hinter dem OB Kreuzung mit der Telenzephalon (Bregma 2,46 mm; siehe Paxinos' Atlas für eine Referenz). Block "B" wird durch zwei koronale Schnitte erzeugt, eine an der vorderen Ebene nur auf die am rostralen Bereich des Corpus callosum (Bregma 1,7 mm) und ein zweites auf der Höhe des Übergangs der beiden seitlichen Kammern (Bregma -0.22 mm). GL, glomerulären Schicht; GCL, Körnerzellschicht; st, Striatum; cc, Corpus callosum; ac, Commissura anterior; lv, Seitenventrikel.
2. stereotaktische Injektion von LV in die V-SVZ / Striatum Rand oder in den lateralen Ventrikel (siehe Abbildung 1b)
- Vorbereitung
- Sterilisieren eine 5 & mgr; l Kapazität Spritze mit einer 33-Gauge-Nadel durch den Körper Sprühen nach unten und Nadel mit 70% Ethanol, wobei der Kolbenganz herausgezogen. Ethanol aus einer 1,5-ml-Mikrozentrifugenröhrchen wiederholt anzusaugen und auszustoßen es den ganzen Weg mehrmals heraus, und spülen Sie die Spritze gründlich mit sterilem Wasser hinterher. Legen Sie die Spritze sicher beiseite in der Kultur Kapuze und trocknen lassen.
- Bereiten Sie eine biohazard Abfallbehälter mit 10% Bleichmittel auf ein geeignetes Volumen für das Eintauchen des gesamten Abfalls aus diesem Verfahren (in der Regel 200 ml in einem 500 ml-Behälter).
- Vorbereitung und Vorwärmung über einen 37 ° C Wasserbett durch einen verschließbaren Plastikaufbewahrungstasche mit Wasser gefüllt und erwärmt sie auf 37 ° C. Dies ermöglicht Mäusen nach Injektion zu erholen.
- Entfernen viralen Bestände von -80 ° C Gefrierschrank Lagerung 1 Stunde vor den Injektionen Start und legen Sie das Fläschchen auf einem rotierenden Rad bei RT. die virale Lager auf Eis während der Zeit der Injektionen Nach dem Auftauen erhalten. Vor der stereotaktische Injektion von LV, verdünnen die konzentrierten viralen Bestände bis 10 6 TU / ul PBS in der Kultur Haube verwenden.
- Desinfizieren den Bereich zum Durchführen der Operation mit 70% Ethanol ausgewählt.
- Mikroinjektion von LV
- Wählen und sterilisieren Werkzeuge für die Operation erforderlich (Skalpell, Bohrer und kleine Pinzette).
- Anesthetize eine 6-8 Wochen alten Maus intraperitoneal durch (ip) eine tierärztliche überwachte Mischung aus Ketamin und Medetomidin injizieren. Wiegen jedes Tier und Dosis mit jeweils 50 bis 75 mg Ketamin und 0,5-1 mg Medetomidin pro kg Maus Körpergewicht (etwa 100 bis 125 ul der Ketamin / Medetomidin Arbeitslösung pro Maus).
- Beurteilen Sie die Narkose Ebene, die durch die Zehen, Schwanz oder Ohr kneifen und sicherzustellen, dass das Tier keine Reaktion zeigt.
- Sobald die Maus anästhesiert wird, Butorphanol subkutan in einer endgültigen Dosis von 0,4-0,5 mg pro kg Maus Gewicht zu minimieren postoperativen Schmerzen injizieren.
- Rasieren Sie den Bereich zwischen den Ohren und desinfizieren Sie die Haut mit einem Iodophor wie iodopovidone oder 70% Ethanol. Reinige sterilen Watte mit-tipped Applikatoren. Achten Sie darauf, nicht zu stark, das Tier zu benetzen, da diese Unterkühlung verschlimmern können.
- Legen Sie das Tier in Bauchlage auf einem stereotaktischen Rahmen und befestigen vorsichtig den Kopf mit den Ohr Bars und den Gaumen Unterstützung der Vorrichtung. Halten Sie die Maus mit einem Heizkissen Satz bei 37 ° C und gelten ophthalmische Schmiermittel auf die Augen.
- Machen Sie einen 1 cm langen Schnitt auf der Kopfhaut in Längsrichtung mit einem Skalpell und zurückziehen die Haut sanft den Schädel mit einer feinen Pinzette freizulegen.
- Reinigen Sie den Knochenoberfläche mit einem sterilen Wattestäbchen. Reinigen Sie die freiliegenden Schädelknochen jeglicher verbleibende Gewebe.
- Montieren Sie den sterilisierten Spritze auf der stereotaktischen Gerät mit dem Spritzenhalter.
- Bewegen Sie den Spritzenhalter x, y und z-Achse, bis die Spitze der Spritzennadel am Bregma positioniert ist, der Punkt, wo die Verbindung sagittal (Längs- und medial) Naht senkrecht von der Kranznaht geschnitten wird (FigurE 1b). Stellen Sie sicher, dass die "Null" -Stellung des dorsoventrale (DV) Achse an der Schädeloberfläche bei Bregma ist.
- Bewegen, um die Spritze zu der x und y Zielkoordinaten (siehe Tabelle 1 und Abbildung 1b).
| Region von Injektions | Koordinaten | ||
| Antero-posterior (AP) | Mediolaterale (ML) | Dorsoventrale (DV) | |
| SEZ / Striatum Grenze | 0,6 mm | 1,2 mm | -3,0 mm |
| Seitenventrikel | -0,3 mm | 1,0 mm | -2,6 mm |
Tabelle 1: Stereotaktische Koordinaten für die inProjektionen. Für den AP und ML-Achse, x und y-Koordinaten werden als ein Abstand (in mm) von Bregma gegeben. "-" Bedeutet "in Richtung posterior". Für die DV "Null" koordiniert ist die Oberfläche des Schädels am Bregma Punkt und DV-Koordinaten den Abstand (in mm) nach unten von diesem Punkt an.
- Kommentieren Sie die x, y und z Zielkoordinaten in dem Nonius um in der Lage zu sein, wieder auf die Injektionsstelle zu kommen später. Mark der Knochen an der x- und y-Koordinaten eines chirurgischen Marker Stift.
- Bewegen Sie die Spritze vom Arbeitsbereich.
- ein elektrischer Bohrer vorsichtig auf den Schädel ein Loch nicht mit dem Gehirn zu beschädigen. Sie nicht die Pia-Oberfläche bohren, da dies die Hirnoberfläche beschädigen können.
- Legen Sie die Spritze mit 1 ul der 10 6 TU / ul Viruslösung. Verwenden Sie eine 33 Gauge scharf abgeschrägten Nadel, deren Spitze einen Winkel von 10 bis 12 ° aufweist. Positionieren Sie die Nadel der Spritze in einem 90 ° angle in Bezug auf die Hirnoberfläche.
- Bewegen Sie die Spritze wieder an der Injektionsstelle und bewegen Sie ihn nach unten, bis die Spitze der Pia-Oberfläche berührt.
- Durchdringen das Gehirn mit der Spritze zur z im DV-Koordinatenachse.
- Freisetzung langsam die Virussuspension mit einer Rate von 0,2 ul / min, um Schäden am Hirngewebe durch zu hohe Flüssigkeitsdruck zu minimieren.
- Warten für 5-10 min den Rückfluss von Virussuspension zu minimieren und dann die Spritze zurückzuziehen sehr langsam. Tupfen Sie überschüssiges an Flüssigkeit, die an der Oberfläche als Folge des Zurückziehens der Spritze mit einem Labortuch und legen Sie sie sofort in der bleichmittelhaltigen Biosicherheit Abfallbehälter auftreten.
- Nehmen Sie das Tier aus der stereotaktischen Satz, legen Sie sie an einem warmen Pad, und schließen Sie die Wunde Hautkleber verwenden. Kehren Sie die Sedierung mit 0,1 bis 1,0 mg / kg Körpergewicht Atipamezol.
- Injizieren Bupenorphrine subkutan in einer letzten Dosis von 0,1 mg pro kg Maus Gewicht alle 12 Stunden,ausgehend von 4 Stunden nach der Verabreichung des kurzer Dauer Butorphanol Analgetikum.
- Legen Sie das Tier in einer individualisierten Käfig mit einem warmen Unterlage und genau beobachten, bis die Maus aus der Narkose erholt. Legen Sie eine Tüte mit Hydrogel in den Käfig des Tieres Hydrat nach der Genesung zu helfen.
- Entsorgen Sie alle Bio-kontaminierte Abfälle in der flüssigen Bleich Biohazard Verfügung. Reinigen Sie die Spritze durch Ansaugen und Ausstoßen von Ethanol und mit Wasser abspülen. Desinfizieren Sie die Fläche, die stereotaktische Satz und das chirurgische Material, das mit Bleichmittel und 70% Ethanol verwendet wurde.
- Halten Sie injizierten Mäusen isoliert in der Biosicherheitsstufe 2 Zimmer für 24 bis 48 Stunden nach dem sie zu einem herkömmlichen Gehäuse Anlage übertragen werden
3. Die histologische Analyse
- Perfusion, Gewebesammlung, und Schneiden
- mit einem veterinär überwacht Mischung von Medetomidin und Ketamin (Beurteilung der Narkose Ebene tief in die Mäuse betäuben durch das T Kneifenoes, Schwanz oder Ohr), wie zuvor beschrieben.
- Transkardial perfundieren die Mäuse mit 25 ml Kochsalzlösung von 75 ml von 4% PFA in PB mit der gleichen Rate 17 gefolgt.
- Extrahieren Sie das Gehirn und Post-fixieren, indem sie es in mindestens der 10-fachen Volumen von kaltem 4% PFA in PB für 1-16 h (erhöhte Postfixierung mal abnehmen kann die Immunreaktivität von einigen Antigene) eintauchen. Gründlich die restliche PFA mit PB.
- Schneiden Sie das Gehirn nach Angaben von 1d und kleben Sie die erhaltene Block an den Inhaber eines Vibratom mit Cyanacrylat.
- Sammeln Sie 30 um dicke Serien Koronalschnitte ein Vibratom verwenden. Bewahren Sie die Hirnschnitten in 24-Multiwell-Platten mit PB bei 4 ° C. Zur Vermeidung von Kontaminationen, 0,05% Natriumazid können zur PB Lösung zugegeben werden.
- Immunhistochemie
- Inkubieren der freischwebenden Teile Puffer (PB mit 0,05% Natriumazid, 1% Glycin, 5% normalem Ziegenserum und 0,1% Trit in Blockierungsauf X-100) für 1 h bei RT mit sanft in einem Wippschüttler schütteln.
- Eine geeignete Verdünnung von anti-GFP-Kaninchen primären Antikörper (siehe Tabelle der Materialien) in Blocking-Puffer und Inkubation Gewebe mit dieser Verdünnung für 48 Stunden bei 4 ° C unter leichtem Schütteln vorsichtig entfernen Blockierungspuffer mit einer Pipette, hinzuzufügen.
- Waschen Sie die primären Antikörperlösung, die mindestens 3-mal mit PB, einen Wasch alle 10 Minuten ab.
- Inkubation der frei schwebenden Abschnitte mit einer geeigneten Verdünnung von Fluorophor-konjugierten Sekundärantikörper) in Blockierungslösung (Table of Materials) für 1 h bei RT und leichtem Schütteln zu sehen. Schützen Sie die Abschnitte von direktem Licht während der Inkubation.
- Waschen Sie die sekundäre Antikörperlösung mit PB, 3-mal einmal alle 10 min ab, und Gegenfärbung des Gewebes durch die Abschnitte mit DAPI Inkubation (4 ', 6-Diamidino-2-phenylindol) bei 1 mg / ml in Wasser für 5 min. Waschen Sie die DAPI-Lösung durch Spülen zweimal und schnell weg Witzh Wasser.
- Sanft legen Sie die Abschnitte auf einem Objektträger einen feinen Pinsel verwenden. Geben Sie einige Tropfen Eindeckmedium für Fluoreszenz-Präparate über das Gewebe (Tabelle der Materialien sehen) und vorsichtig mit einem Deckglas legen und überprüfen, dass die Befestigungslösung korrekt über die gesamte Fläche verteilt wird und es gibt keine Blasen. Vorsichtig das Deckglas drücken Sie die mehr als Einschlussmittel abzulassen.
- Wenn die Montagelösung trocknet aus (2-16 h), Analyse der Probe durch konfokale Laser-Scanning-Mikroskopie mit der 488-nm-Laser.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
LV-vermittelte Gen-Delivery-System kann für die Langzeit-in vivo Transduktion von Zellen in der adulten Maus V-SVZ verwendet werden, so dass ihre Verfolgung und genetische Veränderung während der Proliferation, Migration und Differenzierung. Die Infektion und die Expression sind hochwirksame und zahlreiche Zellen ergeben, die leicht zu unterscheiden und auch nicht-infizierten Zellen durch die Expression des Reporter aufgenommen werden können. Wir haben bisher transduzierten Zellen mit GFP fluoreszierenden R...
Access restricted. Please log in or start a trial to view this content.
Diskussion
LVs bieten wichtige Vorteile gegenüber anderen viralen Systemen für die genetische Veränderung von erwachsenen NSC 16,18. Stereotaktische Lieferung von Lentiviren in die V-SVZ Nische stellt ein effizientes Verfahren zur Markierung und Spuren selten B1-NSC Aufteilen der Grenzen der anderen üblicherweise verwendeten Methoden wie BrdU zu überwinden, die nach mehreren Zellteilungen verdünnt wird, oder Retrovirus, das Zellen, die nur Ziel dass zum Zeitpunkt der Anwendung wuchern. LVs zusammen mit Adenoviren ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Alle Manipulationen wurden in einer biologischen Sicherheitsstufe 2 Zimmer gemacht. Tier Protokolle wurden von der Ethikkommission der Universität von Valencia und waren alle in Übereinstimmung mit den europäischen Richtlinie 2010/63 / EU zugelassen.
Danksagungen
Wir erkennen die Hilfe von MJ Palop und die technische Unterstützung der SCSIE der Universidad de Valencia. Wir danken auch Antonia Follenzi für hilfreiche Kommentare und Diskussion des Manuskripts. IF von der Fundación Botín unterstützt wird, von der Banco Santander durch die Santander Universities Global Division und durch Zuschüsse aus Generalitat Valenciana (Programa Prometeo, ACOMP und ISIC) und Ministerio de Economía y Competitividad (Mineco: SAF2011-23331, CIBERNED und RETIC TERCEL) . Diese Arbeit wurde auch durch BFU2010-21823 und RETIC TERCEL Zuschüsse aus Mineco und des European Research Council (ERC) 2012-StG (260511- unterstützt PD-HUMMODEL) bis AC BM-P. ist der Empfänger von einem spanischen FPI Gemeinschaft des Mineco.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25 mm x 89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13 mm x 51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100 x 20 style |
| FACS tubes | Afora | DE400800 | 12 mm x 75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2x HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100x, used to prepare HeLa and 293T culture medium at a final concentration of 10x. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10x, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1x PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1,000x stock solution at 8 mg/ml in dHO |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | http://www.leicabiosystems.com/ |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33 gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11 cm x 21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25 G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
Referenzen
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow! Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten