Method Article
Mechanismus der Regulierung der Adipocyte Zahlen in adulten Organismen durch Differenzierung und Apoptosis Homöostase
In diesem Artikel
Zusammenfassung
Adipose tissue (AT) can influence whole body homeostasis, therefore understanding the molecular mechanisms of adipocyte differentiation and function is of importance. We provide a protocol for gaining new insights into these processes by analyzing adipocyte homeostasis, differentiation and hypoxia exposure as a model for induced adipocyte apoptosis.
Zusammenfassung
Considering that adipose tissue (AT) is an endocrine organ, it can influence whole body metabolism. Excessive energy storage leads to the dysregulation of adipocytes, which in turn induces abnormal secretion of adipokines, triggering metabolic syndromes such as obesity, dyslipidemia, hyperglycemia, hyperinsulinemia, insulin resistance and type 2 diabetes. Therefore, investigating the molecular mechanisms behind adipocyte dysregulation could help to develop novel therapeutic strategies. Our protocol describes methods for evaluating the molecular mechanism affected by hypoxic conditions of the AT, which correlates with adipocyte apoptosis in adult mice. This protocol describes how to analyze AT in vivo through gene expression profiling as well as histological analysis of adipocyte differentiation, proliferation and apoptosis during hypoxia exposure, ascertained through staining of hypoxic cells or HIF-1α protein. Furthermore, in vitro analysis of adipocyte differentiation and its responses to various stimuli completes the characterization of the molecular pathways behind possible adipocyte dysfunction leading to metabolic syndromes.
Einleitung
Nach dem 2014 Bericht der Weltgesundheitsorganisation, 39% der erwachsenen Weltbevölkerung ist übergewichtig und 13% ist fettleibig 1. In naher Zukunft wird übergewichtigen Menschen einen signifikanten Anteil der älteren Bevölkerung umfassen. Ein wichtiges Merkmal von Fettleibigkeit und Alterung ist Dysregulation von Fett in Bezug auf Morbidität und Mortalität 2. Adipokines, Proteine , die durch das Fettgewebe (AT) sezerniert wird , kann metabolische Syndrome wie Fettleibigkeit auslösen und 2 - Diabetes Typ 3. Stoffwechselerkrankungen werden meist durch zu hohe Energiespeicherung in den Lipidtröpfchen von Adipozyten verursacht, die 4 bei Expansion führt. Es ist daher von Interesse, die Ursachen und die molekularen Mechanismen der AT Expansion, um zu bestimmen, Möglichkeiten zu finden, sie zu kontrollieren.
Überernährung führt zu Expansion an, die durch zwei Ereignisse geregelt wird: übermäßige Energiespeicher in die Lipidtröpfchen von Adipozyten, ein Prozesswas zu einer Hypertrophie (Zunahme der Adipozyten - Größe) und erhöhte adipogenesis, die auch als Adipozyten Hyperplasie 5 bekannt. Adipogenese ist ein Prozess der Differenzierung der multipotenten mesenchymalen Stammzellen (MSC) in Adipozyten. Erstens entwickeln MSCs in Preadipozyten während der Verpflichtungsphase. Zweitens unterscheiden Preadipozyten weitere 6 die Eigenschaften reifen und funktionellen Adipozyten zu erwerben. Mehrere Transkriptionsfaktoren wurden als Masterregler für Preadipozyten Bestimmung, wie Zinkfinger-Protein 423 (Zfp423) und frühen B-Zell-Faktor 1 (EBF1) identifiziert. Während Zfp423 frühen Einsatz induziert wird EBF1 6 zur Erzeugung von Adipozyten - Vorläufern erforderlich. Terminale Differenzierung ist eng durch einen Transkriptions Kaskade gesteuert, wodurch Peroxisomenproliferator-aktivierten Rezeptor γ (PPAR) ist der wesentliche Transkriptionsfaktor 7. Weitere wichtige Transkriptionsfaktoren sind die CCAAT / Enhancer-bindendes Protein (C/ EBP) Familienmitglieder (dh C / EBP & agr, C / EBPβ und C / EBPδ) Kruppel artige Faktoren (KLFs), responsive element cAMP - Bindungsprotein (CREB) und frühe Wachstumsantwort 20 (Krox20) 6.
Vor kurzem wurde gezeigt , dass das Aktivatorprotein-1 (AP-1) -Familie im Adipozyten - Differenzierungsprozess 8,9 beteiligt ist. Die AP-1-Familie wird von einem dimeren Protein-Komplex gebildet, bestehend aus Fos, Jun und / oder aktivierende Transkriptionsfaktor (ATF) Mitglieder. Fos-verwandtes Antigen 1 und 2 (Fra-1 und Fra-2) sind in der Lage Adipozyten-Differenzierung zu regulieren. Fra-1 beeinträchtigt Adipocytendifferenzierung von C / EBP & agr 8, während Fra-2 steuert Adipozyten Umsatz 9 hemmen. Fra-2 dadurch nicht verringert nur die Adipozyten-Zahl von PPARγ2 Expression während der Adipozyten-Differenzierung drücken, sondern verringert auch die Adipozyten Apoptose durch direkte Unterdrückung von Hypoxie-induzierbaren Faktoren (HIFs) Ausdruck. Die HIF-Familie ist eine heterodimeric Transkriptionsfaktor-Komplex, bestehend aus HIF-1α, HIF-2α und HIF-1β. Die Heterodimere bestehen aus einem sauerstoffempfindlichen HIF-α Protein (HIF-1α oder HIF-2α) und dem Sauerstoff-unempfindlichen HIF-1β - Untereinheit 10. Während Normoxie HIF-α - Proteine sind Poly-ubiquitiniert und werden schließlich durch das Proteasom 11 abgebaut. Unter hypoxischen Bedingungen tritt bei bei der Expansion, HIF-α-Proteine sind nicht mehr hydroxylierten. Sie sind daher stabilisiert und Form werden Dimere mit dem konstitutiv exprimiert HIF-1β. Transkriptioneller Aktivierung von Genen durch die HIF - Response - Elemente gesteuert ist , die an der Regulation der Angiogenese, Metabolismus und Entzündung 12. Tatsächlich fördert die HIF-1α AT Dysfunktion durch Glukosetoleranz zu induzieren, den Energieverbrauch und peripheren Verwendung von Lipid Hemmen sowie durch Leptin Niveau erhöht und HFD-induzierten 13 Hepatosteatose. Außerdem HIF-1α reguliert adipocyte Apoptose in vivo und in vitro 9.
Das vorliegende Protokoll beschreibt Methoden für AT Status der Untersuchung der molekularen Eigenschaften von Adipozyten-Homöostase in erwachsenen Mäusen zu entwirren. Es zeigt , wie der Apoptose, Proliferation und Differenzierung von Adipozyten in vivo und in vitro kann durch Hypoxie reguliert werden. Dazu verwenden wir Mäuse mit Adipozyten spezifischen Deletion von Fra-2 erzeugt durch Mäusen , die die Fra-2 floxed Allele mit FABP4-CreERT Mäuse 9 kreuzen. FABP4-Cre ERT Mäuse Durch die Verwendung der Löschung ist Adipozyten spezifische und induzierbare durch Tamoxifen Injektion 14. Für die Erwachsenen-Modell, intraperitoneale Injektionen von Tamoxifen durchgeführt werden mehr als 5 aufeinander folgenden Tagen im Alter von 6 Wochen beginnen. Somit werden die Mäuse für 6 Wochen zu einer normalen Ernährung oder hohen Fett-Diät unterzogen, bevor die Analyse durchgeführt wird. Die Mäuse in dieser Studie verwendet wurden männliche basierend auf einem C57Bl6 Hintergrund weibliche Hormone zu vermeiden, wie ÖstrogeneDargestellt , um die Körperfettverteilung 15 zu regulieren. Eine andere genetische Hintergrund verwenden , kann auch die metabolischen Phänotyp verändern, aufgrund dehnungsbedingte Unterschiede in Lipidmanagement 16.
Dieses Protokoll zeigt , wie AT unter Hypoxie zu analysieren Histologie verwenden und wie Adipozyten Apoptose, Proliferation und Differenzierung in vivo mittels Immunhistochemie und Gen Profilierungs Analysen zu quantifizieren. Die Studie wird von in - vitro - Experimente abgeschlossen, die zeigen , wie primären Adipozyten - Differenzierung und Apoptose durch Exposition gegenüber Hypoxie verändert zu analysieren.
Protokoll
ETHIK STATEMENT: Die Tiere werden nach den Richtlinien des deutschen Tierschutzgesetzes in standardisierten Bedingungen untergebracht. Die Tiere sind eine Standard - Diät und Wasser ad libitum gefüttert und gehalten mit einem 12 Stunden Tag / Nacht - Zyklus. Alle Versuche mit Tieren werden von der örtlichen Ethikkommission autorisiert.
1. In vivo - Analyse von Adipocyte Homöostase bei erwachsenen Männern
- Hypoxie in vivo zu quantifizieren, bestimmen zunächst das Körpergewicht der Mäuse, injizieren dann 60 mg / kg Körpergewicht von festen pimonidazole Hydrochlorid intraperitoneal (zum Beispiel: injizieren 1,5 mg in eine 25 g Maus). Pimonidazole ist eine wirksame hypoxischen Marker, die Addukte mit Thiolgruppen in Proteinen bildet, Peptide und Aminosäuren und wird durch einen spezifischen Antikörper nachgewiesen werden.
- Sacrifice Mäuse und entfernen Sie die perigonadal Fettpolster (Abbildung 1).
- 45 Minuten nach der Injektion, opfere Mäuse durch CO 2 Ersticken und anschließender Zervikaldislokation.
- Festnageln die Glieder von Mäusen (wie in Abbildung 1) und öffnen Sie die Bauchhöhle. Entfernen Sie die linke und die rechte perigonadal (epididymal) Fettpolster im Inneren der Bauchhöhle.
Anmerkung: Fettpolster auf die Epididymis durch die peritoneale Blättchen gebunden sind , wie in Figur 1 gezeigt (perigonadal Fettpolster sind durch Pfeile angedeutet). - Achten Sie darauf, die Gonaden-Gewebe aus dem Fettpolster zu entfernen. Bestimmen Sie Fettpolster Gewichte das Verhältnis zu berechnen: Fettpolster Gewicht (g) pro Körpergewicht (g).
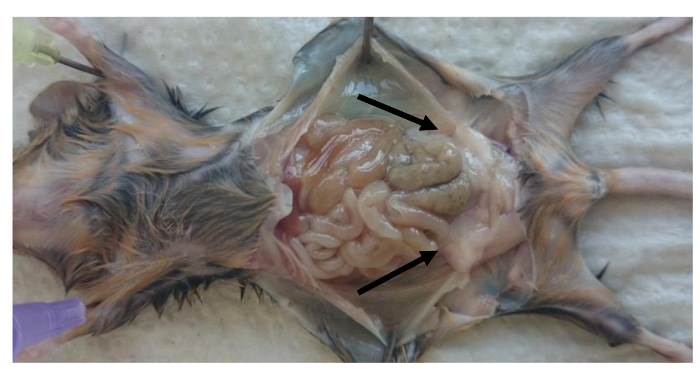
Abbildung 1: Lage der perigonadal Fettpolster in die Bauchhöhle von Mäusen. Bild von perigonadal Fett Lokalisierung in erwachsenen Mäusen nach der Tötung. Perigonadal Fettpolster sind durch die Pfeile angezeigt. Bitte klicken Sie hier , um die vIEW eine größere Version dieser Figur.
- Um eine quantitative Genexpressionsprofil zusammenstellen, verwenden Sie eine perigonadal Fettpolster RNA zu isolieren. Hinweis: Bis das Gewebe verarbeitet wird, zu speichern Gewebeproben in RNA Stabilisierungslösung bei -80 ° C oder in flüssigem Stickstoff.
- Um die Fettpolster homogenisieren, fügen Sie die Fettpolster auf 1 ml einphasige Lösung von Guanidinisothiocyanat und Phenol. Verwenden Röhrchen, die Keramikperlen (1,4 mm), um das Gewebe in einem Homogenisator bei 6.500 Upm (2 mal 20 sec, 30 sec Pause) zu zerquetschen.
- Isolieren Sie die RNA wie folgt (einstufiges Verfahren von Chomczynski und Sacchi 17).
- Um die Phasen trennen, übertragen homogenisiert Fettpolster zu Mikrozentrifugenröhrchen, fügen Volumen von 0,2 ml Chloroform, schütteln für 15 Sekunden, Inkubation für 5 Minuten bei Raumtemperatur und Zentrifuge 12.000 xg für 5 min. Übertragen Sie die obere wäßrige Phase (ca. 400 & mgr; l), die die RNA enthält, in ein neues Mikrozentrifugenröhrchen. Geben Sie hier nicht die DNA-enthaltening Interphase oder die proteinhaltige Phenolphase.
- Zur Fällung der RNA, fügen Sie 1 Volumen Isopropanol, mischen und Inkubation für 15 min bei 4 ° C (es ist auch möglich, bei -20 ° C über Nacht inkubiert). Zentrifuge bei 12.000 xg für 10 min. Entfernen Sie vorsichtig Isopropanol Überstand. Wasche zweimal mit 75% Ethanol mit Zentrifugen Schritten von 12.000 xg für 10 min.
- Das ausgefällte RNA für etwa 10 min bei Raumtemperatur, löst ihn in 50 & mgr; l H 2 O (RNase-frei) nach dem Trocknen. Um dies zu erleichtern, Inkubieren für 2 min bei 65 ° C.
Bemerken: RNA in 75% Ethanol bei -80 ° C oder in flüssigem Stickstoff zur Langzeitlagerung. - Quantifizierung der RNA - Präparationen von A 260/280 (optimale Quotient zwischen 1,8 und 2,2) und berechnen die Konzentration von A 260:
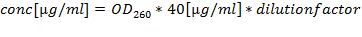
- Um DNA-Kontamination zu vermeiden, verdauen 1 ug der RNA-Präparationmit 1 U DNase I für 30 min bei 37 ° C in einem Volumen von 10 & mgr; l. Inaktivieren für 10 min bei 65 ° C.
Anmerkung: Dieser Schritt ist optional. - Verwenden, 10 ul RNA-Präparation, enthaltend 1 & mgr; g RNA für die Reverse Transkriptase-Reaktion einzelsträngige cDNA, geeignet für die quantitative PCR-Anwendung zu erzeugen. Die Komponenten und ihre Mengen sind in Tabelle 1 aufgeführt.
- Verwenden Sie ein PCR Master Mix für eine quantitative Echtzeit-PCR-Reaktion. Metabolische Veränderungen in der gesamten Fettpolsters, verwenden spezifische Primer für die Gene , die in AT - Homöostase (Tabelle 2) und die PCR - Bedingungen , die in Tabelle 3 beteiligt zu bestimmen.
- Echtzeit-PCR-Analyse der Daten.
- Definieren die Grundlinie (Figur 2), normalerweise Zyklus 1 bis 15, wo es keine Änderung in der Fluoreszenzsignalen ist. Die Echtzeit-PCR-Software normalisiert spezifischen Fluoreszenzsignale zur Baseline-Fluoreszenz und mit dem internen Referenzfarbstoff, ROX, was zudie Größe der spezifischen Signale, die von den Primern Delta Rn (& Delta; Rn).
- Stellen Sie die Schwelle in der exponentiellen Phase der Verstärkungskurve. Der Schnittpunkt definiert den Schwellenzyklus (Ct). Basierend auf dem CT-Wert, die Berechnung der relativen Expression (ACt) und die Falte Änderung (ΔΔCt):
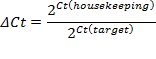
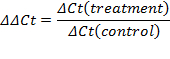
| Komponente | Volume ul / Reaktion |
| 10x RT-Puffer | 2.0 |
| 25x dNTP Mix (100 mM) | 0,8 |
| 10x RT Zufallsprimer | 2.0 |
| MultiScribe Reverse Transkriptase | 1.0 |
| Nuklease-freies H 2 O | 4.2 |
| 1 & mgr; gRNA | 10 |
| Insgesamt pro Reaktion | 20 |
Tabelle 1: Komponenten mit entsprechenden Volumen für die Reverse Transkriptase - Reaktion einzelsträngige cDNA zu erzeugen.
| Offizielle vollständigen Namen | Symbol | Sequenz 3 '-> 5' | ||
| Vorwärts | Umkehren | |||
| Adipogenese | Delta-like 1 homolog (Pref-1) | Dlk1 | GACACTCGAAGCTCA CCTGG | GGAAGGCTGGGACGG GAAAT |
| Am frühen B-Zell-Faktor 1 | EBF1 | CCACCATCGACTACGG CTTC | TCCTGGTTGTTGTGGGG CATC | |
| Zinc Finger Protein 423 | Zfp423 | GTGCCCAGGAAGAAGA CGTA | GGCGACGTGGATCTGA ATCT | |
| Fettsäure-bindendes Protein 4 (Ap2) | FABP4 | TCACCTGGAAGACAGCT BKT | AAGCCCACTCCCACTTC TTTC | |
| CCAAT / Enhancer bindendes Protein (C / EBP), alpha | CEBPA | AAGAGCCGCGACA AGGC | GTCAGCTCCAGCACCT TGTG | |
| CCAAT / Enhancer bindendes Protein (C / EBP), beta | CEBPB | TTTCGGGACTTGATGC AATC | CCGCAGGAACATCTTT AAGG | |
| cAMP responsive element binding protein 1 | CREB-1 | ACTCAGCCGGGTACT ACCAT | TTGCTGCCTCCCTGTT CTTC | |
| CCAAT / Enhancer-Bindungsprotein (C / EBP), delta | Cebpd | CAGCGCCTACATTGAC TCCA | GTTGAAGAGGTCGGCG AAGA | |
| Kruppel-like factor 4 | Klf4 | GCAGTCACAAGTCCCC TCTC | TAGTCACAAGTGTGGG TGGC | |
| Frühe Wachstumsreaktion 2 (Krox20) | EGR2 | AGGCGGTAGACAAAATC CCAG | GATACGGGAGATCCAG GGGT | |
| Peroxisomenproliferator activated receptor gamma | PPARg | AGAGGTCCACAGAGCTG ATTC | GATGCACTGCCTATGAGC ACTT | |
| Lipogenese | Acetyl-Coenzym-A-Carboxylase alpha | Acaca | TGGGGACCTTGTCTTCA TCAT | ATGGGCGGAATGGTCTC TTTC |
| Fettsäure-Synthase | FASN | ACATCCTAGGCATCC GAGA | CCGAGTTGAGCTGGGT TAGG | |
| Stearoyl-Coenzym A-Desaturase 1 | scd1 | CGGGATTGAATGTTCTTG TCGT | TTCTTGCGATACACTCTG GTGC | |
| Lipolyse | Patatin-like Phospholipase Domäne haltendeng 2 | Pnpla2 | AAGGACCTGATGACCA CCCT | CCAACAAGCGGATGGT GAAG |
| Fettsäureaufnahme | Lipoprotein-Lipase | Lpl | GTATCGGGCCCAGCAA CATTATCC | GCCTTGCTGGGGTTTTC TTCATTC |
| CD36-Antigen | CD36 | GTCTTCCCAATAAGCATGT CTCC | ATGGGCTGTGATCGGA ACTG | |
| Hypoxie | Hypoxie-induzierbaren Faktor 1, alpha-Untereinheit | Hif1a | CCTGCACTGAATCAAGAG GTGC | CCATCAGAAGGACTTGCT GGCT |
| Endothelial PAS domain protein 1 (auch bekannt als: HIF-2alpha) | EPAS1 | CAAGCTGAAGCTAAAG CGGC | TTGGGTGAATTCATCG GGGG | |
| Von Hippel-Lindau Tumorsuppressor | Vhl | ACCGAGGTCATCTTTG GCTC | TTCCGCACACTTGGGT AGTC | |
| Arylhydrocarbonrezeptor nuklearen Translokator (auch bekannt als: HIF-1beta) | Arnt | TGGGTCATCTTCTCGC GGTT | TGTCCTATCTGAGCAT CGTG | |
Tabelle 2: Liste von Genen mit der Sequenz der jeweiligen Primer zur Analyse der Adipozyten - Homöostase verwendet.
| Schritt | Temperatur (° C) | Zeit (min: sek) | ||
| Polymerase-Aktivierung | Halten | 95 | 10.00 | |
| PCR | 40 Zyklen | denaturieren | 95 | 00.15 |
| Glüh- / Erweiterung | 60 | 01.00 | ||
| Schmelzkurve | 60 bis 95 | 0,5 ° C / sec | ||
Tabelle 3: Echtzeit - PCR - Bedingungen.
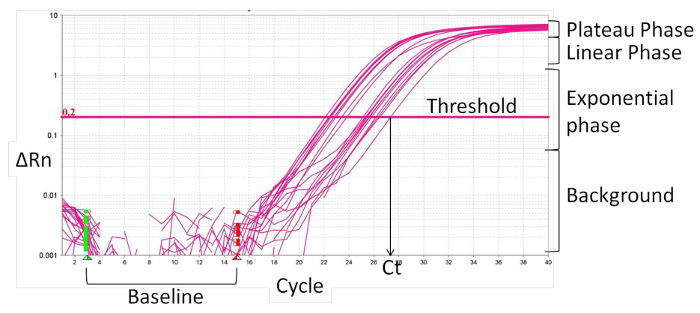
Abbildung 2:. Merkmale der Echtzeit - PCR - Amplifikation Kurve Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Um die histologische Analyse der Adipozyten-Homöostase, verwenden Sie die zweite perigonadal Fettpolster durchführen. Nicht das Gewebe auszutrocknen!
- Befestigen Sie die Fettpolster in 3,7% PBS-gepufferten Formaldehyd über Nacht, einbetten in Paraffin (folgen Sie den Anweisungen wie an anderer Stelle 18 beschrieben) und schneiden Sie das eingebettete Gewebe in 2-5 um dicke Abschnitte (maximal 5 & mgr; m).
- Bestimmen Sie die Anzahl von Adipozyten pro Feld und Adipozyten Größe in einem Hellfeld-Mikroskop nach Hämatoxylin und Eosin (H & E) Färbung:
- Entparaffinieren Abschnitte durch Waschen 3 mal für 5 Minuten in Xylol und rehydratisieren den Abschnitt 2 mal für 2 min in 100% -igem Ethanol und 2 mal für 2 min in 96% Ethanol. Schließlich, waschen Sie den Abschnitt in destilliertem H 2 O für 5 min.
- Stain mit Hämatoxylin, verdünnt 1: 5 mit destilliertem H 2 O, 10 min bei Raumtemperatur und Waschen in H 2 O für 5 min. Stain mit Eosin - Lösung für 30 Sekunden und Waschen wieder mit H 2 O für 5 min (20 ml 5% Eosin Y / 210 ml H 2 O / 25 ul Eisessig destilliert).
- Entwässern Abschnitte mit 96% Ethanol und 100% Ethanol 2 Mal für jeweils 2 min und Xylol 3 mal 5 min. Montieren Sie die Abschnitte mit wasserfreiem Befestigungsmittel.
- Bewerten Sie die Abschnitte unter einem Hellfeld-Mikroskop. Ein repräsentatives Beispiel dafür , wie Adipozyten zu analysieren mit ImageJ 1.48v 19 ist in Fig. 3: Anzahl der Zellen pro Fläche (& mgr; m 2), Zellenbereich (x 10 3 & mgr; m 2 ), Zellgröße (um).
- Öffnen Sie das Bild des Abschnitts mit ImageJ 1.48v. Wenn die Parameter des Bildes in Pixeln statt einer Längeneinheit angegeben werden, stellen Sie die Skala.
- * Wählen Sie Gerade * in der Werkzeugleiste und stellen Sie die Linie zu einem bekannten Abstand mit Bezug auf die Maßstabsleiste. Zum Analysieren -> Set - Skala Der Abstand von der Linie wird in Pixeln dargestellt;. fügen Sie den bekannten Abstand und die Längeneinheit, beispielsweise um. Bestätigen Sie mit OK. Die Größe des Bildes und die Analyse der Parameter werden in der Längeneinheit angegeben angegeben.
- Um die Parameter der Adipozyten bestimmen, stellen Sie die Schwelle. Zum Bild -> Einstellen -> Schwelle Schwelle Fenster zu öffnen. Wählen Sie die folgenden Einstellungen: Schwellwertverfahren: Standard; Threshold Farbe: B & W; Farbraum: HSB. Das Bild wird jetzt in schwarz und weiß dargestellt. Stellen Sie dieHelligkeit weiß Adipozyten zu löschen und schwarze Interzellularräume, wie in Abb zu schließen. 3b.
- Zählen Sie die Anzahl von Adipozyten pro & mgr; m 2 (Abbildung 3e) mit dem * Multi-Point * Auswahl in der Symbolleiste und markieren Sie jede Zelle zum Zählen.
- Um die Adipozyten - Größe bestimmen, wählen Sie * * Gerade wieder in der Werkzeugleiste und ziehen den Durchmesser eines Adipozyten (Abbildung 3c). Zum Analysieren -> Messen und ein neues Fenster erscheint, mit der Länge des Durchmessers in & mgr; m.
- Um die Adipozyten - Bereich bestimmen, wählen Sie * Wand (Tracing) Werkzeug * und in den Adipozyten klicken. Die Innenwand der Adipozyten ist rot (Abbildung 3d) ausgewählt. Zum Analysieren -> Messen und ein neues Fenster erscheint, mit dem Bereich dieses Adipozyten in & mgr; m 2.
- Für immunohistochemistry, bereiten den Abschnitt für Antikörper und TdT-vermittelte dUTP-Biotin nick end labeling (TUNEL) Färbung wie folgt:
- Entparaffinieren Abschnitte durch Waschen 3 mal für 5 Minuten in Xylol und rehydratisieren den Abschnitt 2 mal für 2 min in 100% -igem Ethanol und 2 mal für 2 min in 96% Ethanol. Schließlich, waschen Sie den Abschnitt in destilliertem H 2 O
- Für Antigen-Retrieval, Proteinhydrolysat für 30 min der Gewebeschnitt bei 37 ° C mit Proteinase K-Arbeitslösung (20 ug / ml in 10 mM Tris / HCl, pH 7,4 bis 8) und Spülen mit PBS.
- Führen Sie eine Antikörperfärbung in Nassräumen:
- Um die endogene Peroxidase zu blockieren, verwendet werden 3% Wasserstoffperoxid in PBS für 10 min, anschließend mit 2 mal 5 min in PBS gewaschen. Um die unspezifische Bindung von Antikörpern zu blockieren, verwenden 10% Serum in PBS. Verwenden Sie das Serum des Wirts des sekundären Antikörpers, in diesem Fall Ziege.
- Für die Färbung mit Hilfe der Antikörper für die Apoptose, Proliferation und Hypoxie-Detektion ( Tabelle 4). Verdünnte Antikörper in PBS / 10% Ziegenserum. über Nacht bei 4 ° C inkubieren. Waschen Sie die Abschnitte 3 mal 5 min in PBS.
- Zur Verbesserung verwenden das Signal einen biotinylierten sekundären Antikörper, mit der Verdünnung wie in Tabelle 5 aufgeführt. Für Hypoxie Erkennung verwenden HRP konjugierten Kaninchen anti-FITC als sekundärer Antikörper. Inkubieren für 1 h bei Raumtemperatur. Waschen Sie die Abschnitte 2 mal 5 min mit PBS.
Hinweis: Für die Hypoxie-Färbung mit FITC-MAb1, überspringen Sie Schritt 1.4.4.4) und fahren Sie mit Schritt 1.4.4.5). - Für jede Folie, vorge inkubieren 50 ul Avidin-Lösung mit 50 & mgr; l biotinylierter Peroxidase H für 30 min bei Raumtemperatur (dieses Verfahren auch als Avidin / Biotin-ABC-Komplex-Formulierung bezeichnet wird) und dann zu den Abschnitten für weitere 45 min hinzu. Waschen Sie 2 mal für 5 Minuten mit PBS.
- Inkubieren der Abschnitte in Peroxidase-Substrat-Lösung, bis die Färbung intensiver geworden (zwischen 5 bis 10 min). Waschen Sie für 5 min mit destilliertemH 2 O.
- Für Gegenfärbelösung, Fleck mit Hämatoxylin 1: 5 verdünnt mit destilliertem H 2 O für 10 Minuten bei Raumtemperatur und Waschen in H 2 O für 5 min.
- Entwässern Abschnitte in 96% Ethanol und 100% Ethanol 2 Mal für jeweils 2 min und Xylol 3 mal 5 min. Verschließen Sie die Abschnitte mit Deck und wasserfreien Befestigungsmittel. Bewerten Sie die Abschnitte unter einem Hellfeld-Mikroskop.
- Bestimmen Sie Apoptose durch TUNEL-Assay und folgen Sie den Anweisungen des Herstellers:
- In 50 ul Enzymlösung in 450 & mgr; l-Label-Lösung. Dann bewerben Sie 50 ul TUNEL Reaktionsgemisch auf histologischen Schnitten und für 60 min bei 37 ° C in einer befeuchteten Atmosphäre im Dunkeln inkubiert. Waschen Sie die Abschnitte 3-mal mit PBS für 5 min und eindecken mit Fluoreszenzmedium mit DAPI (4 ', 6-diamidino-2-phenylindole) für Gegenfärbelösung Montage.
- Werten Sie den Abschnitt unter einem Fluoreszenzmikroskop mit 100-fach magnificat Ion. Zur Messung von Fluorescein eine Anregungswellenlänge von 488 nm verwenden, und zwischen 515 bis 565 nm (grüner Laser) erfassen; DAPI regt etwa 360 nm bei und emittiert bei etwa 460 nm, wenn auf DNA (blauer Laser) gebunden.
- Quantifizieren Sie die Overlays von DAPI und Fluorescein:
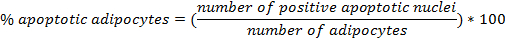

Abbildung 3:. Analysieren von Adipozyten Eigenschaften in Fettpolster Abschnitte Abschnitt Bilder der perigonadal Fettpolster von männlichen Mäusen mit einer fettreichen Diät behandelt (HFD) oder normale Ernährung (ND) mit einem Hellfeldmikroskop (a); wird der Schwellenwert eingestellt in schwarz und weiß (b) und die Adipozyten - Größe (Länge, c), Bereich (d) und Adipozyten - Zellzahl pro mm 2 (e) sind mit ImageJ 1.48v quantifiziert.f = "https://www.jove.com/files/ftp_upload/53822/53822fig3large.jpg" target = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Auf Konzentration | Verdünnung | |
| Apoptosis | Cleaved Caspase-3 (Asp175) (5A1E) Kaninchen mAb | 1: 2,000 |
| Proliferation | Gereinigtes Maus Anti-Human Ki-67 Klon B56 (RUO) | 01.50 |
| Hypoxie | HIF-1 alpha-Antikörper | 1: 100 |
| FITC-MAb1 | 1: 100 |
Tabelle 4: Antikörper mit entsprechenden Verdünnung für die immunhistologische Färbung von AT Abschnitte verwendet.
| Antikörper | Verdünnung |
| biotinylierten antiMaus-IgG (H + L) | 1: 200 |
| biotinylierten anti-Maus IgG (H + L) | 1: 200 |
| HRP-Konjugate Kaninchen anti-FITC | 1: 100 |
Tabelle 5: Sekundäre Antikörper mit Verdünnung für immunhistologische Färbung verwendet.
2. In - vitro - Analyse von Adipocyte Homöostase Beeinflusst durch Hypoxie
- Sacrifice Mäuse und entfernen Sie das subkutane Fettgewebe.
- Opfern , um die Mäuse durch CO 2 Ersticken und anschließende Zervikaldislokation.
- Festnageln die Glieder der Mäuse dargestellt , wie in Abbildung 4. Nehmen Sie die Haut vom Oberschenkel, Lende und flankieren und stecken Sie es nach unten mit Nadeln wie in Abbildung 4. Dann das subkutane Fettgewebe, das hintere an der Basis der Bridgewater Hinterbeine, die Leistenlymphknoten Umgebung (wie in Abbildung 4 dargestellt, links: subkutanen FettpolsterS durch die Pfeile angedeutet; rechts: inguinalen Lymphknoten durch den Pfeil angedeutet).

Abbildung 4: Lage der subkutanen Fettpolster. Bild von subkutanen Fettpolster; die linken Pfeile , um die subkutane Fettpolster und der Pfeil nach rechts zeigt den Leistenlymphknoten anzuzeigen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Isolieren Fettgewebe gewonnene Stammzellen (ADSC) , wie zuvor beschrieben 20.
- Seed ADSC 4.000 Zellen / cm 2 in Dulbeccos modifiziertem Eagle-Medium-Ham F-12 , ergänzt mit 10% normales Kälberserum, 1% Penicillin / Streptomycin, 0,5% Amphotericin B, 16 & mgr; M Biotin, 18 & mgr; M Pantothensäure und 100 uM Ascorbinsäure und wachsen Kultur bis zur Konfluenz um 70 bis 80%, Welche nach 4 bis 6 Tagen der Kultur erreicht wird.
- Induce adipogenen Differenzierung.
- Entfernen Sie die anhaftende ADSC von der Oberfläche durch Behandlung Trypsin.
- Medium entfernen, Waschen mit PBS und fügen 0,025% Trypsin-Lösung (vorgewärmt auf 37 ° C) für 2 min (bis die Zellen sich von der Oberfläche abzulösen). Unmittelbar Medium hinzufügen und die Zellen zu waschen.
- Zählen Sie die Zellen, die eine Neubauer-Kammer verwendet wird.
- Setzen Sie die Glasabdeckung auf dem zentralen Bereich der Neubauer-Kammer. Verdünnen Sie die Zellsuspension 1:10 und laden Sie die Kammer mit 10 & mgr; l Zellsuspension verdünnt. Zählen Sie die Zellen in 4 Quadrate an den Ecken angeordnet, die jeweils aus 16 kleinere Quadrate. Berechnen Sie die Zellzahl pro ml:
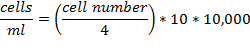
- Setzen Sie die Glasabdeckung auf dem zentralen Bereich der Neubauer-Kammer. Verdünnen Sie die Zellsuspension 1:10 und laden Sie die Kammer mit 10 & mgr; l Zellsuspension verdünnt. Zählen Sie die Zellen in 4 Quadrate an den Ecken angeordnet, die jeweils aus 16 kleinere Quadrate. Berechnen Sie die Zellzahl pro ml:
- Seed ADSC (wie unter Punkt 2.2 beschrieben) in 12-Well-Kulturplatten und Kultur wachsen bis zur Konfluenz um 70 bis 80% (erreicht nach 4 bis 6 Tage).
- Induce adipogenic Differenzierung durch Zugabe von 5 & mgr; g / ml Insulin, 1 uM Dexamethason und 5 & mgr; M 3-Isobutyl-1-methylxanthin (IBMX) zu den Kulturen. Erneuern Sie das Medium alle 2 Tage. Die Zellen vollständig nach 7 Tagen differenziert werden.
- Entfernen Sie die anhaftende ADSC von der Oberfläche durch Behandlung Trypsin.
- Zur Analyse der adipogenetische Differenzierung, Fleck mit Oil Red O, die Triglyceride von reifen Adipozyten Flecken.
Hinweis: Die Arbeiten müssen unter einem Abzug durchgeführt werden!- Entfernen Sie das Medium, waschen Sie die Adipozyten vorsichtig mit PBS und fixieren die Zellen für 60 min mit 2 ml 10% Formalin.
- Oil Red O Färbelösung, mischen 3 Teile des Red Oil O - Stammlösung (300 mg Red Oil O - Pulver , gelöst in 100 ml 99% Isopropanol) mit 2 Teilen destilliertem H 2 O und Inkubation für 10 Minuten bei Raumtemperatur herzustellen. Filtern Sie die Oil Red O Arbeitslösung durch einen 0,2 & mgr; m Injektionsfilter.
Anmerkung: Die Arbeitslösung für 2 h stabil ist. - Für die Oil Red - O - Färbung, entfernen Sie das Formalin, waschen Adipozyten mit H 2 O, Inkubation mit 2 ml 60% Isopropanol für 5 Minuten, entfernen Sie das Isopropanol und 2 ml Oil Red O Arbeitslösung für 5 min. Spülen Sie die Zellen, die mit Leitungswasser, bis das Wasser klar ist. Gegenfärbung mit Hämatoxylin wie in Punkt 1.4.4.5).
- Beurteilen Sie die Platten unter einem Phasenkontrastmikroskop mit 100-fache Vergrößerung. Die Lipide der Adipozyten rot erscheinen und die Kerne erscheinen blau.
- Optionaler Schritt: Ruhe des Gens von Interesse durch Transfektion mit shRNA.
- Ändern Sie das Medium und fügen Serum-freiem Medium.
- Für die Transfektion von Adipozyten, verwenden Lipofektion. Folgen Sie den Anweisungen des Herstellers und verwenden 1 ug shRNA pro 12-Well-Gewebeplatten. Nach Zugabe des Lipid-DNA-Komplex, 48 Adipozyten für eine Stunde bei 37 ° C inkubieren.
- Um Adipozyten unterzogen, um eine Hypoxie, verwenden Sie eine hypoxische Arbeitsstation oder hypoxischen Inkubator analysieren, um die Zellen unter hypoxischen Bedingungen aufrechtzuerhalten. In Abhängigkeit von der Studie, Hypoxie could 0,5, 1 bzw. 2% Sauerstoff sein.
- Analyse der Apoptose von FITC-markiertem Annexin V und anschließende Durchflusszytometrie analysiert.
- Sammeln Sie Adipozyten mit extra weichem Zellschaber, waschen mit PBS und fügen Sie 1 x 10 6 Zellen zu 100 ul Annexin V-Bindungspuffer (10 mM Hepes / NaOH, pH 7,4, 140 mM NaCl, 2,5 mM CaCl 2). Fügen Sie die Menge von Annexin V-FITC vom Hersteller empfohlenen und Inkubation für 15 min bei Raumtemperatur.
- Für die Durchflusszytometrie Messung, 200 & mgr; l Annexin V-Bindungspuffer und 1 & mgr; M von Kern counterstain. Bestimmen Sie die Fluoreszenz im grünen und violetten Kanal. Annexin V + / Kerngegenfärbung + Zellen werden als sekundäre nekrotischen und Annexin V + / Kern Gegenfärbemittel definiert - Zellen sind definiert als apoptotische Zellen (Abbildung 5).
- Quantitativ Adipozyten RNA-Ebene analysieren, um die Homöostase unter hypoxischen Bedingungen zu bestimmen.
- Hinzufügen1 ml einphasige Lösung von Guanidinisothiocyanat und Phenol in jede Vertiefung und zu isolieren , die RNA und gehen Sie wie in den Schritten 1.3.2.1) bis 1.3.5.2 [einstufigen Verfahren von Chomczynski und Sacchi 17 (Schritt 1.3.2) mit]) .
- Analyse der Apoptose von FITC-markiertem Annexin V und anschließende Durchflusszytometrie analysiert.
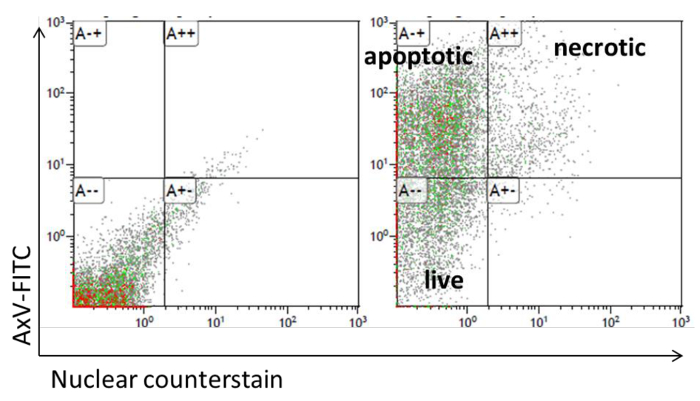
Abbildung 5: Adipocyte Apoptose - Analyse mittels Durchflusszytometrie. Dot Plot Präsentationen der FACS für Annexin V-FITC und TO-PRO-3 - Färbung von Adipozyten. Bitte klicken Sie hier , um eine größere Version dieser Figur sehen.
Ergebnisse
Wir zeigen , wie Adipozyten Homöostase in vivo zu bestimmen und in vitro am Beispiel von Fra-2 fl / fl FABP4-CreERT Mäuse im Vergleich zum Wildtyp - Geschwister. Unser Protokoll legt fest, wie erhöhte HIF-Expression durch Hypoxie mit Adipozyten Dysfunktion korreliert ist, wie durch eine erhöhte Adipozyten Apoptose bezeichnet.
Erhöhte Adipozyten Größe und Fläche in hohen Fett-Diät (HFD) behandelten Mäusen
Überernährung, unter anderen Faktoren resultiert in Adipozyten Hypertrophie, verursacht durch eine übermäßige Energiespeicherung in den Lipidtröpfchen. Die Adipozyten-Größe und Bereich ist ein Indikator für Hypertrophie. Teile der Fettpolster von normalen (ND; 6a) und fettreiche Diät (HFD; 6b) Mäuse sowie Quantifizierungen der Adipozyten - Größe und Fläche deutlich zeigen Adipozyten Hypertrophie nach 6 Wochens von HFD, die durch erhöhte adipocyte Größe in der HFD - behandelten Mäusen (Figur 6c und d) angedeutet ist.
Erhöht Hypoxie im Fettgewebe (AT) adulter Fra-2 fl / fl FABP4-CreERT Mäusen führt zu erhöhten HIF-1α - Ebene und Adipozyten apoptosis
Zur Bestimmung der in - vivo - Status von Hypoxie in AT, Fra-2 fl / fl FABP4-CreERT Mäuse 6 Wochen nach der Fra-2 Löschung im Alter von 12 Wochen analysiert und verglichen mit dem Wildtyp - Geschwister. Pimonidazole wird den Mäusen intraperitoneal als wirksame Hypoxie-Marker verabreicht; es ist nicht toxisch und in der Lage in das AT zu verteilen. Hypoxische Adipozyten in der AT in vivo durch immunhistochemische Antikörperfärbung (Abbildung 7a) definiert ist . Ferner wird die erhöhte hypoxischen Zustand des AT in Mäusen durch eine erhöhte HIF-1α positive ADIP begleitetocytes wie durch die immunhistochemische Färbung 7b angedeutet), die durch Quantifizierung der HIF-1α - Expressionsniveaus und seine Zielgene 9 bestätigt wird. Zusätzlich TUNEL - Färbung von AT Abschnitte von Fra-2 fl / fl FABP4-CreERT Mäusen und Kontroll littermates (Figur 7c) zeigt , dass Adipozyten Apoptose erhöht mit der Anwesenheit von Hypoxie und HIF-1α - Expression korreliert.
HIF-1α-Expression in primären Adipozyten durch Hypoxie induzierte Apoptose Adipozyten erhöht
Um Adipozyten Apoptose in vitro zu analysieren, verwenden wir von subkutanen Fettpolster erzeugt Adipozyten wie an anderer Stelle 20 beschrieben. Wie erwartet, wird das HIF-1α - Expression in Adipocyten nach 24 Stunden einer Hypoxie (Abbildung 8a) erhöht. Zur weiteren HIF-1α-Aktivitäten, die RNA-Werte von HIF Ziel analysierenGene wie Inos (induzierbare NO-Synthase) durch qPCR quantifiziert. 8b zeigt , dass die erhöhte Expression von HIF-1α unter hypoxischen Bedingungen führt Inos mRNA - Ebene zu erhöht. Da wir schon in vivo (Abbildung 8) haben gezeigt, dass HIF-1α - Expression in Adipozyten korreliert mit einer erhöhten Apoptose Adipozyten erhöht wird Apoptose auch in in vitro - Kulturen von Annexin V - Färbung unter hypoxischen Bedingungen quantifiziert. Übereinstimmend mit den in vivo - Daten (Bild 7), eine erhöhte HIF-1α - Ebene wird durch erhöhte adipocyte Apoptose , induziert durch Hypoxie (Abbildung 8b) begleitet. Darüber hinaus, dass hypoxische-induzierte Apoptose zu beweisen, ist HIF abhängig; HIF-1α oder HIF-2α durch RNA-Interferenz in Adipozyten, abgeleitet von Wildtyp oder Fra-2-defizienten Mäusen zum Schweigen gebracht. Die erhöhte Adipozyten Apoptose wird durch Schweigen zu bringen HIF-1α oder HIF-2α, wie durch Annexin restauriert V - Färbung in 8b, was beweist , daß die Hypoxie - Sensor HIF-α regelt die Adipozyten - Apoptose.
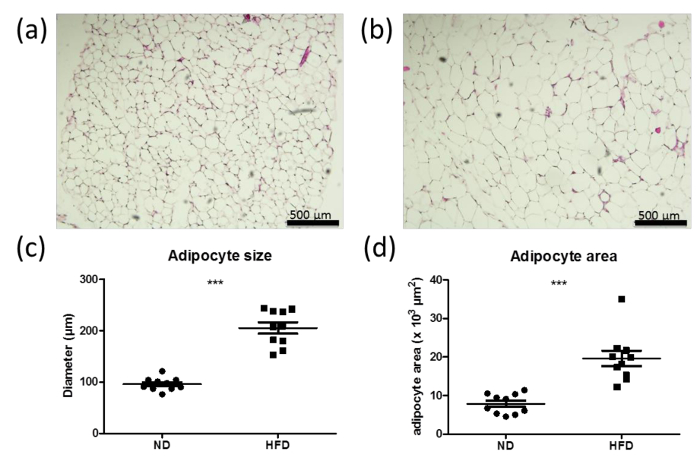
Abbildung 6: Erhöhte Adipozyten Größe und Fläche in hohen Fett - Diät (HFD) Mäuse (a, b) H & E - Färbung von Abschnitten aus dem perigonadal Fettpolster der männlichen Wildtyp - Mäusen mit normaler Ernährung (ND) zugeführt wird (a) oder hoch. -fat Diät (HFD) (b) für 6 Wochen. Die Balken stellen 500 & mgr; m. (C, d) Quantifizierungen von Adipozyten Größe (c) und Fläche (d) von der perigonadal Fettpolster von Wildtyp - Mäusen mit ND zugeführt (a) oder HFD (b) für 6 Wochen. n = 10. Die Daten sind als Mittelwerte ± SEM dargestellt. Die statistische Analyse wurde Schülers t - Test durchgeführt unter Verwendung. *** P <0,0001.: //www.jove.com/files/ftp_upload/53822/53822fig6large.jpg "Target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
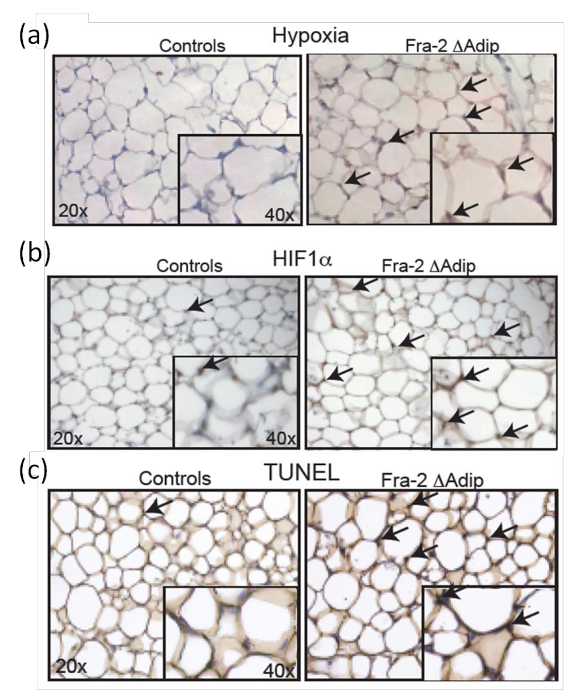
Abbildung 7: Erhöhte HIF-1α - Ebene und die Apoptose in Adipozyten von erwachsenen Fra-2 fl / fl FABP4-CreERT Mäusen. Hypoxie (a) und HIF-1α (b) Färbung im AT der männlichen Fra-2 fl / fl FABP4-creERT Mäuse und männliche Kontrolle littermates 6 Wochen nach der Tamoxifen - Injektion. Vergrößerung 20X, 40X einfügen. Schwarze Pfeile zeigen hypoxische Bereiche und HIF-1α-positiven Zellen. (C) TUNEL - Färbung in Fra-2 fl / fl FABP4-CreERT Mäuse und Kontroll littermates 6 Wochen nach einer Tamoxifen - Injektion. Vergrößerung 20X, 40X einfügen. Schwarze Pfeile zeigen TUNEL-positiven Zellen. Diese Zahl wurde von Luther et geändertal. 9. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
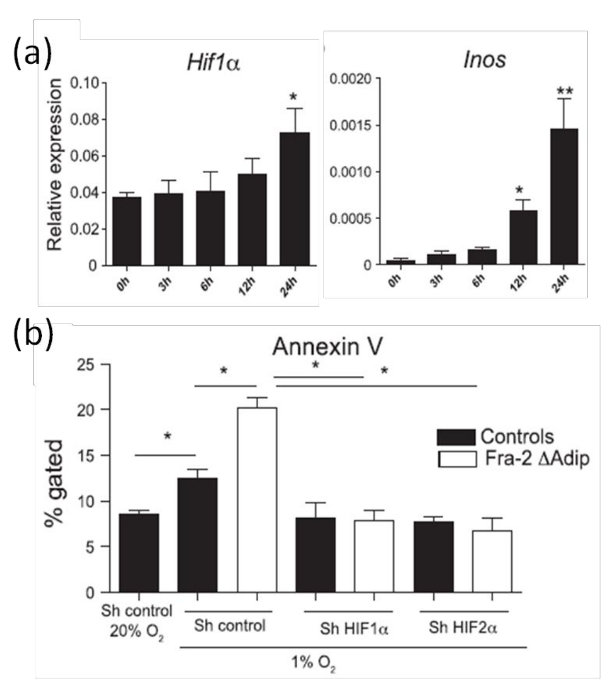
Abbildung 8:. Erhöhte HIF-1α Expression und Adipozyten Apoptose in primären Adipozyten durch Hypoxie (a) Real-time PCR - Analyse von HIF-1α und HIFs Ziel Inos mRNA - Spiegel in primären Adipozyten in hypoxischen Kammern platziert analysiert zu den angegebenen Zeitpunkten. (B) Quantifizierung der Apoptose durch Annexin V FACS - Färbung in primären Adipozyten aus isoliert Fra-2 fl / fl FABP4-CreERT Mäuse oder Wildtyp - Kontrollen transfiziert mit sh Kontrolle oder sh Plasmid gegen HIF-1α oder HIF-2α und unter Hypoxie platziert (1% O 2) für 24 Std. Diese Zahl wurde von Luther et al modifiziert. 9. Die Daten sind als Mittelwerte dargestellt ± SD Die statistische Analyse wurde durchgeführt , Student t- Test. * P <0,05 und ** p <0,01 wurden als signifikant akzeptiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Adipozyten sind phänotypisch charakterisiert durch ihre Größe, Anzahl und Fläche, Adipozyten Hyperplasie und Hypertrophie offenbart, die durch übermäßige Energiespeicher induziert durch Überernährung 5. Diese Ereignisse, die zu Fettsäure Dysregulation und anschließende Metabolisches Syndrom sind auch Zustände erhöhter Fettmasse mit erhaltenen Metabolismen, die auch als "gesund" Fett Expansion bezeichnet wird. Zum Beispiel Kusminski et al. 21 zeigten , dass Mäuse , die mit massiven Fettexpansions metabolisch gesund bleiben, was darauf hindeutet , dass Fett Expansion nicht notwendigerweise auf Metabolisches Syndrom verbunden ist und sein muss sorgfältig bestimmt , um die Eigenschaften der Adipozyten zu bewerten. Das Fettgewebe (AT) spielt eine zentrale Rolle bei der Regulation des Körpermetabolismus. AT ist die größte endokrine Organ , das Dyslipidämie, Atherosklerose, Hyperinsulinämie und Hyperglykämie 3 beeinflussen könnten. Auswertung der AT-Homöostase und der molekularen mechanisms es regulieren könnte ein besseres Verständnis der Stoffwechselsystem Störungen ermöglichen. Daher die Regulierungsmechanismen Adipocytendifferenzierung entwirren, Adipozyten Größe und Fettpolster Masse würde dazu beitragen, neue therapeutische Behandlung von Fettleibigkeit Störungen zu entwickeln. Verwendung von in vivo und in vitro Verfahren ist es möglich , die Rolle der Nahrung und die Genexpression Auswirkungen auf die Adipozyten - Differenzierung und Aktivität zu bestimmen. Um die AT - Homöostase, die Bestimmung der im Gleichgewicht zwischen Adipozyten Differenzierung, Proliferation und Apoptose bestimmen , wie vorgeschlagen durch unser Protokoll so wichtig ist wie die Glucose- und Insulinstoffwechselantwort 22-24 analysiert.
Expressionsprofilen Analysen von Genen in Adipogenese beteiligt, Lipogenese, Lipolyse, Fettsäureaufnahme, Hypoxie, Apoptose und Proliferation in primären Adipozyten und viszeralen AT ist ein Hochdurchsatzverfahren zum Erhalten einer Übersicht über adipocyte Homöostase und deren mögliche Dysfunktion.Interessante Kandidaten sollten weiter auf Proteinebene durch Western-Blot oder immunhistologische Färbung analysiert werden. Um optimale Ergebnisse durch PCR-System in Echtzeit erhalten, unter Verwendung von unsymmetrischen Cyaninfarbstoffen, reichen die Konzentrationen von cDNA von 1 bis 10 ng und die optimale Primerkonzentrationen im Bereich von 50 bis 900 nm sollte zur Minimierung unspezifischer Amplifikation getestet werden. Die kritischen Komponenten sind die Primer; für jeden Lauf, müssen die Schmelzkurven, die Spezifität zu gewährleisten und schließen die Bildung von Primer-Dimeren streng kontrolliert werden. Daher wird eine negative Kontrolle mit H 2 O anstelle von cDNA unter Verwendung empfohlen. Weiterhin handelsübliche unsymmetrischen Cyanin-Farbstoffe werden als Master-Mischungen bereitgestellt, die eine passive Referenzfarbstoff (wie ROX) enthalten ein internes Referenzsignal zu liefern. Das cDNA-Signal wird während der Datenanalyse zu den ROX Signale normalisiert gut zu Well Signalschwankungen zu korrigieren. Ein weiterer Punkt zu berücksichtigen, um eine Schmiere zu etablierend qPCR System ist die Wahl des Housekeeping-Gens. Für jede Bedingung sind verschiedene Housekeeping - Genen verwendet, beispielsweise HPRT, β-Aktin, GAPDH, β-2-MG oder HSP90.
HIF Proteine stabilisiert durch hypoxischen Bedingungen sind Master - Regula Bestimmung nicht nur Adipozyten Überleben, aber auch Stoffwechselveränderungen, beispielsweise Glukose, Insulintoleranz und Lipidstoffwechsel 11,25,26. Um hypoxische Bereiche in das Fettpolster, HIF-1α wird bestimmt in AT Abschnitte durch Immunhistochemie ermitteln. Da HIF Proteine schnell in 5 bis 10 min unter normoxischen Bedingungen abgebaut werden, sollte das Verfahren und die Fixierung des Fettpolsters für die histologische Analyse gesteuert werden eng Latenzzeit zu vermeiden. Daher Hypoxie nicht nur durch HIF-Färbung zu gewährleisten, wird pimonidazole verwendet hypoxischen Bereichen in der AT bestimmen. Pimonidazole der Lage ist , in das Gewebe zu verteilen, wie es bereits in den Knochen gezeigt wurde 27Und markieren Sie effektiv hypoxische Bereiche durch zu thiolhaltigen Proteine spezifisch in hypoxischen Zellen binden, die weiter in histologischen Schnitten durch spezifische Antikörperbindung 28 erfasst wird. Jedoch können auch andere Marker und Methoden verwendet werden, um die Hypoxie Stoffwechselweg zu analysieren. Zum Beispiel ist die Beteiligung der Prolylhydroxylasedomäne (PHD) Enzym, das die Hydroxylierung von Prolin-Reste unter Normoxie induzieren, sowie der von Hippel-Lindau (VHL) Protein, das hydroxylierte Proline erkennen und induzieren die Poly-Ubiquitinierung proteasomaler HIF zu vermitteln Abbau, müssen für eine vollständige Übersicht über den Weg 29,30 analysiert werden. Außerdem allgegenwärtigen Nachweis von HIFs würde bestimmen auch die Proteinstabilität und Abbau , die 31,32 werden verändern können.
Proliferation von Ki67 und Apoptose durch TUNEL - Färbung Weiterhin werden in vivo durch Färbung von AT histologischen Schnitten bestimmt. Die Quantifizierung der Proliferation von Ki67 und einpoptosis durch TUNEL oder Annexin V - Färbung durch Durchflusszytometrie - Analyse wird auch 33 durchgeführt. Proliferation könnte natürlich durch andere Techniken, wie die Analysen der Adipozyten-Zellzyklus gemessen werden, die nicht durch die Messung von Ki67 positive Zellen gerichtet. Darüber hinaus kann die Apoptose Studie von TUNEL abgeschlossen werden durch FACS von Annexin V-Analysen und TOP-PR-3, die das Niveau der Nekrose gegenüber der Apoptose Zelltod Prozess bestimmen wird. Apoptosis ist ein fundamentaler Prozess für das Programm des Zelltods, der für AT Homöostase wichtig ist. Tatsächlich Dysregulation von Adipozyten Apoptose in Prozessen bisher verwickelt zu Fettleibigkeit beitragen und 34 Lipodystrophie. Darüber hinaus im Jahr 2011, Keuper et al. Fettgewebe Entzündung zu Adipozyten Apoptose verknüpft. Sie zeigten, dass Makrophagen induzierte Apoptose in Präadipozyten und Adipozyten, die wiederum Makrophagen ziehen. Die Rekrutierung von Makrophagen beschleunigt Entzündung, die contributes metabolischen Syndromen wie Glucose und Insulintoleranz 35. Allerdings ist Adipozyten Apoptose noch ein wenig untersucht Phänomen, trotz der Hypothese, dass die induzierte Adipozyten Apoptose zu einer verminderten Gewichts führen könnte.
Die vorliegende Protokoll verwendet immunhistochemischen Methoden unterschiedliche Phänomene wie Proliferation, Apoptose und Hypoxie in vivo zu untersuchen. Daher wurde das Gewebe mit 4% Formaldehyd fixiert, was ein kritischer Schritt. Eine erweiterte Gewebefixierungszeit führt der Epitope zu ändern, die für den Antikörper nicht zugänglich. Im Gegensatz dazu erhöht eine kurze Fixierzeit die Empfindlichkeit der Epitope Reagenzien. Die empfohlene optimale Zeitpunkt der Fixierung ist 24 Stunden. Darüber hinaus beeinflusst die Dicke der Abschnitte auch die Antikörper an ihre Epitope binden; optimale Dicke liegt zwischen 2 und 5 um. Abschnitte dicker als 5 & mgr; m erhalten falsch-positive Ergebnisse aufgrund der erhöhten Bindungsstellen. Im Gegensatz, sexionen dünner als 2 um enthalten weniger Bindungsstellen und positive Bereiche sind nicht gut definiert. Weitere wichtige Faktoren sind die Antikörper selbst, Inkubationszeit, Konzentration und gleichmäßige Temperatur, die die Qualität der spezifischen Bindung an die Epitope beeinflussen. Daher ist die Antikörperkonzentration und Inkubationszeit Validierung für jede Bedingung notwendig.
Um die Studie abgeschlossen ist , stellen wir ein in vitro Adipozytendifferenzierung Protokoll, die durch verschiedene Behandlungen, Stimulation oder Co-Kulturen ausgedehnt werden könnte. Durch die Verwendung von in vitro - Kulturen Adipozyten, ist es möglich , Defekte in Adipozyten - Differenzierung und Funktionen zu bestimmen. Um erhalten zuverlässige Ergebnisse, wie für alle primären Zellen, die gesundes Verhalten und Aussehen der ADSCs und Adipozyten ganz wichtig ist. Die Granularität, zytoplasmatische vacuolations und / oder Ablösung sind Anzeichen für eine Verschlechterung, was auf unzureichende Medium, eine mikrobielle Kontamination oder Seneszenz des primärenZellen. Dieses Protokoll wird unter Verwendung von isolierten Adipozyten aus dem Fettpolster Gewebe, während es auch möglich ist , mesenchymale Stammzellen aus dem Knochenmark , wie 36 von anderen Protokollen isoliert zu verwenden. Die neueste Stroma-Vorläuferzellen enthält, die in einem sehr frühen Schritt der Adipozyten-Differenzierung auftretende zusätzliche Differenzierung Probleme widerspiegeln könnte, könnte dies in unserem aktuellen Protokoll fehlen. Darüber hinaus kann ADSCs schnell erweitert werden (mehr als 10 Mal innerhalb einer Woche), und langfristige kultiviert ADSCs nach einigen Passagen noch ihre mesenchymalen Pluripotenz 37,38 behalten. Ein weiterer Vorteil ADSCs ist, dass man leicht auf die menschliche schalten kann, kann, da ADSCs von Patienten durch Liposuktion geerntet werden, die eine einfache und minimal-invasive Methode.
Wie in mehreren anderen Organen in einer endokrinen Weise beeinflusst, sollte das Protokoll zu adipokines erweitert werden. Adipokinen, wie Leptin, Adiponectin, Tumor-Nekrose-Faktor-α (TNF) and resistin, von Adipozyten sezerniert werden bekannte Stoffwechselerkrankungen zu beeinflussen , indem sie den Fettstoffwechsel, Energie - Homöostase und Insulin - Empfindlichkeit Steuerung 39. Daher sollten Analysen Serum und Adipozyten Sekretom ausgeführt werden. Im Falle von Funktionsstörungen AT, adipokines und proinflammatorische Zytokine, wie IL-6, kann zu Fehlregulation von Organen führen, wie der Leber und Bauchspeicheldrüse und der Muskelfunktion 4. Um systemische Organdysfunktion auszuschließen, Tiermodelle oder Zellkulturen auf ihre Reaktion könnte getestet, um Stimulation und Aufnahme Glukose.
Hier bieten wir ein Protokoll für den Grundzustand des AT Analyse und Adipozyten in vivo und in vitro molekularen Mechanismen der Adipozyten - Homöostase und Funktionalität zu offenbaren.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Dr. J. Luther und K. Ubieta die Daten und Dr. B. Grötsch für die Vorbereitung für das Korrekturlesen des Manuskripts zu freundlich danken. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (BO3811 / 1-1-Emmy Noether).
Materialien
| Name | Company | Catalog Number | Comments |
| RNAlater solution | Ambion | AM7021 | RNA stabilization solution |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystems | 4368813 | |
| SYBR Select Master Mix | 4472908 | ||
| Purified Mouse Anti-Human Ki-67 | BD Biosciences | 550609 | Clone B56 (RUO) |
| Purified Mouse Anti-Human Ki-67 Clone B56 (RUO) | 550609 | Proliferation marker | |
| FITC Annexin V | BioLegend | 640906 | |
| Cleaved Caspase-3 Rabbit mAb | Cell signalling | 9664S | Clone 5A1E |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | 9664 | Apoptosis marker | |
| Lipofectamine2000 Reagent | Invitrogen | 11668-027 | |
| TO-PRO-3 Iodide | T3605 | Nuclear counterstain, Monomeric cyanine nucleic acid stain, Excitation⁄Emission: 642⁄661 nm | |
| Mayer’s hemalum | Merck | 109249 | hematoxylin |
| pegGOLD TriFast | Peqlab | 30-2030 | TRIzol, single-phase solution of guanidine isothiocyanate and phenol |
| Percellys Ceramic Kit 1.4 mm | 91-PCS-CK14 | tubes containing ceramic beads (1.4 mm) | |
| Precellys 24 | 91-PCS24 | homogenizer | |
| HIF-1 alpha Antibody | Pierce | PA1-16601 | |
| HIF-1 alpha Antibody, 16H4L13 | 700505 | Hypoxia marker | |
| In Situ Cell Death Detection Kit, Fluorescein | Roche | 11 684 795 001 | TdT-mediated dUTP-biotin nick end labeling (TUNEL) |
| Eosin | Sigma | 318906 | |
| DNase I Solution (1 unit/µl) | Thermo Scientific | EN0525 | |
| biotinylated anti mouse IgG (H+L) | Vector Laboratories | BA-9200 | |
| biotinylated anti mouse IgG (H+L) | BA-1000 | ||
| Vectastain ABC Kit | PK-4000 | ||
| VECTASHIELD Mounting Medium with DAPI | H-1200 |
Referenzen
- Obesity and Overweight. Fact Sheet °113. WHO. , (Jan 2014) (2014).
- Gong, Z., Muzumdar, R. H. Pancreatic function, type 2 diabetes, and metabolism in aging. Int J Endocrinol. , 320482(2012).
- Deng, Y., Scherer, P. E. Adipokines as novel biomarkers and regulators of the metabolic syndrome. Ann N Y Acad Sci. 1212, 1-19 (2010).
- Rezaee, F., Dashty, M. Role of Adipose Tissue in Metabolic System Disorders Adipose Tissue is the Initiator of Metabolic Diseases. J Diabetes Metab. , 008(2013).
- Rutkowski, J. M., Stern, J. H., Scherer, P. E. The cell biology of fat expansion. J Cell Biol. 208, 501-512 (2015).
- Ma, X., Lee, P., Chisholm, D. J., James, D. E. Control of adipocyte differentiation in different fat depots; implications for pathophysiology or therapy. Front Endocrinol (Lausanne). 6, 1(2015).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metab. 4, 263-273 (2006).
- Luther, J., et al. Elevated Fra-1 expression causes severe lipodystrophy. J Cell Sci. 124, 1465-1476 (2011).
- Luther, J., et al. Fra-2/AP-1 controls adipocyte differentiation and survival by regulating PPARgamma and hypoxia. Cell Death Differ. , (2014).
- Semenza, G. L. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annu Rev Cell Dev Biol. 15, 551-578 (1999).
- Kim, W., Kaelin, W. G. The von Hippel-Lindau tumor suppressor protein: new insights into oxygen sensing and cancer. Curr Opin Genet Dev. 13, 55-60 (2003).
- Aragones, J., Fraisl, P., Baes, M., Carmeliet, P. Oxygen sensors at the crossroad of metabolism. Cell Metab. 9, 11-22 (2009).
- Sun, K., Halberg, N., Khan, M., Magalang, U. J., Scherer, P. E. Selective inhibition of hypoxia-inducible factor 1alpha ameliorates adipose tissue dysfunction. Mol Cell Biol. 33, 904-917 (2013).
- Imai, T., Jiang, M., Chambon, P., Metzger, D. Impaired adipogenesis and lipolysis in the mouse upon selective ablation of the retinoid X receptor alpha mediated by a tamoxifen-inducible chimeric Cre recombinase (Cre-ERT2) in adipocytes. Proc Natl Acad Sci U S A. 98, 224-228 (2001).
- Clegg, D. J., Brown, L. M., Woods, S. C., Benoit, S. C. Gonadal hormones determine sensitivity to central leptin and insulin. Diabetes. 55, 978-987 (2006).
- Haluzik, M., et al. Genetic background (C57BL/6J versus FVB/N) strongly influences the severity of diabetes and insulin resistance in ob/ob mice. Endocrinology. 145, 3258-3264 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical biochemistry. 162, 156-159 (1987).
- Paraffin Processing of Tissue. Protocolsonline. , Available from: http://protocolsonline.com/histology/sample-preparation/paraffin-processing-of-tissue/ (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9, 671-675 (2012).
- Planat-Benard, V., et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. 109, 656-663 (2004).
- Kusminski, C. M., et al. MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. Nat Med. 18, 1539-1549 (2012).
- Trajcevski, K. E., et al. Enhanced lipid oxidation and maintenance of muscle insulin sensitivity despite glucose intolerance in a diet-induced obesity mouse model. PLoS One. 8, 71747(2013).
- Montgomery, M. K., et al. Mouse strain-dependent variation in obesity and glucose homeostasis in response to high-fat feeding. Diabetologia. 56, 1129-1139 (2013).
- de Queiroz, K. B., et al. Molecular mechanism driving retroperitoneal adipocyte hypertrophy and hyperplasia in response to a high-sugar diet. Mol Nutr Food Res. 58, 2331-2341 (2014).
- Ye, J. Emerging role of adipose tissue hypoxia in obesity and insulin resistance. Int J Obes (Lond). 33, 54-66 (2009).
- Xiong, Y., et al. The local corticotropin-releasing hormone receptor 2 signalling pathway partly mediates hypoxia-induced increases in lipolysis via the cAMP-protein kinase A signalling pathway in white adipose tissue. Mol Cell Endocrinol. 392, 106-114 (2014).
- Bozec, A., et al. Osteoclast size is controlled by Fra-2 through LIF/LIF-receptor signalling and hypoxia. Nature. 454, 221-225 (2008).
- Varia, M. A., et al. Pimonidazole: a novel hypoxia marker for complementary study of tumor hypoxia and cell proliferation in cervical carcinoma. Gynecol Oncol. 71, 270-277 (1998).
- Park, M. H., Choi, K. Y., Jung, Y., Min do, S. Phospholipase D1 protein coordinates dynamic assembly of HIF-1alpha-PHD-VHL to regulate HIF-1alpha stability. Oncotarget. 5, 11857-11872 (2014).
- Tennant, D. A., et al. Reactivating HIF prolyl hydroxylases under hypoxia results in metabolic catastrophe and cell death. Oncogene. 28, 4009-4021 (2009).
- Kim, J., So, D., Shin, H. W., Chun, Y. S., Park, J. W. HIF-1alpha Upregulation due to Depletion of the Free Ubiquitin Pool. Journal of Korean medical science. 30, 1388-1395 (2015).
- Amelio, I., et al. TAp73 opposes tumor angiogenesis by promoting hypoxia-inducible factor 1alpha degradation. Proceedings of the National Academy of Sciences of the United States of America. 112, 226-231 (2015).
- Suga, H., et al. Adipose tissue remodeling under ischemia: death of adipocytes and activation of stem/progenitor cells. Plast Reconstr Surg. 126, 1911-1923 (2010).
- Moreno-Indias, I., Tinahones, F. J. Impaired adipose tissue expandability and lipogenic capacities as ones of the main causes of metabolic disorders. J Diabetes Res. 2015, 970375(2015).
- Keuper, M., et al. An inflammatory micro-environment promotes human adipocyte apoptosis. Mol Cell Endocrinol. 339, 105-113 (2011).
- Sera, Y., et al. Hematopoietic stem cell origin of adipocytes. Experimental hematology. 37, 1108-1120 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue engineering. 7, 211-228 (2001).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular biology of the cell. 13, 4279-4295 (2002).
- Scherer, P. E. Adipose tissue: from lipid storage compartment to endocrine organ. Diabetes. 55, 1537-1545 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten