Method Article
Anwendungen der Einzel-Sonde: Mass Spectrometry Imaging und Einzelzellanalyse unter Umgebungsbedingungen
In diesem Artikel
Zusammenfassung
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Zusammenfassung
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Einleitung
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protokoll
Tiernutzung und Wohlergehen sollte von der Institutional Animal Care und Use Committee (IACUC) an den NIH Leitfaden für die Pflege und Verwendung von Labortieren folgende Protokolle überprüft und genehmigt einzuhalten. Maus-Gewebeproben wurden durch Mitarbeiter Dr. Chuanbin Mao zur Verfügung gestellt.
1. Maus Gewebeschnitten Vorbereitung
- Legen Sie eine ganze Maus Organ von Interesse (Gehirn, Niere, Leber, etc.) in der Mitte eines kleinen Plastik gut (zB 12-Well - Zellkulturplatte) und versenken in Gewebeein Verbindung bis zu etwa 10 mm Höhe. Stellen Sie sicher , dass es keine Blase in der Gewebeein Verbindung gebildet ist und dass das Organ in der gewünschten Ausrichtung platziert wird (dh sagittalen, koronalen, etc.).
- Ab sofort stellen Gewebe in flüssigem Stickstoff für Flash Einfrieren. Für die langfristige Lagerung, speichern Sie die gefrorenen Proben in einem -80 ° C Gefrierschrank.
- Nehmen Sie das Gefriergut Maus Orgel und tauen auf -15 ° C in einem temperature gesteuert Kryoschnittmaschinen.
- Sichere Gewebe auf eine Stahlbasis mit etwa 500 ul Gewebe Einbettmasse und legen auf eine Kryoschnittmaschinen sectioning montieren, so dass die gewünschte Schnitt Ausrichtung ist mit dem Messer dargestellt.
- Abschnitt das Gewebe bis zu einer 12 & mgr; m Dicke. Legen geschnittene Gewebescheiben auf Polycarbonat-Objektträger und lassen für 30 Minuten bei Raumtemperatur trocknen. Für die langfristige Lagerung, speichern Sie die gefrorenen Folie in einem -80 ° C Gefrierschrank.
2. Zellkultur
Hinweis: Die Zellkultur wurde in biologischen Sicherheitsschrank (Biosafety Level II) unter sterilen Bedingungen durchgeführt. HeLa-Zelllinie wurde als Modellsystem verwendet, und die Zellen wurden in komplettem Kulturmedium mit den folgenden herkömmlichen Protokollen gezüchtet:
- Warm Reagenzien (dh, Trypsin, phosphatgepufferter Salzlösung (PBS), und Zellkulturmedium) auf 37 ° C.
Hinweis: Das Zellkulturmedium enthält anorganische salts, Aminosäuren, Vitamine und andere. Eine vollständige Liste der Bestandteile, beziehen sich auf die Formulierung vom Hersteller. - Erhalten Zellprobe (zB 1 ml HeLa Zellsuspension) und fügen Sie sie in 9 ml komplette Zellkulturmedium in einem Standard - 10-cm - Zellkulturplatte. Die Anfangszellzahl beträgt etwa 0,5 x 10 6 Zellen / ml. Halten Zellen in Kultur bei 37 ° C mit 5% CO 2 für 2-3 Tage , bis die Wachstumsoberfläche bei 70-80% auf der Zellkulturplatte überdeckt ist. Nehmen Sie Zelle Passage-Nummer für jede nachfolgende Runde.
- Führen Zelle Passagierung (dh Zell splitting) in der Zellkulturplatte.
- Absaugen Wachstumsmedium, und verwenden Sie 5 ml 1x PBS, die Zellen zu spülen. Entfernen PBS eine sterile Absaugspitze verwendet, und Inkubieren der Zellen mit 2,5 ml Trypsin (0,25%) für ~ 5 min bei 37 ° C, die Zellen von der Kulturplatte abzulösen.
Anmerkung: Der tatsächliche Trypsin Behandlungszeit optimiert werden müssen entsprechend der spezifischen Trypsin product vom Hersteller bezogen. Eine unzureichende Behandlungszeit lässt die anhaftenden Zellen an der Platte, während eine übermäßige Behandlung zum Zelltod führt. - Stop Trypsin-Aktivität durch Zugabe von 7,5 ml kompletten Zellkulturmedium, und dann resuspendieren gleichmäßig um die Zellen (Gesamtvolumen 10 ml). Verwenden Sie die Zellsuspension für Kultur (Schritt 2.2) oder der Zubereitung von SCMS Proben (Schritt 2.4).
- Absaugen Wachstumsmedium, und verwenden Sie 5 ml 1x PBS, die Zellen zu spülen. Entfernen PBS eine sterile Absaugspitze verwendet, und Inkubieren der Zellen mit 2,5 ml Trypsin (0,25%) für ~ 5 min bei 37 ° C, die Zellen von der Kulturplatte abzulösen.
- Bereiten Sie die Zellproben für SCMS Experimente.
- Legen Sie einzelne Mikro Abdeckung gleitet in einer 12-Well-Platte, und fügen Sie 1,8 ml Zellkulturmedium und 0,2 ml Zellsuspension in den Brunnen.
- Sanft Zellen unter leichtem Schütteln der Platte, zu mischen und in einer 5% CO 2 -Umgebung bei 37 ° C für ~ 24 Stunden inkubiert. Zur medikamentösen Behandlung zu den kultivierten Zellen durchzuführen, fügen Sie eine Wirkstoff - Verbindung Lösung (zB in DMSO (Dimethylsulfoxid)) in 12-Well - Zellkulturplatte.
Hinweis: Die endgültige Arzneimittelkonzentration (beispielsweise 10 nM, 100 nM, 1 uM und 10 uM) und treatment Zeit (beispielsweise 4 h) werden entsprechend dem besonderen Zweck Studien variiert. Die Zellen werden zu den Mikro Abdeckung gleitet und bereit für die CSMS Experimente (Schritt 6) angebracht ist.
3. Single-Sonde Fabrication
- Legen Sie die Dual-Bohrung Quarzrohr (Innendurchmesser (ID) 127 & mgr; m Außendurchmesser (OD) 500 & mgr; m) in eine Laser-Mikropipette Abzieher und ziehen Sie eine Dual-Bohrung Quarz Nadel. Verwenden Sie die folgenden Parameter als Startpunkte: Wärme = 400, Fil = 3, Vel = 80, Del = 150, und Pul = 250 (alle Einheiten sind Hersteller Einheiten). Achten Sie darauf, die gezogen Dual-Bohrung Quarz Nadel hat eine konische Spitze für eine optimale Sondeneigenschaften. Schneiden Sie die Spitze gezogen, so dass es ~ 5 mm lang von unpulled Dual-Bohrung Quarzkapillarsäulen am anderen Ende links.
Anmerkung: Die tatsächlichen Parameter des Lasers puller sollten optimiert werden entsprechend den spezifischen Bedingungen des Instruments. - Schneiden Sie ein ~ 80 mm Abschnitt Quarzglaskapillare (ID 40 & mgr; m, OD. 105 & mgr; m) als Lösungsmittel Bereitstellung Kapillare, und legen Sie sie in eine Bohrung am flachen Ende des Dual-Bohrung Quarz Nadel.
- Schneiden Sie ein ~ 40 mm Abschnitt Quarzglaskapillare (ID 40 & mgr; m, OD 105 & mgr; m) und ein Rasiermesser rasieren ~ 5 mm der Polyimid-Beschichtung von dem mittleren Punkt. Verwenden Sie eine Propanflamme schnell zu erwärmen, und ziehen Sie die fusionierten Kapillare in einem Nano-Elektrospray-Ionisation (ESI) Emitter mit einem feinen Verjüngung. Schneiden Sie ein Nano-ESI-Emitter (~ 7-10 mm lang), und setzen Sie sie in die andere Bohrung am flachen Ende des Dual-Bohrung Quarz Nadel. Alternativ können Sie die Laser-Abzieher eine feine Verjüngung zu erzeugen.
- Tragen Sie eine minimale Menge (~ 1-2 ul) UV-aushärtenden Harzes auf dem flachen Ende des Dual-Bohrung Quarz Nadel und verfestigen das Harz unter Verwendung einer LED-UV-Lampe für ~ 20 Sekunden das Lösungsmittel Bereitstellung Kapillare und die Nano- zu sichern ESI-Emitter. Die Verfahren , die einzelnen Teile in einer einzigen Sonde zu montieren sind in 1a gezeigt.
- Schneiden Sie ein Standardmikroskop glass Schieber (1 "x 3") in die Hälfte der Länge nach. Legen Sie die Single-Sonde auf ein Ende des Glasobjektträger, so dass die Nano-ESI-Emitter nach außen gerichtet ist. Wenden Sie das regelmäßige Epoxid , um den Körper des Einzel Sonde , so dass es auf den Glasträger (Abbildung 1b) gesichert wird. Lassen Sie über Nacht zum Härten. Paar die hergestellte Single-Sonde mit der integrierten Single-Sonde Setup (Abbildung 1c), die mit einem Massenspektrometer angebracht ist , wie in 1d dargestellt.
4. Bauen Sie die integrierte Einzel-Sonde MS-Setup
- Ändern Sie die Ionenquelle Trennstellenflansch des Massenspektrometers und fabrizieren den Ständer (mit einstellbarer Position und Höhe) des digitalen Stereoskop (Figuren 1e und 1f).
- Bohren Sie eine Ionenquelle Trennstellenflansch mit zwei Löchern so dass für die Befestigung eines Aluminium optischen Bord. Machen Sie eine Gleitschiene Vorrichtung und eine Höhenverstellstab (anein XY - Tisch für die Feinpositionsabstimmung), so dass das digitale Stereoskop System kann auf dem Aluminium optischen Platte (1e angebracht sein).
- Bringen Sie den modifizierten digitalen Stereo-Mikroskop, ein USB-Digital-Mikroskop, ein Miniatur-Handbuch XYZ-Bühne mit einem flexiblen Klemmhalter, die motorisierte XYZ-Stufen-System an das Aluminium optische Platine, die auf die kundenspezifische Ionenquelle Trennstellenflansch des Massenspektrometers angebracht ist (Figuren 1c und 1f). Verwenden Sie den flexiblen Klemmhalter die Glasobjektträger mit einem Single-Sonde gebunden zu beheben.
- Bringen Sie die Single-Tastkopfeinstellung dem Massenspektrometer (Abbildung 1f). Stellen Sie die flexible Klemmhalter und den Miniatur-XYZ-Stativs dem Emitter des single-Sonde vor dem Einlass des Massenspektrometers zu legen. Verwenden Sie das USB-Digitalmikroskop (mit einstellbarem Betrachtungswinkel) auf der Seite der Single-Sonde, die eine gezoomte in Bild des Einzel p zu liefernRobe Spitze oder die Nano-ESI-Emitter und die digitale Stereoskop (mit einstellbarer Höhe) über dem Single-Sonde die Zellen und die Sondenspitze zu sehen.
Hinweis: ausgestattet mit Umgebungs Ionisierungsquellen die entsprechenden Ionenquelle Flansch Mit dieser integrierten Single-Sondensystem kann auf alle anderen Arten von Massenspektrometern gekoppelt werden.
5. Ambient MSI
- Auftauen Probenabschnitt bei Raumtemperatur und legen Sie es auf den motorisierten XYZ-Stufen-System unter dem Single-Sonde. Stellen Sie die Probenposition durch die Koordinaten in der Steuersoftware zu ändern.
- Die Spritze mit der Sampling - Lösungsmittel bei einer geeigneten Rate (beispielsweise 0,2 & mgr; l / min), und Anwendung der Ionisationsspannung (zB 5 kV) zu pumpen. Die Auswahl des Probenahme Lösungsmittel ist flexibel, und die häufigsten sind MeOH: Wasser (9: 1) und Acetonitril. Das Totvolumen des nano-ESI-Emitter wurde geschätzt ~ 3 nl zu sein, und die Zeit zwischen dem Sonden surface Kontakt und Ionensignal Beobachtung ist in der Regel weniger als 1 sec 15.
Anmerkung: Die kundenspezifische Ionenquelle Trennstellenflansch ermöglicht die Ionisationsspannung von dem Massenspektrometer zu einer leitenden Verbindung durch eine Krokodilklemme zu liefern. Die Ionisationsspannung wird dann durch eine leitfähige Vereinigung mit dem Lösungsmittel in der Kapillare und die einzelnen Sondenkanälen übertragen, und auf die Nano-ESI-Emitter angelegt, um die abgetastete Analyten zu ionisieren. Stellen Sie sicher, dass die Ionisierung Spannung abgeschaltet wird, wenn die Krokodilklemme mit dem leitenden Vereinigung zu verbinden. - Stellen Sie die Höhe der einzelsträngigen Sonde, so daß sie gerade über die Oberfläche der Probe aufliegt und in der Lage oberflächen Extraktion von Metaboliten auszuführen. Heben Sie den Z-Bühne, und verwenden Sie dann den USB-Digitalmikroskop (auf der Seite der Single-Sonde), um die Abstandsänderung zwischen der Single-Sondenspitze und Gewebeoberfläche zu überwachen. Überwachen Sie Änderungen im Massenspektrum in dieser Höhenverstellung und stoppen Aufzuging der Z-Stufe, wenn eine Änderung des Ionensignals von Lösungsmittel Hintergrund Gewebe Metaboliten beobachtet wird.
- Wiederholen Sie Schritt 5.3 dreimal für automatisierte Oberflächen Abflachung Anpassung drei verschiedenen Punkten innerhalb der Bühne Steuerprogramm einzustellen. Die Spitze der einzelsträngigen Sonde an drei Punkten auf der Probenoberfläche in einem Abstand von etwa 10 mm voneinander entfernt sind. Führen Höhenverstellung durch Drücken auf die Taste und den Abwärtspfeil, und verriegeln Sie die drei Punkte in die richtige Position unter dem "Plan-Methode".
- Legen Sie ggf. weitere Parameter für die über den Abschnitt von Interesse in der Probe mit diesem Programm Rasterung. Für die Maus Nierenschnitten hier dargestellt, mit einem 10,0 um / s Rasterung Geschwindigkeit und 20 & mgr; m Abstand zwischen den Linien. Das motorisierte Stufen-System verfügt über eine 0,1 um minimale Inkrement Bewegung. Der Abstand zwischen der einzelnen Sondenspitze und Gewebe aus Schritt 5.3 erhalten.
- Legen Sie ein Verfahren zur automatisierten Erfassung von MS-Spektren aus dem Massenspektrometer nach oben. for hohe Massenauflösung MSI auf Maus Nierenprobe, verwenden Sie die folgenden Parameter: Massenauflösung 60.000 (m / Dm), ~ 5 kV positiven Modus, 1 Micro, 150 ms max Einspritzzeit und AGC auf. Alle erfassten MS-Spektren einzelnen Zeilen des Bildes darstellen MS hatten die gleiche Anzahl von Abtastungen mit gleichförmigen Zeitabstand zwischen jeder Abtastung, die anzeigt, dass die Pixelgrößen für die erzeugten Bilder wurden gleichmäßig verteilt.
- Starten Sie die MSI-Datenerfassung. Starten Sie die MS Erfassungssequenz für das Massenspektrometer und dann die Rasterung Sequenz für das XYZ-Steuerprogramm zu initiieren.
- Zum Beispiel gehen in der MS-Datenerfassungsprogramm hier genutzt, um "Sequence Setup", wählen Sie "Neue Sequenz", erzeugen eine Reihe von Dateien für eine neue Sequenz von 01 bis X nummeriert, wobei X die Anzahl der Zeilen für die verwendete gewünschte MS Bild genommen werden, und dann "Run-Sequenz" drücken.
- Verwenden Sie eine selbst gemachte elektronische Gerät die Software zu ermöglichen, eine Conta zu produzierenct Schließsignal für das Massenspektrometer, um die Daten zu sammeln. Der Schaltplan wird in der zusätzlichen Abbildung (Abbildung S1) als Referenz gezeigt.
- Konstruieren Sie MS Bilder aus rohen MS-Dateien mit entsprechenden MSI-Visualisierungs-Software. Zum Beispiel, wenn das Software - Paket von Laskin Gruppe am PNNL 17 entwickelt wurde, führen Sie die folgenden Schritte aus .
- Klicken Sie auf "Brows Datei." Wählen Sie die erste Datei aus dem MSI-Experiment erhalten. Angeben, wo die Datei startet und endet unter "Anzahl der Kanäle." Wählen Sie einen Bereich von m / z - Werte für die MS - Bildbereich unter "Enter MZ Range".
- Drücken Sie die Schaltfläche "Start" die Bildentstehungsprozess zu initiieren. Sobald die MS Bild gemacht, klicken Sie auf "Bild speichern" unter "Symbolleiste" Bilder im Computer zu speichern.
6. In-situ - Live - SCMS
- Richten Sie die Single-Sondensystem, wie pro anweisenIonen für MSI. Stellen Sie das Lösungsmittel (zB MeOH / H 2 O oder Acetonitril) Strömungsrate (zB ~ 25 nl / min).
- Waschen der kultivierten Zellen, die auf den Mikrodeckglasobjektträger angebracht sind, mit PBS Kulturmedien und die extrazelluläre Wirkstoffkomponenten zu entfernen. Legen Sie Zelle mit Glasträger auf den motorisierten XYZ-Stufen-System für das Experiment.
Hinweis: Alternativ können Sie die frische Zellkulturmedium (ohne fötales Rinderserum), um die kultivierten Zellen zu spülen. Weniger Ionensuppression beobachtet. Darüber hinaus können Zellen für eine längere Zeit während des Experiments überstehen, wo die Umgebungstemperatur (~ 20 ° C) wesentlich niedriger als die Züchtungstemperatur (37 ° C). Die Arzneimitteltyp, Lösungskonzentration und Behandlungszeit variieren in verschiedenen Studien. - Fokus des digitalen Stereo-Mikroskop (über der Probe) auf die Spitze der Single-Sonde Zellpenetration bei der Analyse zu überwachen. Verwenden Sie das USB-Digitalmikroskop (auf der side der Single-Sonde), um die Arbeitsbedingungen der Nano-ESI-Emitter auf der Single-Sonde zu überwachen.
- Verwenden Sie den motorisierten XYZ-Bühne Steuerprogramm und digitale Stereo-Mikroskop (oben Zellen), um eine Zelle von Interesse zu suchen, und positionieren genau die Single-Sondenspitze über die Probe. MS beginnen Datenerfassungs- bevor die einzelsträngige Sondenspitze in die Zelle eingeführt wird.
- Verwenden Sie die folgenden Parameter als Referenz für die MS-Analyse ein hochauflösendes Massenspektrometer: Massenauflösung 100.000 (m / Dm), ~ 3 kV positiven und negativen Modus, 1 Micro, 150 ms max Einspritzzeit, AGC-Modus auf. Automatische Übernahme von MS-Spektren wird durch Klicken auf "Start" in der MS-Datenerfassungsprogramm.
- Heben Sie den motorisierten Z-Bühne durch Klicken auf das Symbol der Zellmembran und halten die Aufzeichnung der MS-Signal aus der Zelle erzeugt einzudringen. Eine Zeitverzögerung von 1-2 sec ist in der Regel zwischen der Sonde und dem Einsetzen MS Signalerfassungs beobachtet. Als die andere BestätigungZellpenetration, kann eine dramatische Veränderung der MS-Signale auf die Penetration der Zellmembran beobachtet werden. Die MS-Signale der intrazellulären Verbindungen können in der Regel für dauern ~ 15-20 Sekunden vor eine deutlich verringern.
- Weiter unten der Zellenplatte die einzelnen Sondenspitze aus der Zelle zu ziehen, enthält. Es dauert in der Regel <15 sec für die Ionensignale der zellulären Verbindungen um den Geräuschpegel zu nähern. Lassen Sie den Lösungsmittelfluss für ~ 3 min vollständig die Single-Sonde spülen zu. Inzwischen positionieren Sie den motorisierten System XYZ-Bühne die nächste Zelle zu lokalisieren analysiert werden. Jede Zelle erfordert Experiment ~ 3 min durchgeführt werden.
Ergebnisse
Die Single-Sonde wurde für die Umgebungs MSI Analyse der aufgeschnittene Mausnierengewebe 15 erfolgreich eingesetzt. Die Vorrichtung verwendet den Mechanismus der Oberflächenflüssigkeit Mikroextraktion (1a), die hocheffiziente Analyten Extraktion aus einem kleinen Bereich, was zu reichlich Ionensignale Intensitäten in den MSI Ergebnisse. Zum Beispiel haben die Signalintensitäten von mehr als 10 7 seit einigen reichlich Metaboliten (Abbildung 2a) erreicht. Eine große Anzahl von Metaboliten wurden in dieser Weise erfasst wird , einschließlich einer Anzahl von Sphingomyelin (SM) und Phosphatidylcholin (PC) -Spezies wie [SM (34: 1) + Na] + (725,5575 m / z), [PC (32: 0) + H] + (734,5700 m / z), [PC (34: 1) + Na] + (782,5696 m / z) und [PC (38: 5 + Na)] + (814,5726 m / z). Diese Verbindungen wurden mit hoher Massenauflösung und Massengenauigkeit identifiziert, wenn gekoppelt toa hochauflösenden Massenspektrometer. So wurde beispielsweise die Identifikation mit weniger als 4 ppm m / z Massengenauigkeit (dh die Differenz zwischen den beobachteten und theoretischen Werte) für jeden Metaboliten (2b) in hier dargestellten Ergebnisse erzielt. Darüber hinaus analysiert Tandem MS (dh, MS / MS) wurden auch für sicherer Identifizierung von Spezies von Interesse durchgeführt. 15
Aufgrund der Fähigkeit , kann eine effiziente Flüssigkeitsmikroextraktion der Durchführung auf einer kleinen Fläche, die Single-Sondenvorrichtung verwendet werden , 15 eine hohe räumliche Auflösung MSI Experimente unter Umgebungsbedingungen durchzuführen. Zum Beispiel haben detaillierte MS Bilder von Maus - Nierenschnitten erhalten wurden , die räumliche Verteilung von ausgewählten Metaboliten darstellt (Abbildung 2c). Die räumliche Auflösung des MS Bild wurde bestimmt 8,5 um, werden im Anschluss an die weit verbreitete Metrik, um die Transiti des Habens. auf Punkt einer scharfen Funktion innerhalb einer 20-80% Intensitätsänderung des MS - Signals bestimmt 18 Im Fall von Phospholipid [PC (38: 5 + Na)] + auf der Maus Nierenschnitt, das Feature Übergang zwischen der inneren Medulla und die äußere Medulla erfolgt über einen Zyklus in der Chronogramm ist eine Intensitätsänderung von mehr als 20-80% Bereich zeigt. Basierend auf der Probenbewegungsgeschwindigkeit (10,0 & mgr; m / s) und MS Datenerfassungsrate (0,85 sec / Spektrum), die Probe in einer MS Bewegungsdistanz Zyklus scannen (8,5 & mgr; m), dh die MSI - räumliche Auflösung, kann berechnet werden (Abbildung 2d). Diese räumliche Auflösung gehört zu den höchsten noch für Umgebungs MSI Techniken auf biologische Proben durchgeführt erreicht.
Für SCMS war die Single-Sonde der Lage , die Analyse der einzelnen Live - HeLa - Zellen 16 zu erreichen. Die Spitze Größe der Single-Sonde ist in der Regel weniger als 10 & mgr; m (Abbure 3a), die direkt in vielen Typen von eukaryontischen Zellen eingeführt werden , die klein genug ist, dessen Durchmesser von ~ 10 um, für die Extraktion und MS - Analyse. Der Einführvorgang der einzelsträngigen Sondenspitze in eine Zelle kann visuell unter Verwendung eines digitalen Stereo - Mikroskop beobachtet werden (Abbildung 3b), und die Zellmembran Penetration kann durch die schnelle und signifikante Änderung der Massenspektren von PBS (oder frische Zellkultur bestätigt werden mittel) an intrazelluläre Verbindungen (Figuren 3c und 3d). Die Experimente können in sowohl positive als auch negative Ionen Modi durchgeführt werden, um breitere Typen von molekularen Spezies erkennen. Beispielsweise 18 verschiedenen Lipidarten wurden im positiven Modus identifiziert, einschließlich der Sphingomyeline (SM) und Phosphatidylcholine (PC), während Adenosin - Phosphaten (AMP, ADP und ATP) wurden im Negativ - Ionen - Modus (Fig 3c und d) nachgewiesen. Die Zeitverzögerung zwischen der Single-Sonde Einfügung into einer Zelle und der Signalerfassungs betrug typischerweise weniger als zwei Sekunden, eine nahezu Echtzeit-Erkennung von zellulären Metaboliten ermöglicht. SCMS wurde auch auf Experimenten angewendet , wo Zellen , die mit Antikrebsmitteln behandelt wurden (beispielsweise OSW-1, Paclitaxel und Doxorubicin) 19]. Die entsprechenden Arzneimittel können bei einer Reihe von Konzentrationen (dh 10 nM, 100 nM, 1 uM und 10 uM) in HeLa - Zellen nach 4-stündiger Behandlung nachgewiesen werden in DMSO (Dimethylsulfoxid), die unbehandelten Zellen unter Verwendung (Hinzufügen DMSO nur ) als die Kontrollen. Die MS - Signale von Drogen waren nicht innerhalb der extrazellulären PBS oder der Kontrolle (Abbildung 3e), wurden aber in den einzelnen Zellen , die die Single-Sonde MS - Technik nachgewiesen werden (Ergebnisse nur 100 nM Behandlung sind in Abbildung 3f gezeigt). Weil die Zellen mit PBS (oder frisches Zellkulturmedium) gespült wurden extrazellulären Verbindungen und Verunreinigungen zu entfernen, die Detektion von endogenen Metaboliten (zB Zelllipiden einerd Adenosin - Phosphate) und exogene Verbindungen (zB Krebsmedikamente) anzeigt , daß die einzelsträngige Sonde MS Technik intrazellulären Verbindungen zu analysieren , verwendet werden können.
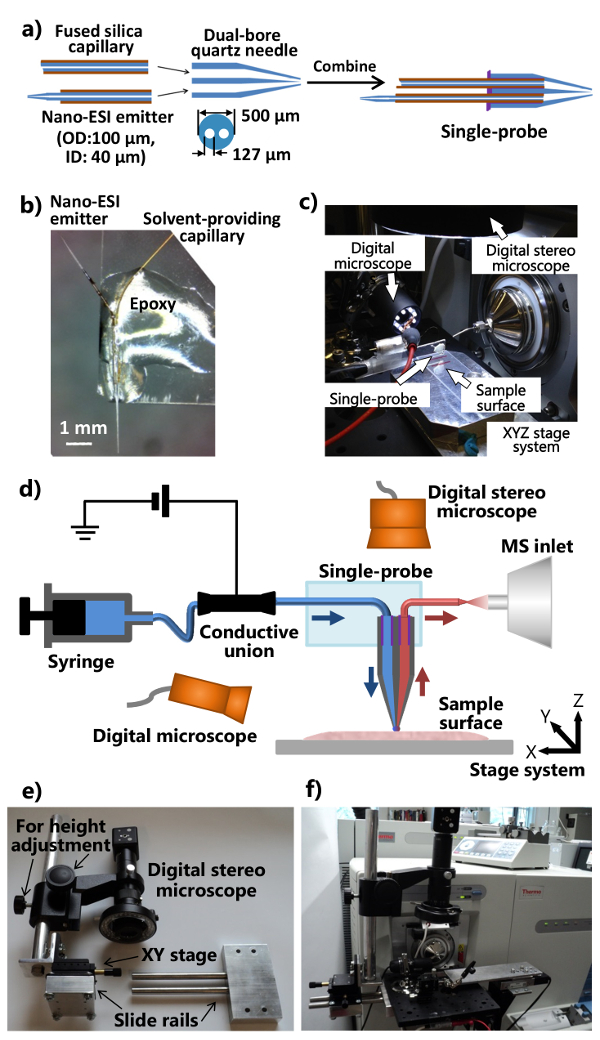
Abbildung 1. Die Herstellung und Einrichtung der einzelnen Sonde für Umgebungs MSI und SCMS Analyse a . ) Herstellung Verfahren der Einzelsonde. B) Foto eines gefertigten Einzel Sonde an einem Glasträger. C) Fotografie des Single- mit einem Massenspektrometer. d) Schematische Darstellung der Einzel Tastkopfeinstellung gekoppelt mit einem Massenspektrometer angebracht Tastkopfeinstellung. Während eines Experiments wird das Probenahme Lösungsmittel kontinuierlich aus der Spritze vorgesehen, die Ionisierung Spannung an die leitfähige Vereinigung von dem Massenspektrometer zugeführt wird, zwei digitale Mikroskopen verwendet Probe Platzierung zu überwachen, die motorisierte XYZ-StativsSystem wird verwendet , Probe Bewegung zu steuern, und ein Massenspektrometer für die Analyse. e) Foto des individualisierten digitalen Stereoskop - System f . ) Foto zeigt die digitale Stereoskop zu der Ionenquelle Trennstellenflansch durch einen optischen Platte angebracht verwendet. Bitte klicken Sie hier , um die sehen eine größere Version dieser Figur.
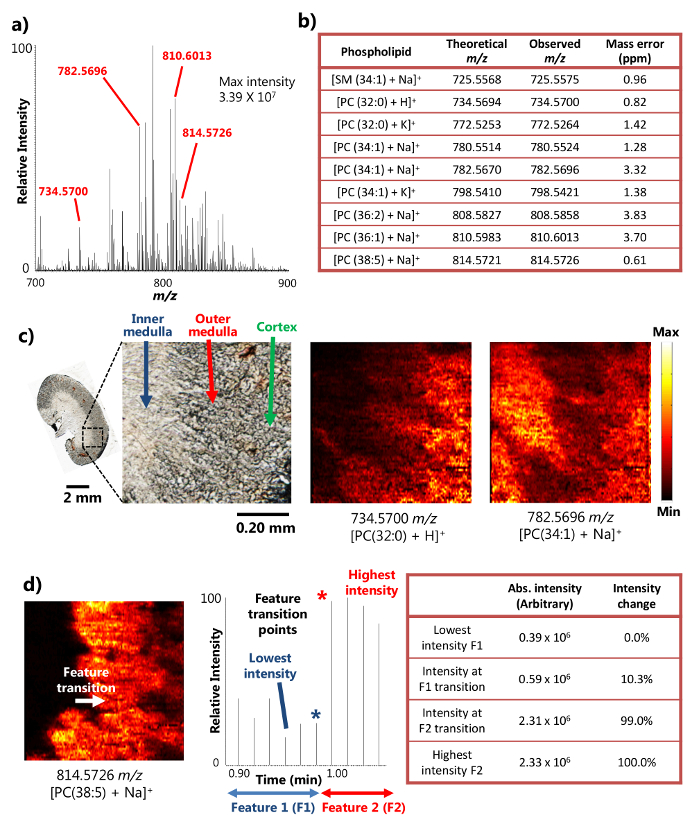
Abbildung 2. Die Ergebnisse einer Umgebungs MSI Studie einer Maus Nierenschnitt mit hoher räumlicher und Massenauflösung. A) Eine repräsentative Massenspektrum aus der Single-Sonde MSI. Die maximale Intensität der nachgewiesenen Metaboliten können mit ihren Massengenauigkeit. C 3,39 x 10 7 (willkürliche Einheiten). B) Eine Auswahl der nachgewiesenen Metaboliten angegeben erreichen)MS Bilder von [PC (32: 0) + H] + und [PC (34: 1) + Na] + von einem Maus - Nierenschnitt bei 8,5 um räumliche Auflösung gemacht. PC: Phosphatidylcholin. Maßstabsbalken: 2 mm; 0,20 mm (kleines Bild) d) Bestimmung der räumlichen Auflösung des MS Bild für. [PC (38: 5) + Na] + (angepasst mit Genehmigung aus Lit. 15). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Die Ergebnisse einer Umgebungs SCMS Analyse der Arzneimittel - behandelten HeLa - Zellen mit hoher Massenauflösung. A) Vergrößerte-in Fotografie der Single-Sondenspitze eine typische Größe von <10 & mgr; m im Durchmesser zeigt. B) Foto an dem Punkt gemessen von Single-Sonde Einsetzen in eine HeLa-Zelle. Maßstabsbalken: 50 & mgr; m.c) Eine typische positive Ionenmodus - Massenspektrum mit den Identifikationen einer Anzahl von PC (Phosphatidylcholin) -Spezies. d) Eine repräsentative Liste von Metaboliten aus SCMS Analyse von HeLa - Zellen nachgewiesen sowohl in den positiven und negativen Ionenmodus. ef) Massenspektren für die Kontrolle und behandelt (100 nM OSW-1) Zellen (mit Genehmigung aus Lit. 16 angepasst). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Abbildung S1. Schaltplan der elektronischen Vorrichtung verwendet , um Kontaktschließsignal zu erzeugen , für Massenspektrometer Daten zu sammeln. Bitte klicken Sie hier , um diesen Wert anzuzeigen oder herunterzuladen.
Diskussion
Die einzelsträngige Sonde ist ein Multifunktionsgerät, das für beide MSI und SCMS-Experimente verwendet werden kann. Die Single-Sonde Setup (einschließlich Übersetzung Bühnensysteme, Mikroskope, Ionenquelle Trennstellenflansch, etc.) wird als Add-On - Komponente entwickelt , die an das bestehende Massenspektrometer flexibel angepasst werden kann. Ein schneller Austausch zwischen der Single-Sonde Setup und der herkömmlichen ESI-Ionenquelle kann innerhalb einer Minute erreicht werden. Im Prinzip die entsprechende Ionenquelle Trennstellenflansch verwendet, kann die Single-Sonde Setup auf die alle anderen Massenspektrometern angepasst werden. Zusätzlich kann die Probennahme Lösungsmittel eine Vielzahl von Reagenzien enthält, die mit dem Einzelsondenaufbau für reaktive MSI und SCMS-Experimente verwendet werden, die stark die Detektion breitere Bereiche von Biomolekülen verbessert. Neben tierischen Geweben und Zelllinien, ist die Single-Sonde ebenfalls in der Lage andere biologische Systeme wie Pflanzen analysiert. Daher kann mit dem gleichen Versuchsaufbau undähnlichen Benutzertraining kann eine Vielzahl von Studien durchgeführt werden, um ein einzelnes Instrument und durch den gleichen Benutzer, so dass für eine effiziente und vielseitige Experimente mit der minimalen Trainingszeit und Instrumentierungs Kosten erreicht werden.
Die Schlüsselkomponente des Single-Sonde MS-Technik ist die Sonde selbst. Die Qualität der Single-Sonde hat einen wesentlichen Einfluss auf die Leistung, die weitgehend die Qualität der beiden MSI und SCMS Experimente bestimmt. Bei Single-Sonden Herstellung, stellen Sie sicher, dass die Kapillaren innerhalb des Dual-Bohrung Schläuche sind sicher die Möglichkeit, Lösungsmittelleck während der Versuche zu beseitigen geklebt. Es ist wichtig, eine minimale Menge an UV-härtbarem Epoxid zu verwenden, so dass die Öffnungen und Kapillaren werden nicht während der Sondenherstellung verstopft.
Die Single-Sonde verwendet wurde 15 hoher räumlicher und Massenauflösung Umgebungs MSI auf biologischen Proben durchzuführen. Der große Vorteil der Umgebungs MSI überNicht-Umgebungs Verfahren ist , dass die Probenvorbereitung zumindest ohne die Notwendigkeit einer Vakuumprobennahme Umgebung gehalten wird, die die Probe 8 in einer nahezu nativen Zustand analysiert werden können. Eine der größten Hürden für die meisten anderen Umgebungs MSI Technik hat einen Mangel an räumlicher Auflösung 1 gewesen. Verglichen mit der Desorption basiert MSI Techniken (wie DESI und LAESI), die kleine Spitze Größe der einzelsträngigen Sonde ermöglicht eine robuste und effiziente Oberflächenflüssigkeit Mikroextraktion über einen kleinen Bereich durchgeführt werden, was zu einer hohen räumlichen Auflösung von 8,5 um, die zu den höchsten 15 Umgebungs MSI Techniken erreicht werden. Zusätzlich stellt die Komponenten der Probenahme Lösungsmittel Einstellen zusätzliche Flexibilität die Experimente durchzuführen. Beispielsweise, Probenahme Lösungsmittel enthalten Reagenzien (zB dikationische Verbindungen) wurden zur Durchführung reaktive MSI Experimenten verwendet, was eine signifikante Zunahme in der Anzahl der identifizierten Metaboliten per Experiment 20. Der andere Vorteil der einzelsträngigen Sonde ist die integrierte Konstruktion, die den Bedienungskomfort während der gesamten Datenerfassungsprozess bereitstellt. Da der Abstand zwischen der Spitze und der Gewebeoberfläche für die Ionensignalintensität und Stabilität sehr empfindlich ist, eine flache Gewebeschnitt zu erhalten und leitenden Oberflächenanpassung Abflachen des Abstandsvarianz zu minimieren, ist ein Schlüssel für hochwertige MSI Experimenten. Daraus folgt, dass die Single-Sonde MSI Techniken nicht geeignet sind, eine hohe räumliche MS Bilder von unebenen Oberflächen zu erhalten.
Neben der Bereitstellung einer qualitativ hochwertigen Sonde zu Herstellung, das Gerät sorgfältig Tuning ist essentiell für einen erfolgreichen MSI Experiment. Unter allen Abstimmungsschritte, die Anpassung der Höhe der einzelnen Sondenspitze über dem Gewebeschnitt Oberfläche ist die kritische. Wenn die Sonde Höhenverstellung, die Pumpe das Lösungsmittel Probenahme und schalten Sie die Ionisierung Spannung, so dass nur die Lösungsmittel Hintergrund Ionensignale observ sein kanned. Dann überwacht die Änderung des Massenspektrums während sorgfältig die Sondenoberflächenabstand zu reduzieren, indem die motorisierte Z-Stufe, bis starke und stabile Ionensignale von Gewebeschnitt Anheben beobachtet werden kann; diese Sondenhöhe wird für MSI Datenerfassung während des Experiments verwendet werden. Darüber hinaus ist eine optimierte Lösungsmittelflussrate für MSI Experimente notwendig. Stellen Sie die Durchflussrate mit der optimierten Sondenhöhe. Stellen Sie sicher , dass es keine Lösungsmittel Ausbreitung auf der Gewebeoberfläche ist ( das heißt, Durchflussrate zu hoch) oder Blasenbildung innerhalb des Nano-ESI - Emitter (dh Durchfluss zu niedrig ist).
Die Single-Sonde ist ein multifunktionales Gerät für die Bioanalytik. Zusätzlich zu den Experimenten MSI, ist es in der Lage nahezu in Echtzeit der Durchführung in-situ SCMS 16 detaillierte chemische Informationen vom lebenden eukaryotischen Zellen zu erläutern, was ein großer Vorteil ist , verglichen mit anderen Vakuum basierend SCMS Techniken (wie MALDI 10 und SIMS 21 ). Die geringe Größe der Sondenspitze bietet die Möglichkeit, in eine lebende eukaryotische Zelle eingeführt zu werden und die intrazelluläre Verbindungen zur sofortigen MS-Analyse zu extrahieren und zu ionisieren. Ebenso können die Probenahme Lösungsmittel enthalten Reagenzien (zB dikationischer Verbindungen) in den SCMS Experimenten verwendet werden, und ein breiteres Spektrum von zellulären Bestandteile können als je zuvor in einer Live - Einzelzelle nachgewiesen werden (laufende Forschung, werden Daten nicht gezeigt). Obwohl die Echtzeit-Analyse der chemischen Profile von lebenden Einzelzellen liefert, aufgrund der Zellpenetration der Membrane und Extraktion von Zellinhalt, wird die Zelle in Untersuchung nach dem Versuch getötet werden was bedeutet, daß die einzelsträngige Sonde SCMS Technik immer noch eine destruktive Methode. Darüber hinaus kann die Sondenspitze und Nano-ESI-Emitter in der Single-Sonde leicht für unerfahrene Anwender verstopft sein. Um die Wahrscheinlichkeit von Geräteverstopfung zu reduzieren, stellen Sie sicher zu berühren den Kern zu vermeiden, wenn die Single-Sondenspitze in eine cel Einfügenl. Wenn Verstopfung auftritt, kann das Gerät durch Aufheizen der verstopften Sondenspitze oder die Nano-ESI - Emitter mit einer selbstgebauten Heizwendel 16 regeneriert werden. Eine weitere Einschränkung der einzelsträngigen Sonde SCMS - Technik ist , daß nur die Klebe Zellen (dh werden die Zellen an Oberflächen befestigt) analysiert werden können aktuelle Setup. Indem jedoch die Zellmanipulationssystem in die Einzelsonde MS gerät, breiteren Zelltypen können in Zukunft untersucht werden.
Ähnlich wie bei dem Experiment MSI, eine qualitativ hochwertige Sonde und ein optimiertes Lösungsmittelflussrate ist für SCMS Studien kritisch zu erhalten. Wenn das Lösungsmittel Flussrate Abstimmung wird die Single-Sondenspitze über die Probe gelegt (dh kein Kontakt mit der Zelle oder dem Kulturmedium), und stellen Sie sicher , dass es von der Sondenspitze oder Blasenbildung in der Nano-ESI kein Lösungsmittel tropft ist Emitters.
Offenlegungen
We have no conflict of interest to declare with the work presented here.
Danksagungen
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Materialien
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Referenzen
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten