Method Article
Forming Gigantismus Polymersome Mit Gel-unterstützte Rehydrierung
In diesem Artikel
Zusammenfassung
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
Zusammenfassung
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
Einleitung
Schaffung von synthetischen zellgroßen, giant unilamellaren Vesikeln (GUV) ist ein zunehmendes Interesse an der in vitro Rekonstruktion verschiedener zellulärer Prozesse ein Rahmen für die Erzeugung einer künstlichen Zelle artigen Systems 1,2 aufzubauen. Während GUVs von Lipidmembranen bestehen ausgezeichnete Mimetika von natürlichen, biologischen Membranen sind, sind sie nicht stabil gegenüber Umweltschwankungen und haben eine ziemlich kurze Haltbarkeit. Aufgrund dieser Einschränkungen sind amphiphile Blockcopolymere als Lipid-Mimetika verwendet Polymer-Vesikel zu bilden, oder Polymers. In diesem Zusammenhang sind Polyersomen bei der Entwicklung von biomimetischen Zellsystemen vorteilhaft aufgrund ihrer erhöhten Stabilität 3, chemische Vielseitigkeit 4,5 und modifizierbar körperliche Merkmale 6 - 8.
Aktuelle Methoden Gigantismus Polyersomen Elektroformation 9 und Templat Rehydrierung 10, die beide w umfassen zu bildenhich sind zeitaufwändig, arbeitsintensiv, erfordern spezielle Ausrüstung und produzieren geringe Ausbeuten an intakten riesigen Polyersomen. Eine einfache Gel-assisted Rehydratation Verfahren wurde zur Herstellung von Lipid GUVs 11 kürzlich entwickelt. Hier beschreiben wir eine Anpassung der Gel-unterstützte Rehydrierung Technik bis hin zu riesigen Polyersomen mit unterschiedlichen Polymerzusammensetzungen, kontrollierte Größe und in verschiedenen Pufferzusammensetzungen erstellen.
Kurz gesagt, 1% w / v Standard-DNA-Gelelektrophorese Agarose Filme werden auf ein Deckglas dehydratisiert. Polymerlösungen in Chloroform hergestellt werden dann über die dehydratisierte Agarose Film ausgebreitet und verdampfen. Nach vollständiger Entfernung des Lösungsmittels, Polymerfilme werden in dem Puffer der Wahl bei mäßiger Erwärmung (40-70 ° C) und Riesen (> 4 & mgr; m) Größe Polymers innerhalb von 30 min gebildet werden rehydratisiert. Dieses Verfahren erzeugt schnell Hunderte von völlig intakt, wohlgeformte Polyersomen unter Verwendung von Standardlaborgeräten und reagents bei minimalen Kosten.
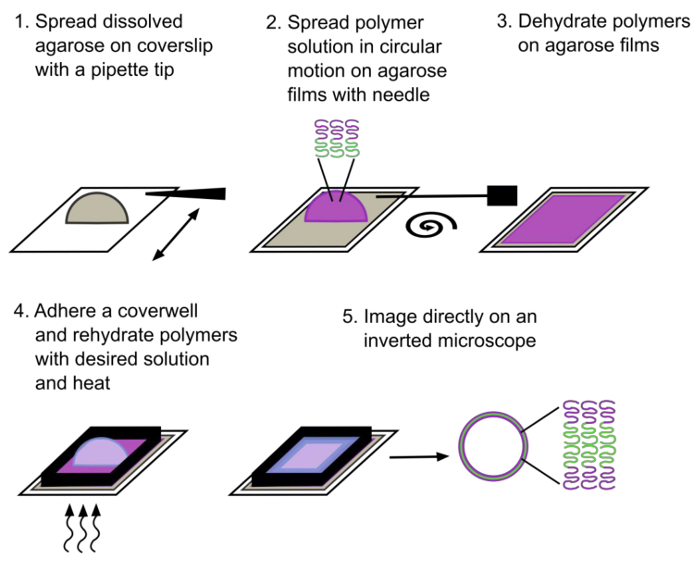
Abbildung 1. Schematische Darstellung der Gel-unterstützte Rehydrierung Methode. Riesen Polyersomen eines Diblockcopolymers bestehen nach ~ 30 min Rehydratisierungsgeschwindigkeit gebildet. Der hydrophile Block wird in Magenta und der hydrophobe Block bezeichnet wird grün gekennzeichnet. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Protokoll
1. Polymer und Agarose Vorbereitung
Hinweis: Handschuhe und Laborkittel sollte während dieses Protokoll jederzeit getragen werden. Schutzbrille sind ebenfalls bei der Arbeit mit einem beliebigen organischen Lösungsmittel oder einem Schritt mit möglichen Spritzwasser erforderlich.
- Eine 5 mg / ml Lösung von Polymer in Chloroform. 1 ml Chloroform und 5 mg festes Poly (ethylenoxid) - b- Poly (butadien) (PEO-PBD, EO 22 -BD 37) Diblockcopolymer in einem Glasfläschchen und Drall vollständig aufzulösen. Führen Sie alle Schritte Chloroform in einer chemischen Abzugshaube verwenden.
- Mischen in einem fluoreszenzmarkierten Lipids (erworben bereits in Chloroform gelöst) in einem 0,5 Mol-% Endkonzentration in 99,5 mol% unmarkiertem Polymer.
- Beispielsweise Pipetten ~ 12 & mgr; l einer 1 mg / ml fluoreszenzmarkierten Lipids in Chloroform in 997,58 ul PEO-PBD, EO 22 -BD 37 Polymer in Chloroform (mit einem Molekulargewicht von 2.950 Daltons) für eine Endkonzentration von 0.5 Mol-% markiertes Lipid gemischt und 99,5 mol% Polymer.
- Store-Lösung in einer luftdichten Phiole mit einem Chloroform beständigen Deckel bei -20 ° C. Wickeln Sie Klempner Band auf dem Fläschchen Rand, wo die Deckelschrauben auf das Fläschchen und sichern Sie den Deckel auf dem Fläschchen. Wickeln ein weiteres Stück plumbers Band auf der Außenseite des Deckels und schließlich wickeln Parafilm auf der Außenseite des Bandes minimal Verdampfung zu gewährleisten.
- Machen Sie eine 1% w / v Agarose-Lösung von in 50 ml Wasser 0,5 mg Standard-Agarose-Mischung (oder 50 ml 100 mM Saccharose) in einem 250 ml Erlenmeyerkolben. Kochen Sie die Agarose-Lösung in einem Standard-Mikrowelle für ca. 1 min (oder bis zur vollständigen Auflösung, wie durch die Räumung der Lösung angegeben).
Anmerkung: Die Agarose-Lösung kann nach wenigen Minuten der Abkühlung verwendet werden oder erstarren gelassen, gespeichert und erneut geschmolzen, um die gleiche Prozedur.
2. Agarose Film Vorbereitung
- Schneiden Sie das Ende aus einer 1000 ul Pipettenspitze zu einer Verstopfung zu verhindern. Mit Hilfe der Schnitt Spitze, Pipette 300 & mgr; l geschmolzener Agarose Lösung auf eine 25 mm im Quadrat Deckglas direkt vom Hersteller.
- Lassen die Agarose abkühlen zu ~ 65-75 ° C vor der Abscheidung. Wenn die Agarose zu kühl ist, wird sie beginnen an der Oberfläche während des Streuprozesses zum Verklumpen. Umgekehrt, wenn die Agarose zu heiß ist, wird es verbreitet erfordern die Agarose zu der Oberfläche zu haften.
- Halten Sie nur den Rand des Deckglases mit behandschuhten Fingern und verwenden Sie die lange Kante eines anderen 1000 ul Pipettenspitze die Agarose gleichmäßig über die Oberfläche des Deckglases zu verbreiten. Bewegen Sie die Pipettenspitze hin und her über das Deckglas, bis die Agarose vollständig haftet und deckt das Deckglas.
- Legen Sie die Agarose-beschichtete Deckglas auf ein Stück Parafilm mit der Agarose nach oben zeigt. Sobald die gewünschte Anzahl von Deckgläser beschichtet sind, legen Sie den Parafilm mit den Deckgläschen in einer 37 C-Inkubator ° der Agarose auf die Oberfläche für mindestens 1 h zu dehydratisieren.
Hinweis: Dehydrationwird durch das Verschwinden der sichtbaren Schicht aus Agarose bestimmt; das Deckglas flach aussehen und klar sollte. Sobald die Filme vollständig dehydriert sind, Deckgläser Speicher mit der Agarose-Oberfläche in einem Einweg-Kunststoff-Petrischale nach oben zeigt.
3. Polymerfilmbildung
- Pipette 30 ul hergestellten Polymerlösung auf dem Agarose-Film.
- Halten Sie nur den Rand des Deckglases mit behandschuhten Fingern und verwenden Sie die lange Kante einer 18 G-Nadel, die Lösung für die Agarose-Filme zu verbreiten eine kreisförmige Ausbreitung Bewegung. Weiter verbreitet, bis die Lösung verdampft wird.
Hinweis: Seien Sie der scharfen Ende der Nadel vorsichtig. - Platzieren Sie die Polymerfilme in einer Kunststoff-Petrischale Polymerseite nach oben und setzen die Petrischale in eine Standard-Haus Vakuumexsikkator in Aluminiumfolie abgedeckt (um zu verhindern Photobleichen des markierten Lipids) für mindestens 1 Stunde vollständig jegliches restliche Lösungsmittel zu entfernen.
4. Bildung von Polymersomes
- Halten Sie eine coverwell, entweder ein hausgemachtes Polydimethylsiloxan (PDMS) gut (ein ~ 0,5 cm dicken Block aus gehärteten PDMS mit ~ 1 cm Durchmesser der Mitte gestanzt) oder eine im Handel erhältliche gut an das Deckglas mit dem Polymerfilm beschichtet. Drücken der coverwell vorsichtig auf die polymerbeschichteten Deckgläschen mit dem Polymer nach oben, bis eine enge Abdichtung zwischen dem coverwell und dem Deckglas ausgebildet. Achten Sie darauf, nicht zu schwer zu drücken und das Deckglas brechen.
- Hinzufügen 200-500 ul Rehydratationslösung (Wasser ist gut, aber eine Reihe von Puffern oder Medien funktioniert auch) in die Kammer (Rehydratisierung Volumen ist abhängig von der Größe des coverwell geklebt).
- Erstellen Sie eine Feuchtigkeitskammer Verdampfen des Rehydrationslösung zu verringern. Legen Sie eine gerollt, nass Kimwipe entlang der Ränder einer Glaspetrischale. Platzieren Sie den Polymerfilm mit der beklebten coverwell in die Feuchtigkeitskammer und Deckel mit einem Deckel. Decken Sie die Petrischale mit Aluminiumfolie zu Photobleichens minimieren. Ortdie Petrischale auf einer Heizplatte für mindestens 30 min auf 40 ° C eingestellt.
- Die Temperatur der heißen Platte während der Rehydratisierung 24-70 ° C einzustellen , die Größe der Vesikel gebildet (Figur 5). 70 ° C ist in der Nähe der T m der Agarose so Vorsicht verwendet werden sollte , wenn über dieser Temperatur fortfahren.
5. Charakterisierung von Polymersome durch Frap (FRAP)
- Bewegen Sie das Deckglas mit der beklebten coverwell direkt an einem inversen Mikroskop für die Bildgebung.
- Wählen Sie den entsprechenden Filtersatz basierend auf dem fluoreszierenden Lipids in der Polymerlösung enthalten. Für Rhodamin-markierte Lipide in den Polymerlösungen dotiert ist, verwenden Sie ein 560/25 nm Anregungsfilter und ein 607/36 nm Emissionsfilter oder vergleichbare Filtersätze.
- Verwenden Sie ein 100X Öl-Objektiv auf der Oberseite des Deckglases zu konzentrieren, in denen die Polyersomen wird eingehalten werden. Wenn die Polyersomen sind besondersgroß (> 20 um) oder wenn der Polymerfilm zu dick ist, eine geringere Leistungsziel (beispielsweise 40X) sollten besser genutzt werden , um die Polymers visualisieren.
- Identifizieren Sie die Polyersomen mittels Fluoreszenzmikroskopie. Identifizieren Polyersomen durch die charakteristische hohle, kugelförmige Vesikel mit einem Durchmesser von> 5 & mgr; m.
- Charakterisieren Membranfluidität Fluorescence Recovery unter Verwendung von nach Photobleaching (FRAP) auf einem Fluoreszenzmikroskop einen einstellbaren Kondensator enthält. Aufgrund der adhärenten Natur und dichte Packung von Polyersomen auf den Substraten wird die natürliche Bewegung der Polyersomen begrenzt, FRAP Abbildungsqualität zu erhöhen.
- Konzentrieren Sie das Mikroskop auf die Polymerosom von Interesse. Schließen Sie den Kondensator auf einen kleinen Bereich und sicherzustellen, dass der Rand eines Polymerosom innerhalb der Abbildungsregion von Interesse ist.
- Erhöhen Sie die Kamera Belichtung und sicherzustellen, dass alle Neutralfilter entfernt werden, um wirksam die Region von Interesse photobleach. Lassen Sie die Membran fl uorescence Intensität für 30-60 Sekunden oder bis die Fluoreszenzintensität zu photobleach signifikant verringert.
- Schalten Sie die Lampe ausgeschaltet und vollständig in den Kondensator öffnen. Verringern Sie die Belichtung wieder auf die Starteinstellungen und beginnen sofort Bilder alle 30 Sekunden für 3 min zu erfassen.
- Berechnen Membrandiffusionskoeffizienten unter Verwendung von Standardverfahren 12. Wenn der gebleichten Bereich der Fluoreszenzintensität innerhalb des 3-5 min zurückgewinnt, zeigt dies an, daß die Membran Fluid ist.
6. Charakterisierung von Polymerosom Größe
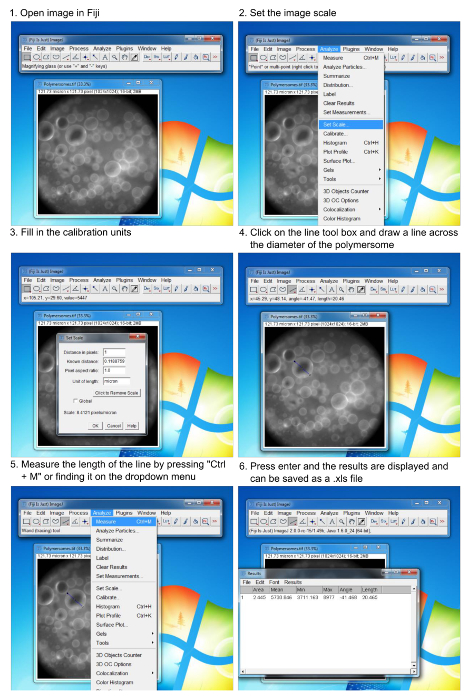
Abbildung 6. Verfahren zur Größenanalyse von Polyersomen Imaging - Software. Schritt- für -Schritt - Anleitung, wie man den Durchmesser der Vesikel gebildet zu messen. Der Benutzer muss wissen, um die Kalibrierungseinheiten in Pixel / & mgr; m des Mikroskops verwendet.ove.com/files/ftp_upload/54051/54051fig6large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
- Öffnen Sie die aufgenommenen Bilder von Polyersomen in der Bildanalyse - Software 13.
- Stellen Sie den Maßstab für das Bild, indem Sie auf den Dropdown-Feld zu analysieren und das Klicken "Set-Skala".
- Kalibrieren Sie den Maßstab für das Mikroskop mit Standardverfahren (dh ein Mikrometer).
- Füllen Sie die Kalibrierung Einheiten und klicken Sie auf "OK".
- Klicken Sie auf die Linie Werkzeugkasten und ziehen Sie eine Linie überspannt den Durchmesser eines Vesikel.
- Sammeln Sie die Längenmessungen durch Klicken auf das Dropdown-Feld zu analysieren und klicken Sie auf "Messen".
- Weiterhin einzelne Vesikel nach dem oben beschriebenen Verfahren zu messen und jede neue Messung mit den Messungen Datenfenster hinzugefügt werden.
- Drücken Sie "Strg + D" nach jeder Zeile Zeichnen und Messen der Länge der Linie auf die gezogene einzuprägenBild wodurch es einfacher zu verfolgen, welche Vesikel wurden analysiert.
Ergebnisse
Polyersomen wurden unter Verwendung der oben beschriebenen Verfahren (Abbildung 1) und die gemeinsame Laborgeräte in Abbildung 2 gezeigt skizzierte gebildet. Polyersomen wurden mit VE - Wasser (Abbildung 3) rehydratisiert und auf einem inversen Mikroskop in Epifluoreszenz- abgebildet , um eine 100X Öl - Objektiv verwendet wird . Beachten Sie, dass, wenn Polyersomen nicht sichtbar sind, können sie in Größen gebildet haben, zu groß und mit einem 100X Öl Ziel zu erfassen; eine geringere Leistung Ziel stattdessen werden müssen verwendet werden. Einer der Vorteile von Gel-assisted Rehydratisierung unter Verwendung ist die Vielseitigkeit der Polymers in einer Vielzahl von Rehydratationslösungen bilden. Polymers wurden in deionisiertem Wasser, eine vollständige Säugetierzellkulturmedium, Saccharoselösungen und zwei physiologisch relevanten Pufferlösungen (Phosphat-gepufferte Salzlösung (PBS) oder Tris-gepufferter Salzlösung (TBS)), wie in 4 gezeigt. Unter Standardbedingungen erfolgreich gebildet (Rehydrierungmit Wasser bei 40 ° C für 1 h), größer als ~ 70 Polymers werden typischerweise pro 40 x 40 & mgr; m 2 Sichtfeld gefunden. Während die Oberfläche Herstellung von Polymersome nicht homogen ist, gibt es Dutzende von Sichtfeldern mit diesem repräsentativen Ertrag. Weiterhin Polymers waren stabil in Lösung für mindestens 24 Stunden.
Polyersomen Größe wurde leicht durch Rehydratisieren Polymerfilme bei unterschiedlichen Temperaturen abgestimmt. Polymers in deionisiertem Wasser bei RT gebildet hatten einen mittleren Durchmesser von 2,9 ± 0,7 um. Wenn die Temperatur steigt während der Rehydration, steigt die durchschnittliche Größe der Polymers auch (Tabelle 1). Bei hohen Temperaturen (> 60 ° C), gebildet Polymers mit Größen sogar größer als 100 um (Abbildung 5).
Alle Bildverarbeitung wurde Open-Source - Bildbearbeitungssoftware (Abbildung 6) abgeschlossen werden.Bilder gesammelt wurden in der Software-Programm geöffnet. Die kalibrierte Pixelgröße wurde in Set Maßstab Feld eingegeben. Mit Hilfe der Zeilenwerkzeug wurden Linien über die Durchmesser gezogen. Nach jeder einzelnen Linie gezogen wurde, wurde die kalibrierte Länge gemessen und dem Ergebnisfeld hinzugefügt. Die Daten können dann in der mathematischen Software der Wahl aufgetragen werden (zB Excel, Prism, Herkunft, etc.)
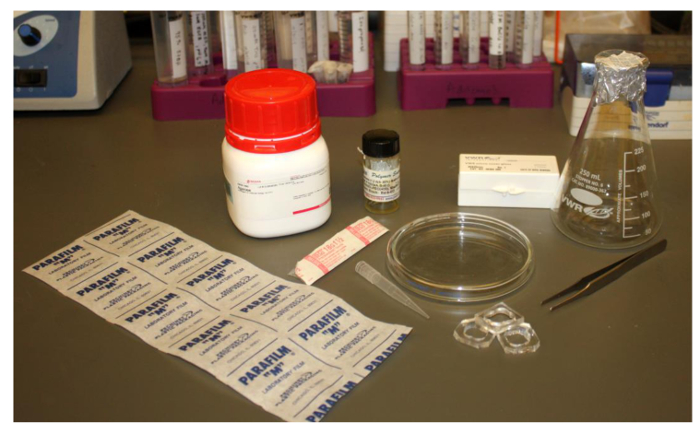
. Abbildung 2. Abbildung der gemeinsamen und kostengünstige Labormaterialien für die Bildung von Polyersomen erforderlich Die Artikel sind: Parafilm, ein 18,5 G - Nadel, Polymer in Chloroform oder einem anderen geeigneten Lösungsmittel, einem 1000 ul Pipettenspitze, einen Erlenmeyerkolben, Pinzette, Agarose, 25 mm im Quadrat Deck, PDMS - Bildgebung Brunnen und eine Glaspetrischale. Bitte klicken Sie hier , um diesehen eine größere Version dieser Figur.

Abbildung 3. Bilder des Gels unterstützten Rehydrierung Verfahren. Gelöste Agarose wird auf einer 25 mm im Quadrat Deckglas , bis sich eine sogar die gesamte Deckfilmüberzüge. Deckgläser werden dann in eine 37 ° C-Inkubator gestellt und Film dehydratisiert. Eine Polymerlösung wird auf die dehydrierte Agarose Film aufgebracht und verteilt eine Nadel in einer kreisförmigen Bewegung. Das Deckglas wird dann in einen Exsikkator O / N vollständig alle Lösungsmittelreste zu verdampfen. Schließlich wird und Imaging - Kammer an dem Substrat haftet und Polymere werden mit der Lösung der Wahl rehydriert und in eine Petrischale gegeben , bei 40 ° C für mindestens 25 min zur Bildung von Polyersomen zu ermöglichen. Bitte hier klicken , um eine größere Version davon zu sehen Zahl. >
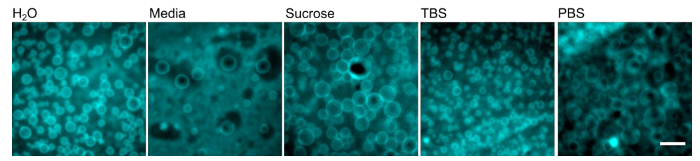
Abbildung 4. Polymersome können in einer Vielzahl von verschiedenen Puffern bilden. PEO-PBD Polymerfilme wurden mit den angegebenen Puffer rehydratisiert bei 40 ° C für 1 Stunde. Maßstabsbalken = 10 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
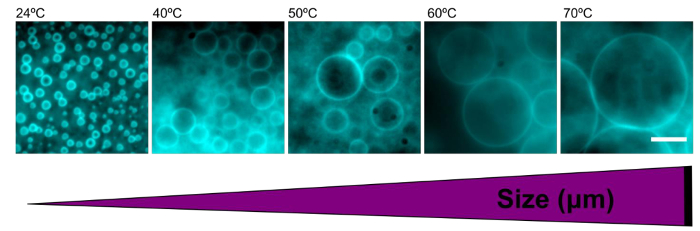
Abbildung 5. Die Erhöhung der Temperatur während der Rehydrierung erhöht die Größe der Polyersomen. Repräsentative Epifluoreszenz- Bilder von Polyersomen in Wasser bei den angegebenen Rehydrierung Temperaturen gebildet. Bei steigender Temperatur zu größeren Polyersomen. Maßstabsbalken = 10 & mgr; m._blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
| Temperatur (° C) | Durchschnittliche Größe (um) |
| 24 | 2,93 ± 0,7 |
| 40 | 5,76 ± 2,5 |
| 50 | 6,65 ± 2,4 |
| 60 | 11.46 ± 5.8 |
| 70 | 14.04 ± 7.0 |
Tabelle 1. Die Erhöhung der Temperatur während der Rehydrierung führt zu einer erhöhten Polymerosom Größe. Die mittleren Durchmesser für mehr als 100 Polyersomen in Wasser pro unterschiedlichen Temperaturbedingungen wurden berechnet und sind hier dargestellt. Fehler ist die Standardabweichung.
Diskussion
Polyersomen werden immer als biologische Membran ahmt weit erforscht. Die robusten und vielseitigen Eigenschaften von Polymeren machen sie weit attraktiv für Studien erfordern Membran Funktionalisierung, Langlebigkeit und abgestimmt Ansprechverhalten. Traditionelle Verfahren zur Bildung von Gigantismus Polyersomen 9,10 (> 4 & mgr; m) sind arbeitsintensiv und erfordern teure und spezielle Ausrüstung. Hier präsentieren wir zum ersten Mal, eine schnelle, flexible und robuste Methode zur Bildung von riesigen Größe Polyersomen mit kostengünstigen Standard-Laborreagenzien und Ausrüstung.
Verwendung von Gel-assisted Rehydratation kann unilamellar Polymers gebildet werden rasch (<30 min), in einer Vielzahl von Rehydratationslösungen (einschließlich Zellkulturmedien), und mit einer Vielzahl von unterschiedlichen Polymeren (Daten nicht gezeigt). Die Bildung von multilamellaren Vesikeln oder asymmetrischen nicht mit dieser Technik beobachtet. Während dieser Arbeit verwendeten wir Poly (ethylenoxid) - b- Poly (Butadien) (PEO-PBD, EO 22 -BD 37) neutral Diblockcopolymer. Viele verschiedene Polymerzusammensetzungen (einschließlich geladene Diblockcopolymere) arbeiten mit gut diese Methode (nicht dargestellt). Jedoch einige kommerziell erhältliche Triblock-Copolymere und höhermolekulare Diblockcopolymere (~> 5.000 Daltons) bilden keine deutliche Polymers. Für alle Experimente in diesem Manuskript wurde eine niedrige Konzentration an markiertem Lipid in die Polymerlösungen dotiert nur für Visualisierungszwecke. Andere Verfahren zur Visualisierung, einschließlich Polymere direkt mit einem fluoreszierenden Farbstoff funktionalisiert, können ebenfalls verwendet werden. Polyersomen kann ebenfalls mit Hellfeldmikroskopie abgebildet werden, obwohl die Fluoreszenzmikroskopie eine höhere Auflösung bietet.
Die meisten geringfügige Änderungen an dem Protokoll der Regel nicht verändern Ergebnisse. Beispielsweise Lösung kleine Unterschiede in der Konzentration des Polymers auf die Deckgläser verteilt verändern nicht die Bildung des Polymers film gebildet. Während die vollständige Konzentrationsbereich nicht bestimmt wurde, wird die Polymerosom Bildung erfolgreich mit einer großen Palette von Polymerfilm Konzentrationen (zB 1-10 mg / ml) auftreten. Es gibt jedoch einige Protokoll Veränderungen, die sich negativ auf die Polymerosom Bildung beeinflussen. Das bemerkenswerteste ist, dass die runden Glasplättchen (statt quadratisch) Ergebnis in einem sehr schlechten Bildung von Polyersomen. Wir führen dies auf die extrem gleichmäßige Schicht von Agarose auf dem Glas, die tatsächlich die Bildung von Polyersomen behindert.
Eine der wichtigsten Herausforderungen dieser Technik ist die Fähigkeit, die Polymers von der Oberfläche mit einer hohen Ausbeute zu gewinnen. Es gibt bestimmte Fälle, in denen die Polymers von der ursprünglichen Oberfläche entfernt von Vorteil sein kann. Aufgrund der hohen Hintergrundfluoreszenz aus dem entwässerten Polymerfilm, individuelle Polymers entfernen und anhaftenden ihnen Deckgläser zu reinigen werden Bildqualität und Charakterisierung (parti erhöhensonders bei FRAP-Analyse). Um dies zu tun, vorsichtiges Pipettieren mit einer Pipettenspitze in der das Ende geschnitten wurde ausgeschaltet wird die Polyersomen von der Oberfläche desorbieren (obwohl die Anzahl der gewonnenen Vesikel ist deutlich niedriger als die ursprünglich gebildet wird). Polymers kann dann auf modifizierten Deckflächen angeordnet werden, so dass der Polymerosom mit dem neuen Deckglas zu interagieren. Typischerweise für neutrale PEO-PBD Polyersomen, Deck mit Ozon behandelt für 15 min die Polyersomen erlauben für die Bildgebung an die Oberfläche zu fallen. Unterschiedliche Oberflächenmodifikation für verschiedene Polymerosom Zusammensetzungen erforderlich (zB negativ oder positiv Polymere geladen).
Die meisten Materialien in diesem Protokoll verwendet werden für Tage bis Wochen erfolgreich gespeichert und verwendet. Die erstarrte Agarose kann aufgekocht und wieder verwendet werden, bis die Agarose-Aggregate haben, auch nach dem Kochen beginnt, oder die erstarrte Agarose beginnt zu trocknen. Die Deckgläser mit getrockneten Agarose-Filme können gespeichert und Verwendung werdend auf unbestimmte Zeit (zB Monate). Das Polymer in Chloroform gelöst kann für mehrere Monate bei -20 ° C gelagert werden. Sobald der Polymerfilm auf der Agarose Filmen getrocknet wird, jedoch müssen die Filme innerhalb von zwei Wochen (längerfristige Lagerung wurde nicht direkt bestimmt unter Hausvakuum gespeichert und verwendet werden, aber es gibt deutliche Unterschiede in Polymers von Polymerfilmen gebildet älter als zwei Wochen).
Mit Hilfe der Gel-unterstützte Rehydrierung Protokoll hier vorgestellten, Hunderte von gleichmäßig förmigen Polyersomen gebildet werden schnell mit nur wenigen Stunden der Arbeit mit Standard-Ausrüstung und kostengünstige Laborreagenzien. Weiterhin kann Polymers in einer Vielzahl von physiologischen Pufferlösungen und von verschiedenen Polymerzusammensetzungen (nicht gezeigt). Geringfügige Änderungen an dem Verfahren gebildet werden , nicht negativ auf die Bildung von Polymers verändern, Gel-assisted Rehydratation ein vielseitiges und leicht zugängliche Technik Wissenschaftler Rendering mit unterschiedlichen technischen eXpertise.
Die Fähigkeit, leicht Riese Polyersomen auf der Größenskala von Zellen schaffen ist wichtig für den Aufbau von künstlichen zellähnlichen Systemen. Die einfache Handhabung und Vielseitigkeit der Gel-unterstützte Rehydrierung diese Polyersomen zu machen bietet eine enorme Fortschritt in der biomimetischen Feld für die Erstellung robuster Zellmembran imitiert. Beispielsweise unter Verwendung dieser Technik, Strategien für die Verkapselung von verschiedenen intrazellulären Komponenten, die Funktionalisierung des Polymers mit Zell-Membranproteinen und Inkorporation von Membrantransportproteinen, um nur einige zu nennen, können entworfen werden Polymerosom basierte künstliche Zellen zu bauen.
Offenlegungen
Sandia National Laboratories is a multi-program laboratory managed and operated by Sandia Corporation, a wholly owned subsidiary of Lockheed Martin Corporation, for the U.S. Department of Energy's National Nuclear Security Administration under contract DE-AC04-94AL85000.
Danksagungen
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
Materialien
| Name | Company | Catalog Number | Comments |
| 125 ml Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9 ml capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
Referenzen
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse - Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten