Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kapillarelektrophorese zum Monitor Peptid Verpflanzen auf Chitosanfilme in Echtzeit
In diesem Artikel
Zusammenfassung
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Zusammenfassung
Free-Lösung Kapillarelektrophorese (CE) trennt Analyten, im allgemeinen geladenen Verbindungen in Lösung durch die Anwendung eines elektrischen Feldes. Im Vergleich zu anderen analytischen Trenntechniken, wie Chromatographie, ist CE billig, robust und erfordert effektiv keine Probenvorbereitung (für eine Reihe von komplexen natürlichen Matrices oder polymere Proben). CE ist schnell und kann verwendet werden , die Entwicklung der Mischungen in Echtzeit zu verfolgen (beispielsweise chemische Reaktionskinetik), da die Signale für die abgetrennten Verbindungen beobachtet direkt proportional zu ihrer Menge in Lösung.
Dabei wird die Effizienz der CE gezeigt, zur Überwachung der kovalente Pfropfung von Peptiden auf Chitosan-Filme für nachfolgende biomedizinische Anwendungen. Chitosan ist antimikrobiell und biokompatiblen Eigenschaften machen es zu einem attraktiven Material für biomedizinische Anwendungen wie Zellwachstumssubstrate. Kovalent Pfropfen der Peptid RGDS (Arginin - Glycin -Asparaginsäure - Serin) auf die Oberfläche des Chitosanfilme zielt auf die Zellanheftung zu verbessern. Historisch haben Chromatographie und Aminosäureanalyse wurde eine direkte Messung der Menge des aufgepfropften Peptid bereitzustellen, verwendet. Jedoch ermöglicht die schnelle Trennung und Abwesenheit von Probenvorbereitung durch CE vorgesehen gleichermaßen genaue noch eine Echtzeitüberwachung des Peptids Pfropfverfahren. CE ist in der Lage, die verschiedenen Komponenten der Reaktionsmischung abzutrennen und zu quantifizieren: Die (nicht gepfropften) -Peptid und die chemischen Kupplungsmittel. Auf diese Weise führt die Verwendung von CE in verbesserte Folien für Downstream-Anwendungen.
Die Chitosan-Filme wurden charakterisiert durch Festkörper-NMR (kernmagnetische Resonanz) -Spektroskopie. Diese Technik ist zeitraubend und kann nicht in Echtzeit angewendet werden, aber eine direkte Messung des Peptids ergibt und somit validiert die CE-Technik.
Einleitung
Freie Lösung Kapillarelektrophorese (CE) ist eine Technik , die Verbindungen in Lösungen auf der Basis ihrer Ladung-zu-Reibungsverhältnis 1,2 trennt. Ladungs-Größenverhältnis wird häufig in der Literatur erwähnt, aber diese Vereinfachung gilt nicht für Polyelektrolyte, einschließlich Polypeptiden in dieser Arbeit, und wurde auch für kleine organische Moleküle 3 nicht als geeignet gezeigt. CE unterscheidet sich von anderen Trenntechniken in, daß es nicht eine stationäre Phase hat, nur eine Hintergrundelektrolyt (normalerweise ein Puffer). Dies ermöglicht die Technik in seiner Fähigkeit , robust zu sein , eine große Auswahl an Proben mit komplexen Matrices 4 wie Pflanzenfasern 5, Fermentation Sude 6 Pfropfen auf synthetischen Polymeren 7, Lebensmittelproben 8 und kaum lösliche Peptide 9 ohne langwierige Probenvorbereitung zur Analyse und Reinigung. Dies ist besonders bedeutsam für komplexe Polyelektrolyte, die Auflösung Probleme haben (such als Chitosan 10 und Gellangummi 11) und existieren daher als aggregierte oder in Lösung ausgefällt und haben ohne Probenfiltration erfolgreich analysiert. Ferner ging es um die Analyse von Zuckern in Frühstückszerealien Proben mit Partikeln von Frühstück Getreideproben in Wasser 8 gefällt injiziert wird . Diese erstreckt sich auch auf die Analyse von verzweigter Polyelektrolyte oder Copolymere 12,13. Umfangreiche Arbeit wurde auch in der Entwicklung von CE - Techniken speziell für die Analyse von Proteinen für die Proteomik 14, chirale Trennung von natürlichen oder synthetischen Peptide 15 und Mikrochip - Trennungen von Proteinen und Peptiden 16 abgeschlossen ist. Da die Trennung und Analyse in einer Kapillare nehmen, sind nur kleine Volumina von Probe und Lösungsmittel verwendet , das CE ermöglicht eine niedrigere Betriebskosten als andere Trennverfahren einschließlich Chromatographie 5,6,17 haben. Da die Trennung durch CE schnell ist, erlaubt es die monitoRing der Reaktionskinetik. Dies wurde in dem Fall der Pfropfung von Peptiden auf Chitosan - Filme für verbesserte Zelladhäsion 18 gezeigt.
Chitosan ist ein Polysaccharid aus der N -deacetylation von Chitin abgeleitet. Chitosan - Filme können solche für verschiedene biomedizinische Anwendungen verwendet werden , wie Bioadhäsive 19 und Zellwachstumssubstrate 18,20 aufgrund Chitosan der Biokompatibilität 21. Zellbindung an spezifische extrazelluläre Matrixproteine wie Fibronektin, Kollagenen und Laminin, direkt 22 , um das Überleben der Zellen verbunden. Bemerkenswert ist, erfordern unterschiedliche Zelltypen oft Bindung an verschiedene extrazelluläre Matrixproteine für das Überleben und die einwandfreie Funktion. Zellanheftung an Chitosan - Filme wurde durch das Pfropfen von Fibronektin 23 werden verstärkt dargestellt; jedoch Herstellung, Reinigung und Veredelung von solchen großen Proteinen ist nicht wirtschaftlich. Alternativ kann ein Bereich von kleinen Peptiden have wurde in der Lage gezeigt, die Eigenschaften der großen extrazellulären Matrixproteinen zu imitieren. Zum Beispiel Peptide wie die Fibronektin - Mimetika RGD (Arginin - Glycin - Asparaginsäure) und RGDS (Arginin - Glycin - Asparaginsäure - Serin) wurden die Zellbindung 24 verwendet zu erleichtern und zu erhöhen. Kovalentes Pfropfen von RGDS auf Chitosan - Filme zu einer verbesserten Zellanhaftung für Zellen in vivo 18 bis Fibronektin zu befestigen bekannt. Substituieren größere Proteine gefällt Fibronektin mit kleineren Peptiden, die die gleiche Funktionalität stellt eine erhebliche Kostenreduzierung aufweisen.
Hier Peptid an Chitosan Pfropfung wurde durchgeführt , wie zuvor 18 veröffentlicht. Wie zuvor gezeigt, bietet dieser Ansatz eine einfache und effiziente Pfropfen durch die Kupplungsmittel EDC-HCl (1-Ethyl-3- (3-dimethylaminopropyl) carbodiimid) und NHS (N - Hydroxysuccinimid) unter Verwendung der Carbonsäure der RGDS zu funktionalisieren zu sein auf das gepfropfteChitosan-Film. Zwei Vorteile dieses Pfropfverfahren sind , dass es keine Änderung des Chitosans benötigt oder des Peptids, und es wird in wäßrigem Medium durchgeführt zu maximieren Kompatibilität mit zukünftigen Zellkulturanwendungen 18,20. Als Kupplungsmittel und das Peptid aufladbar ist, ist CE ein geeignetes Verfahren für die Analyse der Reaktionskinetik. Wichtig ermöglicht, die Analyse der Reaktionskinetik mittels CE Echtzeit-Überwachung der Pfropfreaktion, und ermöglicht damit sowohl der Optimierung und der Pfropfgrad zu quantifizieren.
Während es nicht routinemäßig erforderlich ist, können die Ergebnisse der CE - Analyse durch eine direkte Messung des Peptids off-line überprüft werden Pfropfung auf die Chitosan - Filme unter Verwendung von Festkörper-NMR (kernmagnetische Resonanz) -Spektroskopie 25,26 , um die kovalente Pfropfung demonstrieren des Peptids auf den Film 18. Doch im Vergleich mit Festkörper-NMR-Spektroskopie, die Echtzeit-Analyse zur Verfügung gestellt vonCE ermöglicht die Quantifizierung des Peptids Verbrauch in Echtzeit und damit die Fähigkeit, die Kinetik der Reaktion zu bewerten.
Das oben erwähnte Verfahren ist einfach und ermöglicht die Echtzeit-Analyse von Peptid auf Chitosan-Filme mit indirekter Quantifizierung des Ausmaßes der Pfropfung Pfropfung. Die aufgezeigte Methode kann zur Echtzeit-quantitative Bewertung verschiedener chemischer Reaktionen verlängert werden, solange die Reaktanden oder die Produkte analysiert werden können berechnet.
Protokoll
1. Herstellung von Chitosanfilme
- Abwiegen 2 g Eisessig, komplett auf 100 ml mit Reinstwasser.
- Man wiegt 1,7 g Chitosan-Pulver, 100 ml der 2% m / m Essigsäure wässriger Lösung. Rühren Sie für 5 Tage mit Rührstab und magnetische Rührplatte bei Raumtemperatur entweder mit Aluminiumfolie abgedeckt oder in der Dunkelheit.
- Zentrifugieren Sie die Chitosan-Dispersion bei 1076 × g bei 23 ° C für 1 Stunde. Die überstehende Flüssigkeit mit einer Spritze und entsorgen Sie den Niederschlag.
- Für jeden Film, Aliquot von 10 ml der Chitosan-Suspension in eine 9 cm Kunststoff-Petrischale bei Raumtemperatur. Lassen Sie die verdeckten Filme für mindestens 7 Tage trocknen.
- Mit einer Schere schneiden Sie die trockenen Filme in 1 x 1 cm große Quadrate. Hinweis: Das Experiment kann in diesem Stadium angehalten werden.
2. Herstellung von Phosphat-gepufferter Saline (PBS)
- Man wiegt 8 g Natriumchlorid, 0,2 g Kaliumchlorid, 1,44 g Dinatriumhydrogenphosphat phosphat und 0,24 g Kaliumdihydrogenphosphat.
- Man löst diese abgewogen Chemikalien in 800 ml Reinstwasser und titriert die Lösung mit konzentrierter Salzsäure auf einen pH-Wert von 7,4.
Hinweis: Das Experiment kann in diesem Stadium angehalten werden.
3. Herstellung von 75 mM Natriumboratpuffer bei pH 9,2
- Man wiege 3,0915 g Borsäure. Man löst es in 75 ml Reinstwasser.
- Titrieren die Borsäure Lösung auf einen pH von 9,2 mit einer Natriumhydroxid-Lösung bei einer Konzentration von 10 M oder höher.
Achtung: Konzentrierte Natronlauge sind ätzend und sollte mit Handschuhen angefasst werden. - Komplett mit Reinstwasser zu erhalten 100 ml Lösung. Dies ergibt eine 500 mM Natriumboratpuffer bei pH 9,2.
- Verdünne das 500 mM Natriumboratpuffer mit Reinstwasser bis 75 mM Natriumboratpuffer. Hinweis: Das Experiment kann in diesem Stadium angehalten werden.
4. Herstellung von Chitosan Films für die Pfropfreaktion
- Spülen 10 Quadrat Chitosanfilme (1 x 1 cm) in 5 ml PBS für 2 Stunden in einer Petrischale bei Raumtemperatur.
- Während dieser Zeit vorzubereiten und die Kapillar-Elektrophorese-Instrument (Schritt 5) zu validieren.
5. Herstellung und Validierung der Kapillarelektrophorese Instrument
- Vorbereiten eines 43,5 cm bare Quarzglaskapillare mit einem Innendurchmesser von 50 & mgr; m (43,5 cm beträgt die Gesamtlänge, die wirksame Länge zu dem Detektionsfenster wird in der Regel 35 cm), indem das Polymer äußeren Beschichtung der Kapillare Schwächung bei der eingestellten Länge mit einem stumpfe utensil schnappen dann die Kapillare.
- Erstellen eines Fenster für die Kapillare durch ein Feuerzeug mit Hilfe der Polymerbeschichtung bei 8,5 cm von dem Einlaß zu verbrennen und nach Abwischen kühlt es sauber mit Ethanol. Brennen Sie die Beschichtung der Kapillare an jedem Ende für ein paar Millimeter mit einem Feuerzeug, und nachdem sie abkühlt sauber wischen mit Ethanol.
- Platz Kapillare inside Detektionsfenster und installieren in der Kapillarkassette indem sie bei gleichen Längen in dem Einlass und Auslass platziert und um die Spindeln der Wickelkassette. Installieren Sie dann die Kassette in der Kapillar-Elektrophorese Instrument.
- Die Parameter des Verfahrens für jede Trennung. Im Software-Menü wählen Sie "Methode", dann "das gesamte Verfahren zu bearbeiten". Stellen Sie die Temperatur, Zeit, Spannung und Phiolen für die Trennung verwendet wird (beispielsweise 25 ° C, 10 min, 30 kV).
- Im Abschnitt Präkonditionierung, stellen die aufeinanderfolgenden Spülungen: 10 min mit 1 M Natriumhydroxid (in Wasser), 5 min mit 0,1 M Natriumhydroxid (in Wasser), 5 min mit Reinstwasser und 5 min mit 75 mM Natriumboratpuffer bei pH 9,2 für die erste Methode einer Reihe von Analysen.
- Für die folgenden Methoden, stellen Sie die Menge, die die aufeinanderfolgenden Spülungen in der Pre-Konditionierstrecke: 1 min mit 1 M Natriumhydroxid (in Wasser), 5 min mit 75 mM Natriumboratpuffer bei pH 9.2.
- Im Injektionsabschnitt, eingestellte Parameter für einen hydrodynamischen Injektion mit 30 mbar Druck für 10 Sekunden für alle Methoden. In dem Trennabschnitt, stellen die Trennungsbedingungen zu 30 kV bei 25 ° C für 9 min für alle Methoden.
HINWEIS: Bedienungsanleitung der spezifischen CE-Gerät als Verfahren finden Sie in der CE-Gerät für den Betrieb zwischen Herstellern variieren. Bereiten Sie die 1 M Natriumhydroxid-Lösung am Tag.
- Einschleusen und einen neutralen interner Standard trennen (10 & mgr; l von 10% v / v Dimethylsulfoxid (DMSO), verdünnt in Wasser in 450 ul 75 mM Natriumboratpuffer). Dann spritzen und auf die gleiche Weise ein Oligoacrylat Standard trennen (gelöst in Reinstwasser bei 10 g ∙ L -1; siehe Liste der Materialien) , um die Gültigkeit der Kapillare zu überprüfen. Unterbrechen Sie die hier Sequenz, bis die Pfropfreaktion ist startbereit.
6. Verpflanzen von RGDS auf Chitosanfilms
- Wiegen Sie das Peptid (1 mg RGDS)und die Kopplungsmittel (3 mg EDC-HCl und 2 mg NHS).
- 2 h nach dem Start der Chitosanfilm Einweichen in PBS, lösen sich das Peptid und das Kupplungsmittel in 5 ml PBS.
- Nehmen Sie ein 50-ul-Aliquot dieser Lösung. Hinzufügen 2 & mgr; l von 10% v / v DMSO in Wasser als interner Standard neutral zum Aliquot. Analysieren Sie den aliquoten mit CE (siehe Schritt 7).
- Entfernen die 5 ml PBS verwendet, die Chitosan-Filme aus der Petrischale zu spülen. Fügen Sie die 5 ml-Lösung von Peptid und Kupplungsmitteln zu der Petrischale, die Chitosan-Filme enthält.
- Decken Sie die Petrischale mit Paraffinfilm und legen Sie es auf einem Schüttler bei Raumtemperatur. Bis zu 50 & mgr; l-Aliquots von Reaktionsmedien zu festgelegten Zeiten.
HINWEIS: Die Gesamtanalysezeit mit CE beträgt 15 min, wodurch ein Aliquot kann alle 15 min genommen werden (oder alle 30 Minuten , wenn zwei Reaktionen parallel überwacht werden, etc.).- Hinzufügen 2 & mgr; l von 10% v / v DMSO in Wasser als interner Standard neutral zu jedem aliquot.
HINWEIS: Aliquots sollten so bald mit CE analysiert werden, da sie (siehe Schritt 7) getroffen werden.
- Hinzufügen 2 & mgr; l von 10% v / v DMSO in Wasser als interner Standard neutral zu jedem aliquot.
- Nach 4 Stunden Schütteln und Aliquotentfernung, entfernen Sie die Petrischale aus dem Schüttler. Entfernen des Reaktionsmediums aus der Petrischale. 5 ml PBS, die Chitosan-Filme zu spülen.
- Entfernen Sie die PBS aus der Petrischale, spülen Sie die Chitosan-Film mit Reinstwasser und lassen sie über Nacht trocknen. Entfernen Sie die Reinstwasser und speichern die Filme bei 20 ° C in einer Kunststoff-Petrischale.
7. Überwachung von Pfropfreaktion CE Verwendung
- Injizieren und getrennte Aliquots von Reaktionsmedien unmittelbar nach der Entnahme aus der Petrischale mit den Analysebedingungen wie in Abschnitt 5.2.
- Nach Abschluss der Trennungen Spülen der Kapillare mit ultrareinem Wasser für 10 min. Trocknen Sie es durch einen Flush mit einem leeren Fläschchen (Luft) für 10 min.
HINWEIS: Das Experiment kann in diesem Stadium angehalten werden.
8. Daten Trea tment für CE
- Überprüfen Sie die Gültigkeit jeder Trennung, durch die Überprüfung sowohl der Strom während der Trennung und die Migrationszeit der elektroosmotischen Mobilität Marker (DMSO in diesem Fall) sind ähnlich denen, die für die Oligoacrylat Standardtrennung beobachtet.
HINWEIS: Bis zu 10-15% Abweichung von dem erwarteten Stromwert von etwa 50 & mgr; A und Migrationszeit-Wert von 1,3 min (elektrophoretische Mobilität Werte anstelle von Migrationszeiten verwendet werden sollte, wenn eine höhere Wiederholgenauigkeit erforderlich ist) akzeptabel ist. - Für jede erfolgreiche Trennung Exportieren Sie die Rohdaten von der Kapillar-Elektrophorese-Software durch einen bestimmten Datensatz der Auswahl Recht auf Export klicken und ein entsprechendes Signal auswählen.
- Wandeln die Rohdaten von der CE aufgezeichnet (dargestellt als UV-Absorption als Funktion der Migrationszeit). Wandeln die X-Achse (Wanderungszeit t m) in eine elektrophoretische Mobilität μ folgenden Gleichung 1:
n 1 "src =" / files / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
wobei L d die Länge zum Detektor ist, L t die Gesamtlänge der Kapillare, V die Spannung ist, und t eo ist die Migrationszeit eines neutralen Spezies (der interne Standard DMSO in diesem Fall) 27.
Wandeln die Y-Achse der Rohdaten (Extinktion in au) zu einer Verteilung der elektrophoretischen Mobilitäten W (μ) nach der Gleichung 2: 28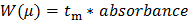 (2)
(2)
9. Weitere Charakterisierung von Peptid-gepfropft Films 18
- Legen Peptid-gepfropft Chitosanfilme, rollte um sich in einem 4 mm Festkörper-NMR-Rotor. Füllen den Rotor mit phosphatgepufferter Kochsalzlösung, die Filme zu quellen, und den Rotor zu schließen. Warten Sie ein paar Stunden.
- Analysieren Sie den Film mit 13 </ sup> C - NMR - Spektroskopie 18.
Ergebnisse
CE ist gut geeignet , um die Transplantation von Peptiden zur Überwachung (zB RGDS) auf Chitosan - Filme. Geeignete Kupplungsmittel schließen EDC-HCl und NHS , die das Peptid zu aktivieren , auf dem Chitosan (Abbildung 1) gepfropft werden. CE ist in der Lage, die verschiedenen Moleküle von Interesse aus dem Reaktionsmedium abzutrennen. Um die Peaks auf der Elektropherogramm, reine RGDS, EDC-HCl und NHS vergeben wurden aufgelöst, injiziert und separat getrenn...
Diskussion
Die Einfachheit des hier beschriebene Protokoll macht es ideal für eine breite Anwendung geeignet. Allerdings muss besonderes Augenmerk auf die folgenden wesentlichen Schritte zu zahlen.
Proper CE Instrumentenaufbereitung
Es ist wichtig, einen bekannten Standard unmittelbar vor der Trennung von unbekannten Proben (wie auch am Ende einer Reihe von Trennungen) zu trennen, um die Gültigkeit der Kapillare und Instrument am Tag zu überprüfen. Dies...
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Materialien
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Referenzen
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten