Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Multimodale Bildgebung und Spektroskopie Faserbündelmikroendoskopie Plattform für Nicht-invasive,
In diesem Artikel
Zusammenfassung
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Zusammenfassung
Recent Faserbündelmikroendoskopie Techniken ermöglichen nicht-invasive Analyse von in vivo Gewebe entweder Bildgebungstechniken oder eine Kombination von Spektroskopie - Techniken. Die Kombination von Techniken Bildgebung und Spektroskopie in einer einzigen optischen Sonde kann eine vollständigere Analyse von Gewebe Gesundheit. In diesem Artikel werden zwei unterschiedliche Modalitäten kombiniert, hochauflösende Fluoreszenzmikroendoskopie Bildgebung und diffuse Reflexionsspektroskopie, in einem einzigen optischen Sonde. Hochauflösende Fluoreszenzmikroendoskopie Bildgebung ist eine Technik verwendet, um apikale Gewebe-Mikroarchitektur visualisieren und zwar meist eine qualitative Technik hat effektive Echtzeit-Differenzierung zwischen neoplastischen und nicht-neoplastischen Gewebe nachgewiesen. Diffuse Reflexionsspektroskopie ist eine Technik, die Gewebe physiologischen Parametern, einschließlich der lokalen Hämoglobinkonzentration extrahieren kann, Melaninkonzentration und die Sauerstoffsättigung. Dieser Artikel beschreibt die Spezifikationen required die faseroptische Sonde zu konstruieren, wie die Instrumentierung zu bauen, und zeigt dann die Technik auf in vivo menschlichen Haut. Diese Arbeit zeigte, dass Gewebe-Mikroarchitektur, die speziell apikal Hautkeratinozyten kann mit den damit verbundenen physiologischen Parametern zusammen registriert werden. Die Instrumentierung und Faserbündel-Sonde hier dargestellt kann in einer Vielzahl von Organsystemen für den Einsatz entweder als ein Handheld oder endoskopisch-kompatiblen Gerät optimiert werden. Weitere klinische Forschung ist notwendig, um die Lebensfähigkeit dieser Technik für verschiedene epitheliale Krankheitszustände zu testen.
Einleitung
Faserbündel Mikroendoskopie Techniken analysieren typischerweise in vivo Gewebe entweder mit bildgebenden Verfahren oder eine Kombination von Spektroskopie - Techniken. 1-3 Eine solche Abbildungstechnik, hochauflösende Fluoreszenzmikroendoskopie, können Bild apikal Gewebe - Mikroarchitektur mit subzellulärer Auflösung in einem kleinen , mikroskaligen Feld-of-view, ein aktuelles Kontrastmittel wie Proflavinkonzentration, Fluorescein oder Pyranin Tinte. 1,3-11 Diese Bildgebungsmodalität klinische Leistung hat gezeigt , viel versprechende in qualitativ differenzier kranken und gesunden Epithelgewebe in Echtzeit unter Verwendung von mit niedrigen Gelegentlich inter~~POS=TRUNC Variabilität. 8, werden die Ermittler hochauflösende Fluoreszenzmikroskopie Daten verwenden , um quantitative Merkmale wie Zell- und Kerngröße oder Drüse Bereich extrahieren, aber dies bleibt ein in erster Linie qualitative Technik gezielt in Richtung Gewebemorphologie zu visualisieren. 1,3,8- 10 Andererseits seits~~POS=HEADCOMP Spektroskopietechniken, wie beispielsals diffuse Reflexionsspektroskopie, sind auf die Bereitstellung funktioneller Gewebeinformationen gezielt und haben in quantitativ zu identifizieren Krebsläsionen in mehreren Organen vielversprechende klinische Leistungsfähigkeit gezeigt. 2,12-15
Daher besteht ein Bedarf für eine Vorrichtung, beide Arten von Modalitäten möglicherweise weiter zu reduzieren inter-observer Variabilität enthalten, zu erhalten Echtzeit-Visualisierung von Gewebe-Mikroarchitektur und stellen eine vollständigere Analyse der Gewebegesundheit. Um dieses Ziel zu erreichen, ein multimodales sondenbasierte Instrument wurde konstruiert , das zwei Modalitäten in einem einzigen faseroptischen Sonde kombiniert. Hochauflösende Fluoreszenzmikroendoskopie und Unter diffuser Reflexionsspektroskopie 11 Dieses Verfahren co-registers qualitative Bilder mit hoher Auflösung von apical Gewebemorphologie (strukturellen Eigenschaften) mit quantitativen spektrale Information (funktionelle Eigenschaften) aus zwei verschiedenen Gewebetiefen, einschließlich der lokalen Hämoglobinkonzentration ([Hb]), Melanin - Konzentration ([Mel]) und Sauerstoffsättigung (SaO 2). 11,12,16 Diese spezifische Unter diffusen Reflexionsspektroskopie Modalität verwendet zwei Quellen-Detektor - Trennungen (SDSs) zwei einzigartige Gewebetiefen zur Probe zur Verfügung zu stellen ein umfassenderes Bild der Gewebegesundheit durch an die Basalmembran und das darunter liegende Gewebe Stroma Abtasten nach unten. 11
Die Faser-Sonde besteht aus einem zentralen 1 mm Durchmesser Bildfaser mit ca. 50.000 4,5 um Durchmesser Faserelementen, einem Manteldurchmesser von 1,1 mm und einer Gesamtbeschichtungsdurchmesser von 1,2 mm. Die Bildfaser wird von fünf 200 & mgr; m Durchmesser Fasern mit Manteldurchmesser von 220 & mgr; m umgeben. Jede 200 & mgr; m Multimode-Faser ist ein Mitte-zu-Zentrum Abstand von 864 & mgr; m entfernt von der Mitte der Bildfaser. Jedes der 200 & mgr; m Multimode-Fasern sind 25 ° auseinander. Mit dem am weitesten links stehende 200 & mgr; m Multimode-Faser als "Quelle" Faser, und die zusätzliche three 200 & mgr; m Multimode-Fasern als die "Sammlung" Fasern, schafft diese Geometrie notwendigerweise drei Mitte-zu-Mitte SDSs von 374 & mgr; m, 730 & mgr; m, 1051 & mgr; m und 1323 & mgr; m. Die Faserspitzen werden in einem zylindrischen Metallgehäuse eingeschlossen, dass die Abstände zwischen den Fasern konstant hält. Der Durchmesser des zylinderförmigen Metallgehäuses ist 3 mm. Das distale Ende (in Richtung der faseroptischen Sondenspitze) der faseroptischen Sonde 2 Meter lang. Die Sonde trennt dann in den sechs jeweiligen einzelnen Fasern am proximalen Ende ( in Richtung der Instrumentierungs) , die zusätzlich 2 Meter lang ist, für eine Gesamtlänge von 4 Fuß. 1 zeigt eine Darstellung des faseroptischen Sonde.

Abb . 1: faseroptische Sonde Design Die faseroptische Sonde besteht aus einem 1 mm Durchmesser Bildfaser und vier 200 um Multimode - Fasern. DiesAbbildung zeigt Darstellungen von (a) die Metallabschlusskappe , die die Geometrie der Fasern an der Sondenspitze beschränkt SDSs von 374, 730 und 1051 & mgr; m in Bezug auf die am weitesten links stehende 200 & mgr; m Multimode - Faser (Skala bar ≈ 1 mm) zu erhalten, (b) die Fasern innerhalb der Metallkappe eingeschränkt zu werden, um die Faserkerne zeigt, Fasermantel und Faserbeschichtung (Skala bar ≈ 1 mm), (c) die Schutz Polyamid Ummantelung um die Fasern (Skala bar ≈ 1 mm), (d ) die fertige distale Spitze der Sonde, mit dem Metall Fingergriff und einzelne schwarze Kabel alle Fasern (Skala bar ≈ 4 mm), und (e) ein Bild von der distalen Spitze der Sonde (Skala bar ≈ 4 mm) enthält. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diese multimodalen Instrumentierung und die damit verbundenen technique ist die erste Kombination dieser Modalitäten innerhalb einer einzigen Sonde, obwohl andere kombinierte strukturelle / funktionelle Techniken tun, dass verschiedene Modalitäten kombinieren existieren. Zum Beispiel verbindet hyperspektrale Bildweitfeld - Bildgebung mit quantitativen Hämoglobin und Melanin Eigenschaften, 17,18 und andere Techniken entwickelt worden , die die optische Kohärenztomographie kombinieren (OCT) mit Analyse von Gewebeproteinexpression, 19 ein paar zu nennen. Dieser Artikel berichtet über eine kompakte und einfach zu implementierende Instrumentierungs Einrichtung, die eine allgemeine faseroptische Sonde verwendet, die für verschiedene Zwecke, einschließlich endoskopischen Einsatz im unteren Gastrointestinaltrakt und der Speiseröhre oder als Handsonde zur Verwendung in der Mundhöhle optimiert werden kann, und Außenhaut Platzierung. 11,20
Die Hardware für diese Besetzung erfordert sowohl individuelle Datenerfassung und Nachbearbeitung Code diffusen Reflexionsspektren zu erfassen und extrahieren Sie dann die resultierende volumE-gemittelte Gewebe physiologische Parameter einschließlich [Hb], [Mel] und SaO 2. Die benutzerdefinierte Datenerfassungscode wurde die gleichzeitige Erfassung von einer Kamera (für hochauflösende Fluoreszenzmikroskopie) und ein Spektrometer (für diffuse Reflexionsspektroskopie) zu ermöglichen, errichtet. Treiber sind von den Websites der Hersteller oft zur Verfügung Integration mit einer Vielzahl von Programmiersprachen zu ermöglichen. Die benutzerdefinierte Post-Processing - Code importiert a priori - Absorptionswerte von in vivo [Hb] und [Mel] 21 und verwendet dann eine zuvor nicht - linearen entwickelte Optimierungsanpassungsprozess, der eine angepasste Kurve der Spektren erzeugt. 22 Die angepasste Kurve durch Minimierung der gebaut χ 2 -Wert zwischen sich und dem Rohspektren und die Gewebe physiologischen Parameter zu bestimmen ([Hb], [Mel] und SaO 2) aus der angepassten Kurve und mit dem niedrigsten χ 2 -Wert. 22 der Code kann geändert werden , umfassenAbsorption von anderen Chromophoren als auch, wie die exogenen Pyranin Tinte hier verwendet wird, so dass Ziel sind physiologische Parameter nicht beeinflusst.
Physiologische Indikatoren der Gewebegesundheit, wie [Hb], [Mel] und SaO 2, können als Berichte von Tumor Ansprechen auf die Therapie oder als Indikatoren für die lokale Vaskularisierung und Angiogenese verwendet werden. 14,23 Inklusive einer hochauflösenden Fluoreszenzmikroendoskopie Modalität hilft Sonde Plazierungsführung und ist ein interner vollständigeres Bild der Beziehung zwischen Epithelgewebe Struktur und Funktion. In diesem Artikel, den Bau und die Anwendung des multimodalen Mikroendoskop beschrieben. 11
Protokoll
Institutional Review Board Genehmigung (IRB # 15-09-149) wurde für alle Aspekte dieser Studie an der Universität von Arkansas vom Human Subjects Forschungsprogramm erhalten. Die beschriebenen Verfahren wurden in Übereinstimmung mit den genehmigten Richtlinien durchgeführt, und informierte Zustimmung wurde von allen Teilnehmern erhalten.
1. Montage des Hochauflösende Fluoreszenzmikroendoskopie Modality
Hinweis: Die beschriebenen Schritte für die Montage des hochauflösenden Fluoreszenzmikroendoskopie Modalität kann in Abbildung 2 dargestellt werden.
- Legen Sie eine 470 nm dichroitischer Spiegel Innerhalb eines 30 mm Cage Cube.
- Besorgen Sie sich ein 30 mm Käfig Würfel und entfernen Sie das dichroitische Filter montieren.
- Legen Sie eine 470 nm dichroitischen Spiegel in dem dichroitischen Filter montieren.
- Wiedereinsatz und sichern das dichroitische Filter in den Käfig Würfel Halterung zurück.
- Befestigen Cage Montagestangen an den 30 mm Cage Cube.
- Sichernvier 1,5-Zoll-Käfiganordnung Stangen an der Vorderseite des Käfigs Würfels.
- Sichern Sie vier 3,0-Zoll-Käfig Montagestangen auf der rechten Seite des Käfigs Würfel.
- Sichere zwei 2,0-Zoll-Käfig Montagestangen schräg auf der linken Seite des Käfigs Würfel.
- Bauen Sie eine Käfigplatte / Objektiv Tube Assembly.
- Besorgen Sie sich eine 1,0-Zoll-Gewinde 30 mm Käfigplatte und heften sich an der Innenseite der Käfigplatte mit dem mitgelieferten Threading einen stressfreien Haltering.
- Schrauben Sie in einem 1,0-Zoll-Objektiv Rohr mit dem stressfreien Haltering.
- Bringen Sie ein zweites 1,0 Zoll 30 mm Käfigplatte mit dem 1,0-Zoll-Objektiv Rohrgewinde und stellen Sie die Standardhalteringe so, dass die beiden Käfigplatten bündig sind.
- Schieben Sie die 1,0-Zoll-Cage-Platte / Linsenrohreinheit auf die linke Seite des 30 mm Cage Cube.
- Bauen Sie die rechtwinkligen Spiegelbaugruppe montieren.
- Besorgen Sie sich einen rechten Winkel Spiegelhalter und einen 1,0-Zoll-UV-verstärkten Aluminium-Spiegel.
- Legen Sie die 1,0 inch UV-verstärkten Aluminium-Spiegel in den Spiegel montieren und festziehen.
- Sichern Sie vier 2,0-Zoll-Käfig Montagestangen an der Vorderseite des Spiegelhalterung
- Sichere zwei 2,0-Zoll-Käfig Montagestangen diagonal auf der rechten Seite des Käfigs Würfel.
- Verbinden Sie den rechten Winkel Spiegelhalterung Montage auf der linken Seite des 1,0-Zoll-Käfigplatte / Linsenrohranordnung durch die gegenüberliegenden Käfigmontagestangen durch die jeweiligen Öffnungen des 30 mm Käfigplatte platzieren.
- Gewinde eine z-Achse Übersetzung Halterung durch die 3,0-Zoll-Käfig Montagestangen auf der rechten Seite der Baugruppe.
- Bringen Sie ein 10fach unbunten Objektivlinse zu der z-Achse Übersetzung Halterung.
- Bauen Sie ein 1,0-Zoll-Faser-Adapterplatte / xy-Achsen-Translationslinsenanordnung montieren.
- Erhalten Sie xy-Achsen-Übersetzung Halterung und ein 1,0-Zoll-Faser-Adapterplatte.
- Befestigen Sie die 1,0-Zoll-Faser-Adapterplatte in die xy-Achsen-Übersetzung Objektivfassung.
- Slide ter 1,0 Zoll Faseradapter / xy-Achsen-Translationslinsenanordnung vor der Objektivlinse montieren.
- Erhalten Sie zwei 0,5 Zoll lang, 1,0 Zoll Durchmesser der Linse Röhren, ein 440/40 nm Bandpassfilter (Anregungsfilter) und ein 525/36 nm Bandpassfilter (Emissionsfilter).
- Legen Sie jedes Filter in einem 0,5 Zoll lang, 1,0 Zoll Durchmesser Linsenröhre, so dass der Pfeil auf der Außenseite des Filters ist mit Blick auf die Seite der Linse Rohr mit dem Außengewinde.
- Bringen Sie die Filter auf der Baugruppe.
- Erhalten Sie zwei Standard-Halteringe.
- Sichern Sie sich die Filter in den 0,5-Zoll lang, 1,0 Zoll Durchmesser der Linse Röhren mit den Standard-Sicherungsringe.
- Schraube in dem Linsenrohr mit dem Anregungsfilter auf der Vorderseite des Käfigs 30 mm-Würfel und Schraube in dem Linsenrohr mit dem Emissionsfilter auf das rechtwinklige Spiegelhalterung.
- Schraube im 0,5-Zoll-Linsentubus mit der Emissionsfilter an der Vorderseite des rechtwinkligen Spiegelhalterung.
- obtain zwei 1,0-Zoll-Gewinde 30 mm Käfigplatten und legen Sie sie vor den 0,5 Zoll lang, 1,0 Zoll Durchmesser der Linse Rohre, die die Filter enthält.
- Mit Epoxy oder starken Klebstoff, fügen Sie eine 455 nm auf die Käfigplatte mit dem Anregungsfilter angeschlossenen LED.
- Erhalten Sie ein 0,5 Zoll lang, 1,0 Zoll Durchmesser der Linse Rohr und ein 1,0 Zoll achromatischen Dublett Tubuslinse mit einer Brennweite von 50 mm.
- Das Röhrchen Linse innerhalb des Linsenrohrs, so dass der Pfeil auf der Außenseite der Linse ist die Seite der Linsenröhre mit dem Außengewinde gegenüber.
- Schrauben Sie in der Tubuslinse zur Montage.
- Erhalten einer Standardhaltering.
- Befestigen Sie die Linse im 0,5 Zoll lang, 1,0 Zoll Durchmesser Linsenröhre mit dem Standard-Haltering.
- Bringen Sie den Objektivrohr mit der Rohrlinse an der am weitesten links stehenden Käfigplatte.
- Legen Sie eine 30 mm Käfigplatte vor dem 0,5 Zoll lang, 1,0 Zoll Durchmesser der Linse Rohr das Rohr Linse enthält.
- Bringen Sie ein stressfreie Haltering an der Innenseite des 30 mm Käfigplatte.
- Bringen Sie einen USB-Monochrom-Kamera an die Käfigplatte mit dem spannungsfreien Haltering.
- Konstruieren Sie die optischen Post Montagevorrichtungen.
- Erhalten Sie vier 0,5-Zoll-Stifthalter, vier 0,5 Zoll optische Pfosten und vier Montagesockel.
- Sichern Sie sich die 0,5-Zoll-optische Beiträge in den 0,5-Zoll-Stifthalter.
- Sichern Sie sich die 0,5-Zoll-Stifthalter auf die Montagesockel.
- Schrauben Sie die vier optischen Post Montagevorrichtungen an den Schraubenlöchern unter dem Würfel 30 mm Käfig befindet, der im rechten Winkel Spiegelhalterung, die Käfigplatte mit der LED verbunden ist, und die Käfigplatte an die Kamera angeschlossen.
- Schrauben Sie die vier den optischen Post Montagevorrichtungen entweder eine optische Steckbrett oder optische Tischkonstruktion des hochauflösenden Fluoreszenzmikroendoskopie Modalität zu beenden.
ftp_upload / 54564 / 54564fig2.jpg "/>
Abbildung 2:. Montage der hochauflösenden Fluoreszenzmikroendoskopie Modalität Die hochauflösende Fluoreszenzmikroendoskopie Modalität kann durch den Bau einer Schale von 1,0 Zoll Durchmesser großen Bauteilen, mit besonderer Sorgfalt im Umgang mit dem dichroitischen Spiegel, Objektivlinse, Anregungs- / genommen konstruiert werden Emissionsfilter und Tubuslinse. Glasoberflächen dieser Komponenten müssen sorgfältig mit Objektiv Papier behandelt werden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
2. Montage des Teil diffusen Reflexionsspektroskopie Modality
Hinweis: Die beschriebenen Schritte für die Montage des Unter diffuser Reflexionsspektroskopie Modalität kann in Abbildung 3 sichtbar gemacht werden.
- Besorgen Sie sich eine Wolfram-Halogen-Lichtquelle und unter Verwendung von Epoxy oder einen starken Klebstoff, sichern einen 1,0 Zoll Gewindebolzed 30 mm Käfigplatte auf der Vorderseite.
- Sichern Sie vier 3,0-Zoll-Gestellanordnung Stangen an der Käfigplatte.
- Anhängen einer z-Achsen-Translations an die Käfigbaugruppe Stangen montieren.
- Schrauben Sie in einem 20X achromatischen Objektivlinse zu der z-Achse Übersetzung montieren.
- Bauen Sie ein Faser-Adapterplatte / xy-Achsen-Translationslinsenanordnung montieren.
- Erhalten Sie xy-Achsen-Übersetzung Halterung und ein 1,0 Zoll Faseradapterplatte.
- Befestigen Sie die Faseradapterplatte in die xy-Achsen-Übersetzung Objektivfassung.
- Schieben Sie die 1,0-Zoll-Faser-Adapter / xy-Übersetzung Montage vor der Objektivlinse montieren.
- Bauen Sie den Motor Armbaugruppe.
- Beziehen Sie die maßgeschneiderte Aluminium-Motor Arm und ein SMA Faseradapterplatte.
- Schrauben Sie in der Faseradapterplatte (mit Außengewinde) in den Aluminiummotor Arm (mit Innengewinde).
- Bringen Sie die maßgeschneiderte Aluminium-Motor Arm-Adapter an den Motor Arm mit vier # 4-40 0.5 in. Schrauben.
- Bauen Sie den Motor / Motor Arm / Motorgehäuse Montage.
- Beziehen Sie die maßgeschneiderte Aluminium-Motorgehäuse und das 400-Schritt-Schrittmotor.
- Richten Sie die Schraubenlöcher an den Schrittmotor und Motorgehäuse und befestigen Sie dann mit vier # 4-40 0,5-Zoll-Schrauben.
- Führen Sie den rotierenden Motorstange des Schrittmotors durch die Öffnung des Motors Armbaugruppe und ziehen Sie die Sicherungsschraube auf dem Alu-Motor-Arm-Adapter.
- Bauen Sie die optischen Schalteranordnung.
- Beziehen Sie die maßgeschneiderte Aluminium optische Schalter und drei 1,0-Zoll-Faseradapterplatten.
- Führen Sie die Adapterplatten in die Gewindelöcher in dem optischen Schalter.
- Bringen Sie die maßgeschneiderte Aluminium optische Schalter Frontplatte auf den optischen Schalter mit vier # 4-40 0,5-Zoll-Schrauben.
- Bringen Sie den Motor / Motorarm / Motorgehäuseanordnung mit dem optischen Schalter durch den rotierenden Motorstange des Schrittmotors durch das zentrale Loch des t Einspeisener optische Schalter.
- Erhalten Sie elektrischen Leiterplatte und Schrittmotor-Treiber, und dann den Schrittmotor-Treiber über die zentrale Nut des Steckbrett.
- Beachten Sie die elektrischen Anschlussschema (Abbildung 3, 2.12) für den Schrittmotor - Treiber, 12 V Stromversorgung und Schrittmotor.
- Schließen Sie den Schrittmotor - Treiber, 12 V Stromversorgung und Schrittmotor wie im Schaltplan angegeben (Abbildung 3, 2.12) Aufbau des motorisierten optischen Schalters zu vervollständigen.
- Schrauben Sie in den optischen Schalter - Komponenten und Wolfram-Halogen - Lichtquelle zu einem optischen Steckbrett oder optischen Tisch in der Nähe der zuvor konstruierten (Abbildung 2, 1,24) hochauflösende Fluoreszenzmikroendoskopie Montage.
- Ein Ende eines 550 & mgr; m, 0,22 NA-Patch-Kabel mit dem 1,0-Zoll-Faser-Adapterplatte des Motors Armbaugruppe.
- Schließen Sie das andere Ende des 550 & mgr; m, 0,22 NA-Patchkabel an die Faser verbindenoder des USB-Spektrometers.
- Schrauben Sie in den fünf distalen Sondenkabel mit den entsprechenden 1,0-Zoll-Faseradapterplatten auf die Instrumentierung Fertigstellung des multimodalen hochauflösende Bildgebung und Unter diffusen Reflexionsspektroskopie Faserbündel- Mikroendoskop zu beenden.
- Schrauben im mittleren Durchmesser von 1 mm Bildfaser-Kabel mit dem 1,0-Zoll-Faser-Adapterplatte in Schritt 1.9.2 erwähnt.
- Schrauben Sie in der linken 200 um Multimode-Glasfaserkabel mit dem 1,0-Zoll-Faser-Adapterplatte in Schritt 2.6 erwähnt.
- Schrauben Sie in der 2. 200 & mgr; m Multimode - Glasfaserkabel mit dem am weitesten links stehende 1,0 - Zoll - Faser - Adapter mit dem Wolfram-Halogenlampe in Schritt 2.9.2 erwähnt angebracht.
- Schrauben Sie in der 3. 200 & mgr; m Multimode - Glasfaserkabel mit dem mittleren 1,0 - Zoll - Faser - Adapterplatte in Schritt 2.9.2 erwähnt.
- Schrauben im 4. 200 & mgr; m Multimode - Glasfaserkabel mit dem am weitesten rechts stehenden 1,0 - Zoll - Faser - Adapterplatte in Schritt 2.9.2 erwähnt.

Fig . 3: Montage der Unter diffuser Reflexionsspektroskopie Modalität Die Unter diffuse Reflexionsspektroskopie Modalität kann unter Verwendung einer basischen Wolfram-Halogen - Lampe auf eine Objektivlinse gekoppelt konstruiert werden , um Licht durch das 200 & mgr; m Multimode - Abgabefaser zu fokussieren, und ein Spektrometer. Zusätzlich ist ein custom-built motorisierte optische Schalter kann in der Lampe-Faser-Spektrometer Pfad zwischen jedem SDS zu wechseln aufgebaut werden. Die Ermittler mehrere Spektrometer unter Verwendung von mehreren SDSs erwerben kann die optische Schaltkomponente umgehen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
3. Kalibrierung des Teil diffusen Reflexionsspektroskopie Modality
Hinweis: Die fach Schritte (Abschnitt 3) müssen vor der spektralen Datenerfassung (Abschnitt 4) abgeschlossen sein.
- Schalten Sie alle Komponenten der Instrumente, einschließlich der 455 nm LED, Breitband-Wolfram-Halogenlampe, CMOS-Kamera, USB-Spektrometer, Schrittmotor und Motorsteuerung. Sicherstellen, dass der Verschluss auf dem Wolfram-Halogen-Lampe offen ist.
- Schalten Sie alle Umgebungslicht.
- Öffnen Sie die benutzerdefinierte Datenerfassungssoftware.
- Halten Sie Ausrüstung für 30 min für die Lampe läuft erreichen eine geeignete Temperatur und für Eigenrauschen von dem Spektrometer zu stabilisieren.
- Legen Sie eine 20% diffuse Reflexion Standard innerhalb der unteren Öffnung des speziell angefertigten, 3D-gedruckten Kalibrierungsstandard-Gerät.
- Legen Sie die faseroptische Sonde innerhalb der äußersten linken Steckplatz des benutzerdefinierten, 3D - Faser-Halter gedruckt, demonstriert in Abbildung 4. Der Steckplatz ganz links der senkrechten Abstand fixiert von der faseroptischen Sondenspitze auf dem Reflexionsstandard bei 2,1 mm, die das ist optimale Abstand, in dem das Signal, das das Spektrometer erreicht, wird für die ersten SDS von 374 & mgr; m maximiert.
- Stellen Sie den motorisierten optischen Schalter der äußersten linken Position, so dass das Spektrometer zu den ersten SDS von 374 & mgr; m verbunden ist.
- Stellen Sie die Integrationszeit auf 500 ms. Diese Integrationszeit gewählt werden muss, um nicht das Spektrometer sättigen, sondern eine praktisch niedrige Integrationszeit aufrechtzuerhalten.
- Erwerben Sie ein Spektrum, R max, 374μm, indem Sie auf "Acquire Spectrum" in der Software.
- Schließen Sie den Verschluss auf der Wolfram-Halogenlampe und zeichnen Sie ein Spektrum, R dunkel, 374μm, Hintergrundgeräusche, indem Sie auf "Acquire Spectrum" in der Software. Einmal erworben, öffnen Sie den Auslöser erneut.
- Legen Sie die faseroptische Sonde im Inneren des äußersten rechten Steckplatz des benutzerdefinierten, 3D - Faser-Halter gedruckt, demonstriert in Abbildung 4. Der Steckplatz ganz rechts der senkrechten Abstand von der Faser-o fixiertptic Sondenspitze bei 3,9 mm zu dem Reflexionsstandard, das der optimale Abstand ist, in dem das Signal, das das Spektrometer erreicht zum zweiten SDS von 730 & mgr; m maximiert wird.
- Stellen Sie den motorisierten optischen Schalter in die mittlere Position, so dass das Spektrometer zu den zweiten SDS von 730 & mgr; m verbunden ist.
- Erwerben Sie ein Spektrum, R max, 730μm, indem Sie auf "Acquire Spectrum" in der Software.
- Schließen Sie den Verschluss auf der Wolfram-Halogenlampe und zeichnen Sie ein Spektrum, R dunkel, 730μm, Hintergrundgeräusche, indem Sie auf "Acquire Spectrum" in der Software.
- Öffnen Sie den Auslöser erneut.

Fig . 4: Die Kalibrierung des Unter diffuser Reflexionsspektroskopie Modalität für die vorge experimentellen Kalibrierung, die faseroptische Sondenspitze muss bei unterschiedlichen platziert werdensenkrechten Abstände von der 20% diffusen Reflexionsstandard auf dem SDS abhängig. Konsequent diese senkrechten Abstände in allen Experimenten erreichen, wird ein Kalibrierungsstandard Vorrichtung wurde (Vorrichtungsquerschnitt in (a) gezeigt) entworfen , um die Sonde auf genaue Abstände von der 20% diffuse Reflexionsstandard zu halten. In diesem speziellen faseroptischen Sonde Einrichtung, Licht von der Halogenlampe wird an der Quelle-Detektor - Abständen von (b) 374 & mgr; m und (c) 730 & mgr; m (mit Motor und Motor Arm aus dem optischen Pfad entfernt , durch den optischen Schalter dargestellt zur Klarheit). Entfernungen von (d) 2,1 mm für die 374 & mgr; m SDS, und (e) 3,9 mm für die 730 & mgr; m SDS für die Kalibrierung erforderlich sind. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
4. In - vivo - Daten Acquisition und optische Eigenschaft Extraktion aus der menschlichen Haut
In diesem Abschnitt wird die multimodale Mikroendoskop Technik auf in vivo menschlichen Haut nachgewiesen werden.
- Öffnen Sie die benutzerdefinierte Datenerfassungssoftware und stellen Sie die Spektrometer Integrationszeit durch "Integration Time" klicken und legen Sie es so, dass es das gleiche wie bei der Kalibrierung ist, die 500 ms in diesem Fall (Schritt 3.8) war.
- Bestimmen den Bereich der Haut, in denen Daten zu erfassen, die sich auf die Anwendung des Untersuchers unterscheiden. In diesem Fall wurde die dünne Haut des Unterarms als Demonstrations ausgewählt.
- Wenn die Haut Bereich Haar enthält, entfernen Sie das Haar mit einem sterilen Einweg-Rasierer.
- Besorgen Sie sich einen gelben Standardmarker, die Pyranin Tinte enthält, und leicht die gewählte Hautstelle markieren.
- Schalten Sie die 455 nm LED und schließen Sie den Verschluss an der Wolfram-Halogenlampe.
- Platzieren Sie die Sonde in sanften Kontakt mit der Haut.
- Bewegen Sie die Sonde einRunde auf den verschmutzten Bereich des Gewebes eine Live-hochauflösende Zufuhr von apikal Keratinozyten-Architektur auf dem Sichtfenster der Software anzuzeigen.
- Wählen Sie eine geeignete Belichtungszeit und Gain, 150 ms und 10 dB Verstärkung in diesem Fall Bildsättigung zu vermeiden, indem Sie auf "Belichtungszeit" und "Gain", in die entsprechenden Werte eingeben, und klicken Sie auf "Übernehmen" in der Software Schnittstelle.
- ein Bild erwerben, die von "Bild erfassen" in der Software-Schnittstelle klicken.
- Während die Sonde an der gleichen Bild Ort zu halten, schalten Sie die 455 nm LED und öffnen Sie den Verschluss auf die Wolfram-Halogen-Lampe aus.
- Stellen Sie den motorisierten optischen Schalter in die linke Stellung, so daß das Spektrometer zu den zweiten SDS von 374 & mgr; m verbunden ist.
- Erwerben Spektren, R Gewebe, 374μm, indem Sie auf "Acquire Spectra" in der Software - Schnittstelle.
- Stellen Sie den motorisierten optischen Schalter in die mittlere Position so tham Spektrometer ist mit den zweiten SDS von 730 & mgr; m verbunden.
- Erwerben Spektren, R Gewebe, 730μm, indem Sie auf "Acquire Spectra" in der Software - Schnittstelle.
- Öffnen Sie die benutzerdefinierte Post-Processing-Software.
- Führen Sie die Post-Processing - Software , indem Sie auf "Ausführen" , und wählen Sie die hochauflösenden Fluoreszenzbild, vier Kalibrierungsspektren, und die zwei in - vivo - Spektren aus dem Ordner , in dem die Daten gespeichert wurden , wenn sie von der Software dazu aufgefordert werden .
HINWEIS: Die kundenspezifische Software erhält die wahre absolute Reflexionsvermögen (R abs, 374μm und R abs, 730μm) der folgenden Gleichungen.
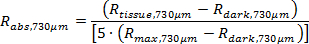
Die Nachbearbeitungscode, wie zuvor beschrieben, berechnet einen angepassten Kurve der diffusen Reflektionsspektren (Gleichungen 1 und 2) und dann determines Gewebe physiologische Parameter einschließlich ([Hb], [Mel] und SaO 2). 11,22,24
Ergebnisse
Nach diesem Protokoll wird die Ermittler einen fokussierten erhalten hochauflösendes Bild der Gewebestelle mit dem gesamten Sichtfeld (Abbildung 5). Umrisse von Zellen, wenn mit Pyranin Tinte aus einem Standard-gelben Textmarker gefärbt gesehen werden, während einzelne Zellkerne gesehen werden kann, wenn mit einem Farbstoff wie Proflavinkonzentration gefärbt. Nach spektraler Erwerb, die Post-Processing - Software verwendet a priori Wissen von in - <...
Diskussion
Die multimodalen hochauflösende Bildgebung und Unter diffusen Reflexionsspektroskopie Faserbündel- Mikroendoskop hier berichtet können von den Forschern für eine Vielzahl von Anwendungen, einschließlich endoskopischen oder Hand Verwendung für die menschliche oder tierische Studien optimiert und verwendet werden. Es stellt somit eine flexible Methode zur in - vivo - apikal Gewebe - Mikroarchitektur neben Messungen der Hämoglobinkonzentration, Melaninkonzentration und Gewebesauerstoffsättig...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Materialien
| Name | Company | Catalog Number | Comments |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit - 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f = 50 mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor - 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno - R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard - Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver - Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12 V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
Referenzen
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J Biomed Opt. 15, 026027 (2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598 (2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002 (2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512 (2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. . Optical Absorption of Hemoglobin. , (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001 (2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501 (2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001 (2012).
- Greening, G. J., James, H. M., Muldoon, T. J. . Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002 (2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten