Method Article
Induktion von beschleunigter Atherosklerose bei Mäusen: Das "Wire-Injury"-Modell
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt ein invasives Verfahren zur Induktion von beschleunigter Arteriosklerose bei Mäusen. Im Vergleich zu anderen Methoden, bei der elektrisch oder kryoinduzierte Verletzungen verwendet werden, imitiert die mechanisch induzierte Verletzung den menschlichen Zustand der Restenose nach Revaskularisationstherapien und ist ideal für die Untersuchung der beteiligten molekularen Mechanismen.
Zusammenfassung
Atherosklerose ist eine proliferative fibro-entzündliche Erkrankung, die sich in der arteriellen Wand entwickelt und einen mangelhaften Blutfluss oder einen Mangel an Blutfluss induzieren. Darüber hinaus induziert Die Arteriosklerose durch Bruch der defekten Gefäßwand eine okklusive Thrombusbildung, die die Hauptursache für Myokardinfarkt oder Schlaganfall und die häufigste Todesursache darstellt. Trotz der Fortschritte im kardiovaskulären Bereich bleiben viele Fragen unbeantwortet, und zusätzliche Grundlagenforschung ist unerlässlich, um unser Verständnis der molekularen Mechanismen bei Arteriosklerose und ihrer Auswirkungen zu verbessern. Aufgrund begrenzter klinischer Studien besteht bedarf es repräsentativer Tiermodelle, die atherosklerotische Erkrankungen wie neointimaische Bildung nach Stentimplantation, Ballonangioplastie oder Endarterektomie nachbilden. Da die Maus viele Vorteile bietet und das am häufigsten verwendete Modell für die Untersuchung molekularer Prozesse ist, schlägt die aktuelle Studie ein invasives Verfahren der endotheliaalen Denudation vor, auch bekannt als draht-Verletzungsmodell, das für den menschlichen Zustand der Neointimabildung in Arterien nach Revaskularisationsverfahren repräsentativ ist.
Einleitung
Atherosklerose ist die wichtigste Pathologie, die kardiovaskulären Ereignissen wie Myokardinfarkt oder Schlaganfall zugrunde liegt. Die Hauptmechanismen, die akute kardiovaskuläre Syndrome auslösen, sind Plaquebruch, oberflächliche Erosion und Thrombusbildung. Es gibt mehrere klinische Situationen, die mit der Plaqueentwicklung verbunden sind: native atherosklerotische Plaque, Restenose nach Endarterektomie und Restenose nach Ballonangioplastie mit/ohne Stentimplantation1. Nach arteriellen Verletzungen sind die Unterdrückung der entzündlichen Prozesse2,3 und die Rückgewinnung des Endothelfachs unerlässlich, um weitere Komplikationen zu verhindern1. Klinische Forschung beschränkt sich auf Gewebe- und Blutproben aufgrund ethischer Erwägungen, Kosten und mangelnder Kenntnisse in grundlegenden Mechanismen. Aus diesen Gründen ist es notwendig, molekulare Mechanismen in Tiermodellen4-6zu untersuchen, die die klinischen Bedingungen nachbilden können. Unser Modell der beschleunigten Neointimabildung im Zusammenhang mit Arteriosklerose ist das Ergebnis langjähriger Erfahrung in der Umsetzung dieser Modelle bei Kleintieren7-7 . Das Mausmodell ist das attraktivste Modell für die Forschung, aufgrund seiner einfachen Handhabung, der Fähigkeit, große Tiergruppen aufgrund der niedrigen Kosten im Zusammenhang mit dem Kauf und der Pflege von Tieren zu haben, und der Verfügbarkeit verschiedener transgener und Knockout-Stämme.
Der Hauptnachteil des Mausmodells ist die geringe Größe der Hauptarterien, die einer atherosklerotischen Erkrankung ausgesetzt sind (die Halsschlagader, die Aorta und die Oberschenkelarterie), die qualifizierte chirurgische Kenntnisse und Fähigkeiten erfordert, um die Gefäße zu manipulieren und eine atherosklerotische Plaque invasiv zu induzieren. Daher wird das in diesem Papier vorgeschlagene Modell der beschleunigten Neointimabildung im Kontext der Restenose nach Endarterektomie oder Stentimplantation mit einer Schritt-für-Schritt-Richtlinie und Vorschlägen zur Erleichterung der Einführung für interessiertes Personal vorgestellt. Ein weiterer Nachteil ist, dass die Denudation an der normalen arteriellen Wand erfolgt, und daher wird die Neo-Intima-Bildung im Vergleich zur klinischen Situation moderat sein. Der hohe Gehalt an Plasmacholesterin, das in Apolipoprotein E Knockout (Apoe-/-) Mäuse erreicht wird, die mit einer hohen Fettdiät gefüttert werden, schafft eine richtige pro-inflammatorische Umgebung, die für die Neo-Intima-Bildung benötigt wird.
Die Operation wird unter einem Stereomikroskop durchgeführt. Die Halsschlagader wird durch einen medianen Schnitt im ventralen Zervixbereich ausgesetzt. Anatomische Strukturen auf und um die Halsschlagader werden minimal manipuliert, um postoperative Entzündungen zu reduzieren. Die Carotis-Arterien-Bifurkation wird ausgesetzt. Um eine beschleunigte Neointimabildung zu induzieren, werden innere und äußere Karotisarterien für die Abhörung des Durchflusses und die anschließende häufige Karotisarterienverweigerung vorbereitet. Zusammenfassend lässt sich sagen, dass die Methode von Mitarbeitern mit minimaler Erfahrung in Tieroperationen erlernt werden kann.
Protokoll
Die in diesem Papier vorgestellten Experimente werden nach deutschem Recht und den europäischen Tierpflegerichtlinien durchgeführt. Die Tiere werden in der Tieranlage des Instituts für Labortierkunde, Universitätsklinikum Aachen, unter der Leitung von Prof. Dr. R. Tolba und Dr. A. Teubner (Tierschutzbeauftragter) gezüchtet.
1. Tierpflege
- Halten Sie die Mäuse in einer spezialisierten Pflegeeinheit, um einen angemessenen Zugang zu Lebensmitteln und spezialisierte tierärztliche Kontrolle und Behandlung zu gewährleisten. Wenn die Tiere von Dritten bewegt oder gekauft werden, stellen Sie bitte eine einwöchige Unterbringungsfrist sicher, bevor Sie das Verfahren durchlaufen.
2. Hyperlipidämie-Induktion
- Füttern Sie 6 - 8 Wochen alt, 18 - 20 g, weibliche (optional) ApoE-/- Mäuse mit einer atherogenen Diät (21% Fett, 0,15% Cholesterin, 19,5% Casein, Wt/Wt) eine Woche vor dem chirurgischen Eingriff und setzen Sie die Diät fort, bis die atherosklerotische Plaqueanalyse durchgeführt werden soll.
3. Chirurgische Vorbereitung
- Anästhesisieren Sie die Mäuse mit einer intraperitonealen Injektion von 100 mg/kg Ketamin nach Körpergewicht und 10 mg/kg Xylazin nach Körpergewicht. Bestätigen Sie die richtige Anästhesisierung vor der Operation durch den Mangel an Reflexen und Schnurrbartbewegung. Legen Sie eine kleine Menge steriler Augensalbe in das Auge, um das Trocknen zu minimieren.
- Stellen Sie die Aufrechterhaltung steriler Bedingungen sicher, um Infektionen während der Operation zu vermeiden, indem Sie sterile Materialien und Instrumente verwenden.
- Rasieren Sie die Mäuse im ventralen Halsbereich. Desinfizieren Sie die Haut vor dem Einschnitt mit Betadin. Machen Sie einen 1 cm Hautschnitt im mittleren Bereich des Nackenbereichs, auf der Oberseite der Luftröhre.
- Trennen Sie die beiden Fettkörper, um einen richtigen Blick über den Trachealbereich zu gewährleisten. Verwenden Sie Retraktoren, um die Muskelschicht zu halten und die Halsschlagader freizulegen. Wenn vorhanden, führen Sie die stumpfe Zerlegung der dünnen Muskelschicht durch, die die Halsschlagader bedeckt.
- Verwenden Sie scharfe gekrümmte Zangen, um die Halsschlagader von der Vagusnerv- und Jugularvene zu trennen. Daher sollte der Bifurkationsbereich mit der inneren und äußeren Halsschlagader sichtbar sein. Verwenden Sie 0,9% NaCl, um Gewebetrockenheit während des chirurgischen Eingriffs zu vermeiden.
4. Draht-Verletzung
- Legen Sie eine 7 cm lange 0/5 Seidennaht unter die Halsschlagader, proximal zum Aortenbogen. Machen Sie eine offene Schleife, die jederzeit geschlossen werden kann.
- Legen Sie zwei 0/7 Seidennähte (jeweils 1,5 cm lang) um die äußere Halsschlagader: eine Schleife in der Nähe des Bifurkationspunkts und eine Schleife so distal wie möglich. Bereiten Sie sie als offene Schleife vor, die jederzeit geschlossen werden kann.
- Legen Sie eine 0/7 Seidennaht (1,5 cm lang) unter die innere Halsschlagader. Bereiten Sie es als offene Schleife vor, die jederzeit geschlossen werden kann.
- Positionieren Sie den Maustisch mit dem Mauskopf in Richtung des Bedieners, um eine korrekte Positionierung für das Einstecken des Führungsdrahtes während der Denudation zu gewährleisten (Abbildung 1A).
- Unter der mikroskopischen Ansicht stoppen Sie den Blutfluss durch die gemeinsame Halsschlagader, indem Sie die Enden der 0/5 Seidennaht mit Hämostatzange halten und ziehen.
- Unmittelbar nach der gemeinsamen Halsschlagader ligatur, schließen Sie die Nahtschleifen auf der inneren Halsschlagader und die distale Naht auf der äußeren Halsschlagader fest (Abbildung 1B).
- Führen Sie einen kleinen Schnitt (Arteriotomie, die Hälfte des Gefäßdurchmessers) distal zur äußeren Halsschlagader, zwischen den beiden Schlaufen, mit einer kleinen Schere (Abbildung 1C). Wenn der Schnitt zu groß ist, befolgen Sie bitte die Fehlerbehebungsanweisungen (siehe Diskussion).
- Verwenden Sie kommerziell polierte Führungsdrähte oder verwenden Sie internes Fachpersonal, um die Führungsdrähte zu polieren. Desinfizieren Sie den 14 Zoll polierten flexiblen Führungsdraht mit Alkohol und befeuchten Sie ihn in einem Tröpfchen von 0,9% NaCl, um ein ordnungsgemäßes Gleiten in das Gefäß zu gewährleisten.
- Legen Sie den Führungsdraht über die Querarteriotomie der äußeren Halsartery (Abbildung 1D) in die gemeinsame Halsschlagader ein. Erhalten Sie die endotheliale Denudation, indem Sie den Führungsdraht entlang des Schiffes passieren, während Sie sich drehen. Wiederholen Sie diesen Vorgang dreimal. Bewahren Sie die gleiche Amplitude der Rotationsbewegung in jeder Maus bei, um die Reproduzierbarkeit zu erhöhen.
- Schließen Sie die proximale Schleife an der äußeren Halsschlagader fest. Stellen Sie den Blutfluss in der Halsschlagader wieder her, indem Sie die Naht um die gewöhnliche Arterie und die Naht um die innere Halsschlagader schneiden.
5. Naht und Erholung
- Entfernen Sie die Retraktoren und bringen Sie die Muskelschicht und die beiden Fettkörper in die physiologische Position zurück.
- Schließen Sie die Haut mit drei getrennten Nähten 0/6, wenn echokardiographische Messungen erforderlich sind. Wenn keine Bildgebung erforderlich ist, verwenden Sie metallische Clips, um die Haut zu schließen.
- Legen Sie die Maus auf der linken Seite unter das Infrarotlicht, bis sie aufwacht. Lassen Sie ein Tier nicht unbeaufsichtigt oder in Begleitung anderer Tiere, bis es vollständig geborgen ist.
- Markieren Sie die Maus für die zukünftige Identifizierung mit dem lokalen System. Fragen Sie den Tierschutzbeauftragten der örtlichen Einrichtung.
6. Analyse der atherosklerotischen Plaque
- Anästhesisieren Sie die Mäuse am Endzeitpunkt mit einer intraperitonealen Injektion von 100 mg/kg Ketamin nach Körpergewicht und 10 mg/kg Xylazin nach Körpergewicht. Bestätigen Sie die richtige Anästhesisierung durch den Mangel an Reflexen und Schnurrbartbewegung.
- Exsanguination durch retro-orbitale oder Herzpunktion durchführen und das Blut für die weitere Analyse sammeln2.
- Desinfizieren Sie die Haut mit Betadin. Öffnen Sie die Brusthöhle und entfernen Sie das rechte Auriculum des Herzens. Durchdringen Sie phosphatgepufferte Lösung durch linke Herzkammer, um das restliche Blut aus dem Gefäß zu entfernen und dann 4% PFA zu durchdringen, um das Gewebe zu fixieren.
- Wenn keine Fixierung erforderlich ist, entfernen Sie die Halsschlagader sofort nach dem Waschen2,4,11. Führen Sie Standardprotokolle mit Analyse von Interesse durch: Paraffineinbettung, Kryosektion, mRNA oder Proteinanalyse usw.
- Für morphometrische Messungen expflanzen Sie sorgfältig die Halsschlagader einschließlich der Bifurkation, mit minimaler Manipulation, als proximal zum Aortenbogen mit gekrümmten Zangen und einer kleinen Schere.
- Einbetten der Halsschlagader in den Paraffinblock mithilfe von Standardeinbettungsprotokollen. Um transversale Schnitte durchzuführen, legen Sie die Halsschlagader aufrecht auf Bifurkation. Schneiden Sie 5 'm dicke serielle Abschnitte ab der Bifurkation und sammeln Sie sie alle auf beschichteten histologischen Dias(Abbildung 2A).
- Flecken Sie jeden10. Abschnitt mit Movat Färbung, um die Laminas2,4,11hervorzuheben. Nach dem Sammeln mikroskopischer Bilder aller Gefäße (mit einem 10-fachen Objektiv) messen Sie das Lumen sowie die interne und externe Lamina für jeden Abschnitt mit speziell entwickelter Software2,4,11, wie in Abbildung 2Bdargestellt. Berechnen Sie das Intimwachstum und die Medien der Gefäße.
- Analysieren Sie glatte Muskelzellen und Makrophagengehalt oder endotheliale Erholung in seriellen Abschnitten, mit der üblichen immunhistologischen Färbung2 (Abbildung 2C).
Ergebnisse
Das atherosklerotische Plaque-Induktionsverfahren dauert 15 - 20 min und zeigt eine minimale Sterblichkeitsrate, hauptsächlich aufgrund der Blutungen, die während des Eingriffs auftreten. Nach der Operation erholen sich die Mäuse innerhalb von 20 - 25 min von der Anästhesie. Nach der Operation wurden keine körperlichen Beeinträchtigungen wie Lähmungen oder Fütterungsstörungen beobachtet.
Die Drahtverletzung induziert eine Deendothelialisierung, die Gefäßläsionen nach Ballondenudation oder Stent-Implantation imitiert. Unmittelbar nach der Verletzung wird die denuded Vaskuläre Wand mit einer Schicht von Thrombozyten bedeckt werden, die vermittelt und begünstigt die Haftung der Monozyten12. Aktivierte glatte Muskelzellen aus den Medien vermehren sich und wandern in die Intimräume, die die Neointima bilden. Andere Vorläufer für glatte Muskelzellen wandern aus dem Blut (schätzungsweise 40%) und tragen zum Neointima-Wachstum bei. Die Plaquebildung endet nach der vollständigen Reendothelialisierung, in der Regel 4 Wochen nach der Drahtverletzung.
Die Neointimabildung kann mit Movat-Färbung beurteilt werden. Die Plaquegröße wird für jede Folie mit Hilfe einer Software berechnet, wie in Abbildung 2Bdargestellt. Die Gesamtplaquegröße (linke Halsschlagader) kann zwischen 70.000 und 100.000 m2 variieren, während die Kontrollgefäßgröße (rechte Karotisarterie) zwischen 7.000 und 8.000 m2 variieren kann. Diese Werte hängen weitgehend vom Chirurgen ab. Daher empfehlen wir dringend, den gleichen Chirurgen während der Experimente für die gleiche Studie zu verwenden.
Die entwickelte Plaque ähnelt der Stent-Restenose, die überwiegend aus vermehrten und migrierten glatten Muskelzellen aus den Medien besteht. in stent Die durch immunologische Färbung ermittelte zelluläre Zusammensetzung zeigt, dass der Gehalt an glatten Muskelzellen etwa 30 - 40% beträgt, während Makrophagen in 15 - 25% der Neointima des verletzten Gefäßes gefunden werden. Die Reendothelialisierung kann nach der Färbung eines Endothelmarkers gemessen und als Prozentsatz des Umfangs berechnet werden, der über den gesamten Umfang des Lumens gefärbt ist. In der Regel erreicht die Reendothelialisation 80 - 90% nach 3 Wochen und sollte nach 4 Wochen fast abgeschlossen sein (Abbildung 2C). Um das Plaquewachstum während seiner Entwicklung zu verfolgen, kann die gleiche Analyse für jeden Zeitpunkt nach der Drahtverletzung wiederholt werden, je nach Interesse und untersuchtem Thema (siehe Tabelle 1).
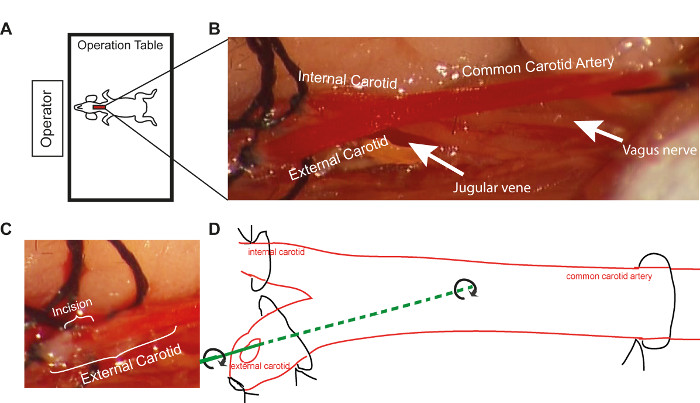
Abbildung 1. Schematische Darstellung der operativen Prozedur. (A) Die Positionierung des Operationstisches gegenüber dem Bediener während des Drahtverletzungsverfahrens(B) Vergrößerte Ansicht der gemeinsamen Halsschlagader und ihrer Zweige, wie sie unter dem Mikroskop bei 10-facher Vergrößerung(C) erscheint.D) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
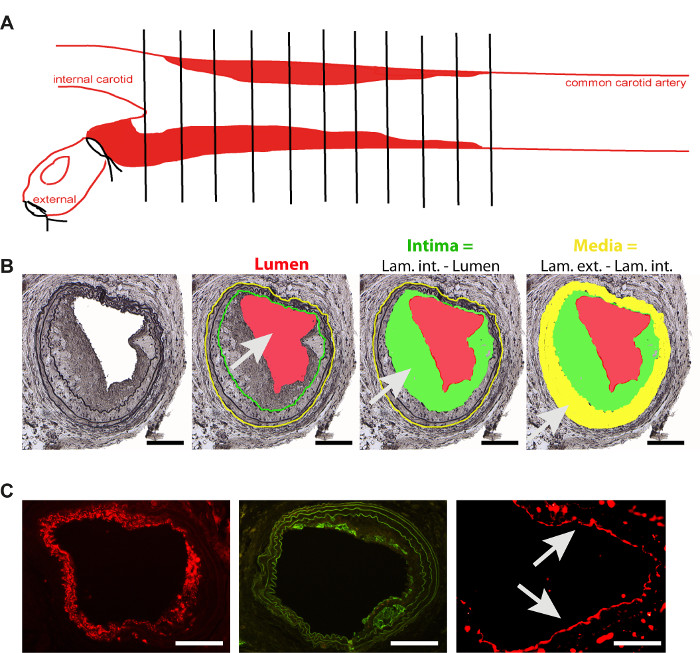
Abbildung 2. Analyse der Restenose Plaque. (A) Schematische Darstellung der Plaqueanalyse in der gemeinsamen Halsschlagader, 4 Wochen nach Drahtverletzungsinduktion(B) Neointima-Bildung 4 Wochen nach der Drahtverletzung und schematische Darstellung der wichtigsten für die Analyse verwendeten Parameter. Intima (grüne Fläche) ist der Unterschied zwischen dem Lumen (rot) und der lamina interna (grüne Linie). Medien (gelber Bereich) ist der Unterschied zwischen der Lamina externa (gelbe Linie) und interna (grüne Linie). Skala bar 100 m(C) Repräsentative Bilder der Färbung der wichtigsten Zelltypen, die an der Neointimabildung beteiligt sind. Glatte Muskelzellen (glattes Muskelaktin -rot, Skalenbalken 100 m), Makrophagen (Mac 2- grün, Schuppenstange 100 m) und Endothelzellen (CD31- rot, Pfeile, Skalenbalken 50 m). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Zeit | Trombus | Plaque (m2) |
Makrophagen (% von Plaque) |
Glatte Muskelzellen (% von Plaque) |
Reendothelialisierung (% Lumenumfang) |
| 1 Tag | vorhanden | 0 | 0 | 0 | 0 |
| 1 Woche | - | < 30 000 | > 10 | < 50 | < 50 |
| 2 Wochen | - | < 50 000 | > 10 | < 50 | > 50 |
| 3 Wochen | - | < 70 000 | 15-25 | 30-40 | 80-90 |
| 4 Wochen | - | 70 000 – 100 000 | 15-25 | 30-40 | vollständig |
Tabelle 1. Zeitabhängige Plaque-Entwicklung.
| Modell | Tiere | Vorteile | Disanvantages |
| Diät-induzierte native Arteriosklerose | klein |
|
|
| Große |
|
| |
| Ballondilatation | klein |
|
|
| Große |
|
| |
| Drahtverletzung | klein |
|
|
| Stent-Implantation | klein |
|
|
| Große |
|
|
Tabelle 2. Vor- und Nachteile von existenten Modellen der arteriellen Verletzung.
Diskussion
In diesem Beitrag geben wir nützliche Tipps, um den Draht-Verletzungs-Verfahren auch von Mitarbeitern mit minimaler Erfahrung in Tieroperationen durchzuführen. Es gibt zwei kritische Schritte bei der Durchführung dieses Verfahrens: den Einschnitt der äußeren Halsschlagader und das Einsetzen des Drahtes. Der Schnitt in der äußeren Halsschlagader muss so weit wie möglich aus der Bifurkation durchgeführt werden, um genügend Restmaterial zu gewährleisten (Abbildung 1C). Der Schnitt sollte nicht zu groß sein, da das Risiko besteht, das gesamte Gefäß zu schneiden. Der zweite kritische Schritt ist das hohe Blutungsrisiko während der Arteriotomie und das Einsetzen des Führungsdrahtes, wenn der Blutfluss nicht effizient eingestellt wird. Darüber hinaus kann es nicht zu einer Endotheldenudation kommen oder ein arterieller Bruch ist möglich, wenn der Führungsdraht nicht ordnungsgemäß in das Lumengefäß eingeführt wird. Um dies zu vermeiden, muss die Oberfläche des Führungsdrahtes vor dem Betrieb sorgfältig poliert werden.
Um das Protokoll zu optimieren, sorgt die Position des Operationstisches mit dem Mauskopf in Richtung des Chirurgen für eine bessere Sicht, Zugänglichkeit und Kontrolle für die richtige Führungsdrahtmanipulation. Darüber hinaus, um die Reproduzierbarkeit zu erhöhen, verwenden Sie den gleichen Führungsdraht in allen Studien. Da sich die Drahtgröße nicht ändert, ist es wichtig, alle möglichen Unterschiede zwischen den Mäusen zu berücksichtigen und zu beseitigen, indem für alle Mäuse, die in einer Studie enthalten sind, das gleiche Geschlecht, alter und das gleiche Gewicht verwendet wird. Danach wird Evans-Blue Färbung dem Chirurgen helfen, die Effizienz der Denudation zu bestimmen. Das Vorhandensein geeigneter Ausrüstungen ist eine Voraussetzung für den Erfolg des Verfahrens. Ein 10-Fach-Stereomikroskop ist für die Durchführung dieses Verfahrens unerlässlich. Die richtige Vorbereitung des Führungsdrahtes (z.B. Polieren) ist entscheidend. Daher empfehlen wir dringend, die Drahtvorbereitung durch spezialisiertes technisches Personal durchzuführen, sofern verfügbar.
Dieses Protokoll hat viele Schritte zur Fehlerbehebung. Wenn Sie die äußere Halsschlagader in der Nähe der Bifurkation einschneiden, binden Sie die Externa vorsichtig in der Nähe der Bifurkation, so dass keine Blutungen auftreten. Beim Schneiden ist die äußere Halsschlagader nicht zu sehen. Betrachten Sie daher die Bifurkation auf der Ebene der Seidennaht. Sammeln Sie Abschnitte, wenn die Seidennaht verschwindet. Wenn der Einschnitt in die äußere Halsschlagader zu groß ist und das Gefäß gebrochen wird, stellen Sie sicher, dass der Blutfluss in die Karotis-Communis und die innere Halsschlagader effektiv unterbrochen wird und versuchen, die Öffnung des Gefäßes mit Zangen zu finden. Nach dem Einführen des Führungsdrahtes und der Denudation, binden Sie das Gefäß in der Nähe der Bifurkation. Während des Schneidens, beginnen zu sammeln, wenn die Seide aus der Naht beginnt zu verschwinden. Wenn während der Denudation mit dem Führungsdraht ein arterieller Bruch auftritt, überprüfen Sie unter dem Mikroskop, ob der Führungsdraht richtig poliert ist.
Trotz der Ähnlichkeit des Drahtverletzungsmodells mit klinischen Situationen konzentrieren sich viele Gruppen auf einheimische Arteriosklerose bei Mäusen, oder sie wählen invasive Arteriosklerose-Induktionen, wie Ballon-Angioplastie bei Ratten oder Kaninchen, wegen des Mangels an ausgebildetem Personal, das kleine Tieroperationen durchführen kann. Trotz der Vorteile der Verwendung von Kaninchen/Ratten, z. B. ohne miniaturisierte Ausrüstung, bieten weder Rattenmodelle noch Kaninchenmodelle eine Vielzahl unterschiedlicher Knock-out-Stämme an, was die Untersuchung molekularer Mechanismen betrifft, die an Neointimawachstum und In-Stent-Thrombose beteiligt sind.
Die bestehenden Modelle für das Studium der In-Stent-Restenose bei Mäusen sind schwierig, erfordern hohe chirurgische Fähigkeiten und haben ein hohes Risiko von Komplikationen wie Blutungen oder Lähmungen. Zum Beispiel wird die mechanische Verletzung oder Stent-Implantation in die Thoraxaorta über die Oberschenkelarterie von einer hohen Sterblichkeitsrate begleitet (35%) aufgrund von Unterschenkellähmung oder Blutungen13-15. Wir beschreiben auch Stent-Implantation in der Halsschlagader einer Maus16. Das Verfahren ist ähnlich; die Gewebeverarbeitung für die Analyse ist jedoch kompliziert und steht nicht allen Laboratorien zur Verfügung16. Die Halsschlagader ist direkt zugänglich, nicht nur für Operationsverfahren, sondern auch für bestehende bildgebende Verfahren wie Ultraschall-Bildgebung. Andere Verletzungsinduktionen in den Karotisarterien bei Mäusen können mit elektrischen Geräten durchgeführt werden17. Diese Methode ist einfach durchzuführen und sorgt für eine hohe Reproduzierbarkeit. Es führt jedoch zu Verletzungen in allen Gefäßschichten, die nicht mit mechanischen Verletzungen identisch sind. Ballonanwendungen haben Vorteile, z.B. die Anpassung an den Gefäßdurchmesser im Einklang mit der klinischen Praxis und haben einen starken Einfluss auf das pathologische Ergebnis. Obwohl Mausballons verfügbar sind, sind sie sehr teuer und daher nicht weit verbreitet. Stattdessen ist die Drahtverletzung die etablierte Methode, die In-Stent-Stenose imitiert.
Die Denudation wird an der normalen arteriellen Wand durchgeführt, wenn auch mit einem atherosklerotischen Hintergrund. Daher wird die Neointima-Bildung im Vergleich zur klinischen Situation moderat sein. Die hohe Anzahl präklinischer Modelle zeigt, dass keines der Modelle alle Kriterien erfüllt, die notwendig sind, um die Gesamtheit der zellulären und molekularen Mechanismen aufzudecken, die zur Pathophysiologie beim Menschen führen (siehe Tabelle 2).
Nach der Durchführung des Drahtverletzungsverfahrens können andere biologische und molekulare Analysen durchgeführt werden, um Zellen, Proteine, mRNAs, microRNAs, Gene oder andere Biomarker zu identifizieren, die als therapeutische Ziele zur Entwicklung neuer Behandlungsstrategien für Arteriosklerose und insbesondere für die Neointimabildung nach Gefäßverletzungen verwendet werden können. Sofern verfügbar, kann das Plaquewachstum mit hochfrequentem Ultraschall oder anderen hochauflösenden Bildgebungstechniken überwacht werden. Darüber hinaus würde die Beherrschung dieser Technik dem Bediener die Möglichkeit geben, das Protokoll an andere invasive Arteriosklerose-Induktionsmodelle anzupassen, wie z. B. Kragenplatzierung, Partielle Ligation oder sogar Stent-Implantation.
Offenlegungen
Es gibt keine Angaben der Autoren.
Danksagungen
Diese Arbeit wurde vom Interdisziplinären Zentrum für Klinische Forschung IZKF Aachen (Junior Research Group to E.A.L.) innerhalb der Fakultät für Medizin der RWTH Aachen unterstützt. Wir danken auch Frau Roya Soltan für die Hilfe bei der Immunhistochemie Färbung.
Materialien
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | - |
| Forceps | FST, Germany | 91197-00 | standard tip curved 0,17 mm |
| Hemostat forceps | FST, Germany | 13007-12 | curved |
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | - |
| Retractors | FST, Germany | 18200-10 | 2.5 mm wide |
| Retractors | FST, Germany | 18200-11 | 5 mm wide |
| Ketamine 10% | CEVA, Germany | - | - |
| Xylazine 2% | Medistar, Germany | - | - |
| Bepanthene eye and nose cream | Bayer, Germany | - | - |
| Silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 µm, |
| section thickness 100 µm, | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC-1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | - |
| Michel Suture Clips | FST, Germany | 12040-01 | - |
| Clip Applying Forcep | FST, Germany | 12018-12 | - |
| 14”Wire for Catheter | Abbot | 1000462H | Use 10 cm from stiff part and equalize the ends |
| Mice | Charles River | Apolipoprotein E -/- mice with C57/Bl6 background | - |
Referenzen
- Simsekyilmaz, S., Liehn, E. A., Militaru, C., Vogt, F. Progress in interventional cardiology: challenges for the future. Thromb Haemost. 113 (3), 464-472 (2015).
- Kubo, N., McCurdy, S., Boisvert, W. A. Defective Fas Expression on Bone Marrow Derived Cells Alters Atherosclerotic Plaque Morphology in Hyperlipidemic Mice. Discoveries. 3 (1), e37 (2015).
- Saffarzadeh, M., et al. Characterization of rapid neutrophil extracellular trap formation and its cooperation with phagocytosis in human neutrophils. Discoveries. 2 (2), e19 (2014).
- Lindner, V., Fingerle, J., Reidy, M. A. Mouse model of arterial injury. Circ Res. 73 (5), 792-796 (1993).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110 (16), 2498-2505 (2004).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J Am Coll Cardiol. 19 (2), 267-274 (1992).
- Curaj, A., et al. Noninvasive molecular ultrasound monitoring of vessel healing after intravascular surgical procedures in a preclinical setup. Arterioscler Thromb Vasc Biol. 35 (6), 1366-1373 (2015).
- Liehn, E. A., Schober, A., Weber, C. Blockade of keratinocyte-derived chemokine inhibits endothelial recovery and enhances plaque formation after arterial injury in ApoE-deficient mice. Arterioscler Thromb Vasc Biol. 24 (10), 1891-1896 (2004).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Simsekyilmaz, S., et al. Role of extracellular RNA in atherosclerotic plaque formation in mice. Circulation. 129 (5), 598-606 (2014).
- Wu, Z., et al. Rhodamine-loaded intercellular adhesion molecule-1-targeted microbubbles for dual-modality imaging under controlled shear stresses. Circ Cardiovasc Imaging. 6 (6), 974-981 (2013).
- Schober, A., et al. Crucial role of the CCL2/CCR2 axis in neointimal hyperplasia after arterial injury in hyperlipidemic mice involves early monocyte recruitment and CCL2 presentation on platelets. Circ Res. 95 (11), 1125-1133 (2004).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler Thromb Vasc Biol. 27 (4), 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Simsekyilmaz, S., et al. A murine model of stent implantation in the carotid artery for the study of restenosis. J Vis Exp. , e50233 (2013).
- Schroder, K., et al. NADPH oxidase Nox2 is required for hypoxia-induced mobilization of endothelial progenitor cells. Circ Res. 105 (6), 537-544 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten