Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung von Labile organischer Kohlenstoff im Boden Mit Sequential Begasung Incubation Procedures
In diesem Artikel
Zusammenfassung
Labile organic carbon (LOC) and the potential carbon turnover rate are sensitive indicators of changes in soil nutrient cycling processes. Details are provided for a method based on fumigating and incubating soil in a series of cycles and using the CO2 accumulated during the incubation periods to estimate these parameters.
Zusammenfassung
Managementpraktiken und Umweltveränderungen können Erdnahrung und Kohlenstoffkreislauf verändern. Boden labilen organischen Kohlenstoff, ein leicht abbaubaren C-Pool, ist sehr empfindlich gegenüber Störungen. Es ist auch das primäre Substrat für Mikroorganismen im Boden, die auf den Nährstoffkreislauf von grundlegender Bedeutung ist. Aufgrund dieser Eigenschaften, labiler organischer Kohlenstoff (LOC) wurde als Indikator Parameter für Bodengesundheit identifiziert. Quantifizieren der Fluktuationsrate von LOC hilft auch beim Verständnis Veränderungen der Bodennährstoffkreislauf-Prozesse. Eine sequentielle Begasung Inkubation Methode wurde entwickelt Boden LOC und potenzielle C Fluktuationsrate zu schätzen. Das Verfahren erfordert Räucherpatronen Bodenproben und Quantifizieren CO 2 -C respired während einer 10 - tägigen Inkubationsperiode über eine Reihe von Begasung-Inkubation Zyklen. Labile organischen C und potenzielle C Fluktuationsrate werden dann von akkumulierten CO 2 mit einem negativen exponentiellen Modell hochgerechnet. Die Verfahren für diese Methode der Durchführung sind beschreibend.
Einleitung
Aufgrund seiner lebenswichtige Rollen in Kohlenstoff (C) und den Nährstoffkreislauf und seine Empfindlichkeit gegenüber Bodenveränderung, Boden LOC ist ein wichtiger Parameter als Indikator der organischen Bodensubstanz Qualität zu messen. Wälder und landwirtschaftliche Ökosysteme in hohem Maße abhängig von der Mineralisierung von Nährstoffen in organischen Substanz im Boden als Quelle von Nährstoffen. Management - Aktivitäten können die Poolgröße und Umsatzrate organischer Boden C ändern, was zu Veränderungen der Nährstoffzufuhr 1. Die organische Boden C besteht aus zwei Hauptfraktionen von widerspenstigen C, die Umsatzraten von mehreren tausend Jahren, und LOC, die Umsatzraten von wenigen Wochen bis zu einigen Jahren 2,3,4 hat. Boden labile C besteht aus leicht abbaubaren Substraten wie mikrobielle Biomasse C, Niedermolekulare Verbindungen (Aminosäuren, einfache Kohlenhydrate) aus pflanzlichen Rhizodeposition und Zersetzungsprodukte entstehen und Sickerwasser aus Streu 1,4,5. Da Boden labile C leicht abbaubar ist, ist essehr empfindlich auf Management - Praktiken und natürliche Phänomene , die Erde 6 stören oder zu verändern. Boden labile C dient als primäre Energiequelle für die Mikroorganismen im Boden bei der Zersetzung von organischer Substanz 7. Als solche LOC Auswirkungen Nährstoffkreislauf in einem größeren Ausmaß , als dies stabile Formen der organischen Boden C 8. Bodenmikroorganismen sind auch verantwortlich für die Mehrheit der heterotrophe Atmung, die durch die stimulierende Wirkung von LOC 9,10,11 erleichtert bei der Zersetzung von widerspenstigen organischen Substanz im Boden vorkommt. Diese Atmung spielt eine wesentliche Rolle in der globalen C - Zyklen , da die organische Boden C etwa doppelt so hoch atmosphärischen C 11 ist.
Als Ergebnis seiner Bedeutung in terrestrischen Ökosystemen haben mehrere Verfahren zur Abschätzung Boden LOC entwickelt. Diese Verfahren können in drei allgemeine Klassifikationen abgegrenzt werden: physikalische, chemische und biochemische. Densitometrische Trennverfahren sind physikalische Methods , die zur Trennung der organischen Boden C in schweren oder leichten Fraktionen oder in groben und feinen partikulären organischen C 12,13,14,15 bestehen. Trennverfahren sind relativ einfach durchzuführen, aber sie tun nicht häufig konsistente Ergebnisse , da diese Fraktionen mit Bodenart mineralischen Zusammensetzung, Pflanzenmaterial Größe und Dichte, und Boden - Aggregat Konsistenz 13,15 variieren. Trennverfahren produzieren auch nur quantitative Informationen über LOC 15.
Mehrere chemische Verfahren sind für LOC Schätzung zur Verfügung. Wässrige Extraktion von organischem Kohlenstoff ist relativ einfach durchzuführen, und die Methoden bieten oft leicht reproduzierbare Ergebnisse. Allerdings sind diese Extraktionen betreffen nicht das gesamte Spektrum der verfügbaren Substrate für Mikroorganismen 15. Mehrere Oxidationsverfahren für die chemische Fraktionierung der organischen Boden C entwickelt wurden. Oxidationsverfahren haben den Vorteil, die Charakterisierung der Quantität und Qualität der labilen organischen C, Obwohl einige Methoden erfordern Arbeit mit gefährlichen Chemikalien und es gibt Variabilität unter den Methoden der Reproduzierbarkeit der Ergebnisse 15. Die Säurehydrolyse Extraktionsmethode ist eine andere Art von chemischer Fraktionierung Prozedur, die die Quantität und Qualität der LOC messen kann, aber die Ergebnisse dieser Methode erleichtern nicht Auslegung ihrer biologischen Eigenschaften 13,15.
Biochemische Verfahren zur Interpretation von Boden LOC entwickelt. Labile organischen C gemessen werden als CO 2 durch Mikroorganismen in der Atmung Tests freigegeben. Diese Tests stellen Schätzungen der wahren mineralisierbaren organischer Substanz, aber in der Regel nur die labilen Verbindungen sind mineralisierten während der Tests 15. Boden mikrobielle Biomasse C , gemessen durch Begasung-Inkubation 16 und Begasung-Extraktion 17 verwendet worden ist Rückschlüsse auf LOC zu entwickeln. Jedoch liefern diese Verfahren Schätzungen von C in der mikrobiellen Biomasse statt LOC. Beide Verfahren umfassen die Begasung Subtraktion von Werten von nicht-begaste Erde mikrobiellen Biomasse C , um zu bestimmen, aber es wurde vorgeschlagen , dass erhaltenen Werte ohne Abzug von nicht-begaste Erde ein Maß für labile organische Fraktionen von C zusätzlich zu mikrobieller Biomasse 18 bereitzustellen .
Die sequentielle Begasung-Inkubation (SFI) Verfahren 13 für LOC Messung ist ein biochemischer Verfahren von dem Verfahren der Begasung-Inkubation angepasst 16 für mikrobiellen Biomasse C - Messung. Die SFI-Verfahren hat einige Vorteile gegenüber anderen Methoden der LOC Abschätzen. Eine konzeptionelle Grundlage für das Verfahren ist, dass LOC ist die mikrobiell abbaubare C, das mikrobielle Wachstum und das LOC regelt, ist physisch zugänglich und chemisch abbaubar durch Mikroorganismen im Boden. Unter Feldbedingungen ist das mikrobielle Wachstum typischerweise durch Kohlenstoff Verfügbarkeit, Nährstoffverfügbarkeit, verfügbar Porenraum und / oder das Verdrängen begrenzt. Diese Faktoren sind fast eliminiert durch Begasung, ungehinderten Bedingungen für das mikrobielle Wachstum zu schaffen. Keine Nährstoffe werden während der Inkubationszeit des Verfahrens entfernt wird. Im Laufe mehrerer Begasung und Inkubation Zyklen wird durch C Menge und Qualität (Labilität) 13 mikrobielles Wachstum begrenzt. Die akkumulierte CO 2 veratmet während der Inkubation Zyklen verwendet LOC mit einem einfachen negativen exponentiellen Modell 11,13,19 zu extrapolieren. Das Potential C Fluktuationsrate kann auch von der Steigung des exponentiellen Modell abgeleitet werden, so dass die SFI - Methode den Vorteil gegenüber den meisten anderen LOC Methoden der gleichzeitig die Konzentrationen und mögliche Fluktuationsrate von LOC 11 Schätzen hat. Für andere Methoden, Informationen über die potenziellen Umsatzraten von LOC kann nur ermittelt werden , wenn Tracer wie 14 C 13 verwendet werden. Die SFI-Verfahren ist somit eine relativ einfache und kostengünstige Technik für Messungen von sowohl LOC und seine möglichen Umsatzraten zu erhalten.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Sammeln Bodenproben Vertreter der Bedingungen innerhalb des experimentellen Bereich zu bekommen und innerhalb der experimentellen Einheiten 20
- Identifizieren Sie alle Unterschiede in den Site-Eigenschaften wie Steigung und Bodeneigenschaften einschließlich Textur, Schüttdichte, pH, organische Horizont Tiefe und / oder Nährstoffkonzentrationen. Identifizieren Sie alle Unterschiede in der Vegetation Typ innerhalb Parzellen. Bekannt oder veröffentlichten Schätzungen von Variationskoeffizienten für Site-Eigenschaften die Anzahl der Proben abzuschätzen erforderlich, um einen vorgegebenen relativen Fehler zu erreichen.
- Beispiel Boden eine Schnecke oder eine andere Sammelvorrichtung in einem Muster basierend auf der Baustelle und Versuchseinheit Bedingungen.
- Für homogene Bedingungen, verwenden Sie ein Stichprobenmuster in jeder Versuchseinheit.
- Zuordnen Abtastpunkte entweder vollständig zufälligen Stellen innerhalb der Versuchseinheit oder in einem Zickzackmuster.
- Beispiel Boden an jedem beliebigen Punkt oder an Punkten in einem Zick-Zack-Rüttler zugewiesenn. Pinsel beiseite organischer Substanz von der Oberfläche der Mineralboden vor der Schnecke oder andere Sammelvorrichtung mit Bodenprobe auszuheben.
HINWEIS: Die SFI - Verfahren wurde unter Verwendung von Bodenhorizonten von der Oa entwickelt und unter 13. Weitere Tests ist notwendig, wenn Horizont über dem Oa getestet werden können, wird die SFI-Methode. - Kombinieren Sie alle Proben innerhalb des Versuchseinheit in einem einzigen Behälter gesammelt und mischen physikalisch die einzelnen Proben innerhalb des Behälters eine Mischprobe für jede Versuchseinheit zu schaffen.
- Für heterogene Bedingungen, die viel häufiger sind, verwenden Sie einen systematischen Stichprobenmuster in jeder Versuchseinheit.
- Proben Böden entlang der transect in der Mitte jeder Versuchseinheit, so dass der Abstand zwischen Abtastpunkten innerhalb des transect kleiner ist als der Abstand innerhalb der Versuchseinheiten darstellen Variabilität notwendig.
- Beispiel Böden entlang mehrerer transects innerhalb jeder Experimental Einheit, die ein Gittermuster in relativ großen experimentellen Einheiten oder Versuchseinheiten mit mehreren Quellen von Variabilität bilden.
- Kombinieren Sie alle Proben entlang jeder transect in einem einzigen Behälter gesammelt und mischen physikalisch die einzelnen Proben innerhalb des Behälters eine Mischprobe für jede transect zu erstellen.
- Für homogene Bedingungen, verwenden Sie ein Stichprobenmuster in jeder Versuchseinheit.
2. Bereiten Boden für die SFI-Assay
- Prüfmuster in einem Eis-Packung gefüllt Kühler unmittelbar nach der Entnahme in das Feld ein.
- Bei der Ankunft in der Einrichtung bei denen die Proben bis zur Analyse, Platz Proben in einem Kühlschrank bei 4 ° C gelagert werden, bis die Probenvorbereitung und SFI-Verfahren durchgeführt werden.
- Sieve Bodenproben durch einen 6,4 mm x 6,4 mm Maschenweite. Reinigen Sie das Gitter mit Wasser zwischen jeder Probe eine Kontamination zwischen den Proben zu verhindern.
- Für jede Probe messen drei 100 g Teilproben und legen Sie die 100 g Teilproben in einem 250-ml-Becher. Abdeckung each Becher mit Parafilm und lassen sie auf einer Arbeitsplatte für 10 Tage bei 25 ° C.
3. Nehmen Sie Subsamples für otro Gewichtsbestimmung
- Am Ende der 10 Tage Vorinkubation von Bodenproben, entfernen Parafilm von jeder Probe.
- Nehmen Sie das Gewicht eines Aluminium-Boot wiegen. Nehmen Sie 1 g Boden von allen Proben und in Boot wiegen.
- Das Gewicht des feuchten Boden und wiegen Boot.
- Platzieren Sie die wiegen Boote mit Boden in einem Ofen bei 105 ° C. Nachdem die Proben erreichen ein konstantes Gewicht, das nach 48 Stunden typischerweise Rekordgewichte der Boote und Boden wiegen.
- Subtrahiert wiegen Bootsgewicht aus den Gewichten der feuchten Erde genommen und trockenen Boden im wiegen Boot feucht und trocken Bodengewicht zu erhalten. Leiten Sie die trocken: feucht Boden Verhältnis von trockenem Boden, Gewicht durch die feuchte Erde Gewicht dividiert wird.
4. Fumigate Bodenproben
- Legen Sie ein feuchtes Papiertuch in der Unterseite von mindestens zwei (more kann in Abhängigkeit von der Anzahl der Proben) 10,5 L Glasvakuum Exsikkatoren mit Porzellanplatten notwendig.
- Für alle Proben 30 g Boden in drei separate Glasfläschchen wiegen. Verwenden Sie Fläschchen groß genug, um 40 g Boden und schmal genug zu halten, innerhalb einer 40 mm Öffnung zu passen, wenn die Inkubation Behälterdesign in Abschnitt 5 verwendet wird.
- Bei Verwendung von Etikettenband jeweils 30 g Boden Substichprobe zu identifizieren, verwenden Bleistift weil Begasung Tinte verschlechtert.
- Legen Sie zwei der drei 30 g Teilproben für jede Bodenprobe in einem Vakuumexsikkator für die Begasung und eine Teilprobe in einem Vakuumexsikkator, die nicht Begasung durchführen wird.
- In einem 100-ml-Becher, legen Sie eine Schicht aus Steinen ausreicht, um den Boden des Bechers zu kochen.
- Gießen 50 ml ethanolfreiem Chloroform (CHCl 3) in den 100 ml - Becherglas mit einer Schicht aus Siedesteine. Platzieren Sie den 100 ml - Becherglas mit siedendem Steinen und CHCl 3 in der Mitte eines Exsikkator mit 30 g Erde gefülltsubsamples. Führen Sie diesen Schritt unter einer Abzugshaube.
- Unter einem Abzug verwenden , um ein Vakuum , um die CHCl 3 zu kochen zwei Sätze von Teilproben pro Bodenprobe auszuräuchern.
- Schließen Sie das Vakuum an den Vakuumtrockner mit Vakuumschlauch. Starten Sie das Vakuum und zusehen , wie CHCl 3 zu sieden beginnt.
- Lassen Sie 3 CHCl für 30 Sekunden zum Kochen bringen und ziehen Sie das Vakuumschlauch aus dem Exsikkator Luft zu ermöglichen , in den Exsikkator zurückfließen. Dieser Schritt fördert CHCl 3 Gaseintritt in den Bodenproben. Zweimal wiederholen.
- Führen Sie eine vierte und letzte Kochen von CHCl 3, so dass es für 2 Minuten kochen lassen.
- Mit noch Vakuum ausgeführt wird, schließen Sie die Dichtung auf dem Vakuumexsikkator, so dass das Vakuum im Exsikkator gehalten wird. Schalten Sie das Vakuum aus und ziehen Sie den Vakuumschlauch aus dem Exsikkator.
- Verschließen Sie den Exsikkator enthält, die nicht begasten Proben durch einen Deckel Aufsetzen auf dem Exsikkator und Abdichten des Vakuumverschluss. Pschnüren die Exsikkatoren (begast und nicht begast) in einem abgedunkelten Bereich (wie ein Schrank) für 24 Stunden. Sie nicht die Vakuumverfahren des Absatzes wiederholen 4.7 auf den Exsikkator nicht begasten Proben enthält.
5. Bauen Sie Container für Bodenprobe Incubation
- Schieben Sie eine 15 cm Länge Glasstab über eine Größe 10 Gummi-Stopper mit einem Loch in der Mitte gebohrt. Der Stabdurchmesser sollte ausreichend sein, eng anliegend durch das Loch zu passen.
- Beschriften 0,5 L durchscheinend breiten Mund Polypropylenflaschen mit Identifikation, die dem begast und nicht-begasten Substichprobe Identifikation entspricht.
6. Evakuieren Chloroform von Exsikkatoren unter einer Abzugshaube
- Öffnen Sie den Stopfen auf einem Vakuumexsikkator um den Luftstrom in den Exsikkator ermöglichen. Entfernen Sie den Deckel aus dem Exsikkator, und nehmen Sie die Proben und das feuchte Handtuch aus Exsikkator.
- Verwenden Sie ein Vakuum CHCl 3 Gas aus Bodenproben zu evakuieren.
- Setzen Sie den Deckel auf den Exsikkator gestellt. Schließen Sie den Exsikkator auf ein Vakuum mit Vakuumschlauch.
- Schalten Sie die Vakuumpumpe ein und lassen Pumpe für fünf Minuten zu laufen. Ziehen Sie den Vakuumschlauch aus dem Exsikkator Luftstrom in den Exsikkator zu ermöglichen.
- Wiederholen Sie Schritt 6.3.2 viermal.
7. Bewegen Sie jede Boden Subsample in eine Incubation Container (Abbildung 1) einen 10-tägigen Inkubation Conduct
- Pipette 1 ml entionisiertes Wasser in den Behälter Inkubation. Schließen Sie eine leere Glasfläschchen mit dem Glasstab von der Größe 10 Stopfen erstreckt, um eine Gummiband. Das offene Ende des Glasfläschchen sollte die Basis der Anschlagfläche. Die Glasfläschchen sollte ausreichend zu halten, bis zu 40 ml Flüssigkeit von einer Größe sein.
- Legen Sie ein Fläschchen mit dem 30 g Boden Substichprobe in die Inkubation Behälter enthält.
- 1 g der nicht-begaste Erde von der ursprünglichen Bodenprobe zu jedem seiner entsprechenden Teilproben (begast und nicht-begaste) als inoculuMeter
- Pipette 1 ml 2 M NaOH in das Glasfläschchen mit dem Stopfen / Glasstab verbunden ist. Schieben Sie den Stopper / Glasstab auf die Oberseite des Behälters Inkubation. Decken Sie die Oberseite des Behälters Inkubation mit Parafilm.
- Erstellen Sie eine Inkubation Behälter, der keinen Boden enthält. Montieren Sie drei vor fünf nicht-Bodeninkubation Containern.
HINWEIS: Die verwendete Säure Proben des Behälters no-Boden zu titrieren ist wesentlich für die Bestimmung von CO 2 Mineralisierung während der Inkubationszeit, die unten in Abschnitt 9.3 beschrieben ist. Als solches mehrere nicht-Bodenbehälter sind als Schutz gegen falsche Handhabung oder Titration einer no-Bodeninkubation Container erstellt , die einen Fehler in CO 2 Mineralisierung Berechnung für alle Proben schaffen würde. Die verwendete Säure Proben zur Titration von den nicht-Bodenbehälter sollten in Werte in der Nähe sein; ein sehr ungleichen Säurewert unter den Proben Behälter nicht-Boden ist wahrscheinlich das Ergebnis einer falschen Handhabung der Proben oder Titration.- Folgen Sie den Anweisungen des Abschnitts 5 der Inkubation Behälter montieren.
- Folgen Sie den Anweisungen von 7,1 und 7,4.
- Platzieren alle Inkubationsbehälter in einem verdunkelten Lagerfläche bei 25 ° C. Lassen Sie alle Inkubationsbehälter in dem Speicherbereich für 10 Tage.
8. Führen Sie Titration auf jede Teilprobe CO 2 durch mikrobielle Respiration während der Inkubationszeit Produktion zu beziffern
- Entfernen Sie die Glasampulle, die 2 M NaOH aus der Inkubation Behälter enthält.
- Pipette 2 ml 1 M BaCl 2 in das Glasfläschchen , das 2 M NaOH.
- Einen Tropfen Phenolphthalein (C 20 H 14 O 4) aus einer Pipette oder Medizin Pipette in das Glasfläschchen , die Mischung von BaCl 2 und NaOH enthält. Legen Sie einen magnetischen Rührstab in dem Glasfläschchen und legen Sie das Glasfläschchen auf einer Rührplatte.
- Mit der Rührplatte aktiviert, fügen Sie langsam 0,1 N HCl mit einer Bürette bis zur Wiederd Färbung der Mischung in dem Glasfläschchen klar wird.
- Aufzeichnung der Menge an HCl erforderlich, um die Färbung der Mischung in dem Glasfläschchen zu ändern.
9. Bestimmen Sie mikrobielle Biomasse C aus gesammelten Daten während des ersten Begasung-Inkubation Zyklus 16,21,22
- Bestimmen Sie das Trockengewicht des Bodens in jedem Substichprobe durch seine Feuchtgewicht durch das trockene Multiplikation: feucht-Gewichtsverhältnis 3,8 in Schritt erhalten.
- Bestimmen Sie die durchschnittliche Menge an HCl verwendet, um titrieren die No-Bodeninkubation Containern.
- Berechnen CO 2 mineralisiert während der 10-tägigen Inkubation unter Verwendung der Formel:

wobei CO 2 = CO 2 mineralisiert während der 10-Tage - Inkubation
NS = Säure verwendet, um Proben in nicht-Bodeninkubation Behälter zu titrieren
S = Säure verwendet, um Proben zu titrieren, die Erde in der Brutbehälter enthalten
M = Molarität von the HCl
E = 6, das Äquivalentgewicht
W = Trockengewicht des Bodens in der Inkubation Behälter enthalten - Berechnen der mikrobiellen Biomasse C unter Verwendung der Formel:
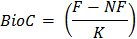
wo BioC = mikrobielle Biomasse C
F = CO 2 mineralisiert aus dem Boden subsamples , die begast wurden
NF = CO 2 mineralisiert aus dem Boden subsamples , die waren nicht begast
K = Anteil an mineralisiertem mikrobiellen Biomasse C zu CO 2- Bestimmen Sie den Wert für K entweder durch direkte Messung von 14 C - Mineralisierung in Vorversuchen mit dem Boden oder veröffentlichten Werten 22. Ein Wert von 0,45 für K für diesen Test 23 verwendet.
- Führen sequenziellen Begasung und Inkubationszyklen durch Abschnitte 4-8 siebenmal für die Bodenteilproben zu wiederholen, die in der ersten Begasung-Inkubationszyklus begast wurden.
10. Determine Labile C und Potential C Umschlag Mit CO 2 mineralisierte über den Verlauf der Acht Begasung und Inkubationszyklen
- Verwenden Sie die folgende Formel ein Korrekturfaktor für den Boden Inokulum zu bestimmen, nach jeder Begasung Proben hinzugefügt:
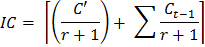
Wo IC = Korrekturfaktor für die Inokulum
C '= Menge von CO 2 aus dem nicht begasten Substichprobe während der ersten 10-Tages - Inkubation
r = Gewichtsverhältnis von Inokulum Boden begast Boden in der ersten Begasung Inkubationszyklus
C t = Inkubationszyklus (1, 2 ... 8), so daß C t-1 = 0 , wenn t = 1 - Verwenden Sie die folgende Formel während jeder Inkubation für jede Substichprobe veröffentlicht die CO 2 zu schätzen:
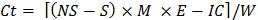
wo Ct = CO 2 während der Inkubation freigesetzt
NS = Säure verwendet, um Proben zu titrierenin keiner Bodeninkubation Behälter
S = Säure verwendet, um Proben zu titrieren, die Erde in der Brutbehälter enthalten
IC = Korrekturfaktor für die Inokulum (bestimmt in Schritt 10.1)
E = 6, das Äquivalentgewicht
W = Trockengewicht des Bodens in der Inkubation Behälter enthalten - Man leite labile organische C unter Verwendung von nicht-lineare Regression.
- Organisieren einer Tabelle , die für jede Probe Identifikatoren für die Probe, Inkubation Zyklusnummer (1, 2 ... 8) und CO 2 freigesetzt während der Inkubation (abgeleitet in Schritt 10.2) umfasst.
- Mit Software, die nicht-lineare Regression, passen das folgende Modell zu dem Datensatz:

wo Csum = die Summe von CO 2 während der acht Inkubation Zyklen freigegeben
LOC = Boden labile organische C
k = potenzielle Umsatzzeit
t = Inkubationszyklus (1, 2 ... 8)
- Convert Umsatzpotenzial time aus Schritt 10.3.2 in Tage durch den Kehrwert k von 10 aufgrund der 10-tägigen Inkubation Zyklus multipliziert wird.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die SFI Methode wurde in dieser Arbeit in einer Reihe von Experimenten durchgeführt , im Südosten der Vereinigten Staaten 24,25,26,27 wie beschrieben verwendet. Zusammen stellen diese Experimente eine Vielzahl von Vegetationstypen umfasste, darunter loblolly Kiefer (Pinus Taeda L.), Rutenhirse (Panicum virgatum L.), Pappel (Populus deltoides Bartram ex Marsh.) Und Sojabohnen (Glycine max L. Merr.). Das Verfahren war empfindlich auf Untersc...
Access restricted. Please log in or start a trial to view this content.
Diskussion
The SFI method is an effective protocol for detecting differences in soil LOC and potential C turnover rates over a range of management practices (such as fertilization, tillage, vegetation control, and harvest practices) and soil conditions. Soil LOC content and C turnover rate can be used to understand alterations of nutrient cycles. The SFI method also provides measurement of microbial biomass C from the first fumigation-incubation event. The ability to measure soil LOC, C turnover, and microbial biomass C concurrentl...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors gratefully acknowledge Michelle Gonzales, Kenny Kidd, Brad Osbon, and all other personnel that conducted the laboratory procedures for these data. The authors are thankful for assistance from Andrew Scott in developing software coding to conduct model-fitting procedures. The authors also appreciate the funding from the U.S. Department of Agriculture National Institute of Food and Agriculture, Sustainable Agriculture and Research & Education, Sun Grant South Central region, and the National Council of Air and Stream Improvement that made possible the studies from which representative results provided in this paper were drawn.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Soil auger sampling kit | JMC | PN039 | Several other manufacturers of punch augers are available |
| Parafilm | Curwood | PM999 | |
| Aluminum weighing boats | Fisherbrand | 08-732-103 | |
| General purpose drying oven | Fisher Scientific | 15-103-0511 | Many other manufacturers of general purpose laboratory ovens are available |
| 10.5 L vacuum desiccator | Corning | 3121-250 | |
| Glass scintillation vial | Wheaton | 968560 | |
| Glass threaded vials, 41 ml | Fisherbrand | 03-339-21N | |
| Chloroform, stabilized with amylenes | Sigma-Aldrich | 67-66-3 | |
| Boiling chips | Fisher Scientific | S25201 | |
| Glass rod | Fisherbrand | S63449 | |
| Size 10 rubber stopper | Fisherbrand | 14-130P | Rubber stoppers can be purchased as solid and drilled in center to install glass rod or bought with a hole to insert glass rod |
| Wide-mouth PPCO bottle, 0.5 L | ThermoScientific | 3121050016 | |
| Sodium hydroxide, reagent grade | Sigma-Aldrich | S5881 | |
| Barium chloride | Sigma-Aldrich | 202738 | |
| Phenolphthalein indicator | Fisher Scientific | S25466 | |
| Hydrochloric acid solution, 0.1 N | Fisher Scientific | SA54-4 |
Referenzen
- Blair, G., et al. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Aust. J. Agric. Res. 46, 1459-1466 (1995).
- Schimel, D. S., et al. Soil organic matter dynamics in paired rangeland and cropland toposequences in North Dakota. Geoderma. 36, 201-214 (1985).
- Parton, W. J., et al. Analysis of factors controlling soil organic matter levels in great-plains grasslands. Soil Sci. Soc. Am. J. 51, 1173-1179 (1987).
- Wu, H., et al. Labile organic C and N mineralization of soil aggregate size classes in semiarid grasslands as affected by grazing management. Biol. Fertil. Soils. 48, 305-313 (2011).
- Jones, D. L., et al. Plant and mycorrhizal regulation of rhizodeposition. New Phytol. 163, 459-480 (2004).
- Harrison, K. G., et al. The effect of changing land use of soil radiocarbon. Science. 262, 725-726 (1993).
- Jinbo, Z., et al. Land use effects on the distribution of labile organic carbon fractions through soil profiles. Soil Sci Soc. Am. J. 70, 660-667 (2006).
- Whalen, J. K., et al. Carbon and nitrogen mineralization from light- and heavy-fraction additions to soil. Soil Biol Biochem. 32, 1345-1352 (2000).
- Gregorich, E. G., et al. Towards a minimum data set to assess soil organic matter quality in agricultural soils. Can. J. Soil Sci. 74, 367-385 (1994).
- Hamer, U., et al. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions. Soil Biol. Biochem. 37, 445-454 (2005).
- Feng, W., et al. Shifting sources of soil labile organic carbon after termination of plant carbon inputs in a subtropical moist forest of southwest China. Ecol. Res. 26, 437-444 (2011).
- Tisdall, J. M. Formation of soil aggregates and accumulation of soil organic matter. Structure and Organic Matter Storage in Agricultural Soils. Carter, M. R., Stewart, B. A. , Lewis Publishers. 57-96 (1996).
- Zou, X. M., et al. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biol. Biochem. 37, 1923-1928 (2005).
- Cambardella, C. A., Elliott, E. T. Particulate soil organic matter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56, 777-783 (1992).
- Strosser, E. Methods for determination of labile soil organic matter: an overview. J. Agrobiol. 27, 49-60 (2010).
- Jenkinson, D. A., Powlson, D. S. The effects of biocidal treatment on metabolism in soil V: a method for measuring soil biomass. Soil Biol. Biochem. 8, 209-213 (1976).
- Vance, E. D., et al. An extraction method for measuring soil microbial biomass C. Soil Biol. Biochem. 19, 703-707 (1987).
- De-Polli, H., et al. Chloroform fumigation-extraction labile C pool (microbial biomass C "plus") shows high correlation to microbial biomass C in Argentinian and Brazilian soils. Cienc. Suelo. 25, 15-22 (2007).
- Olson, J. S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology. 44, 322-331 (1963).
- Pennock, D., et al. Chapter 1, Unit 1, Soil sampling designs. Soil Sampling and Methods of Analysis. Carter, M. R., Gregorich, E. G. , CRC Press, Taylor & Francis Group, LLC. (2008).
- Luizao, R. C. C., et al. Seasonal variation of soil microbial biomass: the effects of clearfelling a tropical rainforest and establishment of pasture in the central Amazon. Soil Biol. Biochem. 24, 805-813 (1992).
- Horwath, W. R., Paul, E. A., et al. Microbial biomass. Methods of soil analysis part 2: microbiological and biochemical properties. Weaver, R. W. , Soil Science Society of America, Inc. 753-773 (1994).
- Jenkinson, D. S., Ladd, J. N. Microbial biomass in soil: measurement and turnover. Soil Biochemistry. Paul, E. A., Ladd, J. N. , Marcel Dekker. 415-471 (1981).
- Blazier, M. A., et al. Poultry litter fertilization impacts on soil, plant, and water characteristics in loblolly pine (Pinus taeda L.) plantations and silvopastures in the mid-South USA. Principles, application, and assessment in soil science. Gungor, E. B. O. , InTech, Inc. 43-74 (2011).
- Blazier, M. A., et al. Straw harvesting, fertilization, and fertilizer type alter soil biophysical properties in a loblolly pine plantation in the mid-South USA. Biol. Fertil. Soils. 45, 145-153 (2008).
- Blazier, M. A., et al. Loblolly pine age and density affects switchgrass growth and soil carbon in an agroforestry system. For. Sci. 58, 485-496 (2012).
- Blazier, M. A., et al. Nitrogen and carbon of switchgrass, loblolly pine, and cottonwood biofuel production systems in the Southeast United States. For. Sci. 61, 522-534 (2015).
- Zhang, M., et al. Decomposition differences of labile carbon from litter to soil in a tropical rain forest and rubber plantation of Xishuagbanna, southwest China. Eur. J. Soil Biol. 55, 55-61 (2013).
- Nelson, D. W., Sommers, L. E. Total carbon, organic carbon, and organic matter. Methods of soil analysis. Part 3: chemical methods. Sparks, D., et al. , Soil Science Society of America, Inc. 961-1090 (1996).
- Huang, L., et al. Correlation among soil microorganisms, soil enzyme activities, and removal rates of pollutants in three constructed wetlands purifying micro-polluted river water. Soil Biol. Biochem. 70, 221-228 (2012).
- Kong, L., et al. Enzyme and root activities in surface-flow constructed wetlands. Chemosphere. 76, 601-608 (2009).
- Cui, L., et al. Evaluation of nutrient removal efficiency and microbial enzyme activity in a baffled subsurface-flow constructed wetland system. Bioresour. Technol. 146, 656-662 (2013).
- Jenkinson, D. S. Determination of microbial biomass carbon and nitrogen in soil. Advances in nitrogen cycling in agricultural ecosystems. Wilson, J. R. , CAB International. 368-386 (1988).
- Sparling, G. P., et al. Interference from plant roots in the estimation of soil microbial ATP, C, N, and P. Soil Biol. Biochem. 17, 275-278 (1985).
- Christie, P., Beatte, J. A. M. Significance of sample size in measurement of soil microbial biomass by the chloroform fumigation-incubation method. Soil Biol. Biochem. 19, 149-152 (1987).
- McLaughlin, K. K., Hobbie, S. E. Comparison of labile soil organic matter fractionation techniques. Soil Sci. Soc. Am. J. 68, 1616-1625 (2004).
- Xia, X., et al. Variation of soil labile organic carbon pools along an elevational gradient in the Wuyi Mountains, China. J. Resour. Ecol. 1, 368-374 (2010).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten