Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hoher Durchsatz, Echtzeit, Doppel-Ausleseprüfung intrazellulärer antimikrobieller Aktivität und eukaryotischen Zelle Zytotoxizität
In diesem Artikel
Zusammenfassung
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
Zusammenfassung
Traditionelle Maßnahmen der intrazellulären antimikrobielle Aktivität und eukaryotische Zelle Zytotoxizität vertrauen auf Endpunkt-Assays. Solche Endpunktassays erfordern mehrere zusätzliche experimentelle Schritte vor, wie Zelllyse auszulesen, koloniebildende Einheit Bestimmung oder Reagenzzugabe. Wenn Tausende von Assays, beispielsweise während des Hochdurchsatz-Screening durchgeführt wird, die stromabwärts Aufwand für diese Arten von Assays erforderlich ist, ist beträchtlich. Daher Hochdurchsatz antimikrobielle Entdeckung zu erleichtern, haben wir ein Echtzeit-Test, um gleichzeitig Inhibitoren der intrazellulären Bakterienwachstums identifizieren und eukaryotischen Zell-Cytotoxizität zu bewerten. Insbesondere wurde das Bakterienwachstum intrazellulärem Echtzeit - Detektion von Markierungs bakterielle Screening Stämme aktiviert entweder mit einem bakteriellen lux - Operon (1. Generation assay) oder fluoreszierendes Protein Reporter (2 nd Generation, orthogonal assay). Eine nicht-toxische, Zellmembran-impermeante, nukleinsäurebindende Farbstoffwurde auch während der anfänglichen Infektion von Makrophagen aufgenommen. Diese Farbstoffe werden aus lebenden Zellen ausgeschlossen. Allerdings nicht lebensfähigen Wirtszellen verlieren die Integrität der Membran erlauben Eintritt und Fluoreszenzmarkierung von Kern-DNA (Desoxyribonukleinsäure). Bemerkenswerterweise ist DNA-Bindung mit einer starken Zunahme der Fluoreszenzquantenausbeute verbunden, die eine lösungsbasierte Auslesen der Wirtszelle Tod liefert. Wir haben dieses kombinierten Assay verwendet ein Hochdurchsatz-Bildschirm in Mikroplattenformat durchzuführen, und die intrazelluläre Wachstum und die Zytotoxizität durch Mikroskopie zu bewerten. Bemerkenswerterweise zeigen können antimikrobielle Mittel Synergie in denen die kombinierte Wirkung von zwei oder mehreren antimikrobiellen Mitteln, wenn sie zusammen angewendet ist größer als bei getrennter Anwendung. Die Prüfung auf in vitro Synergie gegen intrazelluläre Erreger ist in der Regel eine ungeheure Aufgabe als kombinatorische Permutationen von Antibiotika in verschiedenen Konzentrationen zu beurteilen ist. Allerdings fanden wir, dass unsere Echtzeit-Test kombiniert mit automatisierten, digitalen Dosiertechnik pfacile Synergie Test ermitted. Mit diesen Ansätzen konnten wir systematisch Wirkung einer großen Anzahl von antimikrobiellen Mitteln vermessen allein und in Kombination gegen das intrazelluläre Pathogen Legionella pneumophila.
Einleitung
Pathogene, die wachsen oder sich dort aufhalten vorübergehend in intrazellulären Kompartimenten sind schwer zu therapeutisch auszurotten. Obligat oder relativ intrazelluläre Erreger obligat wie Legionella pneumophila, Coxiella burnetii, spp Brucella. , Francisella tularensis und Mycobacterium spp. erfordern oft Kurse der antimikrobiellen Therapie zur Heilung verlängert, die von Monaten sogar Jahre reichen. Darüber hinaus können extrazelluläre Erreger transient intrazellulären Nischen besetzen und auf diese Weise der Freigabe durch normalen Kurse der antimikrobiellen Therapie entkommen und später entstehen neue Runden von virulenten Infektion zu starten. Staphylococcus aureus 1 und uropathogene Enterobacteriaceae 2,3 - Infektionen sind zwei Beispiele zunehmend erkannt. Daher ist eine grundlegende Drug Discovery Ziel Roman antimikrobielle Substanzen zu identifizieren, die in intrazelluläre Kompartimente eindringen. Optimale Therapie, um schnell zu beseitigenintrazelluläre Organismen und Entwicklung von Resistenzen durch subinhibitorischen antimikrobielle Exposition verhindern, ist besonders erwünscht.
Zu diesem Zweck haben wir ein Hochdurchsatz - Screening - Technologie zu intrazellulärem-penetrierenden antimikrobielle Mittel die intrazelluläre Wachstum des Modells pathogen Targeting, Legionellen pneumophila identifizieren. 4 Bisherige klinische Beobachtungen zeigen , dass Standard antimikrobielle Empfindlichkeitsprüfung nicht genau in vivo therapeutische Wirksamkeit gegen diesen Organismus vorhersagen. Spezifisch 5 war dies wegen Hauptklassen von antimikrobiellen Mitteln wie β-Lactame und Aminoglykoside, obwohl hochwirksam gegen axenisch gewachsen Legionellen, nicht ausreichend nicht in die intrazellulären Kompartimente eindringen , wo Legionellen befindet. 5,6 Später Beweise vorgeschlagen , dass technisch komplexer intrazellulären Wachstumstests effektiv klinische Wirksamkeit vorhergesagt. 7 Leider waren diese Assays extrem mühselige Endpunkte Assays infizierten Makrophagen erfordern, mit antimikrobiellen Mitteln behandelt, zu verschiedenen Zeiten Punkte für koloniebildende Einheit Enumeration lysiert werden. Solche Tests sind unpraktisch in großem Maßstab zu tun und für Hochdurchsatz-Wirkstoffforschung ungeeignet sind.
Daher entwickelten wir Technologie für Echtzeit-Bestimmung der intrazellulären Bakterienwachstum. 6 Dies wurde durch die Verwendung eines Bakterienstammes erreicht modifiziert durch Integration von entweder einer bakteriellen Luciferase - Operon 8 (erste Generation Assay zuvor beschrieben) 4 oder fluoreszierendes Protein 9 Reporter (zweite Generation, orthogonal Assays hier beschrieben) in das Bakterienchromosom. Auf diese Weise Lumineszenz- oder Fluoreszenzsignal liefert ein Surrogat, Echtzeit-Auslesen von Bakterienzahl.
Allerdings sind diese Attribute nicht einen großen Störfaktor bei der intrazellulären infectio Adressen-Assays, Off-Target-Effekte auf Wirtszellen. Insbesondere begrenzt der Tod der Wirtszelle von Natur aus intrazellulären Wachstum und führt zu falschen positiven Identifizierung der antimikrobiellen Wirkung. Wie viele Verbindungen in Screening-Bibliotheken sind eukaryotische Zelle toxisch, so Fehlalarme wahr antimikrobielle Substanzen überwältigen würde, eine große Anzahl von Follow-up, Endpunkt Cytotoxizitätsassays für die Auflösung erforderlich macht.
So war es von großem Interesse eukaryotische Zelllebensfähigkeit zu bewerten zu können und das intrazelluläre Wachstum gleichzeitig. Bemerkenswert ist, ein Merkmal der nicht lebensfähigen eukaryontischen Zellen ist der Verlust der Zellmembranintegrität. Sonden, die die Durchlässigkeit der Zellmembran testen kann daher verwendet werden, die Lebensfähigkeit der Zellen zu untersuchen. Wir gekennzeichnet zuvor die Fähigkeit einer Reihe von putativ Zellmembran-impermeante, fluoreszierende DNA-bindende Farbstoffe zuzugreifen und Kern-DNA von abgestorbenen Zellen färben. 4 Bei der Bindung Kern - DNA, diese Farbstoffe eine starke Zunahme der Quantu anzeigenm Fluoreszenzausbeute was zu einer erhöhten Signal gegenüber dem Hintergrund Lösung Fluoreszenz. Als solche, sofern diese Farbstoffe eine quantitative Anzeige der eukaryotischen Zelltod. Bemerkenswerter 4, fanden wir , dass mehrere waren nicht toxisch selbst während längerer Koinkubation mit J774 Makrophagen. Wenn während der Erstinfektion hinzugefügt, sofern sie eine Echtzeit-Fluoreszenz-Anzeige von eukaryotischen Zelltod, die mikroskopisch durch eine Mikrotiterplatte oder Fluorimeter beobachtet gemessen werden kann.
Daher ist es durch Verwendung eines bakteriellen Reporter kombiniert und ungiftig, Membran-impermeablen, DNA-bindende Farbstoffe, waren wir in der Lage, ein einfaches, zerstörungsfrei, Echtzeit-Assay sowohl bakterielle Belastung und eukaryotischen Zell-Cytotoxizität gleichzeitig zu messen zu entwickeln. Dieser Assay hat uns in 384-Well-Plattenformat ~ 10.000 bekannt bioactives einschließlich ~ 250 antimikrobiellen Mitteln und> 240.000 kleine Moleküle mit funktionell nicht charakterisierten Aktivität auf die Fähigkeit zur Hemmung der intrazellulären Wachstum zu screenen erlaubtLegionella pneumophila, während zur gleichen Zeit für jede Verbindung eukaryotischen Zell - Cytotoxizität Daten. 6 Unsere Analyse bekannter antimikrobieller Mittel gegen intrazelluläre Wachstum von Legionellen war die umfassendste Untersuchung dieser Art bisher. 6
Basierend auf der Effizienz unseres Testformats, erforschten wir auch anschließend die potenziell synergistische Wirkungen bekannter antimikrobieller Mittel, wenn sie in Kombination verwendet werden. Eine der häufigsten Synergietests, die so genannte Schachbrett Assay wird üblicherweise durch die Beurteilung der kombinatorischen Wirkung von zweifachen Reihenverdünnungen von zwei oder mehreren antimikrobiellen Mitteln durchgeführt. 10 In diesen Assays wird Synergie durch die Beobachtung von grßeren Effekt definiert , wenn zwei oder mehr antimikrobielle Mittel zusammen als die Summe der Wirkungen von jeweils separat aufgetragen angewendet werden. Zu beachten ist , konzentrierte sich bisher nur und selektive Synergie Test wurde gegen intrazelluläre Legionella pneumophila durchgeführt wegen der großen Anstrengungen in der traditionellen Endpunkt-Assays durch die kombinatorische Permutationen erforderlich multipliziert beteiligt.
Um Synergie Prüfung zu erleichtern, haben wir den Einsatz unserer Echtzeit - intrazellulären Wachstum / eukaryotischen Zytotoxizitätstest in Kombination mit automatisierten digitalen Dosiertechnik 6. Diese Automatisierung erlaubt uns serielle Verdünnungen der Verbindungen in DMSO oder wässriger Lösung allein oder in Kombination in 384-Well-Format gelöst zu verzichten. 11 Darüber hinaus solche robuste Liquid - Handling - Technologie erlaubt uns leicht höhere Auflösung führen zu, Quadratwurzel von zwei Kindern ( und nicht als der Standard, mit geringerer Auflösung, Verdoppelung) Verdünnung Kombinationen zu einer höheren Spezifität in unserem zweidimensionalen erreichen, schachbrett Synergie Analyse. Diese Resolution war besonders wertvoll Bedenken in der Synergie Bereich über Reproduzierbarkeit Adressierung bei der Verwendung von zweifache Verdünnungsreihe 12. Schließlich war unser Test quantitative und auch therefore Abstufungen der Hemmung gemessen. Als Ergebnis erfasst der Test für die Vollständigkeit der inhibitorischen Informationen exprimierbar in Isokontur Isobologramme in dem kombinatorischen Konzentrationen mit ähnlichen Mengen an Wachstumshemmung Isokonturen verbinden. 6 Diese Plotten Strategie erlaubt die Visualisierung von kombinatorischen Dosis-Wirkungs-Kurven. Um unsere Methodik zu illustrieren, beschreiben wir unser Protokoll dieser Assays für die Durchführung und repräsentative Ergebnisse.
Protokoll
1. Echtzeit intrazelluläres Wachstum und eukaryotischen Zelle Zytotoxizitätstest
- Vorbereiten Wirtszellen (J774A.1 Zellen)
- Kultur J774A.1 Mus musculus Makrophagen-ähnlichen Zellen in Suspension in RPMI 1640 mit 9% Eisen ergänzt Kälberserum. Zunächst Passage in Zellkulturflaschen. Nachdem die Zellen konfluent in einem 75 cm 2 Gewebekulturkolben in 15 ml Medium geworden sind, geteilt durch Abkratzen und Verdünnen auf 65 ml mit dem gleichen Typ des Mediums, von denen 15 ml in die Gewebekulturkolben zurückgeführt wird , und 50 ml transferiert in einen 250 ml Bakterien Schüttelkolben.
- Für Scale-up-Kultur in Suspension in 250 ml und / oder 1000 ml bis zu einem Fünftel Volumen gefüllt Bakterienflaschen mit Gewebekulturmedium. Belüften, indem Rotationsgeschwindigkeit bei etwa 120 Umdrehungen pro Minute. Für ein stetiges Wachstum, genau 5% CO 2 und 37 ° C inkubiert.
- Ernte Zellen , wenn sie erreichen Dichte im Bereich von 2,5 x 10 6 Zellen/ ml bis 5 x 10 6 Zellen / ml. Stellen Sie sicher, tote Zelle Prozentsatz (am einfachsten durch Trypan-Blau-Färbung getestet) 25% nicht überschreiten, da tote Zellen werden Hintergrundgeräusche in Zytotoxizitätstests erhöhen.
- Platte in weiß, Gewebekultur-behandelten 384-Well - Mikrotiterplatten mit 5 × 10 4 J774A.1 - Zellen in 30 & mgr; l Gewebekulturmedium pro Vertiefung. Mikrotiterplatten über Nacht inkubieren 90% Konfluenz am Tag des Experimentes zu erreichen.
- Vorbereiten Lumineszenz- oder Fluoreszenz - Legionella pneumophila
- Passage L. pneumophila (LP02 :: flaA :: Lux 8) Bakterien auf geeigneten Medium, dh gepufferte Kohle Hefeextrakt (BCYE) Medium. Wenn ein Thymidin-auxotrophen Stamm verwenden, ergänzen Medium mit 100 ug / ml Thymidin. Bereiten Sie Patches von Bakterien, die für Experimente von Organismen dicht an einem neuen BCYE Platte und Inkubation 1 Tag verbreitet (wenn aus einer früheren Plattendurchgang) oder zwei bis drei Tage (wenn aus gefrorenem Lager) konfluent zu erhaltenWachstum.
- Bereiten BCYE Platten durch Lösen von 10 g Hefeextrakt, 10 g N - (2-Acetamido) -2-aminoethansulfonsäure, 0,35 g K 2 HPO 4 und 1 g monobasisches Kalium α-Ketoglutarat in 950 ml deionisiertem Wasser hergestellt . Passen Sie auf pH 6,9 bei Kaliumhydroxid (≥2.5 ml von 11,9 Mol-Lösung).
- In 15 g Agar und 2 g Aktivkohle; und bringen auf 1 l Endvolumen. Fügen Sie einen magnetischen Rührstab und Autoklaven. Kühles Medium auf 55 ° C und Addier-Filter-sterilisierten Lösungen, die 0,4 g L-Cystein und 0,42 g Ammoniumeisen (III) -citrat in deionisiertem Wasser gelöst. Verwenden Magnet Rührplatte zu gießen Petrischalen vor mischen.
- Für die Prüfung des Wachstums von L. pneumophila in axenic Wachstumsmedium, bereiten ACES-Hefeextraktbrühe (AYE) durch alle chemischen Reagenzien für BCYE mit Ausnahme von Kohle und Agar verwendet zu kombinieren. Filter sterilisieren und sofort verwenden oder für spätere Experimente einzufrieren.
- Resuspendieren Organismen im same Gewebekulturmedium für J774A.1-Zellen mit 100 ug / ml Thymidin Supplementierung entsprechend verwendet.
- Passage L. pneumophila (LP02 :: flaA :: Lux 8) Bakterien auf geeigneten Medium, dh gepufferte Kohle Hefeextrakt (BCYE) Medium. Wenn ein Thymidin-auxotrophen Stamm verwenden, ergänzen Medium mit 100 ug / ml Thymidin. Bereiten Sie Patches von Bakterien, die für Experimente von Organismen dicht an einem neuen BCYE Platte und Inkubation 1 Tag verbreitet (wenn aus einer früheren Plattendurchgang) oder zwei bis drei Tage (wenn aus gefrorenem Lager) konfluent zu erhaltenWachstum.
- Makrophagen-Infektion
- In Testverbindungen von Interesse (Screening-Verbindungen und positive und negative Kontrollen für die bakterielle Wachstumshemmung und eukaryotischen Zell-Lyse). Vorzugsweise Stammlösungen bei ≥500x in DMSO (Dimethylsulfoxid) oder einer wässrigen Lösung zu ermöglichen, eine ausreichende Verdünnung des Fahrzeugs zu lösen.
- Obwohl Stammlösungen können eingefroren gelagert werden, vermeiden Sie Frost-Tau-Zyklen für labile Verbindungen und antimikrobielle Mittel.
- Verdünnte Leuchtbakterien von 2,5 x 10 6 CFU (koloniebildende Einheit) / m und fluoreszierende Reporter-markierten Bakterien bis 1,0 x 10 7 CFU / ml in Gewebekulturmedium zum Ziel und geeigneten nicht-toxischen hinzuzufügen, membran impermeant, Nukleinsäure- bei 2,5x Endtestkonzentration bindenden Farbstoff.
- In 20 ul Mischung zu jeder J774A.1 Kultur gut, Endassayvolumen50 & mgr; l, letzte Bakterienkonzentration 1 × 10 6 KBE / ml (lux - Operon - Reporter) oder 4 x 10 10 6 KBE / ml (fluoreszierendes Protein Reporter).
- Bei 37 ° C inkubieren , für 1-3 Tage in 5% CO 2 bei 100% relativer Luftfeuchtigkeit Verdunstungsrandeffekte zu vermeiden.
- In Testverbindungen von Interesse (Screening-Verbindungen und positive und negative Kontrollen für die bakterielle Wachstumshemmung und eukaryotischen Zell-Lyse). Vorzugsweise Stammlösungen bei ≥500x in DMSO (Dimethylsulfoxid) oder einer wässrigen Lösung zu ermöglichen, eine ausreichende Verdünnung des Fahrzeugs zu lösen.
- Assay Ablesbarkeit
- Bakterienwachstum Lesen und eukaryotische Zelltoxizität auf einem Mikroplatten-Luminometer und Fluorimeter als geeignet für Reporter verwendet wird.
- Um die Temperatur-assoziierten Randeffekte, thermisch äquilibrieren Mikrotiterplatten vor der Lumineszenz Lesung durch Platzierung in einer einzigen Schicht auf einem Labortisch mit Deckel halb offen für ca. 20 min (oder in einem biologischen Sicherheitsschrank mit Deckel ab ca. 10 min) zu vermeiden.
- Zurück Mikrotiterplatten Inkubator, wenn Echtzeit-Anzeige zu späteren Zeitpunkten erwünscht ist.
- Bakterienwachstum Lesen und eukaryotische Zelltoxizität auf einem Mikroplatten-Luminometer und Fluorimeter als geeignet für Reporter verwendet wird.
2. Datenanalyse
- Normalisieren Daten auf positive und negative controllen Prozent zu berechnen oder Fold-Hemmung für die intrazelluläre bakterielle Wachstum und die prozentuale Zytotoxizität für eukaryotische Zellen.
- Assay Robustheit beurteilen, Berechnen statistische Trennung zwischen den positiven und negativen Kontrollen sowohl für bakterielle Wachstumshemmung und Zytotoxizität unter Verwendung Z-Faktor (Z ') -Analyse , wobei Z' = 1-3 (σ p + σ n) / | & mgr; p + & mgr; n |. In dieser Gleichung σ p und σ n sind die Standardabweichungen für die positiven und negativen Kontrollvertiefungen sind; μ p und & mgr; n sind die Mittelwerte für die positiven und negativen Kontrollvertiefungen, respectively.
- Für Hochdurchsatz-Screening-Assays, berechnen Standard Z-Scores (oder eine andere Alternative, quantitative statistische Maßnahmen) Wirkungen der Testverbindungen von Interesse zu bewerten. Alternativ berechnen eine einfache Falte-Reduktion oder Log-fache Reduktion als potenziell physiologisch relevanter Maß für die Wirkung Größe für geometrisch replizierende Bakterien.
3. Single und Multi-dimensionale (dh Synergy) Dosis-Wirkungs-Prüfung und Interpretation der Daten
- Bereiten Makrophagen und Bakterien wie in Protokollabschnitt 1 beschrieben.
- Unmittelbar vor der Infektion oder axenischen Inkubation, antimikrobielle Mittel von experimentellen Interesse in einer seriellen hinzuzufügen Verdünnungsreihe Verdoppelung mit dem Ziel , spanning am oberen Ende mit einer Konzentration , die vollständig das Wachstum beseitigt (dh die minimale Hemmkonzentration oder MHK) und auf der Nieder Ende eine Konzentration, die keine offensichtliche Aktivität zeigt.
- Verwenden eines automatisierten Liquid-Handling-System einzelne Dosis-Wirkungs-und kombinatorische Synergie-Test-Setup durch direkte, automatisierte Zugabe von antimikrobiellen Verdünnungen zu erleichtern dem Protokoll des Herstellers nach.
- Betrachten wir die Verwendung von Sub-Verdopplungsverdünnungen, beispielsweise841 / 54841eq1.jpg "/> - Verdünnungsreihe falten und Test repliziert Genauigkeit und Reproduzierbarkeit der Daten zu erhöhen.
- Für Makrophagen - Infektion, verdünnten Leuchtbakterien von 2,5 x 10 6 CFU (koloniebildende Einheit) / ml in Gewebekulturmedium zu zielen. In 20 ul Mischung zu jeder J774A.1 Kultur gut, Endassayvolumen 50 & mgr; l, endgültige Bakterienkonzentration 1 × 10 6 KBE / ml; und bei 37 ° C in 5% CO 2 bei 100% relativer Luftfeuchtigkeit inkubiert.
- Für axenic Wachstumstests, verdünnten Leuchtbakterien bis zu einer Endkonzentration von 1 x 10 & sup6 ; CFU / ml in Medium AYE, werden 50 & mgr; l in jede Vertiefung einer 384-Well - Platte und inkubiere bei 37 ° C in 5% CO 2 bei 100% relativer Luftfeuchtigkeit.
- Berechnen fraktionierte Inhibitor-Konzentration Index für antimikrobielle Kombinationen, die das Bakterienwachstum zu hemmen. Für jedes Medikament in der Kombination (a, b,.. N), die in vollständig oder> 99% Hemmung des Bakterien g ergibtrowth, die Berechnung der einzelnen fraktionierten inhibitorischen Konzentration (FIC a, b, n...) wie folgt: FIC a = die Konzentration der Verbindung "a" durch die minimale Inhibitor - Konzentration von "a" von selbst geteilt. . Unter Verwendung der gleichen Formel, berechnen FIC b, usw. Dann die kombinatorische FIC - Index berechnen oder
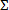 FIC = FIC a + b + FIC. . .FIC N für jede hemmende Kombination.
FIC = FIC a + b + FIC. . .FIC N für jede hemmende Kombination. - Verwenden Sie die kombinatorischen Index, der am weitesten von 1,0 abweicht Synergien zu beurteilen. Betrachten wir ein Cutoff von ≤0.5 als konservative Angabe einer synergistischen Effekt und ≥4, eine antagonistische Wirkung. 12
- Plot Isobologramme, Isokontur Isobologramme und / oder Isofläche Isobologramme 6 als alternative grafische Darstellungen von kombinatorischen Wirkungen.
Ergebnisse
Microplate intracellular growth assay
Figure 1 diagrams the assay steps. The automated steps shown can be performed manually. However, throughput is greatly facilitated using liquid handling systems.
Figure 2 shows representative results from a 384-well microplate, dual-readout, real-time intracellular growth and eukaryotic cell cytoto...
Diskussion
We describe real-time assays for simultaneous detection of intracellular bacterial growth and host cell cytotoxicity. There are several critical steps in the protocol. First, for robust assay performance, there must be sufficient spectral separation between bacterial and cytotoxicity readouts. Such separation is intrinsic for combinations of luciferase operon reporters and fluorescent DNA-binding dyes. However, based on our experience (Table 1-3, Figure 2), use of dual, fluorescent reado...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Research reported in this manuscript was supported by the National Institute of Allergy and Infectious Diseases of the National Institutes of Health under award number R01AI099122 to J.E.K. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health. We would like to thank Jennifer Smith, David Wrobel, Su Chiang, Doug Flood, Sean Johnston, Jennifer Nale, Stewart Rudnicki, Paul Yan, Richard Siu, and Rachel Warden from the ICCB-Longwood Screening Facility and/or the National Screening Laboratory for the New England Regional Centers of Excellence in Biodefense and Emerging Infectious Diseases (supported by U54AI057159) for their assistance in development and performance of high-throughput screening assays. We also would like to thank Kenneth P. Smith for helpful comments on the manuscript.
Materialien
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
Referenzen
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten