Method Article
Herstellung und Kultur von Myogenic Vorläuferzellen / Primär-Myoblasten aus Skelettmuskel von adulten und im Alter von Menschen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine robuste, reproduzierbare und einfache Methode zur Isolierung und Kultivierung von Myoblasten Vorläuferzellen aus dem Skelettmuskel von Erwachsenen und alten Menschen. Die Muskeln hier sind Fuß- und Beinmuskeln. Dieser Ansatz ermöglicht die Isolierung einer angereicherten Population von primären Myoblasten für funktionelle Studien.
Zusammenfassung
Der Skelettmuskel-Homöostase ist abhängig von Muskelwachstum (Hypertrophie), Atrophie und Regeneration. Während der Alterung und bei verschiedenen Erkrankungen, tritt Muskelschwund. Der Verlust der Muskelmasse und Funktion wird mit Muskelfasertyp Atrophie, Fasertyp Schalt, defekte Muskelregeneration mit einer Dysfunktion von Satellitenzellen, Muskel-Stammzellen und anderen pathophysiologischen Prozessen assoziiert. Diese Veränderungen werden mit den Veränderungen in der intrazellulären verbunden sowie lokale und systemische Nischen. Neben am häufigsten verwendete Nagetiermodellen von Muskel Altern, ist es notwendig Muskel Homöostase zu studieren und mit menschlichen Modellen verschwenden, was durch die ethischen Konsequenzen, überwiegend aus in vitro Kulturen bestehen. Trotz der breiten Verwendung von menschlichen Myogenic Progenitorzellen (MPL) und primären Myoblasten in myogenesis, gibt es nur wenige Daten zur humanen primären Myoblasten und Myotuben Kulturen zu untersuchen Regulierung molekularen Mechanismen verschiedene Aspekte des altersassoziierten Muscle Verschwendung, bei der Validierung von Mechanismen der Unterstützung in Nagetier Muskel vorgeschlagen Altern. Die Verwendung von menschlichen MPL, primären Myoblasten und Myotuben von Erwachsenen und alten Menschen isoliert, ein physiologisch relevanten Modell der molekularen Mechanismen von Prozessen mit Muskelwachstum verbunden sind, Atrophie und Regeneration. Hier beschreiben wir im Detail eine robuste, kostengünstige, reproduzierbare und effizientes Protokoll zur Isolierung und Wartung von menschlichen MPCs und ihre Nachkommen - Myoblasten und Myotuben aus menschlichen Muskelproben unter Verwendung von enzymatischem Verdau. Darüber hinaus haben wir die Passage Zahl , bei der primären Myoblasten von Erwachsenen und alten Menschen unterziehen Seneszenz in einem in - vitro - Kultur bestimmt. Schließlich zeigen wir die Fähigkeit , diese Myoblasten und die Fähigkeit , zu transfizieren ihre proliferative und Differenzierungsfähigkeit zu charakterisieren und ihre Eignung für die Durchführung vorzuschlagen funktionelle Studien der molekularen Mechanismen der Myogenese und Muskeln in vitro zu verschwenden.
Einleitung
Krankheits- und altersbedingte progressive Verlust der Skelettmuskelmasse und Funktionsergebnisse in Schwachheit, Rückgang der Festigkeit und eine Abnahme der Lebensqualität der Menschen im Alter. Die Skelettmuskulatur ist für etwa 40% der Körpermasse 1. Während der Alterung und Krankheit, progressiver Atrophie einzelner Muskelfasern und Reduktion der Muskelqualität aufgrund der Infiltration von Fett und Fibrose auftritt 1, 2, 3, 4, 5, 6. Vor kurzem wurde vorgeschlagen , dass speziesspezifische Unterschiede bei der Alterung von Skelettmuskel auftreten, insbesondere , dass die Muskelfaserverlust bei Nagetieren auftritt, treten möglicherweise nicht in Menschen 7. Dennoch sind die verbleibenden Muskelfasern des gealterten Säugetieren durch erhöhte Anfälligkeit für Beschädigung und die Beeinträchtigung der Regenerations gekennzeichnet 8. Erwachsene Muskel - Reparatur und Wartung von Satellitenzellen 9, 10 vermittelt. Bei Muskelverletzungen und andere relevante Signale, werden Satellitenzellen aktiviert und sich vermehren. Eine Teilmenge der Zellen wieder in den Ruhezustand und der Rest schreitet in Myoblasten (Myogenic Progenitor Cells - MPCs). Diese tragen zur Reparatur der bestehenden myofiber 11. Die Funktionalität von Satellitenzellen bestimmt den Erfolg von Muskelregeneration und die Veränderungen in der Satellitenzelle Verfügbarkeit mit dem Altern haben 12 gezeigt worden, 13, 14, 15. Außerdem Satellitenzellen aus dem Muskel von alten Menschen und Nagetieren zeigen einen Transkriptionsprofilschalter und reduziert regenerative Potential 16, 17, 18, 19. Satelliten - Zellen des Muskels von alten Mäusen und Menschen haben auch in ihrer reduzierten Funktionalität resultierenden 20 gezeigt Seneszenz zu unterziehen.
Die meisten etablierten Zelllinie die Untersuchung von Muskel - Homöostase ermöglicht ist murine C2C12 - Zelllinie 21. Eine erhebliche Menge an Studien haben auch murinen primären Myoblasten 22 verwendet. Diese Kulturen haben zu einem signifikanten Verständnis von Maus und wirbel myogenesis sowie Muskelregeneration, Myotube / myofiber Atrophie und Hypertrophie Prozesse während der Muskelerkrankung auftreten und Alterung 23, 24, 25, 26. In jüngster Zeit haben mehrere Gruppen unter Verwendung von humanen primären Myoblasten beschrieben Alterung Myogenese und Muskel zu untersuchen. Allerdings gibt es keinen Konsens mit regards auf Unterschiede zwischen primären aus dem Muskel von Erwachsenen isoliert Myoblasten und gealterten Menschen 27, 28, 29, 30, 31. Trotz der Unterschiede in der systemischen und lokalen gekennzeichnet Umwelt während der Entwicklung auftreten, Altern und Krankheit 6, 32, 33, 34, In - vitro - Myoblasten und Myotubenkulturen bleiben die am besten zugänglichen Tools für die molekularen Mechanismen im Zusammenhang mit Muskelentwicklung, Wachstum und Atrophie studieren. Darüber hinaus bieten diese Studien nicht nur robust, sondern auch eine relativ schnelle, kostengünstige und mit hohem Durchsatz in vitro - Werkzeug. Darüber hinaus mit dem Studium der menschlichen Muskeln verbunden sind ethische Implikationen bedeuten, dass für die funktionelle Experimente Manipulationen der Genexpression beteiligt , In vitro menschliche Myoblasten und Myotubenkulturen bleiben die einzige Alternative zu wirbelModellOrganismen zur Verfügung.
Hier zeigen wir ein einfaches experimentelles Protokoll für eine robuste, kostengünstige und reproduzierbare Isolierung von primären Myoblasten oder MPCs, aus dem Muskel von Erwachsenen und alten Menschen und beschreiben standardisierten Bedingungen von in - vitro - Kultur (Abbildung 1). Als Primärkulturen von Muskel in der Regel Fibroblasten neben Myoblasten enthalten, empfehlen wir eine Vorabscheidungsschritt bei verbesserter Reinheit und Qualität der primären Myoblasten Ziel. Zusammenfassend haben wir ein Protokoll ermöglicht effiziente und reproduzierbare Isolierung, Kultur und funktionelle Studien von angereichertem und funktionellen MPL / primären Myoblasten aus Skelettmuskel von Erwachsenen und alten Menschen etabliert.
Protokoll
Alle Experimente beschrieben menschliches Gewebe beteiligt hier wurde im Vorfeld von der University of Liverpool, University Hospital Aintree Krankenhaus und South West Wales Forschungsethikkommission (Zulassungsnummer: 13 / WA / 0374) genehmigt und die Experimente wurden nach guter Praxis Führung durchgeführt. Die Universität Liverpool agierte als die Ethik für diese Studie sponsern. Alle Geber haben Einverständnis für die Einschreibung dieser Studie gegeben. Die Muskeln wurden aus Menschen isoliert (BMI <25): Erwachsener: 30 ± 2,8 Jahre alt und im Alter von: 69 ± 5 Jahre alt.
1. Vorbereitung für die Kultur
- Beschichtung von Kulturflächen mit Laminin
- Bereiten einer Arbeitslösung von 10 ug / ml Laminin in 1x DPBS (Dulbecco Phosphat-gepufferte Saline).
- Pipette eine minimale Menge an Laminin Lösung die Oberfläche vollständig abdecken , auf die Zellen werden zu plattierenden (Tabelle 1). inkubieren ter Kulturschale mindestens 30 min in einer befeuchteten 37 ° C, 5% CO 2 -Inkubator vor dem Ausplattieren der Zellen. Griff Laminin sorgfältig die Verwendung von Wirbel vermeiden. Die Arbeitslösung von 10 & mgr; g / mL Laminin in DPBS verdünnt kann bei 4 ° C und wiederverwendet mehrmals gespeichert werden.
- Verwenden Sie eine 60 mm (20 cm 2) Petrischale oder 2 Vertiefungen in einer 6-Well - Platte (2 x 10 cm 2) pro ~ 18 - 19 mg der Skelettmuskulatur auf die Platte , die Zellen (5,50 x 10 4 Zellen insgesamt). Durchführen zu allen Zeiten Zellzählung, wenn die Zellen für funktionelle Studien Plattieren.
HINWEIS: Die Proben wurden ursprünglich von Fuß-Operationen (extensor digitorum brevis, tibialis anterior oder Entführers Zehen Muskeln) der weiblichen Patienten (Erwachsene: 30 ± 2,8 Jahre alt, im Alter von: 69 ± 5 Jahre alt, BMI <25) erhalten.
- Herstellung von Enzymlösung
- Bereiten 250 mM CaCl 2 Arbeitslösung: 277 mg Lager CaCl 2 in 10 ml 1x DPBS. Filtern Sie die solution mit einer 0,2 & mgr; m Filtermembran und lagern bei 4 ° C.
- Bereiten einer Arbeitslösung von 1,5 U / ml Kollagenase D, 2,4 U / ml Dispase II und 2,5 mM CaCl 2 in serumfreiem DMEM (Dulbecco-modifiziertes Eagle-Medium) (Tabelle 2).
- Gut mischen und filtern die enzymatische Lösung durch einen 0,2 & mgr; m Filtermembran für die Sterilisation. Bereiten Sie die enzymatische Lösung im Voraus und froren (-20 ° C) in Teilmengen für die zukünftige Verwendung.
2. Die Gewebe Verdauung: Mechanische und enzymatische Dissoziation
- Im Anschluss an die Probenentnahme halten Muskel bei 4 ° C in DPBS, bis die Verdauung. Bereiten Sie ein Mindestvolumen von 2 ml Kollagenase-Dispase-CaCl 2 -Lösung pro 18 - 19 mg des Muskelgewebes und warm es auf 37 ° C vor Gewebedissoziation.
- Tauchen Sie die Muskelbiopsie kurz in 70% Ethanol, waschen mit frischem DPBS und legen Sie das Gewebe auf eine neue Petrischale mit 1 ml EnzymLösung.
- Entsorgen Sie so viel fibrotische und Fettgewebe wie möglich und reißen schnell den Muskel , aber vorsichtig in kleinen , aber unterscheidbare Stücke (etwa> 0,5 mm 2) mit einer sterilen Schere oder einem chirurgischen Skalpell (Klinge No. 10).
- Übertragung der Probe in ein 50 ml - Röhrchen mit den restlichen 1 ml der Kollagenase-Dispase-CaCl 2.
- Inkubieren des Gewebes bei 37 ° C bis zu 30 - 40 min. Bewegen Sie das Muskelgewebe durch sanft das Rohr Rühren alle 5 - 10 min.
- Coat die Pipetten mit Medien, um die Haftung der freigesetzten Zellen an den Kunststoffwänden der Pipetten zu vermeiden. Hinzufügen 2 Volumina sterilem Wachstumsmedium, beispielsweise 4 ml DMEM 20% FBS (Fetal Bovine Serum), 1% L-Glutamin und 1% P / S (Penicillin-Streptomycin), um die Verdauung zu stoppen.
- Pipettieren nach oben und unten mehrmals mit einer 5-ml-Pipette die Freisetzung der Zellen aus den Muskelfasern zu helfen.
HINWEIS: Die Probe wird in der Regel vollständig dissoziiert aufgrund seiner geringen Größe. However, wenn Fragmente von Muskel bleiben noch eine zweite Inkubation mit den verbleibenden Muskelstücke verwenden und mit frischer Enzymlösung. - Filtern Sie die Muskel-Lösung durch ein 70 & mgr; m Zelle Sieb über einen 50 ml konischen Röhrchen. Waschen Sie die restlichen Zellen mit mehr Medien und Filter durch das Sieb.
- Zentrifuge bei 443 × g für 5 min bei RT um die Zellen zu pelletieren. Entsorgen Sie vorsichtig den Überstand.
- Auflösen des Pellets in F-12 Medium (Ham F-12 Nutrient Mix), 20% FBS, 10% HS (Pferdeserum), 1% P / S, 1% α-Glutamin und 2,5 ng / ml FGF-b ( rekombinantem humanem basischem Fibroblastenwachstumsfaktor). Hier verwenden 4 ml Medium pro 60 mm Petrischale.
3. Seeding von Zellen
- Sammeln Sie die Kulturgefäß vorher mit 10 ug / ml Laminin aus dem Inkubator beschichtet (Abschnitt 1.1).
- Entfernen Sie vorsichtig den Überschuss von Laminin aus der Kulturschale und berühren nicht die Oberfläche (oder es wird die Proteinstruktur stören). Waschendie Kulturschale mit DPBS (optional).
- Platte , die Zellen direkt auf dem Laminin beschichteten Behälter und Inkubation für 24 Stunden in einem befeuchteten 37 ° C, 5% CO 2 Inkubator.
- Visualisieren Sie die Zellen unter dem Hellfeld-Mikroskop (100X Gesamtvergrößerung) am folgenden Tag. Rund kleinen Zellen an die Oberfläche gebunden und die verbleibenden Bruchstücke können in dem Kulturmedium zu sehen.
- Ändern, um die Medien zu frischen F-12 Medium mit 20% FBS ergänzt, 10% HS, 1% P / S, 1% α-Glutamin und 2,5 ng / ml FGF-b.
4. Kultur und Passagierung der Zellen
- Ändern Sie die Medien jeden 2 - 3 d und teilen Sie die Zellen, sobald Gruppen von Zellen unter dem Mikroskop sichtbar sind (100X Gesamtvergrößerung, beispielsweise in 2 - Zellen von alten Menschen, Passage 0 nach 7 d) , um spontan zu vermeiden Differenzierung.
- Bei der ersten Passage (P1), ändern die Medien mit hohem Glucose DMEM mit 20% FBS ergänzt, 10% HS, 1%P / S, 1% α-Glutamin. Vermeiden Sie FGF-b von diesem Punkt mit, wie FGF ein potentes Mitogen und wichtiger Faktor zu Beginn der Kultur ist, aber es kann Fibroblasten-Überwucherung zu fördern, wenn mehr in Kultur verwendet.
- Für Zell Passagierbarkeit:
- Entfernen Sie die Medien und waschen Sie die Zellen zweimal mit DPBS.
- Fügen eine Mindestmenge an 0,25% EDTA-Trypsin die Oberfläche der Zellen zu bedecken. Schaukeln sanft, um sicherzustellen, alle Zellen durch die Entfernungslösung abgedeckt werden, Inkubation für 10 Sekunden bei Raumtemperatur, und entfernen Sie es.
- Inkubieren der Zellen in einem befeuchteten 37 ° C, 5% CO 2 -Inkubator für 3 bis 5 min. Tippen Sie sanft und überprüfen unter dem hellen Lichtmikroskop (100X Gesamtvergrößerung), dass die Zellen abgerundet sind aber nicht vollständig von der Oberfläche gelöst. Wenn keine Änderung in den Zellen beobachtet wird, für weitere 5 min inkubiert.
- 5 ml Wachstumsmedium (High-Glucose-DMEM mit 20% FBS ergänzt, 10% HS, 1% P / S, 1% α-Glutamin), um die Zellen zu sammeln, mischengut und übertragen Sie die Zellen mit den neuen Medien in eine T75-Flasche. Waschen der verbleibenden Zellen diesen Schritt mit weiteren 5 ml Wachstumsmedium (10 ml insgesamt für einen T75-Kolben) zu wiederholen.
- Zu Vorbeschichtungszyklus (bevorzugt am ersten Durchgang), inkubiere die Zellen in einer befeuchteten 37 ° C, 5% CO 2 Inkubator für 40 min. Sammeln Sie den Überstand mit den Zellen, die nicht befestigen und brüten sie in einem neuen T75-Flasche. Dies sollte die Kultur in Myoblasten bereichern, da die meisten der Fibroblasten sollte in dem ersten Kolben angebracht sind.
- Ändern Sie die Medien jeden 2 - 3 d und spaltete sich die Zellen 1 bis 4, sobald sie 70% Konfluenz für eine maximale Ausbeute erreicht.
- Zur Unterscheidung erreicht, sobald die Zellen 70-80% Konfluenz, ändern Sie das Kulturmedium zu Differenzierungsmedium (DM): High-Glucose-DMEM mit 2% HS ergänzt, 1% P / S, 1% α-Glutamin. 7 d abhängig von der Qualität und Reinheit der Myoblasten c - Die Zellen sollten innerhalb von 5 unterscheidenulture.
5. Transfektionen Protokoll
- Seed 50.000 Zellen / Well in einer 12-Well-Platte für MF 20, Seneszenz und Lebensfähigkeitstests. Kultur-Zellen auf Deckgläser oder in einer Schale mit Laminin beschichtet. Für Ki67-Färbung, Samen 25.000 Zellen / Well in einer 12-Well-Platte.
- Für Transfektionen folgen Sie den Anweisungen des Herstellers unter Verwendung von 5 ul Transfektionsreagenz, 100 nM von Steuer microRNA nachahmen oder Inhibitor, 100 nM von microRNA Mimik oder 100 nM von microRNA-Inhibitor pro Vertiefung, mit einem Gesamtvolumen von 1 ml.
- Wechsel zur Differenzierung Medium 6 h nach der Transfektion (high-glucose DMEM ergänzt mit 2% HS, 1% P / S, 1% α-Glutamin). Für Proliferationsexperimente, färben die Zellen 2 d nach der Transfektion; für Seneszenz, 7 d nach der Transfektion; und für MF20-Färbung, sieben Tage nach der Transfektion.
6. Immunostaining der Zellen
- Ki67, MyoD und MF 20 Immunfärbung
- Bereiten Sie Block 1 (10% HS und 0,1% Triton-X in PBS) und Block 2 (10% HS und 0,05% Triton-X in PBS) -Lösungen. Verwenden Sie 500 ul Reagenz pro Vertiefung für eine 12-Well-Platte.
HINWEIS: Führen Sie die folgenden Schritte, um einen Schüttler für die Inkubation Schritten. - Entfernen Sie die Medien aus den Zellen.
- Spülen Sie die Zellen mit PBS.
- Fixieren Sie die Zellen mit kaltem Methanol für 10 min auf einer Wippe.
- Entfernen des Methanols aus den Zellen und Spülen mit PBS 3x für jeweils 5 min.
- In Block 1-Lösung und Inkubation die Zellen auf einer Wippe bei RT für 1 h.
- In primären Antikörperlösung: für Ki67-Färbung, verwenden Sie Kaninchen-mAb an Ki67 (1: 1000 Verdünnung in Block 2); für MyoD, MyoD1 (D8G3) XP Kaninchen mAb (1: 100 Verdünnung in Block 2) verwenden; für MF 20 Färbung Verwendung MYH1E (MF 20) primärer Antikörper (DSHB, 1: 1000 Verdünnung in Block 2).
- Inkubieren der Zellen mit dem Primärantikörper für 1 h (RT) zu O / N (4 ° C) auf einer Wippe.
- Sammeln Sie die primäre AB (es mehrmals wiederverwendet werden können, wenn storot bei 4 ° C).
- Spülen Sie die Zellen 3x mit PBS, jeweils 5 min.
- Fügen Sie den entsprechenden sekundären Antikörper: für Ki67 oder MyoD Färbung, Ziegen-Anti-Kaninchen-IgG (H + L) sekundärer Antikörper, Alexa Fluor 488-Konjugat (1: 1000 Verdünnung in PBS); für MF 20 Anfärbung, Ziege-anti-Maus IgG (H + L) sekundären Antikörper, Alexa Fluor 488-Konjugat (1: 1.000 Verdünnung in PBS).
- Wickeln Sie die Platte mit den Zellen und Inkubation sekundärer Antikörper für 2 Stunden im Dunkeln auf einer Wippe bei RT.
- Spülen Sie die Zellen für jeweils 5 min mit PBS 3x.
- Hinzufügen DAPI-Lösung (1: 1000 Verdünnung in PBS) auf die Zellen und inkubiere an der Wippe bei RT während 5 - 10 min.
- Spülen Sie die Zellen für jeweils 5 min mit PBS 3x.
- 1 ml frischem PBS.
- Montieren Sie die Zellen auf den Deckgläsern in Montagelösung oder versiegeln Sie die Platte, die die Zellen in PBS mit Parafilm enthält, um Verdunstung zu vermeiden.
- Lagerung bei 4 ° C.
- Visualisieren Sie die Zellen mitdas Fluoreszenzmikroskop so schnell wie möglich (spätestens 2 Wochen).
- Bereiten Sie Block 1 (10% HS und 0,1% Triton-X in PBS) und Block 2 (10% HS und 0,05% Triton-X in PBS) -Lösungen. Verwenden Sie 500 ul Reagenz pro Vertiefung für eine 12-Well-Platte.
- Viability Assay
- Entfernen Sie die Medien aus den Zellen.
- Spülen Sie die Zellen in PBS.
- 1: 1000 Ethidiumbromid und 1: 1000 Acridinorange in PBS verdünnt.
Vorsicht: Achten Sie darauf und arbeiten in Gesundheits- und Sicherheitsbestimmungen - Ethidiumbromid ist krebserregend. - Wickeln Sie die Platte, die die Zellen in Färbelösung enthält, und Inkubation bei RT auf der Wippe 5 min.
- Nehmen Sie Bilder der Zellen mit dem Fluoreszenzmikroskop: grünen Kanal für Acridinorange; Rot-Kanal für Ethidiumbromid.
Ergebnisse
MPL / primären Myoblasten sollte sichtbar 24 Stunden nach der Aussaat auf die Laminin beschichteten Oberfläche (Abbildung 2) sein. Die Zellen sollten eine spindelartige Form annehmen und sollte MyoD noch in Durchgang 4 (1A, B) exprimieren. Fibroblasten können durch ihre sternförmige Morphologie und fehlende Expression von MyoD (1B, C) zu unterscheiden. Sobald die Zellen am folgenden Tag angebracht werden, sollten Medien mit frischen bFGF Medien ersetzt werden. Die Kulturmedien sollte alle 48 Stunden ersetzt werden.
Die repräsentativen Ergebnisse hier gezeigten und veröffentlichten Daten aus unserem Labor 22 Ziel unserer Isolation und Kultur - Protokoll zu unterstützen und die verschiedenen Techniken zeigen , die für funktionelle Studien von menschlichen primären Myoblasten verwendet werden kann. Myoblasten Proliferation können mit Ki67-Immunfärbung und Lebensfähigkeit untersucht unter Verwendung von staining für die Zelllebensfähigkeitstest (Abbildung 3). Zur Unterscheidung soll die Kulturmedien zu Differenzierungsmedien verändert werden. Myotuben sollte in 5 bilden - 7 d und schwere Kette positiv sein Myosin (Abbildung 3). Beachten Sie, dass die Myotube Bildung möglicherweise weniger effizient , wenn Myoblasten aus dem Muskel von alten Menschen (Abbildung 3) isoliert sind. Seneszenz (SA-β-Galactosidase) Anfärbung kann auch ausgeführt werden , um den Prozentsatz von alternden Zellen in der Kultur (Figur 3) zu schaffen. Wir beobachteten , dass mit längeren Kulturen (Abbildung 3, Kanal 4), mehr Myoblasten aus dem Muskel von alten Menschen zeigen Seneszenz isoliert.
Für funktionelle Untersuchungen Gen und mikroRNA - Expression kann unter Verwendung von lipophilen Transfektionsreagenzien-vermittelte Abgabe von Expressionsvektoren, siRNAs, MikroRNA nachahmt und antimiRs (Abbildung 4) manipuliert werden. Dies ermöglicht eine 40 -70% Transfektionseffizienz mit Gen / microRNA Ebenen sind nach oben oder nach unten reguliert innerhalb eines physiologischen Bereich (4; 22).
| Kulturgefäss | Ca. Area (pro Vertiefung) | Volumen von 10 & mgr; g / mL Laminin |
| 35-mm-Schale | 10 cm 2 | 1 ml |
| 60-mm-Schale | 20 cm 2 | 2 mL |
| 100-mm-Schale | 60 cm 2 | 4 ml |
| 24-Well-Platte | 2 cm 2 | 200 & mgr; l / Vertiefung |
| 12-Well-Platte | 4 cm 2 | 500 & mgr; l / Vertiefung |
| 6-Well-Platte | 10 cm 2 | 1 ml / Well |
| T25 | 25 cm 2 | 3 mL |
| T75 | 75 cm 2 | 5 ml |
Tabelle 1. Empfohlene Mindestmengen von Laminin-DPBS - Lösung (10 ug / ml) zur Beschichtung von Kulturfläche.
| Die spezifische Aktivität / Molare Masse | Endkonzentration | Masse oder Volumen für 10 ml Lösung benötigt | |
| Kollagenase D | 0,15 U / mg | 10 mg / ml (1,5 U / mL) | 100 mg |
| Dispase II | 0,5 U / mg | 4,8 mg / ml (2,4 U / mL) | 48 mg |
| 250 mM CaCl 2 | 110.98 G / mol | 2,5 mM | 100 ul |
Tabelle 2. Enzympräparat zum Muskel Verdauung.
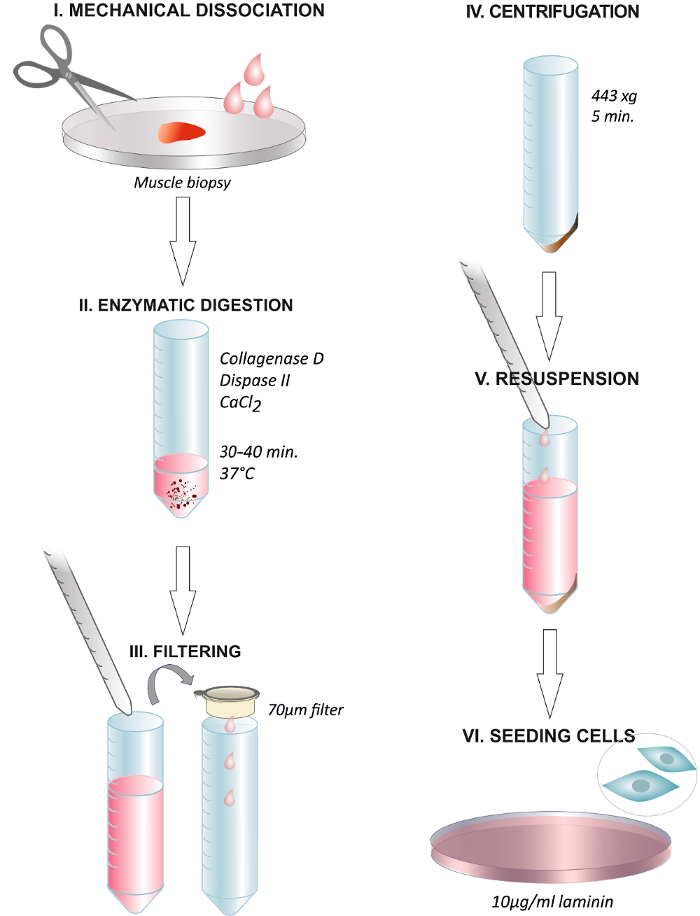
Abbildung 1. Grafische Zusammenfassung der Schritte des Protokolls zusammenfassend. Dissoziation des menschlichen Muskelbiopsie mit einer Schere oder mit einem chirurgischen Skalpell (I). Inkubation mit der Enzymlösung bei 37 ° C für 30 - 40 min (II). Ende der Verdau durch Zugabe von Wachstumsmedien und Filtern der Lösung durch einen 70 um - Membranfilter in ein Zentrifugenröhrchen (III). Zentrifugation bei 443 × g für 5 min (IV). Verwerfen des Überstandes und Resuspension in Wachstumsmedium , das 2,5 ng / mL FGF (V). Ausplattieren der Zellen auf einem Teller beschichtet mit 1081; g / mL Laminin und Ändern der Medien nach 24 h (VI). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
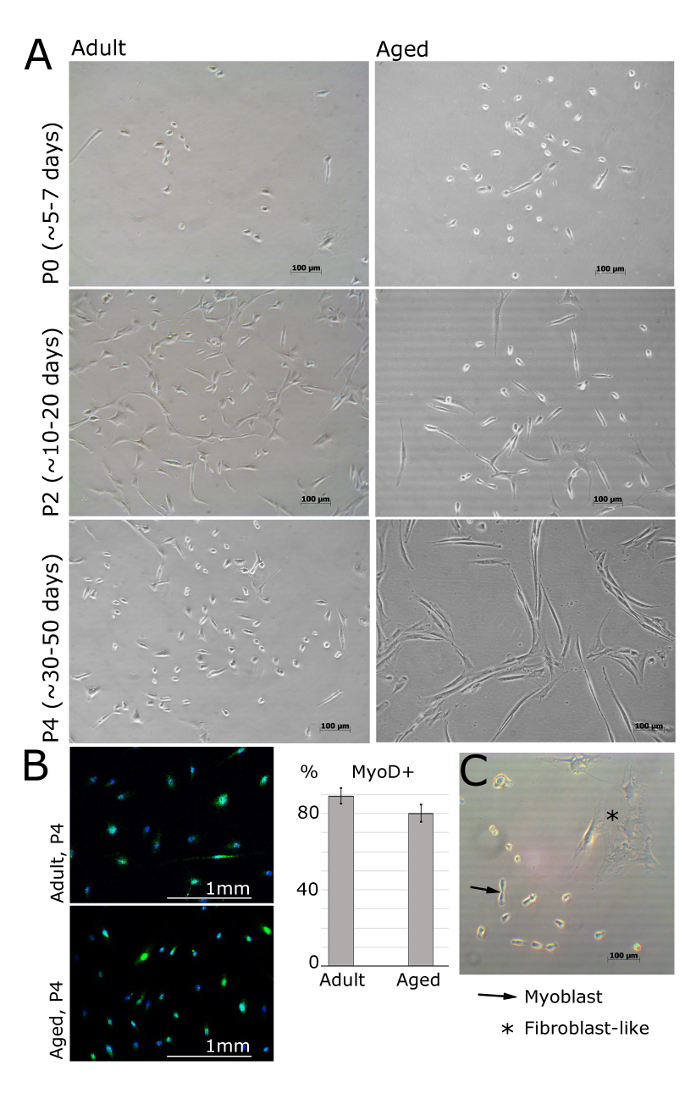
Abbildung 2. Myoblasten Isoliert von Muscle of Adult und im Alter von Menschen bei verschiedenen Passagen. A. Bilder darstellen isoliert Myoblasten aus extensor digitorum brevis, tibialis anterior oder Entführers Zehen Muskeln der weiblichen Patienten (Erwachsene: 30 ± 2,8 Jahre alt, im Alter von: 69 ± 5 Jahre alt, BMI <25). Bei Passage 0 und nach 5 Tagen plattiert wird, werden die Zellen noch rund und klein, aber sichtbar unter dem hellen Lichtmikroskop (A). Myoblasten wird dann eine längliche Form annehmen, wie bei Passage 2 (A) gezeigt. MyoD ist in Myoblasten, aber nicht in Fibroblasten exprimiert (B). Die Quantifizierung von MyoD-positiven Zellen gezeigt wird; Fehlerbalken zeigen die Standardabweichung; n = 3 (B). Repräsentative Bild , um die Unterschiede zwischen der Myoblasten und Fibroblasten - Morphologie zeigen (C). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
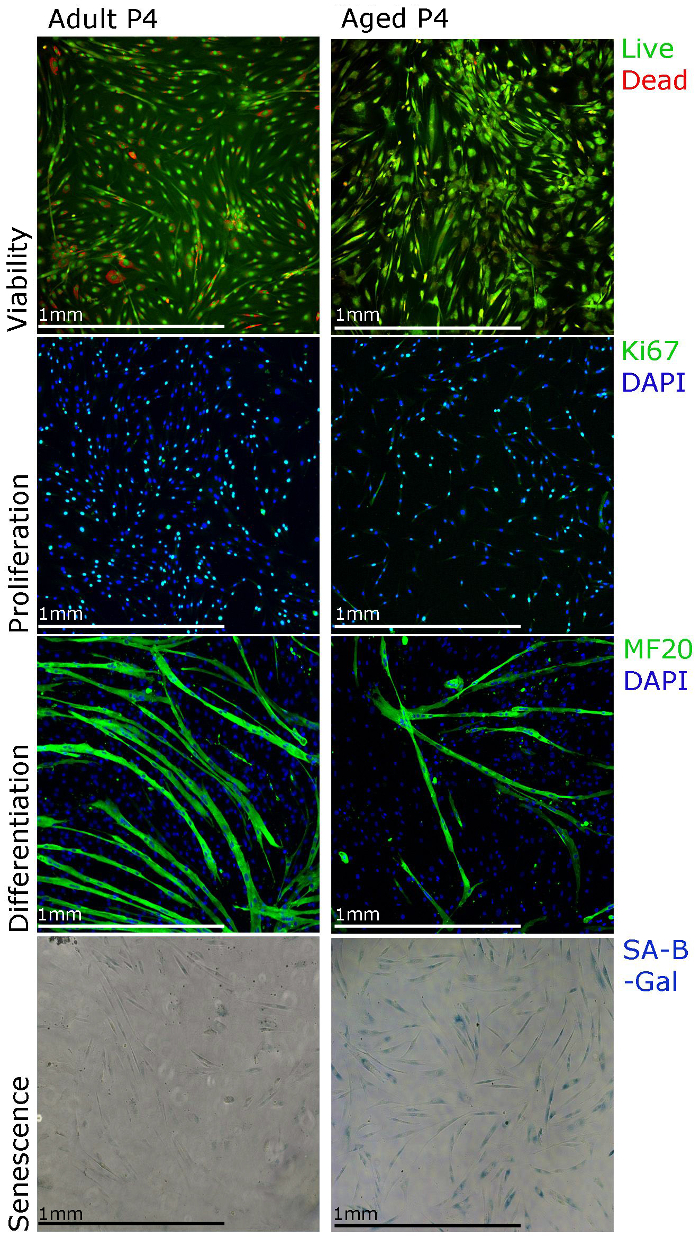
Abbildung 3. humanen primären Myoblasten kann verschiedene Färbungstechniken charakterisierenden. Lebensfähigkeit der Zellen kann unter Verwendung Anfärbung für die Zelllebensfähigkeitstests sichtbar gemacht werden, können die Proliferation unter Verwendung von Ki67-Immunfärbung beurteilt werden, Differenzierung beurteilt werden kann, kann MF20 (Myosin schwere Kette) Immunfärbung und Seneszenz Verwendung visualisiert werden Seneszenz assoziiert beta Galaktosidase (SA-β-Galactosidase unter Verwendung von ) Färbung. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
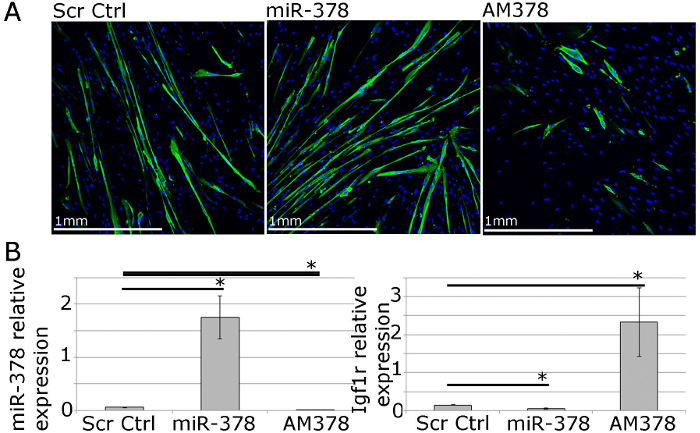
Abbildung 4. menschliche primäre Myoblasten kann für funktionelle Studien von Muskel - Homöostase in vitro verwendet werden. A. MF20 (Myosin schwere Kette) Immunfärbung von differenzierten primären Myotuben von erwachsenen Menschen die Auswirkungen der Überexpression oder Hemmung der miR-378 auf Myotube Größe und Anzahl zeigt. B. qPCR zeigt relative Expression von miR-378 und IGF1 R, validiert miR-378 Zielgen nach miR-378 - Überexpression oder Hemmung in primären menschlichen Myoblasten. Expression relativ zu Rnu-6 und β-2-Mikroglobulin, jeweils, dargestellt. Die Fehlerbalken zeigen SEM; n = 3, * - p <0,05, Student T-Test.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Hier präsentieren wir eine einfache, robuste, preiswerte, reproduzierbare und effiziente Methode der Muskelvorläuferzellen / primären Myoblasten von Erwachsenen und im Alter von Menschen aus Streck digitorium brevis zu isolieren, tibialis anterior oder Entführers Zehen Muskeln. Dieses Protokoll zielt darauf ab, Studien mit humanen primären Myoblasten von Erwachsenen und im Alter von Menschen zu ermöglichen, vor allem, wenn anspruchsvollere Methoden, wie FACS- oder MACS-Sortierung, sind nicht möglich oder nicht praktikabel.
Die Isolationsmethode in diesem Manuskript präsentiert dauert ca. 2 Stunden. Während der Muskel Isolierung wurde Muskel in 70% Ethanol gewaschen, um Verunreinigungen zu vermeiden. Stand der Dissoziation des Muskels zu enzymatisch, ist es wichtig, den Muskel in kleine aber sichtbare Stücke zu schneiden, und Zellschäden durch zu viel mincing vermeiden. Die Verdauung führt zur Dissoziation von Muskelfasern und die Freisetzung von Satellitenzellen und myogenen Vorläuferzellen. In unserem Fall für ~ 20 mg der Skelettmuskulatur, ein 60 mm(20 cm 2) Petrischale war die am besten geeignete Oberfläche der Zellen für die Ernte. Die Zellen auf eine größere Oberfläche plattiert zeigte reduzierte Proliferation, während Zellen ausplattiert zeigte eine kleinere Oberfläche Zelltod und Verklumpung erhöht.
Nach der Isolierung wurden die Zellen kultiviert und erweitert auf Laminin-bedeckten Platten. Die Verwendung von nicht-beschichteten Oberflächen eher den Erfolg der Isolierung zu verringern. Aus diesem Grund können die Zellen vorzugsweise auf einer vorbeschichteten Oberfläche nach Isolierung direkt geerntet werden. Fibroblasten angereicherten Kulturen vorherrschen anstatt Myoblasten-abgeleitete Zellen, wenn die Zellen auf einer unbeschichteten Oberfläche direkt nach der Isolierung geerntet. Abgesehen von Laminin, die Verwendung anderer Zellanheftung Lösungen wie Matrigel und Kollagenbasis Reagenzien können verwendet werden. Beschichtungslösungen können Wachstumsfaktoren und andere Verbindungen umfassen, die das Zellwachstum fördert, aber diese könnte das Zellverhalten verändern und somit die Versuchsergebnisse. Imunsere Erfahrung, 10 & mgr; g / mL Laminin ist die optimale Konzentration und geeignete Beschichtungs Reagenz für Satellitenzellen und Myoblasten-Anhaftung und Proliferation, da es kein Wachstumsfaktor oder andere Komplemente fehlt. Außerdem ist Laminin von Natur aus in der Basallamina, direkt mit dem sarcolemma verbunden, die eine Schlüsselfunktion in der Satelliten Zellanheftung und die Migration durch die Skelettmuskelfaser spielt.
Die Ergänzungen der Kulturmedien kann auch einen nachteiligen Einfluss auf das Verhalten des primären Myoblasten. Beispielsweise Wachstumsfaktor - Gruppen, wie FGFs oder IGFs weisen pleiotrope Wirkungen auf primäre Myoblastenkulturen mit FGF-2 Steuern sowohl mitogene und den programmierten Zelltod Antwort 31. Es ist daher notwendig, konsequent die Kulturbedingungen kontrollieren, vor allem, weil die Unterschiede im Verhalten von primären aus dem Muskel von Erwachsenen und alten Menschen isoliert Myoblasten sind sehr wahrscheinlich auf die Reinheit zu sein of die Kulturen und die Wahrscheinlichkeit von Fibroblasten 35 , die Myoblasten in Kultur während Langzeitkulturen Überholkupplung. Wir haben 1-Stunden-Vorgalvanisierung der Zellen während der ersten Spaltung auf eine nicht-beschichtete Oberfläche verwendet, um die Kontamination der Kulturen mit Fibroblasten zu verringern.
Die Methode, die wir beschreiben, ist für von den Muskeln von beiden Erwachsenen und im Alter von Menschen myogenen Vorläuferzellen zu isolieren. Die isolierte Zelle besteht aus einer repräsentativen myogene Zellpopulation , wie durch einen hohen Anteil an myogenen Zellen (MyoD Expression und myogenen Eigenschaften von MF20 Immunofärbung in den 1 und 2 sichtbar) angezeigt und kann als ein in vitro Modell für funktionelle Studien von Prozessen verwendet werden , mit Muskel Homöostase assoziiert.
Frühere Studien haben die Isolierung und Unterschiede in den Eigenschaften aus, oder das Fehlen davon, aus primären menschlichen Myoblasten ausErwachsene und alte Menschen 6, 20, 27, 28, 29, 30, 31, 35, 3 6, 37, 38. Die Existenz von geriatrischen und / oder nicht-funktionellen humanen MPCs wurde 6 demonstriert, 20, 22. Es wurde jedoch kein Unterschied im Verhalten von frisch isolierten menschlichen MPCs auch 27 gezeigt. Unser Protokoll ermöglicht die Isolierung von primären Myoblasten, die zumindest teilweise ihren Phänotyp, wie reduzierte Proliferationspotential oder Seneszenz der primären Myoblasten aus dem Muskel von alten Menschen und ermöglicht die Verwendung von diesen getrennt zu haltenZellen für funktionelle Studien der molekularen Mechanismen der Muskel Homöostase während 22 altert.
Die primären Myoblasten hier kann mit dem beschriebenen Verfahren isoliert verwendet werden, nicht nur für myogenic Studien Differenzierung, sondern auch intrazelluläre Veränderungen, wie Veränderungen in der Genexpression zu untersuchen, während der Alterung in der menschlichen myogenic Vorläuferzellen auftreten. Jedoch Änderungen , die in Zellen während längerer ex vivo Kultur auftreten müssen berücksichtigt werden , wenn phänotypische und genotypische Veränderungen analysiert während der Alterung auftreten. Wir empfehlen frisch isolierten Zellen für diesen Zweck verwendet wird.
Ferner beschrieben die primäre Myoblasten Kulturverfahren hier ermöglicht Expansion und relativ langfristige Kultur von primären menschlichen Myoblasten, so dass für robust in vitro funktionelle Studien. Wir haben bereits gezeigt, dass myogene Vorläuferzellen unserer Methode isoliert unter Verwendung kann sowohl von Expressionsprofilen und fu verwendet werdennctional Studien von Prozessen im Zusammenhang mit Muskel 22 Alterung. Dieses Verfahren ist auch anwendbar auf die Muskeln von erwachsenen und alten Nagetieren und ermöglicht die Isolierung von einer angereicherten Kultur von Myoblasten , das 22 zum Profilieren genetischen und epigenetischen Veränderungen während des Alterns und funktionelle Studien verwendet werden können. Die Beschränkungen dieses Verfahrens umfassen die Verwendung von bis zu einem gewissen Grad, gemischten Population von Zellen statt einer reinen Population von Satellitenzellen, die 6 unter Verwendung von anspruchsvolleren publizierten Methoden erhalten werden können, 28, 29, 39, 40, 41, 42, 43.
Wir präsentieren eine vereinfachte, kostengünstige und reproduzierbare Protokoll für die Isolierung von primären Myoblasten Zellen von Erwachsenen und im Alter vonMenschen. Nach unserer Erfahrung die zur Verfügung stehenden, anspruchsvollere Verfahren zur Isolierung und Kultur von humanen primären Myoblasten (wie MACS- oder FACS-sortierten Satellitenzellen) sind ideal für einige Arten von Studien, wie Profilierungs transkriptomischen oder Proteom-Veränderungen in den Zellen. Allerdings sind diese Methoden teuer, erfordern zumindest ein gewisses Maß an Know-how und kann schwierig sein, aufgrund der geringen proliferativen Rate von reinen primären Myoblastenkulturen und Fibroblasten zuwachs Myoblasten.
Wir präsentieren ein reproduzierbares Protokoll, das die einfache Isolierung und Kultur von humanen primären Myoblasten für die Verwendung in funktionellen Studien ermöglicht. Darüber hinaus schlagen wir die Verwendung von Laminin 42 und die begrenzte Nutzung von bFGF als Schlüsselfaktoren für eine erfolgreiche Kultur 44. Wir schlagen vor , auch die durch Zentrifugieren erzeugte Spannung zu vermeiden , wenn die Zellen aufgeteilt und ein Pre-Beschichtungsschritt bei der ersten Passage 45. Um es zusammenzufassen, wir habenein effizientes Protokoll zur Isolierung und Kultivierung von primären Myoblasten / MPL aus den Muskeln von Erwachsenen und im Alter von Menschen optimiert, der auch für die Muskeln von Nagetieren ist und ermöglicht die Expression und funktionelle Untersuchungen der Muskel Homöostase.
Offenlegungen
There is nothing to disclose.
Danksagungen
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Materialien
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
Referenzen
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten