Method Article
Zwei-Wege-Valorisierung von Hochofenschlacke: Synthese von gefälltes Calciumcarbonat und Zeolithmaterialien Heavy Metal Adsorbent
In diesem Artikel
Zusammenfassung
A protocol for the parallel production of precipitated calcium carbonate and zeolitic material from blast furnace slag via mineral carbonation and alkaline hydrothermal conversion, respectively, is presented. The performance of the zeolitic material towards nickel adsorption is tested.
Zusammenfassung
The aim of this work is to present a zero-waste process for storing CO2 in a stable and benign mineral form while producing zeolitic minerals with sufficient heavy metal adsorption capacity. To this end, blast furnace slag, a residue from iron-making, is utilized as the starting material. Calcium is selectively extracted from the slag by leaching with acetic acid (2 M CH3COOH) as the extraction agent. The filtered leachate is subsequently physico-chemically purified and then carbonated to form precipitated calcium carbonate (PCC) of high purity (<2 wt% non-calcium impurities, according to ICP-MS analysis). Sodium hydroxide is added to neutralize the regenerated acetate. The morphological properties of the resulting calcitic PCC are tuned for its potential application as a filler in papermaking. In parallel, the residual solids from the extraction stage are subjected to hydrothermal conversion in a caustic solution (2 M NaOH) that leads to the predominant formation of a particular zeolitic mineral phase (detected by XRD), namely analcime (NaAlSi2O6∙H2O). Based on its ability to adsorb Ni2+, as reported from batch adsorption experiments and ICP-OES analysis, this product can potentially be used in wastewater treatment or for environmental remediation applications.
Einleitung
Die indirekte Karbonisierung von industriellen Rückständen reich an Alkalimetallen wurde als Teil der Kohlenstoffabscheidung und -speicherung (CCS) Technologie 1, 2, 3, 4 weit erforscht. Eine gewisse Menge an CO 2 effizient gespeichert werden, permanent und in einer Weise , die gutartig in die Atmosphäre. Während jedoch wertvolle Materialien gebildet werden, besteht ein Teil der Technik, die nur unzureichend erforscht bleibt. Bei der indirekten Karbonisierung Verfahren wird selektiv Calcium aus dem Material extrahiert und anschließend zur Karbonisierung unter kontrollierten Bedingungen unterzogen. Allerdings erzeugt der Abfallverwertungsprozess feste Rückstände aus dem Material; diese Rückstände nicht weiterverarbeitet oder nach dem Calciumextraktionsstufe genutzt wird. Verarbeitungswege, die die Herstellung solcher Rückstände zu reduzieren, oder sogar, dass zu beseitigen, sollte gefunden werden. Um dies zuEnde, die vor kurzem hat es eine Anstrengung gewesen durch die Verwendung Hochofen (BF) Schlacke als Ausgangsmaterial, eine Null-Abfall-Mineral-Sequestrierung von Kohlenstoff, begleitet mit der Bildung von nützlichen Mineralien, kann ein Prozess, durch den, zu entwickeln und zu optimieren sein 5 erreicht, 6.
Mehrere Abfallstoffe so effizient Reaktanden für CO 2 Mineralisierung qualifiziert. Unter ihnen eisen- und stahlerzeugenden Schlacken präsentieren deutlich höhere experimentelle CO 2 uptakes als jeder andere Industrieabfälle 4. Die Attraktivität von BF Schlacke für die Abfallverwertung liegt in seinen Eigenschaften (chemische, mineralischen und morphologischen Eigenschaften) und die möglichen Anwendungen des Materials 5. Es ist ein Nebenprodukt der Eisenherstellungsverfahren, bei dem Verunreinigungen aus Eisenerz in einem pyrometallurgischen Verfahren entfernt werden. Basierend auf der Art und Weise ist es nach seiner Trennung von dem molte abgekühltn Eisen, vier verschiedene Arten von Schlacke erzeugt werden : (i) luftgekühlt (dh kristallin), (ii) granuliert (dh verglast), (iii) erweitert (dh geschäumt) und (iv) pelletiert.
Obwohl die Herstellung von gefälltem Kalziumkarbonat (PCC) der indirekten Karbonisierung von BF Schlacke unter Verwendung eines Verfahrens, das 7 viel Aufmerksamkeit auf sich ziehen es geschafft hat, 8, von Schlacke die hydrothermale Umwandlung zur Herstellung von zeolithischen Mineralien ist eine Technologie, wurde untersucht und erst in den letzten Jahren entwickelt , 9, 10, 11. Jedoch in keinem der Fälle wurde es als eine Technik angesehen, die in Verbindung mit der indirekten Karbonisierung von BF Schlacke, um verwendet werden könnten, die symbiotische Bildung von PCC und Zeolithen zu erzielen. das Zweiwege valorization hier beschriebenen Verfahren folgen, diese beiden Technikengekoppelt sind , die ausreichende Bindung von CO 2 zu erreichen , während auch zeolithische Mineralien und beseitigen mögliche feste Rückstände zu erhalten. Gemäß diesem Verfahren wird CO 2 in dem Calcium gespeichert , die aus Schlacke durch Säureauslaugung über eine Mineral Carbonisierungsreaktion 5 extrahiert wurde. Um die geeigneten PCC Produkteigenschaften für Anwendungen in der Papierherstellung (Mineralogie, Partikelgrößenverteilung und Partikelmorphologie) zu erreichen, das Sickerwasser aus der Extraktionsstufe wird zunächst physikalisch-chemisch gereinigt 6. Parallel dazu zeolithischen Mineralien werden in einer alkalischen Lösung über die hydrothermale Umwandlung der festen Rückstände aus der Calciumextraktionsstufe 5 resultierenden gebildet.
Zeolith ein Alumosilikat Mineral. Es kommt in der Natur, aber es kann auch industriell in großem Maßstab hergestellt werden. Zahlreiche einzigartige Zeolithgerüste wurden verschiedene applic identifiziert, wastionen für die Materialien. Beispielsweise können sie als Katalysatoren in verschiedenen Industriebereichen 12, 13 verwendet werden; sie werden in Waschmitteln und in Konstruktionsmaterialien als Zusatzstoffe in Asphalt, Beton 14, 15, und Portland - Zement 16, 17 festgestellt; und sie haben auch Anwendungen in der Medizin 18, 19, 20 und landwirtschaftlichen 21, 22, 23 - Domänen. Darüber hinaus aufgrund ihrer großen spezifischen Oberflächen und deren Kationenaustauschkapazitäten, Zeolithe können auch als Sorptionsmittel 24, 25, 26, 27 verwendet werden. Diese besonderen Sorptionsmittel können auch t verwendet werdeno behandeln direkt schwermetallbeladene Ströme, wie Abwasser oder kontaminiertem Grundwasser 28, 29, 30, 31. In dieser Studie von BF Schlacken das zeolithische Material über den valorization Verfahren Zweiwege erzeugt wird, zum ersten Mal, als Adsorbens für ein Schwermetall getestet, nämlich Nickel.
Für den vorgeschlagenen symbiotische Verfahren wird ein Extraktionsmittel amiable sowohl mit dem PCC und Zeolith Bildung verwendet werden. Somit ist die Wahl eines geeigneten Extraktionsmittels kritisch. Unter den verschiedenen Mitteln Auslaugung in früheren Forschungen sowohl indirekte Karbonisierung angewendet 7, 8 und hydrothermale Umwandlungs 10, 11 von BF Schlacke wurde Essigsäure als das vielversprechendste ausgewählt. Salzsäure 10 Exponate schädliche Auswirkungen auf sowohl die generation von PCC und auf der Auslaugung Selektivität, was zu erheblichen Verlusten in den Mengen von Si und Al in der Laugungslösung. Auf der anderen Seite hat Ameisensäure 11 als wirksam erwiesen, da sie Ca- und Mg gelingt es aus der Schlacke wirksam zu entfernen , während bemerkenswerte Selektivität Auslaugung präsentiert, so dass sowohl das Si und Al ungestört. Jedoch stellt es eine geringere Säuredissoziationskonstante als Essigsäure 33, was darauf hindeutet , daß die Ausfällung von Calciumcarbonat sollte leichter erzielbar nach der Verwendung von Acetat - Lösungen als Extraktionsmittel sein. Es hat sich auch , dass in einigen Fällen, beispielsweise bei der Verwendung von Succinaten 34 und Oxalate 35, non-Karbonat Ausfällungen Form anstelle von PCC gezeigt. Eloneva et al. 36 verglichen sechzehn Extraktionsmittel für Calcium - Entfernung aus Stahlherstellungsschlacken und gefunden Essigsäure die effizienteste (am bestenLeistung zwischen 0,5 M und 2 M Extraktions Konzentrationen) und erfolgreichsten (höchste Kalzium Erholung bei ~ 100%).
Das folgende Protokoll beschreibt ausführlich die im Labormaßstab experimentellen Prozess, der aus hochreinem PCC und ein zeolithisches Material, mit potentiellen Anwendungen als Papierfüllstoffe und Schwermetall-Sorptionsmittel zur Bildung führt, beziehungsweise. BF Schlacke ist das Ausgangsmaterial. Die Testverfahren zur Bewertung des synthetisierten zeolithischen Materials als adäquate Schwermetall Sorbens aufgebracht werden ebenfalls beschrieben.
Protokoll
1. Calcium Extraktion aus Hochofenschlacke
Hinweis: Wegen der nachteiligen Wirkung der Säure auf Auslaugung Selektivität erfolgt die Extraktion von Calcium in zwei Schritten, die Hälfte der Molarität von Essigsäure (CH 3 COOH) verwenden , die in einem einzigen Schritt verwendet werden würde.
- Grind der BF Schlacke mit einem Mörser und Stößel und Sieb es zu Partikelgröße unter 2 mm.
- Ein Autoklavenreaktor entsiegeln, die mit einem mit doppeltem Impellerrührer ausgestattet ist, einem Heiz- / Kühlmantel, einem Manometer und einem Thermoelement. Stellen Sie sicher, dass das Innere des Reaktorbehälters und die Komponenten aus dem Reaktorkopf vorsteht (Rührwelle; Laufrad und Thermoelement, das als ein Leitblech wirkt) sind sauber und frei von Verunreinigungen, die mit dem Calcium-Extraktionsprozess stören können. Wenn sie nicht sind, reinigen Sie diese gründlich.
- Man wiegt 100 g des gesiebten BF Schlacke (<2 mm) und legen Sie es in das Gefäß. Hinzufügen 731 ml CH 3 COOH (2 M) bis ter Schiff und abdichten. Stellen Sie sicher, dass der verschlossene Reaktor richtig auf seine Unterstützung befestigt ist.
- Setzen Sie den Heizmantel in der richtigen Position, so dass es fast das ganze Schiff abdeckt. Stellen Sie die Erwärmungstemperatur auf 30 ° C und startet die Aufschlämmung bei 1000 rpm mischen. Warten, bis die Temperatur im Inneren des Reaktors den Sollwert erreicht hat (ca. 15 min) und dann die Aufschlämmung verlassen bei den genannten Bedingungen für 60 min zu mischen.
- Sobald die Säureextraktionszeit abgelaufen ist, entfernen Sie den Heizmantel des Reaktors entsiegeln und die Suspension aus dem Reaktor in einen Becher gießen. Ein Ablassventil kann auch verwendet werden, aber die grobe Feststoffe den Durchgang blockieren können.
- Vakuum-Filtern der Aufschlämmung mit der Laugungslösung von den restlichen Feststoffen zu trennen; verwenden Filterpapier mit einer Porengröße von 8 & mgr; m oder weniger. Verarbeiten Sie die Feststoffe sofort (feuchter Kuchen), oder lassen Sie sie bei Raumtemperatur für die Verarbeitung zu einem späteren Zeitpunkt zu trocknen.
HINWEIS: Das Sickerwasser kann gespeichert werden, eint Umgebungstemperatur, aber es sollte vorzugsweise weiter verarbeitet werden (gereinigter und kohlensäure) kurz danach die unkontrollierte Ausfällung von gelösten Verbindungen zu vermeiden. - Waschen Sie sowohl den Reaktorkopf und das Gefäß mit DI-Wasser, um sicherzustellen, dass keine Rückstände aus der Säure oder der Schlacke zurückbleibt.
- Setzen Sie den trockenen, festen Rückstand aus der ersten Ca Extraktionsschritt in dem Gefäß und fügen Sie 731 ml CH 3 COOH (2 M). Wiederholen der gleichen Prozedur (Schritt 1.5) mit der Säure der Feststoffe zu vermischen (bei 30 ° C und 1000 rpm für 60 min).
- Am Ende des zweiten Extraktionsschritt, legen Sie die Post-Extraktion Schlamm in Zentrifugenröhrchen. Verwenden Sie große Kapazität Röhren (zB 50 ml oder mehr) und folgen Standard Zentrifugation Praktiken, wie in jedem Rohr das gleiche Gewicht zu gewährleisten.
- Trennen der Feststoffe aus dem Sickerwasser durch Zentrifugieren der Aufschlämmung bei 2.500 xg für mindestens 10 min. Gießen Sie langsam den Überstand in eine neue Flasche, während keEping die Feststoffe in den Röhren.
HINWEIS: Die Abtrennung der Feststoffe (suspendierte Kieselsäure und Restschlacke BF) aus dem Calciumacetat-reiche flüssige Phase wird somit erreicht.
- Trennen der Feststoffe aus dem Sickerwasser durch Zentrifugieren der Aufschlämmung bei 2.500 xg für mindestens 10 min. Gießen Sie langsam den Überstand in eine neue Flasche, während keEping die Feststoffe in den Röhren.
- Rückgewinnung des festen Rückstandes aus dem zweiten Extraktionsschritt aus den Rohren und resuspendieren sie in DI Wasser. Führen Sie eine weitere Runde der Zentrifugation restliche lösliche Acetate zu entfernen. Gewinnen Sie die gewaschenen Feststoffe und lassen sie unter Umgebungsbedingungen trocknen.
- Kombinieren der Lösungen von sowohl der ersten Extraktionsfiltration (Filtrat) und die zweite Extraktions Zentrifugation (Überstand), um die post-Extraktions Sickerwasser zu erhalten.
2. Physikalisch-chemische Reinigung des Post-Extraktion Sickerwasser
HINWEIS: Trotz der Trennung der Feststoffe aus der Laugungslösung (Schritt 1.9), noch der resultierende Überstand enthält lösliche oder kolloidale Verunreinigungen. Die wichtigste dieser Verunreinigungen sind Siliciumdioxid, Magnesium und Aluminium.Nach den bisher veröffentlichten Werk 32, Kieselsäure Löslichkeit in reinem Wasser auf die Temperatur der Lösung proportional ( das heißt , indem die Temperatur des reinen Wassers abnimmt, auch die Löslichkeit von Kieselsäure abnimmt). Obwohl die Laugungslösung nicht reines Wasser ist, wurde gefunden, dass der Überstand aus der Fest-Flüssig - Trennung des nach der Extraktion Aufschlämmung Abkühlen führt zu einer weiteren Entfernung von Kieselsäure ( im Vergleich zu allein Zentrifugation) Aussetzen 2. Auf der anderen Seite, Magnesium- und Aluminium-Verunreinigungen vorhanden sind, im Überstand in Form der Acetate. Um ihre Löslichkeit deutlich zu reduzieren, müssen sie , um unlösliche Metallhydroxide durch pH - Einstellung 2 transformiert werden.
- Hinzufügen konzentrierter NaOH-Lösung (50% w / w) zu dem Überstand, so dass die Endkonzentration von NaOH im Überstand 1,25 M; Dies wird der pH-Wert auf etwa 8,4, also Umwandlung der Magnesium und Aluminium As erhöhenTates ihrer deutlich weniger lösliche Form von Hydroxiden. Fügen Sie die ätzende Lösung langsam unter Rühren und Messen des pH-Wertes.
- Legen Sie die NaOH-angereicherte Überstand in den Kühlschrank stellen und abkühlen lassen bis 1 ° C die zusätzliche Ausfällung von Kieselsäure zu verursachen.
- Nach dem Abkühlen, Filtern Vakuum die Lösung unter Verwendung von Filterpapier mit einer Porengrße von 0,45 um. Die Mikrofiltration der Lösung führt zu der weiteren Entfernung von Silizium und der ausgefällten Verunreinigungen von Magnesium und Aluminium.
3. Die Carbonisierung der gereinigten Sickerwasser
Hinweis: Durch die Regeneration von Essigsäure auf Carbonisierung wird NaOH als Zusatz verwendet, um die Säure zu puffern, die Calciumpräzipitation hemmt. Für die Herstellung einer reineren PCC, NaOH sollte im Extraktionsschritt (2 M) , die in einem Teil äquimolaren Konzentration in Bezug auf die des CH 3 COOH verwendet werden.
- Gießen Sie das gereinigte Sickerwasser in den Autoklaven reDarsteller. Überprüfen Sie sowohl seine Behälter und Deckel Komponenten zu überprüfen, ob sie aus früheren Verwendungen in der Reihenfolge der Rückstand sauber sind Verunreinigungen zu vermeiden, mit den Carbo Reaktionen stören. Hinzufügen konzentrierter NaOH (50% w / w) in das Gefäß, so dass die endgültige NaOH - Konzentration in der gereinigten Laugungslösung 1,7 M, das um regenerierte CH 3 COOH bei Carbonatisierung zu neutralisieren. Verschließen Sie den Reaktor und sorgfältig befestigen, um ihre Unterstützung.
- Setzen Sie den Heizmantel des Reaktors in der richtigen Position. Stellen Sie die Erwärmungstemperatur auf 30 ° C und startet die Aufschlämmung bei 1000 rpm mischen. Warten, bis der Innenraum des Reaktors die gewünschte Temperatur erreicht hat (ca. 15 min). Starten Sie die Carbonisierung des Gemisches durch den Reaktor CO 2 hoher Reinheit Einführung (99,5%) bei 2 bar; laufen für 60 min.
- Bei der Beendigung der Carbonisierung, entfernen Sie den Heizmantel, drucklos und den Reaktor entsiegeln, und gießen Sie die kohlensäure Brei in einen Becher.
HINWEIS:Ein Ablassventil kann auch nach der Entspannung eingesetzt werden, da die Feststoffe fein sind. - Vakuum-Filtern der resultierenden Aufschlämmung der festen Präzipitate von der Lösung zu trennen; verwenden Filterpapier mit einer Porengröße von 8 & mgr; m oder weniger. Spülen Sie den Filterkuchen gründlich mit VE-Wasser unter Vakuum löslichen Natrium zu entfernen.
HINWEIS: Die deutliche Verringerung der Leitfähigkeit der Spülung Filtrat kann die Spülung Endpunktes zu bestätigen verwendet werden. - Otro das feste Material bei 105 ° C für 24 h die PCC abzurufen.
4. Die hydrothermale Umwandlung der Extraktion feste Rückstände
HINWEIS: Bei hydrothermalen Umwandlung, Calcium abgereicherte Restfeststoffe aus dem Hochofenschlackenextraktions Essigsäure verwendet wurden. Nach jedem Extraktionslauf (beide Stufen einschließlich), weniger als 50 Gew% der Ausgangsmasse (durch Calcium-Extraktion und den teilweisen Verlust von kolloidalem Siliciumdioxid in der Filtration und in Abhängigkeit von dem Filterpapier gewonnen werden porosity) verwendet. Somit werden mehrere Chargen von Extraktion benötigt, um die Masse der Feststoffe in der hydrothermalen Umwandlungsschritt verwendet erzeugen.
- Platzieren 60 g der trockenen Restfeststoffe aus dem Calcium-Extraktion in einen sauberen Autoklavenreaktor. Hinzufügen von 300 ml 2 M NaOH-Lösung. Verschließen Sie den Reaktor und befestigen Sie es an seine Unterstützung.
- Setzen Sie den Heizmantel des Reaktors in der richtigen Position. Stellen Sie die Erwärmungstemperatur auf 150 ° C und startet die Aufschlämmung bei 300 rpm gemischt wird. Warten für etwa 45-50 min, bis das Innere des Reaktors die gewünschte Temperatur erreicht. Lassen die Aufschlämmung 24 h bei den oben erwähnten Bedingungen zu mischen.
- Bei der Beendigung der hydrothermalen Umwandlung, entfernen Sie den Heizmantel und damit der Reaktor für 60 min abgekühlt, auf ca. 35 ° C. Der Kühlkreislauf des Reaktormantel kann auch zu beschleunigen Kühlung verwendet werden.
- Entsiegeln den Reaktor und gießen Sie die konvertierten Brei in einen Becher.
- Vakuumfilter die Aufschlämmung zur Trennung der Feststoffe umgewandelt aus der Lösung; verwenden Filterpapier mit einer Porengröße von 8 & mgr; m oder weniger. Spülen Sie die Feststoffe gründlich mit VE-Wasser unter Vakuum das überschüssige ätzend zu entfernen.
HINWEIS: Die deutliche Verringerung der Leitfähigkeit des Spülgang Filtrat kann die Spülung Endpunkt zur Bestätigung verwendet werden. - Otro das gefilterte Material bei 105 ° C für 24 h das hydrothermal umgesetzt Material zu erhalten.
- Disaggregieren das körnige Material mit einem Mörser und Stößel und Sieb das erhaltene Material auf eine Korngröße <0,85 mm verwendet.
5. Heavy Metal Adsorption Tests mit dem Produkt Zeolithmaterialien
HINWEIS: Ni 2+ als Schwermetall für die Untersuchung ausgewählt. Belastete Lösungen mit unterschiedlichen Anfangsschwermetallkonzentrationen wurden synthetisiert. Erste Schwermetallkonzentrationen von 2-200 mg / l wurden als geeignet für die Bedürfnisse der vorliegenden Studie ausgewählt.
- Um die kontaminierten Lösungen für die Gleichgewichtsexperimente vorbereiten, verwenden Sie eine Mikropipette eine entsprechende Menge von 1.000 mg / l pA Standardlösung von Ni 2+ in 1 l ultrareinem Wasser in einem Messkolben hinzufügen zu produzieren Lösungen von die gewünschten Ni 2+ -Konzentrationen (2 mg / l, 10 mg / l, 20 mg / l, 100 mg / L und 200 mg / L).
- In verkappter Kunststoffflaschen, disperse 1 g des Materials aus hydrothermal umgesetzt Stufe 4.6 in 100 ml jeder synthetisch hergestellten kontaminierten Lösung führt.
- Konzentrierte NaOH (2 M in erster und 0,5 M näher an dem Endpunkt) tropfenweise den pH-Wert der Lösungen auf 4-5 einzustellen. Kontinuierlich rühren Sie die Lösung mit einer niedrigen Geschwindigkeit ein Magnetrührstab auf einer Rührplatte mit. Überwachen Sie den pH-Wert während der NaOH Zugabe von einer pH-Elektrode mit der Lösung getränkt.
- Platzieren Sie die Flaschen in einem Schüttelinkubator und agitieren sie bei 160 rpm und 20 ° C für 24 h.
- Nach dem Mischen hinzufügen konzentrierter HCl (2 M auf den ersten und 0,2 M näher an dem Endpunkt) tropfenweise zu der Lösung, um den pH auf 4-5 nachzustellen. Während der Einstellung rühre die Lösung kontinuierlich mit einer geringen Geschwindigkeit ein Magnetrührstab auf einer Rührplatte verwenden. Überwachen Sie den pH-Wert kontinuierlich, während die HCl-Zugabe durch eine pH-Elektrode in die Lösung getaucht.
- Platzieren Sie den Brei in Zentrifugenröhrchen. Trennen der Feststoffe aus der Lösung durch eine Laborzentrifuge bei 2.500 xg für 5 Minuten verwendet wird. Füllen Sie vorsichtig den Überstand-Lösung auf eine neue Flasche, während die Feststoffe im Rohr Zentrifuge zu halten.
- Ansäuern der Lösung mit HNO 3 (2 Gew% Salpetersäurekonzentration) den pH - Wert auf <2 zu reduzieren.
Hinweis: dieser Schritt durchgeführt wird, um sicherzustellen, dass die Ionen in der Lösung während der Lagerung verbleiben (bei Raumtemperatur) vor Manipulation und Analyse zu fördern. - Bestimmung der Gleichgewichtskonzentration der untersuchten Schwermetall in dem Überstand durch ICP-OES verwenden.
HINWEIS: Die Lösungen werden durch eine verdünnteFaktor 10-100x unter Verwendung von 2 wt% HNO 3 Verdünnungsmittel, so dass die erwartete Konzentration fällt in den linearen Bereich der Instrumentenkalibrierung (0-2 mg / L). Yttrium, bei 2 mg / L, wird zu jeder verdünnten Probe als interner Standard zugegeben. Die ICP-OES Instrument für die Analyse von Metallen in Abwässern 37 basierend auf den Empfehlungen des Herstellers betrieben. Alternative Techniken zur Bestimmung der Nickelkonzentration in Lösung, wie ICP-MS und AAS, eignen sich auch für diesen Schritt. - Berechnen der Menge an Schwermetall adsorbiert pro g des Adsorbens im Gleichgewichtszustand (q e) mit der folgenden Formel:
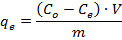
wobei C o die Anfangskonzentration (& mgr; mol / ml) der Schwermetallionen in der Lösung ist, C e die Gleichgewichtskonzentration des Schwermetallionen in der Lösung (& mgr; mol / ml) ist, V die volume der kontaminierten Lösung (ml), und m ist die Masse des trockenen Adsorbens (g).
Ergebnisse
Um die Karbonat Niederschläge für Reinheit zu testen und Ausbeute können mehrere Instrumentaltechniken angewendet werden. Die Elementarzusammensetzung (einschließlich der Haupt- und Nebenbestandteile) kann entweder durch induktiv gekoppelte Plasma-Atomemissionsspektroskopie (ICP-OES), durch induktiv gekoppelte Plasma-Massenspektrometrie (ICP-MS) oder Atomabsorptionsspektroskopie (AAS) nach der Säureaufschluß bestimmt werden (in HCl) oder durch Röntgenfluoreszenzspektroskopie (XRF) mit der Probe in Pulver- oder Pelletform. XRF ist weniger empfindlich für kleinere Komponenten (<1 Gew%). Weitere Details und Beispiele sind in De Crom et al. 6 Diese Ergebnisse werden zeigen , ob unerwünschte Verunreinigungen vorhanden sind und helfen , festzustellen, durch Massenbilanz, die Effizienz des Kalziumgehalts der ursprünglichen Schlacke in PCC umgewandelt wird . Die mineralische Zusammensetzung wird durch Röntgenpulverbeugung (XRD) best bestimmt. Das resultierende Beugungsdiagramm liefert qualitativeInformationen über das Vorhandensein von kristallinen Mineralphasen. Quantifizierung der relativen Mengen durch Rietveld-Verfeinerung Technik (mit einer Genauigkeit von etwa ± 2-3 wt%) hergestellt. Weitere Details und Beispiele finden sich in Santos et al. 38 Diese Ergebnisse werden überprüfen , ob die Verfahrensbedingungen oder Verunreinigungen des Kristallisationsprozesses beeinflussen, erzeugen zusätzliche unerwünschte Phasen neben Calcit (CaCO 3). Die Partikelgrößenverteilung (PSD) und Partikeldurchmesser bedeuten werden am besten durch nass (DI-Wasser) Laserbeugung bestimmt. Weitere Details und Beispiele finden sich in De Crom et al. 6 Diese Ergebnisse werden verwendet , um abzuschätzen , ob die PCC den Anforderungen ihrer beabsichtigten Anwendung erfüllt (dh Papierherstellungs), die in der Regel eine obere Cut-Off - Größe und eine Spannweite der Verteilung angeben.
Die elementare Zusammensetzung der nach der Extraktion von Sickerwasser und Post-KarbonisierungProdukte, sowie die XRD - Muster und volumenbasierten PSD der post-Karbonisierung Ausfällungen, sind in den 1 und 2 dargestellt. ICP-MS-Technik wurde verwendet, um den Gehalt (Gewichts-%) von bestimmten Metallen (Ca, Mg, Al und Si) in der Zusammensetzung des Sickerwassers gemessen nach der Ca Extraktionsstufe und vor der Karbonisierung. Die Verwendung von pA Essigsäure (2 M) als Auslaugmittel resultierte in einer Ca - Extraktion von etwa 90% (Abbildung 1a). Nach den Ergebnissen wurde eine noch höhere Extraktionseffizienz für Magnesium (fast 100%), ein anderes Metall detektiert, die effizient kohlensäure werden kann, aber unter intensiver Bedingungen.
Das Verhalten von Siliciumdioxid und Aluminium während der Extraktionsstufe wurde ebenfalls untersucht. Um erfolgreich Alumosilikat-basierte zeolithischen Mineralien durch hydrothermale Umwandlung erzeugen, aber auch mit unde Kontamination des synthetisierten PCC zu vermeidengezeugt Elemente sowohl Silika und Aluminium sollte während des Extraktionsprozesses in der festen Phase verbleiben. Nach den Ergebnissen zeigte Essigsäure eine zufriedenstellend begrenzt Auslaugung von Siliciumdioxid und Aluminium, mit fast 92% Siliciumdioxid und 62% Aluminium während der Laugung (1b) verbleibende unberührt.
Die Karbonisierung des gereinigten Laugungslösung resultierte in der Herstellung von PCC mit wünschenswerten Eigenschaften, wie in Abbildung 2 dargestellt. Basierend auf dem XRD - Diagramm (Figur 2b), daß die mineralische Phase wurde hauptsächlich wurde synthetisiert , dass von Calcit (88,2 Gew%), während kleine Mengen von Nesquehonit (Mg (HCO 3) (OH) & middot; 2H 2 O; 3,2 wt%) und Magnesia Calcit (Ca 1-0,85 Mg 0-0,15 CO 3; 2,8 Gew%) waren ebenfalls anwesend. Von der PSD - Analyse des Materials (Abbildung 2c), wurde deutlich , dass die mittlere Partikel size klein und die Teilchengrößenverteilung war eng.
Parallel zu Karbonisierung wurden die festen Rückstände aus der Extraktionsstufe einer hydrothermalen Umwandlung unterworfen. Charakterisierung des hydrothermal umgesetzt Material, die Herstellung der zeolithischen Mineralien zu überprüfen und um die Morphologie zu bewerten, wurde wie folgt ausgeführt. Die Elementarzusammensetzung wird am leichtesten durch XRF erhalten. Spurenelementbestimmung erfordert Säureaufschluss gefolgt von ICP-OES, ICP-MS oder AAS, bei der Verdauung mit sequentieller Säureauflösung durchgeführt (HNO 3 -HF oder HNO 3 -HClO 4 -HF) , um die Silicaphase zu lösen. Zwar gibt es keine spezifische elementare Zusammensetzung für das umgewandelte Material gezielt ist, hilft diese Analyse die Mineralzusammensetzung durch XRD bestimmt klären. XRD-Analyse, mineralische Zusammensetzung zu bestimmen, die PSD und der mittlere Partikeldurchmesser wurden in ähnlicher Weise zu Karbonat Niederschläge bestimmt, eins oben genannten. Die spezifische Oberfläche, das Porenvolumen und der mittlere Porendurchmesser wurden durch Stickstoffadsorption bestimmt, mit den Isothermen interpretiert nach Brunauer-Emmett-Teller (BET) Multi-Point-Theorie. Proben zunächst unter Vakuum werden 4 h bei 350 ° C entgast. Weitere Details und Beispiele finden sich in Chiang et al. 5
Die Ca, Mg, Al, und Si - Gehalt in dem hydrothermal umgesetzt Material, bestimmt durch den ICP-OES - Technik verwenden, ist in 3a gezeigt, während ihre mineralogische Zusammensetzung, von XRD - Muster bestimmt wird , wird in 3b gezeigt. Die mittlere Teilchengröße und Größenverteilung, von der PSD - Analyse erhalten, ist in 3c gezeigt. Analcim (NaAlSi 2 O 6 ∙ H 2 O) und Tobermorit (Ca: Das erhaltene Material wird durch die Anwesenheit von zwei Hauptphasen minera gekennzeichnet5 (OH) 2 Si 6 O 16 ∙ 4H 2 O). Das Vorhandensein des letzteren in die umgesetzten Extraktionsrückstände rechtfertigt den bemerkenswerten Calciumgehalt (22,5 Gew%), die in der chemischen Zusammensetzung des Materials festgestellt wurde, wie es XRF analysiert werden. Silica (37.2 Gew%) und Aluminium (11,2 Gew%) waren die anderen Primärelemente, während Magnesium in Mengen von etwa 4 Gew% vorhanden war. Auf der Basis der PSD-Analyse, das Volumen vor (De Brouckere) mittlerer Teilchendurchmesser (D [4,3]) der umgesetzten Materialien war 86,6 & mgr; m, während die Größenverteilung von 0,594 & mgr; m bis 1,11 mm reicht. Stickstoff - Adsorptions - Analyse bestätigte die Bildung von mesoporösen Material (46,0 nm mittlerer Porendurchmesser), wobei die spezifische Oberfläche und das Porenvolumen des hydrothermal umgesetzt Material jeweils von 4,89 m 2 / g bis 95,23 m 2 / g erhöht und von 0,014 ml / g bis 0.610 ml / g über der ursprünglichen Schlacke.
r.within-page = "1"> Die Gleichgewichts Adsorptionsisothermen von Ni 2+ auf das Material hydrothermal umgesetzt, vor und nach der pH - Einstellung der äquilibriert Adsorbens-Adsorbat Lösung, sowie die Anpassung der experimentellen Daten an das linearisierte Langmuir, Freundlich, und Temkin Adsorptions - Modelle sind in Abbildung 4 dargestellt.
Das Langmuir-Modell basiert auf einigen vernünftigen Annahmen, die den Chemisorptionsprozeß charakterisieren. Nach ihnen bietet die Oberfläche des Adsorbens nur eine feste Anzahl von Adsorptionsstellen mit identischen Formen und Größen, durch gleiche Adsorptionskapazität gekennzeichnet. Das adsorbierte Material bildet nur eine Schicht (Dicke von einem Molekül) auf der Oberfläche des Adsorbens und die Temperatur konstant ist. Mathematisch wird das Langmuir-Modell durch die folgende Gleichung ausgedrückt wird:
/files/ftp_upload/55062/55062eq2.jpg "/>
wobei C e die Gleichgewichtskonzentration von Adsorbat in Lösung (& mgr; mol / 100 mL), Q e die Menge an Metall pro g Adsorbens im Gleichgewichtszustand adsorbierte (umol / g), D m die theoretische maximale einschichtigen Beschichtung Kapazität des Adsorbens (umol / g), und k ist die Langmuir - Isotherme Konstante (100 ml / umol).
Die Freundlich-Isotherme wird nicht von den Annahmen eingeschränkt in dem Langmuir-Modell erforderlich. Stattdessen beschreibt die physikalische Adsorptionsverfahren, die Adsorbentien mit heterogenen Oberflächen aufgebracht werden können. Die Adsorptionsstellen, verteilt über die gesamte Oberfläche des Adsorbens, werden durch unterschiedliche Affinitäten für den Adsorbat gekennzeichnet, während das adsorbierte Material mehr als eine Schicht auf der Oberfläche des Adsorbens bildet. Die FreundlichModell wird mathematisch ausgedrückt als:
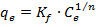
wobei K f und n die Isotherme Konstanten Freundlich, um Adsorptionskapazität und Adsorption Intensität entsprechen.
Schließlich nimmt das Temkin Modell, daß die Adsorptionswärme aller Moleküle der Schicht linear mit der Abdeckung verringert aufgrund der Adsorbens-Adsorbat-Wechselwirkungen, während die Bindungsenergie gleichmäßig verteilt sind. Das Temkin Modell wird durch die folgende Gleichung ausgedrückt:
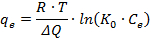
wobei R die universelle Gaskonstante (8,314 J / mol / K) ist, T the Temperatur (K), ist & Delta; Q die Veränderung der Absorptionsenergie ((J / mol) ∙ (g / & mgr; mol)) und 0 K ist die Isotherme Gleichgewicht Temkin Bindungskonstante (100 ml / umol).
Die Werte der Koeffizienten für alle angewandten Modelle wurden auf den aufgetragen Adsorptionsisothermen (4a) und die Linearformen der Langmuir, Freundlich, und Temkin Gleichungen (4b-4d) berechnet. Die Koeffizientenwerte, zusammen mit den linearen Gleichungen sind in Tabelle 1 dargestellt. Schließlich Vergleiche zwischen den experimentellen Daten und der theoretischen Adsorptionsisothermen von Ni 2+ auf die Aktivmaterial für die drei verschiedenen Adsorptions - Modelle sind in Abbildung 5 dargestellt. Basierend auf der Kontur der Graphen und die hohe Nähe der Versuchsergebnisse auf die theoretischen Kurven Isotherme wurde gefunden, dass die neu für verifiziertmed Sorptionsmaterial kann wirksam als Ni 2+ Adsorbens verwendet werden.
Durch einen Vergleich der Einbau Ergebnisse in 5a und 5b dargestellt, sowie die Regressionskoeffizienten (R 2) für die Langmuir und Freundlich Modelle (Tabelle 1), ist es klar , daß der Langmuir - Gleichung ist die, die besser auf die experimentellen Daten beschreibt. Dies impliziert , dass die Adsorption von Ni 2+ -Ionen auf das umgewandelte Material eine Monoschicht - Adsorption ist , und dass seine Natur ist die eines Chemisorptionsprozeß. Um die Natur der untersuchten Adsorption weiter zu analysieren, wir auch versucht, die Temkin Modell an die experimentellen Daten zu passen. Aus dem Diagramm in Abbildung 5c und seine hohe R 2 (Tabelle 1) gezeigt wird , ist es klar , dass das Temkin Modell auch gut die experimentellen Daten passt. Aufgrund der positiven Werte der VariationAdsorptionsenergie (& Dgr; Q), kann gefolgert werden , dass die Adsorption exotherm ist.
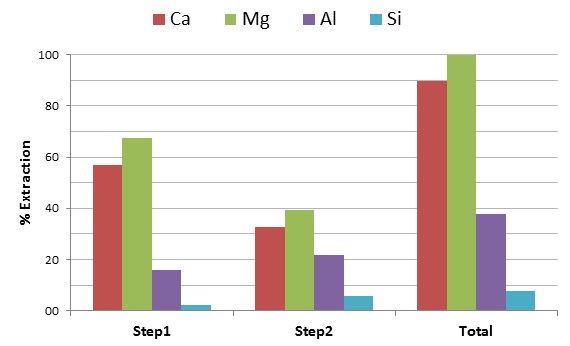
Abbildung 1: Die Essigsäure - Extraktion. Konzentration von Al, Ca, Mg und Si in den Sickerwasserlösungen (erste Stufe, eine zweite Stufe und insgesamt), die aus der Reaktion zwischen Essigsäure und gemahlener, granulierter BF Schlacke bei 30 ° C, 1000 rpm und 60 min. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
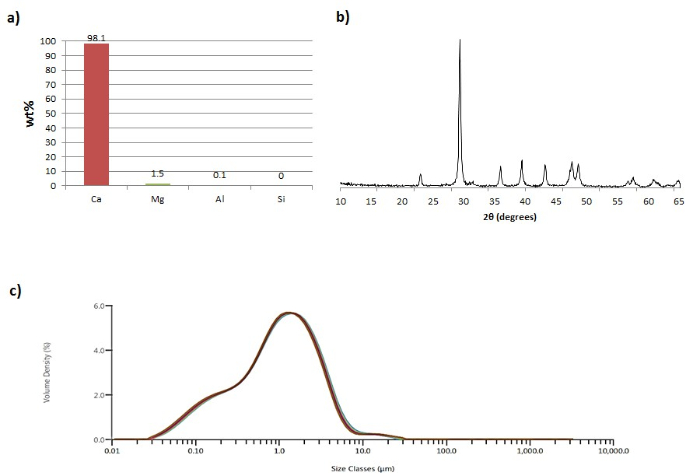
Abbildung 2: Calciumcarbonat ausfällt. (A) Zusammensetzung des Carbonats Präzipitat, ausgedrückt in Gewichtsprozent pro Element, Normalisieren d auf 100% Gesamt. (B) XRD - Diagramm des post-Karbonisierung Präzipitat. (C) Partikelgrößenverteilung des post-Karbonisierung Niederschlag. Übernommen aus De Crom et al. 6 mit Genehmigung von Elsevier (3879261230348). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
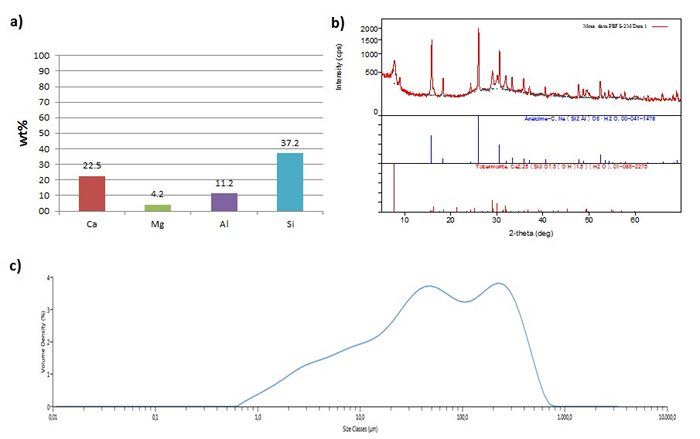
Abbildung 3: Hydrothermal - konvertiertes Material. (A) Zusammensetzung des hydrothermal umgesetzt Material, ausgedrückt in Gewichtsprozent pro Element, normiert auf 100% Gesamt. (B) XRD - Diagramm des hydrothermal umgesetzt Material. (C) Mittlere Partikelgrößenverteilung des hydrothermal konvertiertes Material..com / files / ftp_upload / 55062 / 55062fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
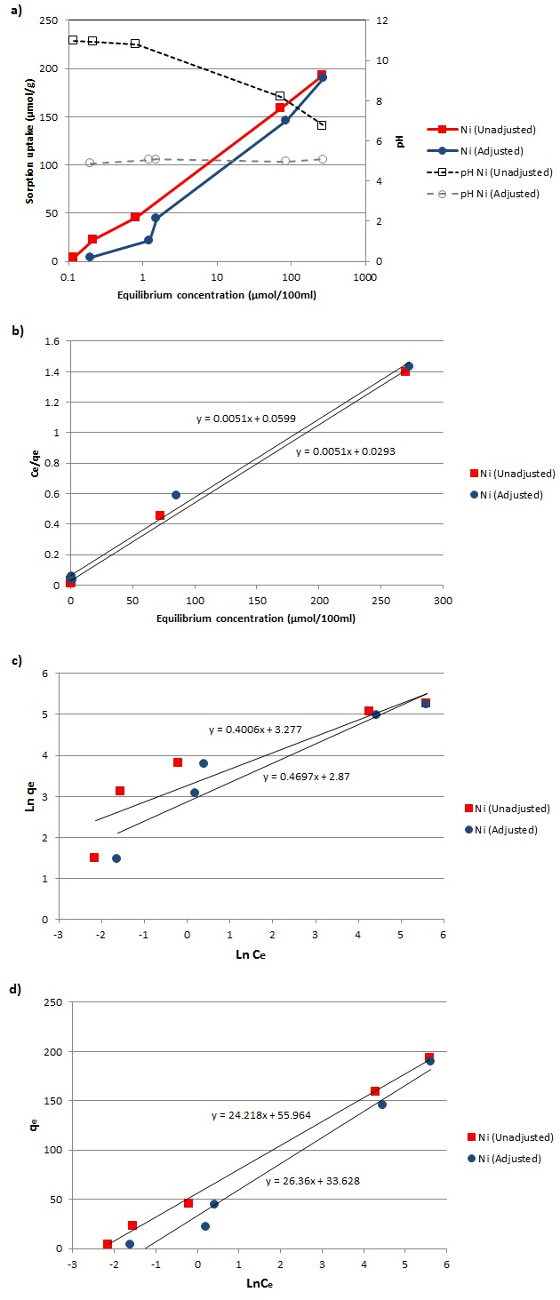
Abbildung 4: Adsorptionsisothermen. (A) Adsorptionsisotherme Daten von Ni 2+ auf das zeolithische Material vor und nach der pH - Einstellung. (B - d) Anpassung der experimentellen Daten an die linearisierten Langmuir, Freundlich, und Temkin Adsorptions - Modelle. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
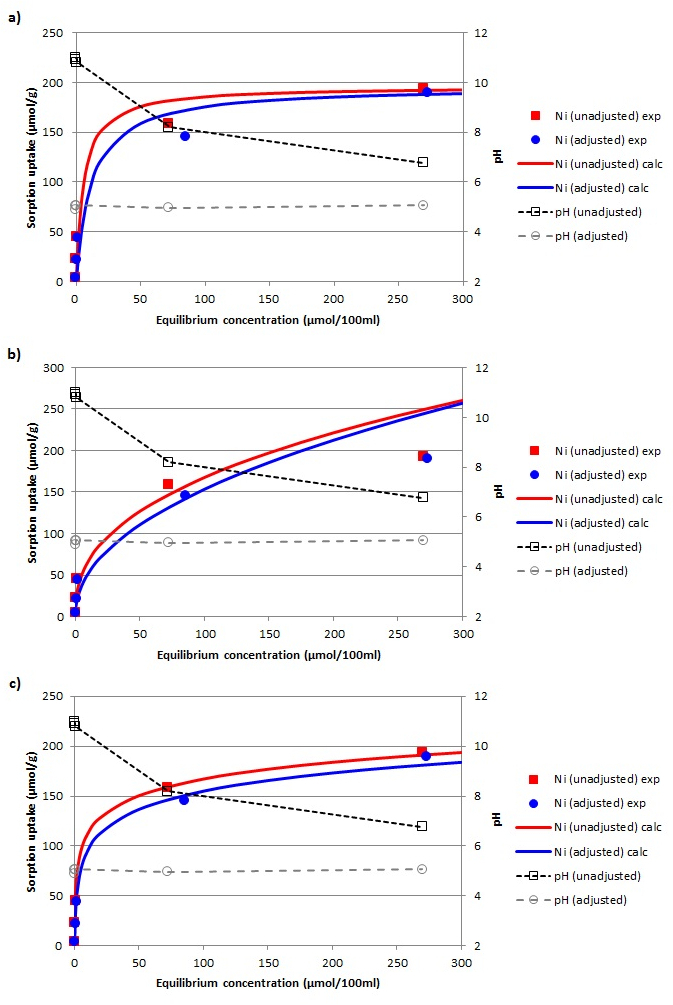
Abbildung 5: Experimentelle und simulierten Daten Nähe. Vergleich zwischen den experimentellen Daten (exp) und die simulierten Adsorptionsisothermen (calc) von Ni 2+ auf das zeolithische Material nach dem (a) Langmuir, (b) Freundlich und (c) Temkin Modellen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Lineare Gleichungen | Beiwerte | nicht angepasst | Bereinigt | ||
| Langmuir - Gleichung | 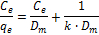 | D m | 196,08 | 196,08 | |
| k | 0,174 | 0,0851 | |||
| R 2 | 0,997 | 0,993 | |||
| Freundlich Gleichung | 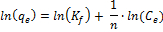 | n | 2,50 | 2.13 | |
| K f | 26.50 | 17,64 | |||
| R 2 | 0,840 | 0,893 | |||
| Temkin Gleichung | 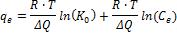 | Δ Q | 102,30 | 93.99 | |
| K 0 | 9.97 | 3,58 | |||
| R 2 | 0,998 | 0,978 | |||
Tabelle 1: Adsorptionsisotherme Parameter für die Ni 2+ Adsorption an zeolithischen Material. Gleichungen und angepassten Parametern aus, linearisiert Langmuir, Freundlich und Temkin Adsorption Modelle.
Diskussion
Obwohl die indirekte Karbonisierung 7, 8 und die hydrothermale Umwandlung 9, 10 von BF Schlacken haben als separate Prozesse weithin untersucht worden, deren Kopplung für die symbiotische Synthese von PCC und zeolithischen Mineralien erst kürzlich 5 vorgeschlagen worden, und die Methodologie wird hier vorgestellt in Detail. Der kritischste Schritt des Verfahrens ist die ausreichende (fast total) Extraktion von Ca und die begrenzte Auslaugung von Siliciumdioxid und Aluminium aus der BF Schlacke während der Extraktionsphase. Die hohe Menge an Calcium in der Auswaschlösung sichert eine hohe Rate der PCC - Synthese Nach der Carbonisierung und verhindert die Erzeugung von großen Mengen an unerwünschten Phasen (zB Tobermorit, Hydrogranat (Ca 3 Al 2 (SiO 4) 3-y (OH) 4y) ) unter den hydrothermal umgewandelt Produkte 9. Auf the Andererseits ist die Erhaltung des größten Teils von Si und Al in den post-Extraktion feste Rückstände von instrumentalen Bedeutung für die Bildung von zeolithischen Mineralien.
Zu diesem Zweck ist unter den verschiedenen Extraktionsmitteln in der Literatur untersucht , 7, 8, 10, 11, 34, 35, 36, wurde Essigsäure als am besten geeignet für den Zweck dieser Studie ausgewählt. Die bestimmte Extraktionsmittel verursacht die Freisetzung von hohen Mengen an Calcium von der Schlacke zu der Lösung, während die Beibehaltung der größte Teil von Si und Al in den resultierenden Rückstände gewährleistet. Dies fördert die Bildung von parallel PCC und Zeolithen. Die Essigsäure-zu-Calcium-Molverhältnis in jedem Extraktionsschritt verwendet wurde, war 2: 1 (bezogen auf die Masse der Schlacke, der Calciumgehalt der Schlacke und the Volumen der Essigsäure-Lösung), was bedeutet, dass das Gesamtverhältnis über zwei Extraktionsschritte war 4: 1. Da Calciumacetat ein Acetat-zu-Calcium - Verhältnis von 2: 1 aufweist , die doppelte stöchiometrische Menge verwendet wurde, wie von Chiang et al notwendig gefunden wurde. 5
Um eine weitere Reinigung zu begrenzen, sollte die Anwesenheit von unerwünschten Verunreinigungen in dem erzeugten PCC, die Laugungslösung, bevor sie mit Kohlensäure unterworfen werden; dies ist eine weitere Neuheit des vorgeschlagenen symbiotischen Prozess. In früheren Arbeiten, die PCC-Qualität (chemische Reinheit, mineralische Zusammensetzung, Partikelgröße und Form) wurde durch Verunreinigungen negativ beeinflusst. Für das synthetisierte PCC als Papierfüllstoff qualifiziert werden, müssen bestimmte Kriterien erfüllt werden. Die hergestellte PCC sollte durch hohe chemische Reinheit (min. 98 Gew% Ca) charakterisiert werden, homogene mineralogisch Struktur, geringe mittlere Teilchengröße und enger Größenverteilung 6. Wie im repräsentatives Ergebnis präsentierts Abschnitt, bietet das vorgeschlagene Verfahren diese Eigenschaften. Die ausgefällten Carbonats ist von hoher Reinheit und hat einen Calciumgehalt von 98,1 Gew% (Abbildung 2a).
Die Optimierung der hydrothermalen Umwandlungsprozess führte zur Herstellung eines Materials mit der Fähigkeit, als Schwermetall-Adsorbens handeln. Die Optimierung wurde durch Auffinden der am besten geeigneten Kombination von Temperatur, NaOH-Konzentration und Reaktionszeit hergestellt. Tobermorit ist eine der unerwünschten Mineralphasen, die sich bilden können; seine geschichtete Kristallstruktur führt zu einer reduzierten spezifischen Oberflächenbereich 39, ein Merkmal wichtig für Sorbentien, obwohl berichtet wurde , dass Tobermorit 40 als ein Sorbens durch einen Ionenaustauschmechanismus wirken kann. Dennoch ist die mineralische Phase, die das umgewandelte Material in dieser Studie unter optimalen Bedingungen dominiert, die von Analcim (Abbildung 3b). Es ist ein Zeolith, der berichtet wurde,haben einen bemerkenswerten Schwermetall Adsorptionskapazität 41, 42 und somit für die Entfernung von toxischen Verunreinigungen aus Abwässern verwendet werden, wie hier gezeigt.
Das Potential der Verwendung dieses Materials als Sorptionsmittel wurde für Nickel Entfernung von Wasser untersucht. Die pH - Werte der synthetisch hergestellt kontaminierten Lösungen von Ni 2+ bis 4-5 während des Tests gesteuert wurden, zuerst, Auflösung des Materials in der anfänglichen sauren Umgebung der synthetischen Lösung zu verhindern, und zweitens, um den pH einzustellen , um das Niveau der Regel in Schwermetallsanierungsbedingungen 43 gefunden. Drei verschiedene Modelle Isotherme, nämlich Langmuir, Freundlich und Temkin wurden angewandt , um die Adsorptionsverfahren (4 und 5), mit dem Langmuir - Modell zur Charakterisierung erweist sich die am besten geeignete zu sein. Es sollte beachtet werden , dass die D m attrib Werteausgeschüttete auf das unbereinigte Gleichgewicht Adsorbens-Adsorbat Lösungen sind höher als die nach der Anpassung an die Gleichgewichtslösungen entspricht. Dies wird durch den pH-Anstieg erläutert, die während der Adsorption auftretende Reaktionen in der Lösung stattfindet, bis sie ihr Gleichgewicht erreicht. Ein höherer pH (> 5) bewirkt , daß Nickel als Ni (OH) 2 auszufällen nach geochemischen Modellierung und experimentelle Untersuchungen von Santos et al. 44, die den D - m - Wert wiederum aufbläst. Diese Art von Schwermetallen sollte nicht als die tatsächliche Adsorptionskapazität des getesteten Materials berücksichtigt werden. In einer Bemühung, eine solche vorgespannte Messungen zu vermeiden, wird der pH-Wert der äquilibriert Adsorbens-Adsorbat Lösung wurde durch Zugabe von Tropfen konzentrierter Salzsäure auf ~ 5,0 nachjustiert. Die unteren q e - Werte (Abbildung 4a), und folglich ist die konservativere Ni Adsorption Schätzung des pH-eingestellte Lösung kann somit sein obtained.
Die hierin beschriebenen Techniken haben das Potential zur Nutzung anderer Materialien als Quellen von Ca, Al und Si für die Synthese von PCC und Zeolithe angepasst werden. Mögliche andere Materialien als Hochofenschlacke kann der Stahlschlacken, Verbrennungsaschen, Bergbau und Erzaufbereitung Tailings, Bau- und Abbruchabfälle, natürliche Mineralien, usw. Nicht alle dieser Materialien enthalten die gleichen Anteile von Ca, Al und Si als BF Schlacke umfassen (was BF Schlacke besonders attraktiv macht), aber nichtsdestotrotz können sie immer noch verwendet werden PCC zu erzeugen, Zeolithen oder anderen mineralischen stammenden Produkten (beispielsweise Aggregate 45 oder puzzolanischen Materialien) durch ähnliche Verarbeitungstechniken (eine Kombination von Extraktion, Niederschlag und / oder chemische Umwandlung). Auch sind die Zeolithmaterialien von BF Schlacke oder anderen Mineralien hergestellt werden, sollten für andere Abwasser oder Sanierungs Anwendungen getestet werden, da sie wahrscheinlich haben Adsorption Kapazität für andere Schwermetalle, wie Cd, Pb, Zn und 46. Economics (der Bedarf an neuem Material im Vergleich zur Vermeidung von Entsorgungsgebühren für Abfallstoffe, oder die finanzielle Rendite auf die Nutzung der Produkte für höher- oder niedriger Wertanwendungen zu bezahlen) sollte eine Rolle bei der Identifizierung eines geeigneten Mineral Beschickung spielen. Substitution anderer Prozesseingänge (Essigsäure, Natriumhydroxid und konzentriertem CO 2) von weniger kostspielig oder leichter erzielbare Alternativen sollten auch die Verarbeitungskosten zu verbessern , werden in Betracht gezogen.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir erkennen die Unterstützung der Forschung durch das Laborpersonal des Sheridan Chemical Environmental Laboratories zur Verfügung gestellt, insbesondere Jaspreet Chandla, Nausheen Zehra, Mike Ovas, Erin Sutton, und Daniel Liao. EG ist auch dankbar Deans Terry Davison und Dave Wäckerlin zum Associate für ihn bei Sheridan Hosting. Die finanzielle Unterstützung von Terry Davison und Dr. Iain McNab, Dekan der Fakultät für Angewandte Wissenschaft und Technologie an Sheridan, wird auch geschätzt. ATS Scientific Inc., Quantachrome Instruments, und Malvern Instruments waren bei der Unterstützung der mit Stickstoff-Adsorptions- und Partikelgröße analysiert gnädig.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid (CH3COOH) | Caledon Laboratories | 1000-1-29 | Glacial (≥99.7%). |
| Autoclave reactor | Parr | 4525-T-HC-M(HC) | One liter volume, equipped with dual turbine impeller, baffle and electric heating jacket. |
| Blast Furnace (BF) slag | ArcelorMittal | - | Granulated BF Slag from Ghent (Belgium); Pelletized BF Slag from Hamilton (Canada). |
| Carbon dioxide (CO2) | Praxair | TBC | Industrial grade (99.5%). |
| Centrifugal Mill | Retsch | ZM100 | 0.50 mm sieve. |
| Centrifuge | Thermo Electron | IEC CL30 | To separate solids from liquids. |
| Ecoclave reactor | Büchi | Type 3E | One liter volume, equipped with turbine impeller, baffle and electric heating jacket. |
| Filter paper | Fisher Scientific | P8 (09-795F) | Porosity: coarse; flow rate: fast. |
| Hydrochloric acid (HCl) | Caledon Laboratories | 6025-1-29 | Reagent grade (36.5%-38.0%). |
| Incubator | New Brunswick Scientific | I 24 | Orbital shaker with temperature control. |
| Inductively Coupled Plasma Mass Spectrometer (ICP-MS) | Thermo Electron | X Series | To determine the concentration of Al, Ca, Mg and Si in the post-extraction leachates and post-carbonation liquid medium. |
| Inductively Coupled Plasma Optical Emissions Spectrometer (ICP-OES) | PerkinElmer | Optima 8300 | To determine the concentration of Ni in the post-centrifuged equilibrated adsorbent-adsorbated leachate. |
| Laser Diffraction Analysis (LDA) | Malvern | Mastersizer 3000 | To measure the average particle size diameter and particle size distribution (PSD) of the solids. |
| Microbalance | Sartorius | Quintix224-S1 | Four decimals. |
| Ni standard solution | Perkin Elmer | N9300136 | Concentration of 1,000 mg/1,000 mL. |
| Nitric acid (HNO3) | Caledon Laboratories | 7525-1-29 | Reagent grade (68.0%-70.0%). |
| Oven | Fisher Scientific | Isotemp oven | 105°C. |
| pH meter | Fisher Scientific | AB15 | Calibrated with standard solutions before each set of measurements; temperature corrected to 25 °C. |
| Sodium hydroxide (NaOH) | Caledon Laboratories | 7871-6-42 | Reagent grade (50% W/W). |
| X-ray Diffraction (XRD) | Rigaku | MiniFlex 600 | To characterize mineralogical properties of adsorbant solids. |
| X-ray Fluorescence (XRF) | PANalytical | Zetium | To characterize chemical composition of solids. |
| Nitrogen Adsorption | Quantachrome | NOVAtouch | To characterize specific surface area, pore volume and mean pore diameter of solids. |
Referenzen
- Stolaroff, J. K., Lowry, G. V., Keith, D. W. Using CaO- and MgO-rich industrial waste streams for carbon sequestration. Energ. Convers. Manage. 46, 687-699 (2004).
- Bobicki, E. R., Liu, Q., Xu, Z., Zeng, H. Carbon capture and storage using alkaline industrial wastes. Prog. Energy Combust. Sci. 38, 302-320 (2011).
- Sanna, A., Dri, M., Hall, M. R., Maroto-Valer, M. Waste materials for carbon capture and storage by mineralisation (CCSM) - A UK perspective. Appl. Energy. 99, 545-554 (2012).
- Bodor, M., Santos, R. M., Van Gerven, T., Vlad, M. Recent developments and perspectives on the treatment of industrial wastes by mineral carbonation - A review. Cent. Eur. J. Eng. 3 (4), 566-584 (2013).
- Chiang, Y. W., Santos, R. M., Elsen, J., Meesschaert, B., Martens, J. A., Van Gerven, T. Towards zero-waste mineral carbon sequestration via two-way valorization of ironmaking slag. Chem. Eng. J. 249, 260-269 (2014).
- De Crom, K., Chiang, Y. W., Van Gerven, T., Santos, R. M. Purification of slag-derived leachate and selective carbonation for high-quality precipitated calcium carbonate synthesis. Chem. Eng. Res. Des. , 180-190 (2015).
- Teir, S., Eloneva, S., Fogelholm, C. -. J., Zevenhoven, R. Dissolution of steelmaking slags in acetic acid for precipitated calcium carbonate production. Energy. 32 (4), 528-539 (2007).
- Eloneva, S., Teir, S., Salminen, J., Fogelholm, C. -. J., Zevenhoven, R. Fixation of CO2 by carbonating calcium derived from blast furnace slag. Energy. 33 (9), 1461-1467 (2008).
- Sugano, Y., Sahara, R., Murakami, T., Narushima, T., Iguchi, Y., Ouchi, C. Hydrothermal synthesis of zeolite A using blast furnace slag. ISIJ Int. 45, 937-945 (2005).
- Kuwahara, Y., Ohmichi, T., Kamegawa, T., Mori, K., Yamashita, H. A novel conversion process from waste slag: synthesis of a hydrotalcite-like compound and zeolite from blast furnace slag and evaluation of adsorption capacities. J. Mater. Chem. 20, 5052-5062 (2010).
- Murakami, T., Sugano, Y., Narushima, T., Iguchi, Y., Ouchi, C. Recovery of calcium from BF slag and synthesis of zeolite A using its residue. ISIJ Int. 51, 901-905 (2011).
- Davis, R. J. New perspectives on basic zeolites as catalysts and catalyst supports. J. Catal. 216 (1-2), 396-405 (2003).
- Primo, A., Garcia, H. Zeolites as catalysts in oil refining. Chem. Soc. Rev. 43, 7548-7561 (2014).
- Vaiana, R., Iuele, T., Gallelli, V. Warm Mix asphalt with synthetic zeolite: A laboratory study on mixes workability. Int. J. Pavement Res. Technol. 6 (5), 562-569 (2013).
- Handayani, A. T., Setiaji, B. H., Prabandiyani, S. The Use of Natural Zeolite as an Additive in Warm Mix Asphalt with Polymer Modified Asphalt Binder. Int. J. Eng. Res. Africa. 15, 35-46 (2015).
- Jana, D. A new look to an old pozzolan, clinoptilolite - a promising pozzolan in concrete. , 168-206 (2007).
- Valipour, M., Pargar, F., Shekarchi, M., Khani, S. Comparing a natural pozzolan, zeolite, to metakaolin and silica fume in terms of their effect on the durability characteristics of concrete: A laboratory study. Constr. Build. Mater. 41, 879-888 (2013).
- Tomasevic-Canovic, M. Purification of natural zeolite-clinoptilolite for medical application-Extraction of lead. J. Serb. Chem. Soc. 70 (11), 1335-1345 (2005).
- Andronescu, E., Grigore, F., Tardei, C., Stefan, E. Natural zeolites with medical applications--preliminary preparation and characterization. Rev. Med. Chir. Soc. Med. Nat. Iasi. 110 (1), 236-241 (2006).
- Rhee, P., et al. QuikClot use in trauma for hemorrhage control: case series of 103 documented uses. J. Trauma. 64 (4), 1093-1099 (2008).
- Mumpton, F. A. . Using zeolites in agriculture. Innovative Biological Technologies for Lesser Developed Countries. , (1985).
- Mumpton, F. A. La roca magica. Uses of natural zeolites in agriculture and industry. Proc. Natl. Acad. Sci. U S A. 96 (7), 3463-3470 (1999).
- Ramesh, K., Reddy, D. D., Biswas, A. K., Rao, A. S. Zeolites and Their Potential Uses in Agriculture. Adv. Agron. 113, 215-236 (2011).
- Gholikandi, G. B., Baneshi, M. M., Dehghanifard, E., Salehi, S., Yari, A. R. Natural Zeolites Application as Sustainable Adsorbent for Heavy Metals Removal from Drinking Water. Iran. J. Toxicol. 3, 302-310 (2010).
- Wang, S., Peng, Y. Natural zeolites as effective adsorbents in water and wastewater treatment. Chem. Eng. J. 156 (1), 11-24 (2010).
- Shoumkova, A. Zeolites for water and wastewater treatment: An overview. 2011 Research Bulletin of the Australian Institute of High Energetic Materials. 2, 10-70 (2011).
- Chiang, Y. W., Ghyselbrecht, K., Santos, R. M., Meesschaert, B., Martens, J. A. Synthesis of zeolitic-type adsorbent material from municipal solid waste incinerator bottom ash and its application in heavy metal adsorption. Catal. Today. 190 (1), 23-30 (2012).
- Shevade, S., Ford, R. G. Use of synthetic zeolites for arsenate removal from pollutant water. Water Res. 38 (14-15), 3197-3204 (2004).
- Erdem, E., Karapinar, N., Donat, R. The removal of heavy metal cations by natural zeolites. J. Colloid Interface Sci. 280 (2), 309-314 (2004).
- Ruggieri, F., Marín, V., Gimeno, D., Fernandez-Turiel, J. L., García-Valles, M., Gutierrez, L. Application of zeolitic volcanic rocks for arsenic removal from water. Engin. Geol. 101 (3-4), 245-250 (2008).
- Terdkiatburana, T., Wang, S., Tadé, M. O. Adsorption of heavy metal ions by natural and synthesized zeolites for wastewater treatment. Int. J. Environ. Waste. Manag. 3 (3-4), 327-335 (2009).
- Alexander, G. B., Heston, W. M., Iler, R. K. The solubility of amorphous silica in water. J. Phys. Chem. 58 (6), 453-455 (1954).
- Bingham, E., Cohrssen, B. . Patty's Toxicology. 3, 472 (2012).
- Santos, R. M., Chiang, Y. W., Elsen, J., Van Gerven, T. Distinguishing between carbonate and non-carbonate precipitates from the carbonation of calcium-containing organic acid leachates. Hydrometallurgy. 147-148, 90-94 (2014).
- Bonfils, B., Julcour-Lebigue, C., Guyot, F., Bodénan, F., Chiquet, P., Bourgeois, F. Comprehensive analysis of direct aqueous mineral carbonation using dissolution enhancing organic additives. Int. J. Greenhouse Gas Control. 9, 334-346 (2012).
- Eloneva, S., et al. Reduction of CO2 emissions from steel plants by using steelmaking slags for production of marketable calcium carbonate. Steel Res. Int. 80 (6), 415-421 (2009).
- Santos, R. M., Van Bouwel, J., Vandevelde, E., Mertens, G., Elsen, J., Van Gerven, T. Accelerated mineral carbonation of stainless steel slags for CO2 storage and waste valorization: effect of process parameters on geochemical properties. Int. J. Greenhouse Gas Control. 17, 32-45 (2013).
- Tsutsumi, T., Nishimoto, S., Kameshima, Y., Miyake, M. Hydrothermal preparation of tobermorite from blast furnace slag for Cs+ and Sr2+ sorption. J. Hazard. Mater. 266, 174-181 (2014).
- Komarneni, S. Heavy metal removal from aqueous solutions by tobermorites and zeolites. Nucl. Chem. Waste Manage. 5, 247-250 (1985).
- Rachkova, N. G., Shuktomova, I. I. Sorption of U(VI) and Ra from aqueous solutions with analcime-containing rock. Radiochemistry. 52 (1), 76-80 (2010).
- Hegazy, E. Z., Hamdy, I., Abo El Enin, R. M. M. Preparation and characterization of Ti and V modified analcime from local kaolin. Appl. Clay Sci. 49 (3), 149-155 (2010).
- Chiang, Y. W., et al. Strategic selection of an optimal sorbent mixture for in-situ remediation of heavy metal contaminated sediments: Framework and case. J. Environ. Manage. , 1-11 (2012).
- Santos, R. M., Mertens, G., Salman, M., Cizer, &. #. 2. 1. 4. ;., Van Gerven, T. Comparative study of ageing, heat treatment and accelerated carbonation for stabilization of municipal solid waste incineration bottom ash in view of reducing regulated heavy metal/metalloid leaching. J. Environ. Manage. 128, 807-821 (2013).
- Bodor, M., et al. Laboratory investigation of carbonated BOF slag used as partial replacement of natural aggregate in cement mortars. Cem. Concr. Compos. 65, 55-66 (2016).
- Chiang, Y. W., Santos, R. M., Vanduyfhuys, K., Meesschaert, B., Martens, J. A. Atom-Efficient Route for Converting Incineration Ashes into Heavy Metal Sorbents. Chem. Sus. Chem. 7, 276-283 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten