Method Article
Zwei Algorithmen für den Hochdurchsatz und Multi-parametrischer Quantifizierung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Zwei Bildanalysealgorithmen, „Drosophila NMJ Morphometrie“ und „Drosophila NMJ Bouton Morphometrie“ wurden geschaffen, um automatisch neun morphologischen Merkmale der neuromuskulären Synapse Drosophila zu quantifizieren (NMJ).
Zusammenfassung
Synaptische Morphologie ist eng verbunden mit der synaptischen Wirksamkeit, und in vielen Fällen morphologische Synapse Mängel letztlich zu synaptischen Fehlfunktion führen. Die Drosophila Larven neuromuskulären Synapse (NMJ), ein gut etabliertes Modell für glutamatergen Synapsen, wird seit Jahrzehnten intensiv untersucht. Identifizierung von Mutationen NMJ morphologische Defekte verursachen ergab ein Repertoire von Genen, die Synapse Entwicklung und Funktion reguliert. Viele von ihnen wurden in groß angelegten Studien identifiziert , die auf qualitativen Ansätzen konzentrierten morphologische Anomalien der Drosophila NMJ zu erkennen. Ein Nachteil von qualitativen Analysen ist, dass viele subtilen Spieler NMJ Morphologie unbemerkt bleiben wahrscheinlich bei. Während quantitative Analysen der subtileren morphologischen Unterschiede zu erkennen sind erforderlich, sind solche Analysen noch nicht allgemein durchgeführt, da sie umständlich sind. Dieses Protokoll beschreibt im Detail zwei Bildanalysealgorithmen "Drosophila Morphometrics“und‚Drosophila NMJ Bouton Morphometrics‘, erhältlich als Fidschi-kompatible Makros für quantitative, genaue und objektive morphometrische Analyse des Drosophila NMJ. Diese Methodik NMJ Terminals entwickelt immunomarkiert mit dem üblicherweise verwendeten Marker Dlg-1 zu analysieren und . Brp Zusätzlich seine breitere Anwendung auf andere Marker wie Hrp, Csp und Syt in diesem Protokoll vorgestellt Die Makros können neun morphologische NMJ Merkmale beurteilen. NMJ Bereich, NMJ Umfang, Anzahl der boutons, NMJ Länge, NMJ längste Zweig Länge, Anzahl von Inseln, die Anzahl der Zweige, die Anzahl der Punkte und die Anzahl der aktiven Zonen in der NMJ Terminal Verzweigung.
Einleitung
Kognitive Störungen wie geistige Behinderung, Autismus - Spektrum - Störung und Schizophrenie sind oft durch abnormale synaptische Funktion 1 charakterisiert, 2, 3. Synapse Morphologie und Funktion sind eng miteinander verflochten; morphologische Defekte können synaptischen Störungen und in umgekehrter Richtung, aberrant synaptischen Übertragung 4 synaptischen Reifung und Morphologie wird Auswirkungen verursachen, 5, 6.
Eine Reihe von Modellorganismen wurde , um besser zu verstehen , Synapse Biologie und Aufschluss darüber , wie synaptische Veränderungen beeinflussen die Gehirnfunktion in Gesundheit und Krankheit 7, 8, 9 eingesetzt. Das Drosophila NMJ wird ein umfangreich untersucht und gut etabliertes in vivo - Modell für glutamaterge synapse biology 10, 11. In den vergangenen Jahrzehnten hat sich dieses Modell für physiologische und Gen-Studien konzentrierten sich sowie für große genetische Screens, mit dem Ziel eingesetzt morphologischen Unterschiede zwischen NMJs zu erkennen. Insbesondere haben vorwärts genetischen Screens viele wichtige Regulatoren und Mechanismen , die Synapse Entwicklung identifiziert und Funktion 12, 13, 14, 15, 16. die meisten dieser Bildschirme jedoch verließ sich auf die visuelle Beurteilung von NMJ Terminal Morphologie und qualitativen Nachweis der synaptischen Abnormalitäten oder semi-quantitative scoring von wenigen morphologischen Eigenschaften. Als Konsequenz eher subtile synaptischen morphologische Anomalien, die nicht offensichtlich für das menschliche Auge sind, sind leicht zu übersehen. Um umfassend zu können quantitative Unterschiede erkennen, dieNMJ hat genau durch systematische Quantifizierung der morphologischen Parameter von Interesse zu bewerten. NMJ Merkmale Messung manuell ist umständlich, insbesondere, wenn es mehr NMJ Merkmale von Interesse und / oder bei großen genetischen Screenings durchgeführt wird. Um multiparametrischer, Hochdurchsatz - morphologische Analyse zu unterstützen und objektive Quantifizierung zu erreichen, zwei Makros „Drosophila NMJ Morphometrics“ und „Drosophila NMJ Bouton Morphometrics“ wurden 17 entwickelt. Beiden Makros ausführen , in der Open - Source - Bildanalyse - Software Fiji 18 und können sowohl konfokale und nichtkonfokalen Bilder quantifizieren.
„Drosophila NMJ Morphometrie“ misst NMJ Terminals mit der postsynaptischen Spuranreißerscheibe immunhistochemisch groß-1 (HLG-1) oder der präsynaptischen Meerrettich - Peroxidase (HRP), mit dem aktiven Zonen - Markierungs - Bruchpiloten (BRP) co-markiert. Sie quantifiziert neun morphologische parameters (weiter unten beschrieben): NMJ Bereich, NMJ Umfang, Anzahl boutons, NMJ Länge NMJ längste Zweiglänge, Anzahl der Inseln, die Anzahl der Zweige, die Anzahl der Verzweigungspunkte und die Anzahl der aktiven Zonen in dem synaptischen Terminal (Abbildung 1) . Obwohl ein Algorithmus die Anzahl der boutons zur Bestimmung in diesem Makro vorhanden ist, es entsprach nicht die Kriterien für die Richtigkeit 17. Um richtig die Anzahl der boutons beurteilen zu können , ist es notwendig , die „Drosophila NMJ Bouton Morphometrics“ Makro zu verwenden, die speziell entwickelt wurde , Boutons mit NMJ Präparate immunhistochemisch durch anti-Synaptotagmin (Syt) oder anti-Cystein - String - Protein (CSP) zu quantifizieren, und Co-immunomarkiert mit Brp. Die „Drosophila NMJ Bouton Morphometrie“ Makro quantifiziert die folgenden Parameter: Anzahl der boutons, NMJ bouton Bereich, NMJ Länge NMJ längste Zweiglänge, Anzahl der Inseln, die Anzahl der Zweige, die Anzahl der Verzweigungspunkte und die Anzahl der aktiven zones (Abbildung 2).
Das Makros besteht aus 3 Unter Makros: (I) identifiziert alle Dateien Bild „zu stapeln Convert“ und erzeugt Z-hyperstacks und Maximumintensitätsprojektion der beiden Kanäle. Als Ausgabe wird dieser Makro zwei neue Dateien pro Synapse erzeugen „stack_image_name“ und „flatstack_image_name“ genannt. II) „Define ROI“ öffnet alle maximalen Projektionsbilder „flatstack_image_name“ nacheinander und präsentieren sie mit der Anforderung , um manuell den interessierenden Bereich (ROI zu definieren) , in dem der spezifischen synaptischen Terminal von Interesse vorhanden ist. Dies wurde Ausschluß von Synapsen Verbinden mit benachbarten Muskeln und / oder anderen Arten von synaptischen Terminals (wie 1 s) zu ermöglichen , implementiert , die in den Bildern 11 vorhanden sein können. (III) „Analyse“ trifft völlig automatisierte Analyse auf alle Regionen der Bilder innerhalb der Grenzen der ROI. Wieein Ergebnis dieses Schrittes wird der Benutzer zwei neue Dateien erhalten: „results.txt“, wo die alles numerische Messung kommentiert werden wird und ein „res_image_name.tif“, wo das darunter liegende Bild Segmentierungen durch das Makro erzeugt wird erläutert. Während der Bildanalyse werden drei Strukturen von jedem synaptischen Terminal abgeleitet: der NMJ Umrisses, der NMJ Skeletts, und die Anzahl der BRP-positiven aktiven Zonen. Die NMJ outline wird verwendet, um den NMJ Bereich und seinen Umfang und eine anschließende Wende Trennung stellt die Anzahl der boutons zu bestimmen. Aus dem Skelett, fünf NMJ Merkmale abgeleitet werden: die Gesamt NMJ Länge, wobei die Summe der Länge der längsten kontinuierlichen Pfad alle zwei Endpunkte (längste Astlänge), die Anzahl der nicht verbundenen Kammern pro NMJ Verbindungs (bezeichnet als „Inseln“ die Anzahl der Verzweigungen und die Anzahl der Verzweigungspunkte), (ein Verzweigungspunkt verbindet, drei oder mehr Verzweigungen). Die Anzahl der aktiven Zonen in der BRP-Kanals bestimmt durch ZählenBRP-positive Flecken. Die kommentierte NMJ outline (gelbe Linie), die NMJ Skeletts (blaue Linie), und die Anzahl der BRP-positiven aktiven Zonen (durch weiße Foci angegeben) werden in einem Ergebnisbild angezeigt, und die Messungen der Parameter werden einem verarbeitet (. txt) Ausgabedatei (Abbildung 3).
Drosophila NMJ Morphometrie“und‚Drosophila NMJ Bouton Morphometrie‘wurden zuerst von Nijhof et al beschrieben und ausführlich validiert. 17. Diese Handschrift konzentriert sich auf die Methodik NMJ Morphologie mit den Makros zu analysieren‚Drosophila NMJ Morphometrie‘und‚Drosophila NMJ Bouton Morphometrie‘. Trotzdem vor der Makro-assisted Analysen müssen NMJ Dissektionen und Immunfärbungen durchgeführt werden. Diese entscheidenden Schritte sind, und die Kombination von Markern für die Immunhistochemie verwendet wird, muss geeignet für Makroanalysen werden. Diese Schritte werden kurz erwähnt in section 1 dieses Protokolls und leiten den Benutzer auf Referenzen im Detail beschreibt die Protokolle, diese Verfahren auszuführen.
Protokoll
1. Voraussetzungen Vor der Bildverarbeitung
- Führen Drosophila offenes Buch Zubereitungen dritten Häutungsstadium wandernden Larven (L3), wie zuvor 19 beschrieben.
- Co-immunolabel Klemmen Drosophila NMJ eine Kombination von zwei Markern: HLG-1 oder Hrp zusammen mit Brp zur Analyse mit „Drosophila NMJ Morphometrie“ und Syt Csp oder zusammen mit Brp zur Analyse mit „Drosophila NMJ Bouton Morphometrie“ 20.
HINWEIS: Antikörper aus der gleichen Spezies kann 17 durch prä-Kennzeichnung ein mit einem Antikörper-Konjugation - Kit wie der Zenon Alexa Labeling Kits kombiniert werden. - Bild NMJ Terminals ein Mikroskop der Wahl unter Verwendung beispielsweise Fluoreszenz (mit oder ohne ApoTome) oder konfokaler Mikroskopie.
- Erwerben eines 2-Kanal-Bildstapel des NMJ Terminal.
- Anpassen der Einstellungen des Mikroskops in einer Art und Weise, dass der Kanal 1akquiriert die NMJ Terminal immunomarkiert mit HLG-1 (oder Hrp, Syt, Csp) und Kanal 2 der Klemme NMJ immunomarkiert mit Brp.
- Optional analysiert Einkanal-Bilder (von Synapsen mit einem einzigen Antikörper immun) mit dem Makros. Bild NMJs immunomarkiert einzigartig mit HLG-1 oder Hrp für die Analyse mit „Drosophila NMJ Morphometrie“ oder Syt oder Csp für „Drosophila NMJ Bouton Morphometrie“.
HINWEIS: Es ist nicht möglich Synapsen immunhistochemisch mit nur anti-Brp zu analysieren.
- Exportieren Sie die erhaltenen Bilder als einzelne‘TIFF-Dateien. Kehren Sie die Kanalreihenfolge vor den Makros ausgeführt, wenn nicht wie angegeben erworben.
- Erwerben eines 2-Kanal-Bildstapel des NMJ Terminal.
2. Software Anforderungen und Installation
- Laden Sie sich die Makros: "Drosophila NMJ Morphometrics" und "Drosophila NMJ Bouton Morphometrics" von der folgenden Website: https://figshare.com/s/ec634918c027f62f7f2a 21.
- Bewegen Sie den Cursor in den Ordner „Macros Update 1“, und klicken Sie auf die erscheinende Option „Ansicht“. Eine Liste mit dem Inhalt dieses Ordners wird angezeigt. Der Ordner enthält die Makros "Drosophila NMJ Morphometrics" und "Drosophila NMJ Bouton Morphometrics".
HINWEIS: Die beiden Makros sind kompatibel mit Fiji-Versionen 1.4, die auch im selben Ordner vorgesehen ist. Die Makros können nicht auf den aktuellen Versionen laufen. Bitte verwenden Sie die mitgelieferte Version 1.4. Es ist unproblematisch, diese Version zu starten, auch auf Computer mit einer neueren Fidschi-Version zur Verfügung. - Klicken Sie auf „Download alle“. Der Ordnerinhalt wird auf den Computer als ZIP-Datei heruntergeladen werden. Entpacken Sie die heruntergeladene Datei.
- Kopieren Sie die Drosophila _NMJ_Morphometrics.ijm und Drosophila _NMJ_Bouton Morphometrics.ijm Dateien Fiji.app/plugins/ Verzeichnis. Wenn das Programm neu zu starten, werden die Makros am unteren Rand des Plugins erscheinenDropdown-Menü.
3. Führen Sie Sub-Makro "Convert to stack" Z-Projektionen und Hyperstacks der NMJ Bilder zu erstellen
- Starten Sie die grafische Oberfläche von Plugins in der Werkzeugleiste und wählen Sie „Drosophila NMJ Morphometrics“ im Dropdown - Menü auswählen.
- Definieren Sie die „Unique Datei-String“ Einstellung in der grafischen Oberfläche des Makros.
HINWEIS: Die Mikroskop-Software verwendet eine Identifikationssignatur Ebene und Kanäle zu organisieren, wenn Stapel als einzelne‘TIFF-Dateien zu speichern. Die eingegebene Zeichenfolge eindeutige Datei Einstellung der Signatur von der Software zu der ersten Ebene des ersten Kanals zugewiesen angeben muß (wichtig: niedrigste Ebene, und die Kanalnummer muss angegeben werden). - Wählen Sie nur die Sub-Makro „Konvertieren zu stapeln“ und klicken Sie auf „OK“ und wählen Sie den Ordner, in dem die Bilder befinden. Wenn ein Hauptverzeichnis mit mehreren Unterordnern ausgewählt wird, werden alle einzelnen‘Tiff-Dateien innerhalbdas Hauptverzeichnis und Unterordner die eindeutigen Datei String Kriterien entsprechen, werden bearbeitet.
- Wenn der z-Stapel nur einen Kanal enthält, wählen Sie das Feld „Kanal 1 nur“.
- Beachten Sie, dass zwei neue Dateien pro NMJ Bild, standardmäßig als stack_image_name bezeichnet und flatstack_image_name erscheint. Bewahren Sie nur diese Stapel und flatstack zur weiteren Analyse. Die TIFF-Datei Serie kann an dieser Stelle gestrichen werden, um die erforderlichen Speicherkapazitäten zu minimieren und mögliche Fehlerquellen zu vermeiden.
4. Führen Sie Sub-Makro "Define ROI", um die NMJ-Terminal in der Nähe Delineate
- Starten Sie die grafische Oberfläche von „Drosophila NMJ Morphometrics“.
- Wählen Sie nur das Kontrollkästchen „Define ROI“ und drücken Sie „OK“ und wählen Sie das Hauptverzeichnis, in dem die Bilder dem Titel flatstack_name gespeichert sind, und drücken Sie „Wählen“. Der Teil Makro „Define ROI“ sucht automatisch durch alle Unterordnerinnerhalb des gewählten Hauptverzeichnis.
- Als der erste Vorsprung öffnet, wählen Sie das „Freihand-Auswahl“ Werkzeug in der Werkzeugleiste. Mit der Maus, um eine Auswahl ziehen, die ausschließlich den kompletten NMJ Terminal von Interesse enthält und klicken Sie auf „OK“ im Fenster „Define Terminal“. Das Makro wird mit der nächsten Projektion fortzufahren.
- Umreißen die nächste ROI und wiederholen, bis alle ROIs definiert sind. Die ROI-Bilddatei mit dem Namen „roi_image_name“, wird im selben Verzeichnis wie die zuvor generierten Stapel und Projektionsbilder für jede der bearbeiteten Bilder gespeichert werden. Der Ausgang dieses Unter Makro ist ein binäres Bild des ROI in weiß auf schwarzem Hintergrund.
5. Führen Sie Sub-Makro „Analyse“ zu Quantifizieren NMJ Terminal-Funktionen
- Gehen Sie auf die Symbolleiste, wählen Sie „Plugins“ und Verwendung:
"Drosophila _NMJ_Morphometrics" , wenn Synapsen mit immunmarkierten anti-HLG-1 oder anti-HRP (Kanal 1) Analyse zusammenmit anti-Brp (Kanal 2), oder "Drosophila _NMJ_Bouton_Morphometrics" , wenn Synapsen mit immunmarkierten anti-Syt oder anti-Csp (Kanal 1) zusammen mit Brp (Kanal 2) zu analysieren.- Wenn ein Kanal - Bildstapel zu analysieren sind (der Strukturkanal HLG-1 oder HRP für „Drosophila_ NMJ_Morphometrics“ oder Syt oder Csp für „Drosophila _NMJ__Bouton_Morphometrics“), wählen Sie das Feld „Kanal 1 nur“.
- Passen die Waage auf die entsprechenden Bilder analysiert werden. Wenn ein Pixel in dem Bild zu 2,5 um entspricht, anzuzeigen Maßstab Pixel = 1, Scale-Abstand in & mgr; m = 2,5. Falls beide Einstellungen auf 0 gelassen, die NMJ Fläche, Umfang, Länge und längste Astlänge werden in Anzahl von Pixeln ausgedrückt werden.
- Falls erforderlich, stellen Sie die Standardanalyseeinstellungen des Makros. Führen Sie Anpassungen nur, wenn das Unter Makro „Analyse“ (diesen Abschnitt mit unbefriedigenden Ergebnissen und determined bessere Einstellungen im Abschnitt 6) ausgeführt wurden.
- Wählen Sie die Kontrollkästchen „Analyse“ und „Wait“ und drücken Sie „OK“.
- Wählen Sie das „Warten“ das Kontrollkästchen, wenn die Sub-Makro ausgeführt wird „Analyse“ auf 2-Kanal-Bilder. Andernfalls Fehler beim Zählen aktiven Zone kann aufgrund begrenzter Rechnerkapazitäten auftreten.
- Als neues Fenster „Wählen Sie ein Verzeichnis“ öffnet, wählen Sie das Verzeichnis, in dem die Bilder befinden, und drücken Sie „select“. Das Makro wird alle Bilder im Hauptverzeichnis und ggf. nachfolgende Ordner (: stack_image_name, flatstack_image_name und roi_image_name mit den drei Dateien von der Ausführung des vorherigen Unter Makros) gespeichert analysieren. Die Makroprozesse jedes Bild einzeln und nacheinander. Dies kann mehrere Minuten pro Bildstapel nehmen (abhängig von der Rechnerkapazität).
- Nach dem Ausführen des Makros, beachten Sie, dass eine neue Bilddatei mit dem Namen res_image_name für jede Synapse wird analysiert gespeichert Created im elterlichen Ordner. Die quantitativen Messungen werden als „results.txt“ Datei gespeichert werden.
- Überprüfen Sie alle Ergebnisbilder zu erkennen und Bilder mit Segmentierungsfehler auszuschließen. Mögliche Segmentierungsfehler sind in Tabelle 3 zusammen mit Beratung beschrieben , wie die Einstellungen anzupassen diese zu umgehen. Ergebnisbilder mit einer solchen Segmentierung Fehler werden als Beispiele in Abbildung 4 zur Verfügung gestellt.
HINWEIS: Wenn Sie das Makro mit den Einstellungen in der Benutzeroberfläche beobachteten Standard ausgeführt wird , gibt es eine Genauigkeit von etwa 95% , wenn die Makro Beurteilung wurde im Vergleich zur manuellen Auswertung 17.
6. Stellen Sie die Makro-Einstellungen auf die Bilder
- Wenn mehr als 5% der Bilder Segmentierungsfehler zeigen, erkunden Sie die verschiedene Algorithmen, um die am besten geeigneten Makroeinstellungen für die Bilder zu definieren / wählen.
- Justieren Rollkugelradiuswert
HINWEIS: Der RollkugelradiusFunktion subtrahiert den Hintergrund des Bildes. Diese Funktion ist von entscheidenden Bedeutung, wenn sie mit Bildern erworben auf Fluoreszenzmikroskopen arbeiten und / oder wenn die Bilder haben eine hohes Hintergrundgeräusch. Die Subtraktion des Hintergrunds wird das Auto-Thresholding Schritten des Makros helfen, eine angemessene Segmentierung der NMJ Terminals herzustellen.- Wählen drei NMJ Z-Vorsprünge (flatstack_image_name Bilder, erzeugt durch Unter Makro „Konvertieren zu stapeln“), die von dem Bilddatensatz repräsentativ sind.
- In der Werkzeugleiste, wählen Sie Bild | Farbe | Split-Kanäle. Zwei Bilder geschaffen werden, ein Kanal 1 darstellen und den anderen Kanal 2.
- Behalten nur das Bild 1 gehörenden offenen Kanal, der DLG-1 entspricht, Hrp, Syt oder Csp Immunomarkierung, und entsorgen den BRP-Kanal durch die Bild schließen.
- Führen Sie die Filter "subtrahiert Hintergrund" von "Process" in der Symbolleiste, gefolgt von der Auswahl "Subtract Background ..." im Dropdown-Menü.
- Klicken Sie auf die Vorschau Checkbox im Popup - Fenster und stellen Sie den Rollkugelradius auf den Wert, den Kontrast zwischen der Synapse und Hintergrund wie in der Platte (5A) zu erhöhen.
HINWEIS: Siehe Abbildung 5 zeigt ein Beispiel. In Abbildung 5a, Teile der Synapse zeigen die gleichen Graupegel wie der Hintergrund, wohingegen in Figur 5A ist der ‚Rollkugelradius‘ auf 500 einen starken Kontrast zwischen dem Synapse und dem Hintergrund erzeugt. - Wenn der geeignete Wert für den Rollkugelradius definiert ist, führen sie den „Subtract Hintergrund“ Algorithmus auf den ausgewählten Z-Vorsprüngen mit demselben Kugelrollradiuswert, und speichert (in einem beliebigen Verzeichnis).
HINWEIS: Der Rollkugelradius Wert für 8-Bit-RGB-Bilder oder sollte mindestens so groß ist wie der Radius des größten Objektes in dem Bild, die nicht Teil des Hintergrunds ist. Für 16-Bit- und 32-Bit-Bilder sollte der Radius inv werdenersely proportional zu dem Pixelwertbereich 22.
- Bestimmen Sie die verschiedenen Auto-Schwellenwerte , die verwendet werden
- Öffnen Sie die Z-Projektionen im vorherigen Schritt gespeichert (6.2.6) und Bild auswählen | einstellen | AutoThreshold | Versuchen Sie, alle.
- Als ein binäres schwellenErgebnisBild mit allen verschiedenen Autoschwellen Algorithmen erscheinen wird, den am besten geeigneten Algorithmus für die Bilder bestimmen.
- Wenn später das Makro ausgeführt wird, entsprechend den Schwellenwert in den Makro-Einstellungen ändern.
- Verwenden restriktivere Schwellenwerte wie „RenyiEntrophy“ oder „Momente“, wie die NMJ outline Schwelle und permissive Schwellenwerte wie „Li“ das NMJ Skelett zu bestimmen und „Huang“, um aktive Zonen zu bestimmen. Wenn Bilder sehr scharf mit wenig bis gar keinen Hintergrund verwenden „Huang“ als“NMJ Umriss Schwelle. Ansonsten Teile des Synapse könnten nach der Bildsegmentierung fehlen.
- Siehe Abbildung 5B zeigt ein Beispiel. Geeignete Segmentierung des Synapse ist mit Auto-Schwellen von grünen Kästen hervorgehoben erhalten. Einige Beispiele für geeignete nicht-Schwellenwerte werden von roten Kästen (check Synapsen bei hohen Vergrößerung) hervorgehoben. Im letzteren entweder Teile der Synapse fehlen oder Teile des Hintergrunds sind enthalten. Siehe 23 für weitere Informationen verweisen.
- Bestimmen die maximale Größe der kleinen Teilchen
ANMERKUNG: Diese Funktion wird schließen alle durch den Umriß NMJ detektierten Partikel Schwelle und Skeleton Schwelle, die von der Analyse in der „kleine Einstellung particles“ kleiner als der definierte Wert sind. Dieser Wert wird in Pixeln definiert. Diese Funktion dient als ein Rauschfilter und ist sehr nützlich, wenn hohe Raten des nicht-einheitlichen Hintergrunds (wie Kristalle / Staub) in den erhaltenen Bildern vorhanden sind.- Öffnen Sie die Z-Projektionen gespeichert in Schritt 6.2.6. und setzendie Skala Anzahl der Pixel zu erkennen, über Analyse | Set-Skala. Gelten die folgenden Einstellungen: Abstand in Pixel = 1, bekannten Abstand = 1, Pixel-Seitenverhältnis = 1 Längeneinheit = Pixel und "OK" drücken. Klicken Sie auf das „Oval Auswahl“ Werkzeug in der Werkzeugleiste.
- Mit ziehen Sie die Maus eine Auswahl eng umgibt einzelne Partikel, die in der Immunfärbung vorhanden sind, aber gehören nicht zu dem NMJ. Drücken Sie Strg + m für einen Windows-Benutzer oder cmd + m für Mac-Anwender. Ein Ergebnisfenster wird geöffnet, die den Bereich der ausgewählten Teilchen in Anzahl von Pixeln.
- Wiederholen des vorherigen Schritt mehrmals mit mehreren Artefakte in den Bildern, den größten kontaminierende Partikel / Artefakts Bereich zu bestimmen. Dies wird der Wert in der Einstellung zu setzen, wenn später das Makro ausgeführt wird. Beim Ausführen des Makros die „Small Particles Größe“, wie die kleinste Partikelgröße beobachtet Eiter eine Marge von 25% festgelegt.
- Siehe Abbildung 5D für ein Beispiel. Der größte Kristall erkennened hat eine Fläche von 112 Pixeln. 150 - Die „Kleiner Partikel Größe“ Einstellung, bei der Verarbeitung dieses Bildes mit dem Makro, soll bis 125 eingestellt werden.
- Bestimmen Mindest Bouton Größe
ANMERKUNG: Diese Funktion wird alle von der boutons NMJ outline Schwelle detektiert auszuschließen, die sich aus der Analyse der kleiner als der definierte Wert sind. Dieser Wert wird in Pixeln definiert.- Folgen die gleichen Schritte wie in Abschnitt 6.4 beschrieben, aber in diesem Fall ist eine Auswahl ziehen Klemme umgibt die kleinsten boutons in der NMJ. Wählen Sie die kleinste Fläche bis ins kleinste bouton der gemessenen diejenigen entsprechen. Dies ist der Wert der minimalen bouton Größeneinstellung zu setzen, wenn später das Makro ausgeführt wird.
- Definieren Sie „finden Maxima Rauschtoleranz“ Wert
- Verwenden Sie die Z-hyperstacks in Abschnitt 6.2.1 ausgewählt.
- In der Werkzeugleiste, wählen Sie Bild | Farbe | Split-Kanäle CreaTE2 Stapel (für Kanal 1 und Kanal 2) und das Bild offen halten zu dem BRP Kanal entsprechen. Verwerfen Sie den anderen Kanal Bild, um es durch das Schließen.
- Gehen Sie auf die Registerkarte Plug-ins in dem Popup-Menü wählen Sie Prozess | Maximum (3D), und wenn die maximum_image_name erscheint (was einige Minuten dauern kann), schließen Sie die Original-Bildstapel.
- Wählen Sie das Maximum ... image_name (das erhaltene Bildstapel) und wählen Sie Plugins | Prozess | Minimum (3D), schließen Sie das Maximum ... image_name Stack.
- In der Symbolleiste wählen Sie Bearbeiten | Finden maxima .... Ein neues Fenster „Find maxima ...“ wird geöffnet. Klicken Sie das Kontrollkästchen „Vorschau Punktauswahl ...“ und füllen Sie die „Rauschtoleranz“ -Box mit dem Makro Standard 50. Die Maxima Punkte Einstellung wird in dem Bild als kleine Kreuze angedeutet werden.
- Erhöhen Sie den „Rauschtoleranz“ Wert , wenn ein Überschuß von kommentierten aktiven Zonen beobachtet, dh Kreuze , die nicht auf der Oberseite der aktiven Zonen sind, die inkonzentrieren sich auf die gewählte Stapelebene, oder falsch aktiven Zonen, die im Hintergrund erkannt werden.
- Auf der anderen Seite, wenn nicht vollständig aktive Zonen kommentierten Beobachtung dh aktive Zonen im Fokus nicht markierte erkannt wird, verringert den „Rauschtoleranz“ -Wert. Halten Sie unterschiedliche Werte versuchen, nach dieser Prozedur, bis die Kreuze entsprechend aktiven Zonen im Fokus Beschriftung sind. Füllen Sie die „Finden Maxima Rauschtoleranz“ mit diesem Wert.
- Siehe Abbildung 5C für ein Beispiel. Zu viele aktive Zonen detektiert. In 5C‘nur die aktiven Zonen in Fokus erfaßt.
- Erhöhen Sie den „Rauschtoleranz“ Wert , wenn ein Überschuß von kommentierten aktiven Zonen beobachtet, dh Kreuze , die nicht auf der Oberseite der aktiven Zonen sind, die inkonzentrieren sich auf die gewählte Stapelebene, oder falsch aktiven Zonen, die im Hintergrund erkannt werden.
- Führen Sie die Sub-Makro „Analyze“ für die repräsentativen Bilder in Schritt ausgewählt 5.1, mit den definierten Einstellungen in den allen vorherigen Schritten.
- Justieren BRP-puncta unteren und oberen Schwellen
- Beachten Sie, dass eine neue Datei nach sehen sein wird die m laufenacro nach 6.6, genannt 2_active_zone_stack_image_name Schritt. In diesem Bildstapel, die die aktiven Zonen durch die „Find Maxima“ Funktion erkannt werden durch weißen Punkte in jeder Ebene angedeutet ist.
- Öffnen Sie diese Datei, indem Sie es in der Symbolleiste und wählen Sie Bild fallen | Stack | Zproject | Projektionstyp = Summe Scheiben schneiden. Eine Projektion des 2_active_zone_stack_image_name wird erhalten.
- Bild auswählen | einstellen | Schwelle. Ein neues Fenster „Threshold“ wird geöffnet. Schieben der oberen Leiste um einen Schwellenwert zu wählen, wo alle gewünschten Brennpunkten / BRP-positive Flecken werden in rot sichtbar gemacht.
HINWEIS: Wenn der Schwellenwert zu niedrig eingestellt ist, wird ein Überschuss an aktiven Zonen gezählt. Wenn zu hoch eingestellt ist, wird ein Teil der aktiven Zonen fehlen.- Siehe Abbildung 5E für ein Beispiel. Als Schwellenwert auf 400 gesetzt ist, werden die meisten der aktiven Zonen (symbolisiert als 1 Pixel Foci) nicht in der Segmentierung enthalten, da sie in rot nicht hervorgehoben sind (Abbildung 5E). Wenn Schwelle auf einen Wert von 50 all die aktiven Zonen eingestellt ist , sind rot (5E‘) markiert.
- Definieren diesen Wert als minimale Schwelle. Leave „Obere puncta Schwelle“ auf den Maximalwert.
- Erneutes Ausführen der Submakros „Analyze“ für die repräsentativen Bilder mit den Einstellungen definiert in all den vorherigen Schritten dieses Abschnitts. Kritisch zu bewerten die resultierenden Bilddateien und stellen Sie sicher, dass die Segmentierung richtig gemacht wird. Ist dies nicht der Fall ist , nachstellen die Einstellungen entsprechend der Art der Segmentierungsfehler (Abbildung 4, Tabelle 3).
Ergebnisse
Die Text Ergebnisdatei wird im Hauptverzeichnis angezeigt. Es fasst alle gemessenen Parameter pro Bild. Die Ergebnisse sind mit dem Dateinamen verknüpft und die Parameter werden anschließend in der Reihenfolge , angegeben in den Tabellen 1 und 2 zusammengefasst.
Res_image_name ist ein Drei-Bildstapel. Das erste Bild zeigt den Umriss und Skelett des Terminals NMJ durch das Makro bestimmt basierend auf Kanal 1 (Immunomarkierung HLG-1, Hrp, Syt oder Csp). Das zweite Bild ist eine Kopie des ersten Bildes und zeigt zusätzlich die identifizierten BRP-positive Flecken, die im Kanal 2 als schematisiert Foci erkannt. Das dritte Bild liefert den maximalen Vorsprung des zweiten Kanals zusammen mit identifizierten BRP-positiver Foci.
Die NMJ Umriss Schwelle wird in gelb in der Makroausgabeergebnisbild dargestellt. NMJ Bereich, perimeter und Anzahl der boutons sind von dieser Schwelle abgeleitet.
Die NMJ Skelett Schwelle wird in blau in der Makroausgabeergebnisbild dargestellt. NMJ Länge, am längsten Zweiglänge, Anzahl der Zweige, Verzweigungspunkte und die Inseln werden aus dieser Schwelle abgeleitet.
Die aktiven Zonen NMJ Schwelle ist nicht im Makroausgabeergebnisbild dargestellt. Diese Schwelle bestimmt den Bereich, in dem die BRP-positive Foci möglicherweise durch das Makro begegnet werden könnte. Es soll eine NMJ Fläche schaffen, die etwas größer als die von der NMJ Umrisse Schwelle definiert ist. Wenn ein zu restriktiv Schwellenwert ausgewählt wird, BRP-positive Foci am Rande des Synapse angeordnet ist, kann ausgeschlossen werden. Wenn der Schwellenwert zu permissiv ist, kann Hintergrundrauschen als BRP-positive Flecken (- 2 Figuren 1) gezählt werden.
Um Validate die Leistung der „Drosophila NMJ Morphometrics“ Makro-, drei mutierten Bedingungen , die bereits beschrieben wurden synaptische Defekte in verschiedenen NMJ Parameter präsentieren getestet. Jeder Defekt wurde durch ein unterschiedliches Bildsegmentierungsverfahren durch das Makro (NMJ outline, Skelett oder aktive Zonen bzw. 17) durchgeführt wird detektiert. Nach Targeting die drei Genen von Interesse durch induzierbare RNAi und Durchführung Dissektionen und NMJ Immunfärbung von L3-Larven wurde das Makro. Die erhaltenen NMJ morphologischen Messungen wurden dann paarweise (RNAi gegenüber ihrer Kontrolle) verglichen, um einen t-Test. In allen drei Fällen wurden statistische Unterschiede zwischen Mutanten und Kontrollen zu beeinflussen Parameter gefunden, die mit den zuvor berichteten morphologischen Defekte in Übereinstimmung sind. Dies bestätigt , dass die Makros tatsächlich in der Lage sind, angemessen zuvor beschriebenen Mängel an der Drosophila NMJ zu identifizieren.
Ankyrin 2 (ANK2, CG42734) Mutanten sind bekannt synaptischen Morphologie Defekte zeigen, einschließlich kondensierter boutons und kleinere NMJs. Diese Defekte wurden für ANK2 Mutanten beobachtet 24, 25 und ANK2 Knockdown fliegt 26. NMJ Klemmen von pan-neuronalen Ank2- RNAi Knockdown Fliegen (w; UAS-Dicer-2 / UAS-ANK2 RNAi KK107238; elav-Gal4 / +) zeigte deutlich kleiner NMJ Bereich (Mittelwert = 339,25 & mgr; m 2; t-Test p = 2,18 x 10 -8) und Umfang (Mittelwert = 238.24 & mgr; m; t-Test p = 1,82 x 10 -3), verglichen mit dem genetischen Hintergrund Steuerdatensatz (w; UAS-Dicer-2 / UAS-KK60100; elav-Gal4 / + () mean = 451,95 & mgr; m 2 und Mittelwert = 288,62 & mgr; m jeweils) nach der "Drosophila NMJ Morphometrie" (Figuren 6A und 4B ausgeführt wird ).
Die GTPase Rab3 (CG7576) ist für die richtige Verteilung und Bruchpilot die RUP - Mutante stellt sich mit einer deutlich verringerten Anzahl von aktiven Zonen 27 erforderlich. Eine signifikante Abnahme in der Zahl der aktiven Zonen beobachtet , wenn BRP-positive Foci durch die "Drosophila NMJ Morphometrie" Makro Messung in NMJ Klemmen von pan-neuronalen Rab3 Knockdown Fliege (w; UAS-Dicer-2 / UAS-RNAi KK100787; elav -Gal4). Die durchschnittliche Anzahl der aktiven Zonen pro NMJ Terminal in Rab3 -RNAi betrug 138 , im Gegensatz zu 290 in dem Steuerdatensatz erfaßt wird (/ +) t-Test p = 4,43 x 10 -29) (Figuren 6A und 4C).
Hochseil (HIW, CG32592) ist ein wichtiger Regulator der NMJ Wachstum; Mutationen in HIW Gen führen zu überwuchern und erweiterten 28 der Klemmen NMJ Verzweigung. Messen NMJ Klemmen von pan-neuronalen Hiw -RNAi Knockdown Linie (w; UAS-Dicer-2 / UAS-RNAi-GD36085; elav-Gal4 / +) mit "Drosophila NMJ Morphometrie", signifikante Unterschiede in den skelett abgeleiteten Parameter beobachtet: Länge (Mittelwert = 147.36 & mgr; m; Kontrolle Mittelwert = 122,07 & mgr; m; t -test p = 7,31 x 10 -7), am längsten Astlänge (Mittelwert = 122.19 & mgr; m; Kontrolle Mittelwert = 105.65 & mgr; m; t-Test p = 4,62 x 10 -4) Zahl der Verzweigungen (Mittelwert = 7,69, Kontrolle Mittelwert = 5,74; t-test p = 2,52 x 10 -2) und die Anzahl der Verzweigungspunkte (Mittelwert = 2,73, Kontrolle Mittelwert = 1,79; t-Test p = 3,31 x 10 -2). All diese Parameter waren signifikant erhöht (von 120 bis 180%) im Vergleich zu den genetischen Hintergrund Kontrollen (w; UAS-Dicer-2 / UAS-GD60000; elav-Gal4 / +) (6A & 4D).
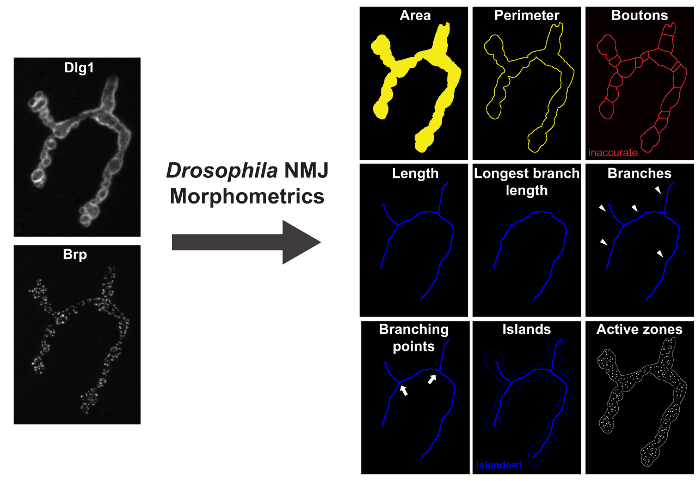
Abbildung 1: Drosophila _NMJ_Morphometrics Maßnahmen 9 Parameter des Drosophila NMJ. Auf der linken Seite sind HLG-1 und BRP-immunomarkiert NMJ Terminals, auf einem Fluoreszenzmikroskop mit ApoTome abgebildet. Auf der rechten Seite sind Ergebnisbilder nach „Drosophila NMJ Morphometrics“ läuft. Parameter Fläche, Umfang und boutons werden durch die Makro kommentierten gelben Umriss angedeutet dargestellt. Parameter Länge, längste Astlänge (LBL), Äste, Verzweigungspunkte und Inseln werden von der Makro kommentierten blau umrandet dargestellt. BRP-immunomarkiert Foci (aktive Zonen) wird durch das Makro als weißen Flecke in den Ergebnisbildern dargestellt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 2: Drosophila NMJ Bouton Morphometrie misst 8 Parameter des Drosophila NMJ. Auf der Linkensind Syt-1 und Brp NMJ Terminal immunomarkiert, auf einem Fluoreszenzmikroskop mit ApoTome abgebildet. Auf der rechten Seite sind Ergebnisbilder nach „Drosophila NMJ Bouton Morphometrics“ läuft. Parameter Boutons und bouton Bereich werden durch die Makro kommentierten gelben Umriss dargestellt. Parameter Länge, längste Astlänge (LBL), Äste, Verzweigungspunkte und Inseln werden von der Makro kommentierten blau umrandet dargestellt. BRP-immunomarkiert Foci (aktive Zonen) wird durch das Makro als weißen Flecke in den Ergebnisbildern dargestellt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
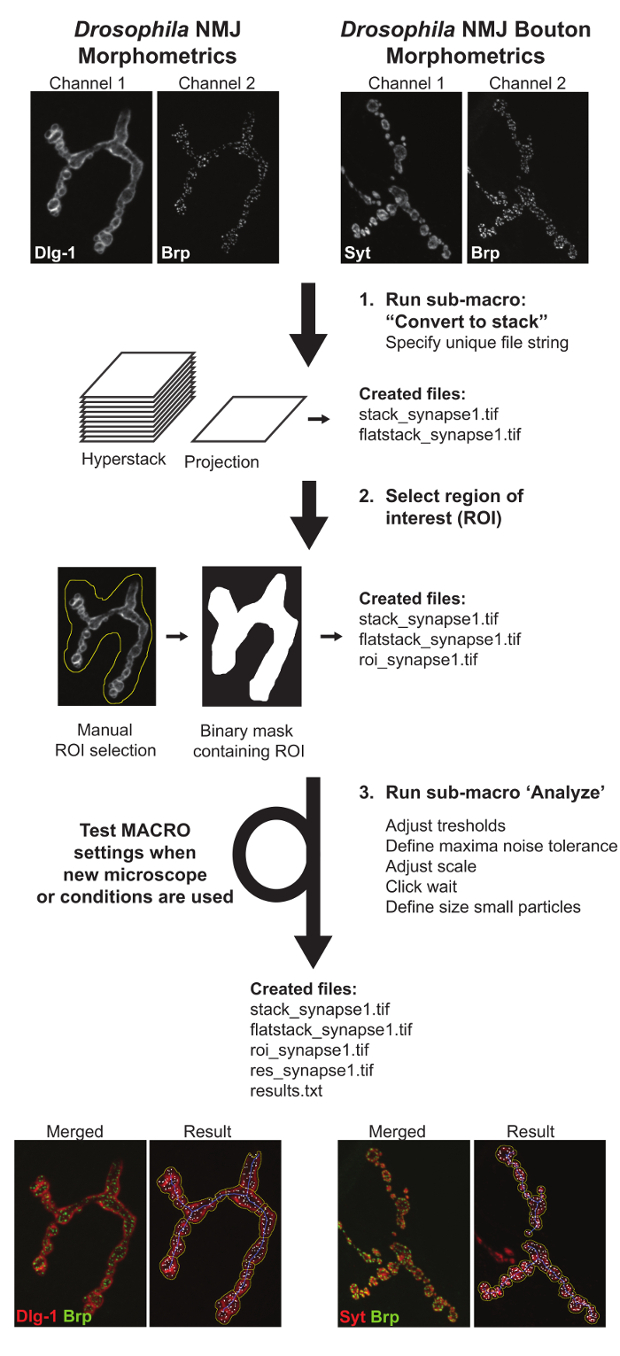
Abbildung 3: Ablaufdiagramm , das Drosophila NMJ Morphometrie und Drosophila NMJ Bouton Morphometrie Macros. Die erste Unter Makro „Convert to stack“erzeugt Projektionen und hyperstacks der abgebildeten NMJs. Die zweite Unter Makro‚Define ROI‘erfordert eine manuelle Eingabe der Position des NMJ Terminal von Interesse definieren. Submakros drei,‚Analyse‘, Maßnahmen alle NMJ Parametern. Ein Text Datei , die die quantitativen Werte und eine Ergebnisbilddatei der Darstellung der Parameter Abgrenzung enthalten, erstellt der Benutzer-Bewertung der Makro - Leistung zu unterstützen. Wenn Bilder unter verschiedenen Bedingungen erworben werden, die Makro - Einstellungen getestet werden müssen und angepasst genaue Analyse zu gewährleisten. Bitte klicken Sie hier eine größere Version dieser Figur zu sehen.
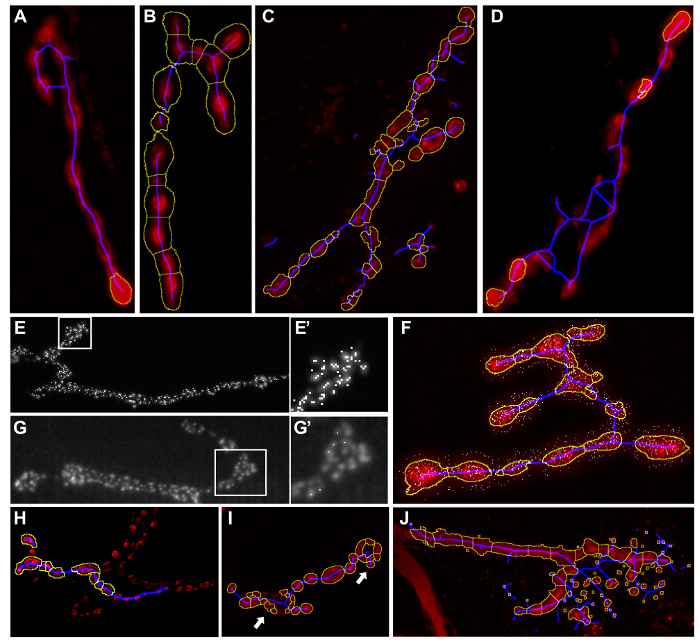
Abbildung 4: Beispiele für Unangemessen Makrosegmentierungsergebnisse. Ergebnisbilder nach "Drosophila NMJ Morphometr läuftics“oder‚Drosophila NMJ Bouton Morphometrie‘. Teile des synaptischen Terminal nicht in der gelben Umriss (A) enthalten. Teile des Hintergrunds im synaptischen Terminal durch den gelben outline (B). Blau Skelettlinie erstreckt sich über die enthalten synaptischen Terminal. (C - D) Zu viele aktiven Zonen detektiert werden (E - E '). Einige aktiven Zonen , die durch die Analyse unentdeckt bleiben (G - G').. aktive Zonen außerhalb des Synapse (F) Falsche bouton Segmentierung detektiert ( es werden nur anwendbar , wenn Drosophila NMJ Bouton Morphometrics läuft), boutons verpasst (H) oder zu viele boutons werden durch die Segmentierung (I) nachgewiesen. Teilchen mit einem solchen Kristallen oder Staub, der Teil des Hintergrunds sind in der Segmentierung enthalten (J) . Informationen , wie die Einstellungen ändern , um diese Fehler zu vermeiden , sind in Tabelle 3 bereitgestellt . Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
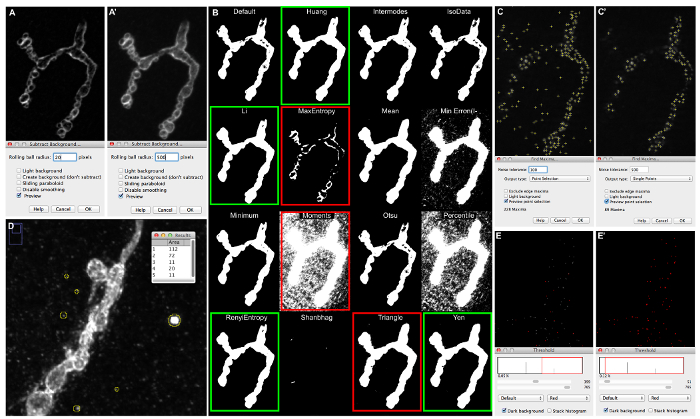
Abbildung 5: Beispiele für Makro-Einstellung Anpassungen und die Folgen für die Bildsegmentierung. (A) Hintergrund Vorschau eines HLG-1 immunomarkiert Synapse subtrahieren, auf einem Fluoreszenzmikroskop abgebildet mit ApoTome, wenn "Rolling Ball Radius" auf 20 gesetzt wird (A) oder 500 (A‘). (B) Ausgangsbilder erhalten nach Bild läuft | einstellen | Auto-Threshold | Versuchen Sie, die alle Bild zeigt Segmentierungen Bild, das durch die 16 verschiedenen Autoschwellenalgorithmen. (C) "Finden Maxima" Vorschau als "Rauschtoleranz" Einrichten bei 50 (C) und 500 (C‘); Active Zonen, die durch die Segmentierung festgestellt werden, werden durch ein kleines Kreuz markiert. (D) Messen des „small particles“ erscheint in dem Bildhintergrund einer Synapse immunomarkiert mit anti-HRP auf einem konfokalen Mikroskop abgebildet wird . (E) "Sum slices" Projektion von der 2_active_zone_stack_ima-ge_name erhalten. Schwelle wird bei 400 (E) und 50 (E‘) eingestellt wird . Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
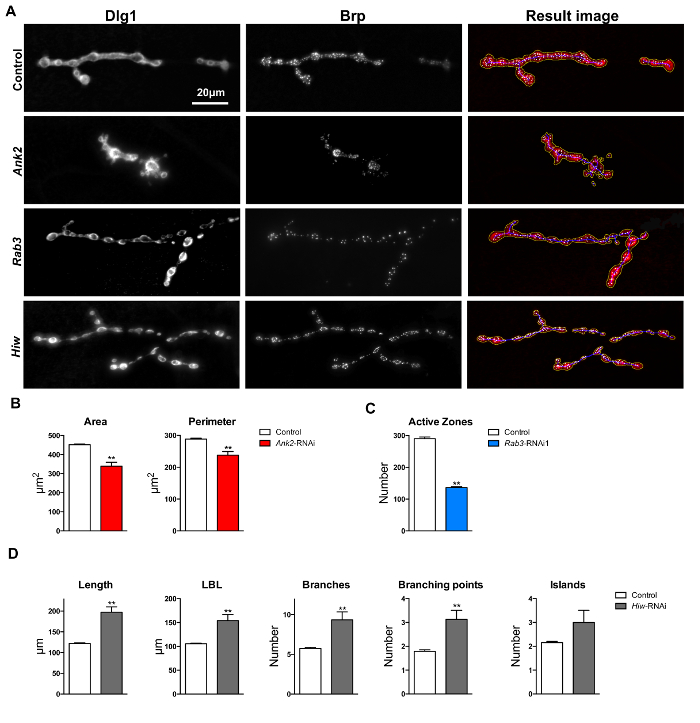
Abbildung 6: Makro Bewertung und Quantifizierung von NMJs auf Muskel 4. (A) Ergebnis Bilder nach "Drosophila NMJ Morphometrics" Makro auf Dlg-1 und Brp läuft immunomarkiert NMJ Terminals. Parameter Fläche, Umfang und boutons werden von der Makro kommentierten gelben Umriss dargestellt. Parameter Länge, längste Astlänge (LBL), Äste, Verzweigungspunkte und Inseln werden von der Makro kommentierten blau umrandet dargestellt. BRP-immunomarkiert Foci (aktive Zonen) wird durch das Makro als weißen Flecke in den Ergebnisbildern dargestellt. Der Skalenbalken zeigt 20 & mgr; m. (B) Ankyrin2 RNAi Knockdown weisen eine kleinere Fläche NMJ und Umfang im Vergleich zu Kontrollen genetischen Hintergrund. (C) Rab3 Knockdown resultierte in NMJs mit einer geringeren Anzahl von BRP-positiven aktiven Zonen gegenüber genetischen Hintergrund Kontrollen. (D) Highwire Zuschlags resultierte in mehr, höher längste Astlänge, stärker verzweigt und mit mehreren Verzweigungspunkten pro NMJ Klemmen im Vergleich zu Kontroll genetischen Hintergrund NMJs. Fehlerbalken zeigen SEM, ** p <0,01, zwei tailed T-Test. Bitte klicken erwieder eine größere Version dieser Figur zu sehen.
| Parameter | NMJ Struktur | Erläuterung |
| Area (um2) | NMJ Umriss | Die Fläche des gesamten markierten NMJ |
| Perimeter (um) | NMJ Umriss | Der Umfang zu dem Bereich gehören, |
| #Boutons | NMJ Umriss | Die Zahl der synaptischen boutons ( ‚Perlen auf einer Schnur‘) des NMJ |
| Länge (um) | Skelett | Die Gesamtlänge des gesamten NMJ Terminal |
| Longest Verzweigungslänge (um) | Skelett | Die Summe der Länge der längsten kontinuierlichen Pfad irgendwelche zwei Endpunkte des Verbindungs NMJ |
| #Astes | Skelett | Die Gesamtzahl der Zweige |
| #Branching Punkte | Skelett | Die Zahl der Verzweigungspunkte (mehrere Zweige können von einem Verzweigungspunkt ableiten) |
| #Islands | Skelett | Die Anzahl der nicht-verbundenen Dlg1-positive synaptischen Abteile (oder eine andere Färbung) |
| #Active Zonen | BRP-positive Spots | Die Anzahl der aktiven Zonen, basierend auf Brp Färbungs |
Tabelle 1: NMJ Gemessene Parameter von "Drosophila NMJ Morphometrics". Die NMJ Parameter gemessen durch die „Drosophila NMJ Morphometrics“ Makro wird als Liste in der erhaltenen Textdatei erscheinen, nach der Reihenfolge in dieser Tabelle beschrieben. Diese Tabelle wird von Nijhof et al nachgedruckt. 17
| Parameter | NMJ Struktur | Erläuterung |
| boutons | NMJ Umriss | Die Zahl der synaptischen boutons ( ‚Perlen auf einer Schnur‘) des NMJ |
| Bouton Bereich | NMJ Umriss | Die Gesamtfläche aller boutons |
| Länge (um) | Skelett | Die Gesamtlänge des gesamten NMJ Terminal |
| Longest Verzweigungslänge (um) | Skelett | Die Summe der Länge der längsten kontinuierlichen Pfad irgendwelche zwei Endpunkte des Verbindungs NMJ |
| #Geäst | Skelett | Die Gesamtzahl der Zweige |
| #Branching Punkte | Skelett | the Anzahl von Punkten Verzweigung (mehrere Zweige können von einem Verzweigungspunkt ableiten) |
| #Islands | Skelett | Die Anzahl der nicht-verbundenen Dlg1-positive synaptischen Abteile (oder eine andere Färbung) |
| #Active Zonen | BRP-positive Spots | Die Anzahl der aktiven Zonen, basierend auf Brp Färbungs |
Tabelle 2: NMJ Gemessene Parameter von "Drosophila NMJ Bouton Morphometrics". Die NMJ Parameter gemessen durch die „Drosophila _Bouton_NMJ_Morphometrics“ Makro wird als Liste in der erhaltenen Textdatei erscheinen, nach der Reihenfolge in dieser Tabelle beschrieben. Diese Tabelle wird von Nijhof et al nachgedruckt. 17
| Segmentierung | Beobachten Fehler | Beispiel | Notwendige Anpassungen | |
| NMJ Fläche und Umfang (Vertreten durch gelben Umriss in Ergebnisbild) | Teile des synaptischen Terminal sind entweder nicht in der gelben Umriss oder Teile des Hintergrundes enthalten sind, in den synaptischen Terminal gelb umrandet enthalten. | 5A-B | Adjust 'Rolling Ball Radius' Wert. Siehe Abschnitt 6.1. | Adjust 'NMJ Umriss Schwelle'. Siehe Abschnitt 6.2. |
| NMJ Länge bezogenen Parameter (dargestellt durch blaue Skelettlinie im Ergebnisbild) | Blaue Skelettlinie erstreckt sich entweder über oder entlang der gesamten synaptischen Terminal nicht vorhanden. | 5C-D | Adjust 'Rolling Ball Radius' Wert. Siehe Abschnitt 6.1. | Adjust 'NMJ Umriss Schwelle'. Siehe Abschnitt 6.2. |
| BRP-positive puncta (durch Punkte in Bild Ergebnisse) | Zu viele aktive Zonen detektiert. | 5E-E‘ | Verringern Sie den ‚Find Maxima Rauschtoleranz‘ Wert. Siehe Abschnitt 6.5. | |
| BRP-positive puncta (durch Punkte in Bild Ergebnisse) | Aktive Zonen werden durch die Analyse verpasst. | 5G-G‘ | Erhöhen Sie die ‚Find Maxima Rauschtoleranz‘ Wert. Siehe Abschnitt 6.5. | Verringern 'BRP-puncta untere Schwelle'. Siehe Abschnitt 6.6. |
| BRP-positive puncta (durch Punkte in Bild Ergebnisse) | Aktive Zone Artefakte sind außerhalb des synaptischen Terminal detektiert. | 5F | Adjust 'Aktive Zone Schwelle' Abschnitt 6.2. | Erhöhen 'BRP-puncta untere Schwelle'. Siehe Abschnitt 6.6. |
| kleine Partikel | Teilchen mit einem solchen Kristallen oder Staub, der Teil des Hintergrunds sind erscheinen in der Segmentierung einbezogen werden. | 5J | Wählen Sie das Feld ‚Entfernen kleinen Teilchen‘. Siehe Abschnitt 6.3. | Bestimmen, kleinen Partikel maximale Größe. Siehe Abschnitt 6.3. |
| Bouton Segmentierung | Falsche bouton Segmentierung (Gilt nur für Drosophila NMJ Bouton Morphometrics; verwenden Drosophila NMJ Morphometrics für bouton Segmentierung nicht). | 5H-I | Adjust 'NMJ Umriss Schwelle'. Siehe Abschnitt 6.1. | Bestimmen Sie ‚Mindest Bouton Größe‘. Siehe Abschnitt 6.4. |
Tabelle 3: Anleitung zur Fehlerbehebung für die verschiedenen Arten von Fehlern in Bildsegmentierung , die durch die Makros erzeugt werden kann. Diese Tabelle beschreibt verschiedene Arten vonBildsegmentierungsfehler, die durch die Makros erzeugt. Diese können leicht in den Ergebnissen Bilder erfasst werden. Beispiele für jeden Fehlertyp sind in Abbildung 4 dargestellt. In dem „Anpassungen Abschnitt“ der Tabelle, die die Einstellungen benötigt, werden eingestellt werden hervorgehoben, und der Benutzer auf den kritischen Teilschritt des Abschnitts bezeichnet 6, die beschreiben, wie diese Einstellungen anzupassen.
Diskussion
"Drosophila NMJ Morphometrics" und "Drosophila NMJ bouton Morphometrics" sind leistungsfähige Werkzeuge für die Forscher interessiert in Synapse Morphologie beurteilen. Manuelle Bewertung der NMJ Parameter ist mühsam; es wird geschätzt, dass die Makros einen erfahrenen Forscher bis zu 15 min sparen würde / NMJ verbrachte auf manuelle Bildsegmentierung. Mit 1.59 Dutzende von ausgewerteten Synapsen pro Zustand oder Genotyp, das summiert sich schnell auf erhebliche Mengen an Zeit gespart, auch in kleinen Studien. Bei großen Bildschirmen durchgeführt wird, die Verstärkung Hochdurchsatzanalyse der Verwendung im Vergleich zur manuellen Bewertung und Quantifizierung kann immens sein. Zusätzlich zu der erhöhten Durchsatz bieten die Makros leicht objektive Analyse; sie schließen persönliche Vorurteile, die sonst geblendet Experimente sowie zwischenmenschliche Unterschiede erfordern, die auftreten, wenn mehrere Forscher bei der Analyse beteiligt sind. Schließlich bieten die Makros eine empfindliche und genaue einalysis von NMJ Funktionen, die Identifizierung von synaptischen Regler ermöglicht, die eher subtil verursachen als dramatische NMJ Defekte und bisher nicht gewürdigt blieb durch das Auge des Forschers. Detaillierte Informationen über Validierungsverfahren und die in den Makros verwendet Algorithmen sind in der Veröffentlichung Nijhof et al. 17.
Die Funktionalität der Makros validiert wurde entsprechend 4. morphologische Merkmale von Drosophila melanogaster NMJs Anschließend an Muskel zu messen, wurde gezeigt , dass die Makros auch geeignet waren Synapsen in anderen Muskeln in diesem Organismus zu analysieren. Es ist wahrscheinlich , dass die Makros können auch mit ähnlicher Struktur in anderer Spezies, einschließlich anderen Drosophila - Spezies und weitere Insekten zu messen morphologische Parameter der NMJ verwendet werden. Auch NMJs sehr weit entfernt in der Evolution, zum Beispiel NMJs von Mäusen, zeigt eine ganz ähnliche strukturelle Konformation 29. Die Makros sind nicht auf NMJ Präparate von anderen Spezies getestet worden, aber potenzielle Nutzer werden die Makros für solche Zwecke zu testen gefördert.
Es ist sehr wichtig, dass der Benutzer den verschiedenen Auto-Schwellenwerte und Algorithmen untersucht, die am besten geeigneten Makroeinstellungen für die Bilder zu definieren / wählen. Mit diesen Einstellungen wird eine Genauigkeit von etwa 95% erreicht, wenn Makro Beurteilung zur manuellen Auswertung verglichen. die Makro-Einstellungen anpassen, um richtig Segment 100% der Bilder kann ein sehr mühsam oder gar unmöglich Verfahren. Daher Ausschluß von Bildern nicht richtig segmentiert wird empfohlen, wenn ihre Zahl unter 5% liegen. Offensichtlich, wenn die Qualität der Bilder niedrig ist, werden die Makros höhere Verhältnisse unbefriedigender Segmentierung erzeugen. Bilder von niedriger Qualität werden in ähnliche Weise manuelle Auswertung beeinflussen und können daher nicht auf die Leistung des Makros verknüpft werden. Dennoch sind die Makros eher robust, wie sie für Bild entworfen wurdenS auf einen hohen Gehalt Mikroskops (ein automatisiertes Fluoreszenz - Mikroskop , das Abbilden von einer großen Anzahl von Proben ermöglicht) 17 erzeugt.
Ein kritischer Punkt ist, dass der Benutzer visuell alle Ergebnisse Bilder von dem Makros erzeugt inspiziert. Dies ermöglicht Bilder mit unbefriedigender Segmentierung zu erkennen und auszuschließen. In Abschnitt 6 dieses Protokolls wird der Benutzer geführt, wie die Einstellungen für eine korrekte Bildsegmentierung einzustellen, wenn der Sub-Makro „Analyze“ ausgeführt wird. Um schnell mit den Anforderungen des Makros vertraut machen und wie die Makro-Einstellungen anpassen ein Ordner namens „Examples_adjusting Makro-Einstellungen“ im Makro-Repository https://figshare.com/s/ec634918c027f62f7f2a enthalten. Dreizehn Unterordner, die jeweils mit den Beispielen Bildern auf verschiedenen Plattformen Mikroskop (high content / konfokalen / Fluoreszenzmikroskope) und verschiedenen Immunfärbungen erhalten, vorgesehen sind. Ein PDF-Titel „Beispiele guide“ ist in den gleichen enthaltenOrdner, in dem die Einstellungen für jedes Beispiel erforderlich sind, zur Verfügung gestellt, zusammen mit einem Textdokument der erwarteten Ergebnisse und die Ergebnisse Bilder bereitstellt.
Die Makros wurden entwickelt, um Bilder gespeichert zu verarbeiten, als TIFF-Dateien getrennt, dennoch einige Nutzer könnten ihre Bilder in einem anderen Format gespeichert haben. Die folgende Website https://figshare.com/s/ec634918c027f62f7f2a 21 enthält einen Ordner mit dem Namen „Drosophila NMJ“ , wo drei Beispieldateien (Beispiel 1 - 3) und das Dokument „Beispiele Guide“ mit detaillierten Anweisungen , wie Sie Bilder in den Makro importieren wenn nicht als .TIFF separierten Dateien gespeichert sind, können auch im gleichen Ordner.
Gemeinsam "Drosophila NMJ Morphometrics" und "Drosophila NMJ bouton Morphometrics" Makros quantifizieren zehn verschiedene NMJ Funktionen: NMJ Bereich, NMJ Umfang, Anzahl der boutons, NMJ bouton Bereich, NMJ Länge, NMJ längste Zweiglänge, Anzahl der islands, die Anzahl der Zweige, die Anzahl der Verzweigungspunkte und die Anzahl der aktiven Zonen. Dies stellt einen großen Vorteil gegenüber bisher verfügbaren Werkzeuge , die 30, 31 nur eine oder wenige synaptischen Funktionen beurteilen können. Multiparametrischer quantitative Analyse trägt ein großes Potenzial für neue Entdeckungen, zum Beispiel neue Regulierer zu identifizieren , die eine Steuerung von bis zu zahlreichen Aspekten der Synapse Biologie. Es bietet auch die erforderliche Auflösung Gene zu bestimmen, die genau die gleichen oder überlappenden Merkmale NMJ coregulate und sind somit wahrscheinlich in gemeinsamen molekularen Wegen zu arbeiten. Schließlich eröffnet sie die Möglichkeit , wie die verschiedenen synaptischen Parameter miteinander in Abwesenheit störender Einflüsse 17 korrelieren zu untersuchen und die Gene dieser koordinierten morphometrische Korrelationen gewährleisten.
Zusammengenommen dieses Protokoll zeigt , wie die beiden Makros „Drosophila NMJ Morphometrics“ verwenden , und„Drosophila NMJ Bouton Morphometrie“, die in einer Hochdurchsatz - Weise objektiv und empfindliche Quantifizierung von zehn morphologischen Merkmalen NMJ zuführen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offen zu legen.
Danksagungen
Wir erkennen die Vienna Drosophila Resource Center und Bloomington Drosophila Stock Center (NIH P40OD018537) für Drosophila - Stämmen bereitzustellen. Wir danken Jack Fransen vom Mikroskopische Imaging Center für kompetente Unterstützung bei der Bildgebung. Diese Studie wurde von VIDI und TOP Zuschüssen unterstützt (917-96-346, 912-12-109) von der niederländischen Organisation für wissenschaftliche Forschung (NWO), die von zwei DCN / Radboud University Medical Center PhD Stipendien vom Deutschen Netzwerk Mentale Retardierung finanziert durch das NGFN + Programm des Bundesministeriums für Bildung und Forschung (BMBF) und durch die FP7 der Europäischen Union integrierter Großnetzwerke Gencodys (HEALTH-241995) zu AS. Die Geldgeber hatten keine Rolle in Studiendesign, Datenerhebung und Analyse, Entscheidung oder Vorbereitung des Manuskripts zu veröffentlichen.
Materialien
| Name | Company | Catalog Number | Comments |
| Immunostaining | Dilution | ||
| Mouse anti-discs large 1 | Developmental Studies Hybridoma Bank | AFFN-DLG1-4D6 | 1/25 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Rabbit anti-horseradish peroxidase | Jackson IR | 323-005-021 | 1/500 |
| Rabbit anti-Synaptotagmin | Gift from Hugo Bellen | Jan-00 | |
| Mouse anti-Cysteine string protein | Developmental Studies Hybridoma Bank | DCSP-1(ab49) | 1/10 (conjungated using the Zenon Alexa Fluor 528 Labeling Kit) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Jan-50 |
| Goat anti-mouse Alexa Fluor 488 | Life technologies | A11029 | 1/200 |
| Goat anti-rabbit Alexa Fluor 568 | Life technologies | A11011 | 1/500 |
| Zenon Alexa Fluor 568 Mouse IgG1 Labeling Kit | ThermoFisher | Z25006 | |
| ProLong Gold Antifade Mountant | ThermoFisher | P36930 | |
| Material | Company | Catalog number | Comments |
| Equipment | |||
| Confocal microscope or fluorescence microscope | Leica SP5 | ||
| Zeiss Axio imager | |||
| Computer | Mac or Pc | ||
| Material | Company | Catalog number | Comments |
| Software | |||
| FIJI |
Referenzen
- Lin, Y. C., Koleske, A. J. Mechanisms of synapse and dendrite maintenance and their disruption in psychiatric and neurodegenerative disorders. Annu Rev Neurosci. 33, 349-378 (2010).
- van Bokhoven, H. Genetic and epigenetic networks in intellectual disabilities. Annu Rev Genet. 45, 81-104 (2011).
- Penzes, P., Buonanno, A., Passafaro, M., Sala, C., Sweet, R. A. Developmental vulnerability of synapses and circuits associated with neuropsychiatric disorders. J Neurochem. 126, 165-182 (2013).
- Mainen, Z. F., Sejnowski, T. J. Influence of dendritic structure on firing pattern in model neocortical neurons. Nature. 382, 363-366 (1996).
- Yuste, R., Majewska, A., Holthoff, K. From form to function: calcium compartmentalization in dendritic spines. Nat Neurosci. 3, 653-659 (2000).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Curr Opin Neurobiol. 22, 383-388 (2012).
- Mehnert, K. I., Cantera, R. Circadian rhythms in the morphology of neurons in Drosophila. Cell Tissue Res. 344, 381-389 (2011).
- Sigrist, S. J., Reiff, D. F., Thiel, P. R., Steinert, J. R., Schuster, C. M. Experience-dependent strengthening of Drosophila neuromuscular junctions. J Neurosci. 23, 6546-6556 (2003).
- Ruiz-Canada, C., Budnik, V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition. Int Rev Neurobiol. 75, 1-31 (2006).
- Menon, K. P., Carrillo, R. A., Zinn, K. Development and plasticity of the Drosophila larval neuromuscular junction. Wiley Interdiscip Rev Dev Biol. 2, 647-670 (2013).
- Kraut, R., Menon, K., Zinn, K. A gain-of-function screen for genes controlling motor axon guidance and synaptogenesis in Drosophila. Curr Biol. 11, 417-430 (2001).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Laviolette, M. J., Nunes, P., Peyre, J. B., Aigaki, T., Stewart, B. A. A genetic screen for suppressors of Drosophila NSF2 neuromuscular junction overgrowth. Genetics. 170, 779-792 (2005).
- Collins, C. A., Wairkar, Y. P., Johnson, S. L., DiAntonio, A. Highwire restrains synaptic growth by attenuating a MAP kinase signal. Neuron. 51, 57-69 (2006).
- Nijhof, B., et al. A New Fiji-Based Algorithm That Systematically Quantifies Nine Synaptic Parameters Provides Insights into Drosophila NMJ Morphometry. PLoS Comput Biol. 12, e1004823(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Dubos, A., et al. Conditional depletion of intellectual disability and Parkinsonism candidate gene ATP6AP2 in fly and mouse induces cognitive impairment and neurodegeneration. Hum Mol Genet. 24, 6736-6755 (2015).
- Nijhof, B., et al. Drosophila NMJ Morphometrics. , figshare https://doi.org/10.6084/m9.figshare.2077399. (2017).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , http://rsbweb.nih.gov/ij/docs/guide/146-29.html (2014).
- Ferreira, T., Rasband, W. ImageJ User Guide IJ 1.46. , Available from: http://fiji.sc/Auto_Threshold (2014).
- Pielage, J., et al. A presynaptic giant ankyrin stabilizes the NMJ through regulation of presynaptic microtubules and transsynaptic cell adhesion. Neuron. 58, 195-209 (2008).
- Koch, I., et al. Drosophila ankyrin 2 is required for synaptic stability. Neuron. 58, 210-222 (2008).
- Iqbal, Z., et al. Homozygous and heterozygous disruptions of ANK3: at the crossroads of neurodevelopmental and psychiatric disorders. Hum Mol Genet. 22, 1960-1970 (2013).
- Prokop, A. Organization of the efferent system and structure of neuromuscular junctions in Drosophila. Int Rev Neurobiol. 75, 71-90 (2006).
- Wan, H. I., et al. Highwire regulates synaptic growth in Drosophila. Neuron. 26, 313-329 (2000).
- Shi, L., Fu, A. K., Ip, N. Y. Molecular mechanisms underlying maturation and maintenance of the vertebrate neuromuscular junction. Trends Neurosci. 35, 441-453 (2012).
- Sutcliffe, B., Forero, M. G., Zhu, B., Robinson, I. M., Hidalgo, A. Neuron-type specific functions of DNT1, DNT2 and Spz at the Drosophila neuromuscular junction. PLoS One. 8, e75902(2013).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten