Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine Vorrichtung zur Durchführung Zellmigration / Wundheilung in einer 96-Well-Platte
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll eine halb hohem Durchsatz Zellmigrationsassay auf einer 96-well Zellkulturplatte durchzuführen. Dieses Protokoll ist eine schnelle, einfache und wirtschaftliche Verfahren in Übereinstimmung Kratzwunden auf einer Zell-Monoschicht zu erzeugen.
Zusammenfassung
Die Zellmigration / Test verwunden ist eine häufig verwendete Methode der Zellmigration und andere biologische Prozesse, wie Angiogenese und Tumormetastasierung zu studieren. In diesem Assay werden die Zellen gezüchtet eine konfluente Monoschicht und eine mechanische Verwundung durch Kratzen mit einem Gerät erzeugt wird, zu bilden. Dann wird die Migrationsrate der Zellen gegenüber dem entblößten Bereich kann durch Bildgebung überwacht werden. Unsere 8-Kanal-mechanischen wounder soll die meisten Probleme mit der Zellmigrationsassay zugeordnet zu bewältigen. Zum einen können unsere wounder leicht durch Autoklavieren oder mit üblichen Desinfektionsmittel sterilisiert werden. Zweitens erlauben die individuell einstellbare Stifte auch mit der Zellkulturplatte in Verbindung, damit scharf und reproduzierbar Wunden geschaffen werden kann. Drittens sorgen die Führungsstäbe auf beiden Seiten der wounder konsistente Verwundung Position in jeder Vertiefung. Die Verwendung von Einweg-Kunststoff-Pipettenspitzen für Verwundung weiter eine bessere Handhabung des wounder bieten kann sowie Quer VERSCHMUTZ zu minimierenIon. Abschließend kann unsere Zelle wounder Forscher bieten mit einer benutzerfreundlichen und reproduzierbare Vorrichtung zur Durchführung des Zellmigration Test, um die Standard-96-Well-Kulturplatte verwendet.
Einleitung
Zellmigration spielt eine wichtige Rolle bei der zellulären Prozessen, wie der Embryonalentwicklung, der Neurogenese, Angiogenese, Wundheilung, Schleimhautreparatur, epithelial-mesenchymalen-Übergänge unter normalen Entwicklung und Krankheitslage 1. Es ist ein komplizierter Prozess, der die Koordination zahlreicher inter- und intrazelluläre Ereignisse , einschließlich Signalmolekül - Wechselwirkungen, Zellpolarisation, Zytoskelett - Reorganisation, Matrixumbau, Membran Vorsprung und dynamische Zell-Zell - Adhäsion Modulation 2 beinhaltet. Durch das Studium der Zellmigration, die Entdeckung und Validierung von Chemikalien oder Biomoleküle, die zu Zellbewegung und seine verwandten biochemischen Wege bestimmt werden. Dieser grundlegende Prozess kann für verschiedene Anwendungen, wie zum Beispiel der Behandlung von Krankheiten und Drug-Targeting-nutzbringend als Proxy verwendet werden.
Die Verwundung Assay ist einer der Zellmigrationsassays 3. Hier wird eineinzelne Probe von Zellen teilweise durch mechanische Mittel entfernt werden, um ein entblößten Bereich zu produzieren, wo Zellen, die den Bereich abdecken wird migrieren. Der Prozentsatz der Rückgewinnung zu einem bestimmten Zeitpunkt wird überwacht werden. Wenn eine große Anzahl von Proben Umgang mit Themen wie der experimentellen Kosten und Kreuzkontamination innerhalb Proben kann problematisch sein. Obwohl viele kommerzielle Tools und Tests für 4 Migration Studium Zelle vorhanden sind, 5, 6, benötigt viele von ihnen teure und komplizierte Ausrüstung und Verbesserungen werden noch benötigt. Aus diesen Gründen ist ein 8-Kanal mechanischen Zell wounder (Abbildung 1) entwickelt.
Unsere 8-Kanal-mechanischen Zell wounder hat bei der Lösung der oben genannten Probleme einige einzigartige Eigenschaften eingearbeitet. Es bietet die Flexibilität, die Zellmigration / Verwundung Assays in 96-Well-Kulturplattenformat durchzuführen. Der einstellbare guIding Bar-Design sorgt dafür, dass die Kratzfläche in der zentralen Position jedes gut ist. Auch kann die Höhe der Führungsstangen verstellt werden, so dass die wounder für verschiedene Marken von Kulturplatten anwendbar ist. Schließlich ermöglicht die einstellbare Verwundung Pin - Design einen noch Kontakt der Pipettenspitzen mit der Kulturplatte Oberfläche zu erreichen gleichzeitige und reproduzierbare Verwundung 7, 8.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Einführung in die Teile des wounder (Abbildung 1)
- Bereiten Sie den Stifthalter durch die Verwundung Stifte in gleichen Abständen zu fixieren. Halten Sie die Pipettenspitzen und stellen Sie die Spitzenhöhe und die einstellbaren Verwundung Stifte nach oben und unten durch Bewegung.
- Den verstellbaren Führungsschiene auf verschiedene Marken von 96-Well-Kulturplatten und stellen Sie sicher, dass die Verwundung Bereich in einer festen Position ist.
- Befestigen Sie den verstellbaren Verwundung Stift durch die Sechskantschraube anziehen. Befestigen Sie den Führungsgriff in der Position, die durch die Kopfkappen Sechskant Anzugs an beiden Enden.
2. Einstellen der Breite des Stifthalters (Abbildung 2)
- Lösen Sie die Sechskantkappen mit dem M5 Inbusschlüssel.
- Legen Sie eine geeignete Anzahl von Ringen auf beiden Seiten des Stifthalters so eingestellt wird, dass die Führungsstangen passen perfekt mit der Breite der 96-Well-Kulturplatte.
HINWEIS: Corning und Iwaki Platten erfordert ein Paar von großen Ringen und 1 Paar kleine Ringe. Falcon und Nunc plAtes benötigen ein Paar große Ringe. - Ziehen Sie die Sechskantkappen der Führungsstange zu befestigen.
3. Einstellen der Führungsstangen (Abbildung 3)
- Montieren Sie die Verwundung Stifte mit sterilen 10-ul Kunststoff Pipettenspitzen.
- Lösen Sie die Sechskantkappen mit dem M5 Inbusschlüssel.
- Halten Sie die wounder und tauchen Sie die Verwundung Stifte in eine Spalte einer 96-Well-Kulturplatte.
- Stellen Sie die Höhe der Führungsstangen, bis alle Spitzen kaum den Boden der Vertiefungen berührt.
- Ziehen Sie die Sechskantkappen. Stellen Sie sicher, dass die wounder jetzt perfekt auf der Kulturplatte passt und dass die Stifte sind gut positioniert in der Mitte der Brunnen.
4. Kalibrierung der Pins
- Halten Sie die wounder senkrecht zu einer flachen sterilen Oberfläche (dh Petrischale) und lösen Sie alle Sechskantschrauben mit dem M3 - Inbusschlüssel.
- Tippen Sie auf die wounder bis alle Spitzen gleichmäßig flach sterile Oberfläche berühren.
- Ziehen Sie die Sechskantschrauben wieder die Stifte in Position zu verriegeln.
- Schauen Sie sich die Gleichmäßigkeit jeder Spitze durch die wounder sanft auf der flachen sterilen Oberfläche aus.
5. Verkratzen Zellmonolayer (Figur 4)
- Seed humane Nabelschnur vaskuläre Endothelzellen auf einer 0,1% Gelatine beschichtete 96-Well-Zellkulturplatte. Kulturzellen in Medium 199 mit 20% hitzeinaktiviertem fötalem Rinderserum, 1% Penicillin / Streptomycin und 0,09 g / L Heparin. Pflegen Zellen in einem befeuchteten Inkubator mit 5% Kohlendioxid bei 37 ºC über Nacht vor der Verwendung. Die Zellen sollten 100% Konfluenz erreichen, bevor der Verwundung.
- Legen Sie die Verwundung Spitzen an der linken (oder der ganz rechten) Seite jeder Vertiefung innerhalb der gleichen Spalte der Kulturplatte. Schieben Sie die wounder auf die andere Seite des Bohrlochs; sicherstellen, dass die Verwundung Tipps, um den Boden des Bohrlochs berühren.
- Wiederholen Sie das Kratzen (Schritt 5.2) für alle Spalten.
- Nach Verwundung Verwerfungs ter Medium in jeder Vertiefung und ersetzen Sie sie durch frisches Medium, das Testen von Verbindungen.
6. Datenerfassung und Bildanalyse
- Bild das ganze auch mit der mechanischen Wunde auf der Zellschicht ein Low-Power - Mikroskop mit Digitalkamera (zB 10X - Objektiv) unmittelbar nach der Verwundung (t = 0 h) verwendet wird .
- In Testverbindungen, wenn für die gewünschte Länge der Zeit gewünscht und brüten. Bild das ganze gut mit dem Wundbereich nach der gewünschten Inkubationszeit (t = & Delta; h).
- Mit Hilfe der Bildanalyse - Software wie ImageJ ( https://imagej.nih.gov/ij/ ), messen Sie den verwundeten Bereich auf dem Bild mit dem Freihand - Werkzeug.
- Berechnen Sie den Prozentsatz des Wundverschlusses:
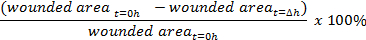
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Dieser 8-Kanal-mechanische wounder ist so konstruiert, eine Zellschicht, um Kratzer auf der Zellmigration Test durchzuführen. Es ist ein benutzerfreundliches Gerät, das Zell Kratzen Assays in 96-Well-Platten in weniger als einer Minute ohne spezielles Training durchführen können. Diese wounder können Wundflächen auf Zellmonoschichten mit einer gleichmßigen Breite von etwa 600 um und mit scharfen Kanten (5 und 6) einzuführen. Die Breite der Wunden...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Unsere Zelle wounder hat einige einzigartige Eigenschaften in die Probleme der traditionellen Zellmigration Assays zu lösen. Der 8-Kanal-mechanischen Zell wounder ist aus hochwertigem Edelstahl (Stahl 304) mit einer langen Lebensdauer hergestellt, die im Autoklaven sterilisiert werden kann. Fast alle Handelsmarken von 96-Well-Kulturplatten auf dem Markt mit dieser mechanischen Zell wounder verwendet werden, da der verstellbaren Führungsstange. Die Konstruktion der verstellbaren Führungsleiste gewährleistet auch, das...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Die Autoren möchten sich Herr Tam Po Leung, Mr. Wong Chi Kin und das technische Personal der Fakultät Werkstatt, Hong Kong Baptist University, für ihre technischen Fähigkeiten und Beratung bei der Herstellung der Prototyp dieser wounder danken.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
Referenzen
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A. Jr, Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980(2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21(2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten