Method Article
Elektrophysiologische Methode für Ganzzell-Spannungsklemmen Aufnahmen von
In diesem Artikel
Zusammenfassung
Ganzzellige Aufnahmen von Drosophila Melanogaster Photorezeptoren ermöglichen die Messung von spontanen Dunkelstößen, Quantenstößen, makroskopischen Reaktionen auf Licht und Strom-Spannungs-Beziehungen unter verschiedenen Bedingungen. In Kombination mit D. melanogaster genetischen Manipulationswerkzeugen ermöglicht diese Methode die Untersuchung des ubiquitären Inositol-Lipid-Signalwegs und seines Ziels, des TRP-Kanals.
Zusammenfassung
Ganzzellige Spannungsklemmenaufnahmen von Drosophila melanogaster Photorezeptoren haben das Feld der wirbellosen visuellen Transduktion revolutioniert, was die Verwendung von D. melanogaster Molekulargenetik ermöglicht, um Inositol-Lipid-Signalisierung und Transient Receptor Potential (TRP) -Kanäle auf Einzelmolekül-Ebene zu untersuchen. Eine Handvoll Labore haben diese mächtige Technik beherrscht, die es ermöglicht, die physiologischen Reaktionen unter stark kontrollierten Bedingungen zu beleuchten. Diese Technik ermöglicht die Kontrolle über die intrazellulären und extrazellulären Medien; Die Membranspannung; Und die schnelle Anwendung von pharmakologischen Verbindungen, wie einer Vielzahl von Ionen- oder pH-Indikatoren, auf die intra- und extrazellulären Medien. Mit einem außergewöhnlich hohen Signal-Rausch-Verhältnis ermöglicht dieses Verfahren die Messung von dunklen spontanen und lichtinduzierten Einheitsströmen ( zB Spontan- und Quantenstößen) und makroskopischen Lichtinduzierten Strömen (LIC) aus der SündeGle D. melanogaster photorezeptoren Dieses Protokoll skizziert im Detail alle wichtigen Schritte, die notwendig sind, um diese Technik durchzuführen, die sowohl elektrophysiologische als auch optische Aufnahmen beinhaltet. Das Fliegen-Retina-Dissektionsverfahren für die Erreichung von intakten und lebensfähigen ex vivo- isolierten Omatidien in der Badkammer wird beschrieben. Die Ausrüstung, die für die Durchführung von Ganzzell- und Fluoreszenz-Bildgebungsmessungen erforderlich ist, ist ebenfalls detailliert. Schließlich werden die Fallstricke bei der Verwendung dieser zarten Vorbereitung bei längeren Experimenten erklärt.
Einleitung
Umfangreiche genetische Untersuchungen der Fruchtfliege , Drosophila melanogaster ( D. melanogaster) , die vor mehr als 100 Jahren initiiert wurde, haben die D. melanogaster- Fliege als äußerst nützliches experimentelles Modell für die genetische Dissektion komplexer biologischer Prozesse etabliert. Die unten beschriebene Methodik kombiniert die akkumulierte Kraft von D. melanogaster Molekulargenetik mit dem hohen Signal-Rausch-Verhältnis von Ganzzell-Patch-Clamp-Aufnahmen. Diese Kombination ermöglicht die Untersuchung von D. melanogaster Phototransduktion als Modell der Inositol-Lipid-Signalisierung und TRP-Kanalregulation und -aktivierung sowohl in der nativen Umgebung als auch in der höchsten Auflösung einzelner Moleküle.
Die Anwendung der Ganzzell-Aufzeichnungsmethode auf D. melanogaster Photorezeptoren hat das Studium der Wirbellosen-Phototransduktion revolutioniert. Diese Methode wurde von Hardie 1 und indep entwickeltEndlich von Ranganathan und Kollegen vor 2 ~ 26 Jahren und wurde entworfen, um die umfangreichen genetischen Manipulationswerkzeuge von D. melanogaster auszunutzen und sie zu verwenden, um Mechanismen der Phototransduktion und Inositol-Lipid-Signalisierung aufzudecken. Zunächst litt diese Technik unter einer raschen Verringerung der Lichtempfindlichkeit und einer geringen Ausbeute an Ommatidien während des Sektionsprozesses, die detaillierte quantitative Studien verhinderten. Später erhöhte die Zugabe von ATP und NAD zur Patchpipette die Eignung der Präparation für längere quantitative Aufnahmen drastisch. Danach wurde eine umfangreiche Charakterisierung des Signaltransduktionsmechanismus auf molekularer Ebene realisiert.
Derzeit ist die D. melanogaster- Phototransduktion eines der wenigen Systeme, in denen Phosphoinositid-Signalisierungs- und TRP-Kanäle ex-vivo bei Einzelmolekül-Auflösung untersucht werden können. Das macht D. melanogaster fototransduktion und das ichThodologie entwickelt, um diesen Mechanismus ein hochempfindliches Modellsystem zu studieren. Dieses Protokoll beschreibt, wie man die D. melanogaster retina seziert und die isolierten Ommatidien mechanisch von den umgebenden Pigment (Glia) Zellen abstreift. Dies ermöglicht die Bildung einer Giga-Dichtung und einer Ganzzell-Patch-Clamp auf den Photorezeptor-Zellkörpern. Glücklicherweise sind die meisten Signalisierungsproteine auf das Rhabdomere beschränkt und diffundieren nicht. Darüber hinaus gibt es einen immobilen Ca 2+ -Puffer namens Calphotin, der sich zwischen dem Signalisierungskompartiment und dem Zellkörper 3 , 4 befindet , und einem hohen Expressionsniveau des Na + / Ca 2+ -Tauscher (CalX) im Mikrovilli 5 . Gemeinsam erlauben die Protein-Confinement zum Rhabdomere, der Calphotin-Puffer und die hohe Expression des CalX relativ lange ( dh bis zu ~ 20 min) Ganzzell-Aufnahmen ohne den Verlust wesentlicher KomponentenDes Phototransduktionsverfahrens und unter Beibehaltung einer hohen Lichtempfindlichkeit. Das folgende Protokoll beschreibt, wie man isolierte Omatidien erhält und ganze Zellaufnahmen durchführt, die die nativen Eigenschaften der Phototransduktionskaskade bewahren. Vollständige Patch-Clamp-Experimente auf dissoziierten Kakerlaken ( Periplaneta americana ) 6 und Cricket ( Gryllus bimaculatus ) 7 Ommatidien wurden ähnlich wie bei D. melanogaster durchgeführt . Darüber hinaus wurden Patch-Clamp-Experimente an dissoziierten Photorezeptoren der File-Clam, ( Lima scabra ) und Jakobsmuschel ( Pecten-Irradianer ) in einer etwas anderen Weise als die von D. melanogaster durchgeführt , wobei sowohl die Ganzzell- 8- als auch die Einkanal-Messungen durchgeführt wurden 9 Hier werden die wichtigsten Errungenschaften, die in D. melanogaster mit dieser Technik erhalten wurden, beschrieben. Die Diskussion iSchließt die Beschreibung einiger Fallstricke und Einschränkungen dieser Technik ein.
Protokoll
1. Reagenzvorbereitung
HINWEIS: Vorbereiten Sie alle Lösungen gemäß den Anweisungen in den Tabellen 1-4 .
- Füllen Sie eine 10-ml-Spritze mit extrazellulärer Lösung (ES oder ES-0Ca 2+ , wie erforderlich, siehe Tabelle 1 ) und auf Eis aufbewahren.
- Bereiten Sie eine Durchstechflasche der Triturierungslösung vor (TS, siehe Tabelle 2 , dh ES oder ES-0Ca 2+ + FBS und Saccharose) und halten Sie diese auf Eis.
- Bereiten Sie genügend ES für das Experiment vor und bewahren Sie das auf Eis, bis es nötig ist.
HINWEIS: Eine kontinuierliche Badperfusion ist nicht erforderlich, daher muss das ES-Volumen nicht mehr als ein paar Dutzend ml betragen. - Mit einem 22 μm PVDF-Filter die intrazelluläre Lösung (siehe Tabelle 3 oder Tabelle 4 ) in eine 1-ml-Spritze mit einer Elektrode einfüllen, die eine längliche Spitze füllt. Halten Sie das auf Eis.
2. Allgemeine Einrichtung von Dissektionswerkzeugen
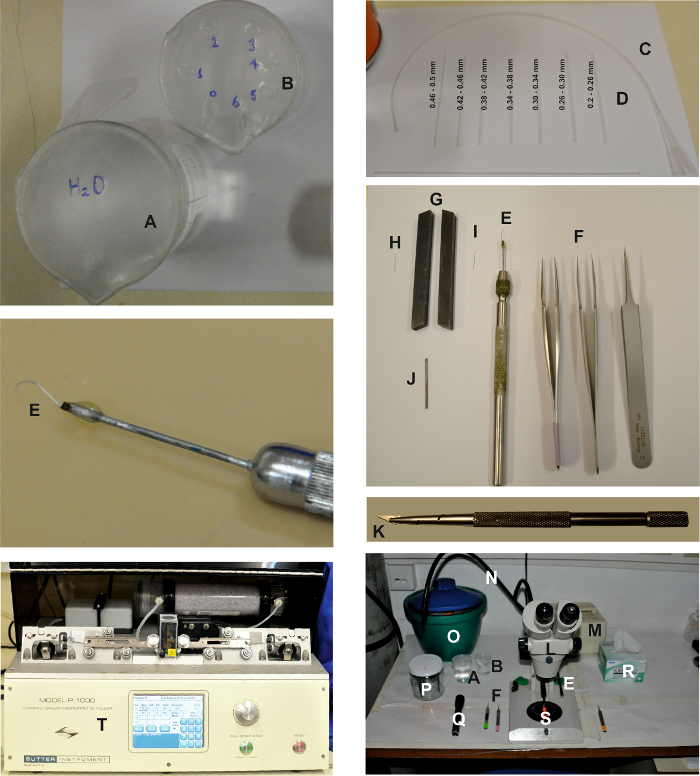
Abbildung 1: Werkzeuge und Vorrichtungen, die für die Herstellung der isolierten Ommatidien Vorbereitung benötigt werden. Die Bilder zeigen die verschiedenen Vorrichtungen, die für die Herstellung der isolierten Ommatidienpräparation erforderlich sind, wie im ausführlichen Protokoll oben beschrieben. Zwei Becher, eine mit Wasser ( A ) und die andere mit Ethanol ( B ) gefüllt, um die Triturationspipetten ( D ) zu reinigen, die mit dem Schlauch ( C ) verbunden sind. Die Sektionswerkzeuge sind: 2 Paar fein und 1 Paar grobe Pinzette ( F ) und eine Netzhautschaufel ( E ). Zur Vorbereitung des Retina-Scooperes wird eine Mikrosissektionsnadel ( H ) zwischen zwei Drehwerkzeugen gedrückt, die als Schraubstock ( G ) wirken, um die Oberseite der Nadel ( I ) zu glätten. Dann ist es mit einem langgestreckten pi verbunden Ece Metall mit Kleber ( J ) und auf einem Nadelhalter ( E ) montiert. Rasierklingen-Chip und -Halter: Abbruch und Montage eines kleinen dreieckigen Chips eines Rasierklingees mit einem Rasierklingenhalter ( K ). Der Sektionsarbeitsbereich besteht aus einem binokularen ( L ) und einer kühlen roten Lichtquelle (( M), ) mit zwei Lichtleitern ( N ). In beiden Seiten des Binokulars befinden sich die Sezierwerkzeuge, einschließlich der Pinzette ( F ), der Retina Scooper ( E ), der Becher ( A und B ), einer Taschenlampe mit einem roten Filter ( Q ) und zarten Wischern ( R ). Ein Eiskübel mit dem ES, dem FBS-ES, den intrazellulären Lösungsspritzen, der 60 mm Petrischale ( S ) und dem Elektrodenhalter ( P ) werden ebenfalls auf den Tisch gelegt. Die Aufzeichnungselektroden werden mit einem horizontalen Abzieher ( T ) gezogen.E.com/files/ftp_upload/55627/55627fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Konstruieren Sie eine Retina Scooper, um die Retinae zu isolieren.
- Setzen Sie den Punkt (1-4 mm) einer Mikrodissektionsnadel (entomologische Nadel, 12 mm Länge, 0,1 mm Durchmesser) zwischen den beiden Schraubbögen ein und glätten Sie ihn mit einem kleinen Hammer.
- Montieren Sie die abgeflachte Nadel auf einem mikrosezierenden Nadelhalter (siehe Tabelle der Materialien ).
- Mit einem Paar Pinzetten, Kurve das abgeflachte Ende der Nadel zu einem Haken mit einer Krümmung von ~ 2,5 mm zu bilden.
- Erstellen Sie Triturationspipetten für die Ommatidien-Trennung.
- Legen Sie eine Glaskapillare von 1,2 x 0,68 mm (OD x ID) über eine offene Flamme und feuern Sie sie ab, um ihre Öffnung zu reduzieren.
- Messen Sie die Größe der Kapillarenöffnung unter einem Mikroskop. Sortieren Sie die erzeugten ommatidial trituration pipettes in seveN-Gruppen je nach Größe ihrer Öffnungen ( dh 0,2-0,5 mm). Lagern Sie sie in separaten geeigneten Behältern ( zB Reagenzgläser).
- Füllen Sie einen kleinen Becher mit doppelt destilliertem Wasser (DDW) und einem weiteren kleinen Becher mit Ethanol 70%. Bedecken Sie jeden Becher mit einer Paraffinfolie.
- Stanzen Sie ein kleines Loch in das Paraffin-Folienblatt, das den DDW-Becher bedeckt (siehe Abbildung 1A ).
- Stanzen Sie sieben kleine Löcher in die Paraffinfolie, die den Ethanolbecher bedeckt, und nummerieren Sie die Löcher von 0 bis 6 (siehe Abbildung 1B ).
- Legen Sie eine ommatidiale Triturationspipette von jeder Größengruppe in jedes Paraffinfilmloch, so dass sich die Pipette mit der größten Öffnung im 0. Loch befindet und die Pipette mit der kleinsten Öffnung im 6. Loch liegt.
- Verbinden Sie eine Plastik 200 μL Pipettenspitze mit einem 35 cm langen, 1,57 x 1,14 mm (OD x ID) Stück Polyethylenschlauch. VerbindenT das andere Ende des Schlauches zu einer der ommatidialen Verreibungspipetten mit der größten Öffnung ( dh 0,46 - 0,5 mm), um sicherzustellen, dass das spitze Ende der Triturationspipette nicht in den Schlauch gerichtet ist.
- Vorbereitung von Ganzzell-Aufzeichnungspipetten durch Ziehen von Patch-Clamp-Pipetten aus einem 1 x 0,58 mm (OD x ID) Borosilikat-Filament mit Glaskapillaren.
HINWEIS: Der Widerstand der Pipetten sollte bei der Verwendung von Intrazellulärlösung auf Kaliumglukonat-Basis (IS1) 8-15 MΩ betragen. Jeder geeignete Patchpipetten- Abzieher kann verwendet werden (zum Beispiel siehe Tabelle der Materialien ). Feuerpolieren ist nicht notwendig. - Bereiten Sie eine Aufnahmekammer vor (siehe Abbildung 2 ), indem Sie ein Deckglas (siehe Tabelle der Materialien ) auf den Boden der Badkammer mit geschmolzenem Paraffin oder Hochvakuum-Silikonfett fixieren . Verwenden Sie eine geeignete hausgemachte oder kommerzielle Kammer, die Elektroden Zugang und Perfusion ermöglicht.
- Montiere das Bad auf der Bühne eines umgekehrten Mikroskops. Legen Sie das Perfusionssystem Rohr, Saug-System und Boden ( dh Ag-AgCl Draht / Pellet) in das Bad (siehe die Tabelle der Materialien und Abbildung 2 ).
- Legen Sie zwei Paare von feinen # 5 Pinzetten (Abbildung 1 ) auf die Arbeitsfläche für den Einsatz während der Retina Dissektion und ommatidia Isolation Schritte.
3. D. melanogaster Aufzucht
- Heben Sie D. Melanogaster fliegt bei einer niedrigen Bevölkerungsdichte ( dh 20 Fliegen in einer Flasche 6 Unzen) in Flaschen, die Standard-Maismehl-Nahrung bei 19-24 ° C enthalten.
HINWEIS: Es ist vorzuziehen, an dunkel angepassten Fliegen zu arbeiten. Um eine hohe Lichtempfindlichkeit zu erhalten, reduzieren Sie die Vielfalt und verhindern die Netzhautdegeneration bei Mutantenfliegen. - Hebe die Fliegen im Dunkeln für mindestens 24 Stunden vor dem Experiment an.
ANMERKUNG: Die Fliegen, die für die Experimente verwendet werden, sollten rece(<2 h) und immer noch weich, blass und zeigt das meconium. Ommatidien kann auch leicht aus Puppen vorbereitet werden, obwohl ihre Lichtempfindlichkeit dann stark vom Alter von 10 abhängig ist.
4. Retina Dissektion und Ommatidia Isolation: Option 1
HINWEIS: Führen Sie alle folgenden Schritte unter dem stereoskopischen Zoommikroskop mit einer Verstärkung aus, die für eine ordnungsgemäße Betrachtung der Vorbereitung geeignet ist (siehe Abbildung 1 ).
- Legen Sie vier Tropfen ES-0Ca 2+ und einen Tropfen TS-Lösung auf eine 60-mm-Petrischale, die umgedreht wurde.
- Mit groben Pinzetten, fangen Sie eine neu verpackt (<2 h nach Eclosion) fliegen durch seine Flügel oder Körper. Nehmen Sie ab diesem Zeitpunkt alle Verfahren schnell und unter einer dunklen Rotation bei 20 ± 1 ° C durch.
- Während Sie die Fliege mit der rauen Pinzette noch fassen, verwenden Sie das erste Paar feine Pinzetten, um den Fliegenkopf vom Körper zu lösen. SubmRge den Kopf in den ersten ES-0Ca 2+ Tropfen.
- Ziehen Sie den Kopf in die Hälfte entlang der Sagittal-Ebene mit dem zweiten Paar feine Pinzette. Stellen Sie sicher, dass am Ende dieses Schrittes beide Augen noch intakt sind.
- Übertragen Sie eine Hälfte des Kopfes auf den zweiten ES-0Ca 2+ Tropfen und die andere Hälfte auf den dritten ES-0Ca 2+ Tropfen.
- Mit der feinen Pinzette, entfernen Sie so viel von dem Gewebe um das Auge wie möglich und stellen Sie sicher, dass kein Schaden an der Netzhaut verursacht wird.
- Fassen Sie den Rand einer Hornhaut mit der feinen Pinzette fest und schaufeln Sie die Netzhaut mit dem Scoop aus.
ANMERKUNG: Nach Beendigung dieses Schrittes wird die Hornhaut leer und intakt gelassen, getrennt von einer intakten Netzhaut. - Spülen Sie die Triturationspipette mit dem Schlauch mit DDW und füllen Sie die Pipette mit einer kleinen Menge an ES-0Ca 2+ aus dem vierten Tropfen.
HINWEIS: Dieser Schritt muss jedes Mal durchgeführt werden, wenn eine neue Ommatidia-Trennpipette verwendet und entfernt wirdM der Ethanol-Becher (die Lösung, die die Pipette füllt, sollte mit der Lösung übereinstimmen, in der die Netzhaut eingetaucht ist). - Vorsicht vorsichtig durch den Mund strecken, um die isolierte Netzhaut in die Pipette zu ziehen. Verwenden Sie äußerste Vorsicht, keine Luftblasen in die Pipette zu streben.
- Übertragen Sie die isolierte Netzhaut auf den Tropfen TS. Führen Sie die Schritte 4.6-4.10 auch auf das zweite Auge.
- Wischen Sie die Tropfen ES-0Ca 2+ mit empfindlichen Tüchern ab und lassen Sie nur den Tropfen TS, der beide Retinae enthält, auf der Petrischale. Füge sechs weitere Tropfen TS an die Spitze der Petrischale. Übertragen Sie beide Retinas auf einen der anderen TS-Tropfen.
- Ersetzen Sie die Triturationspipette durch eine Pipette mit einer kleineren Öffnung. Spülen Sie es wie in Schritt 4.8 beschrieben, mit TS als Lösung, um die Pipette zu füllen.
- Schnell und wiederholt aspirieren und verlaufen beide Retinae in der Lösung, um die Trennung von isolierten Ommatidien, die von Pigmentzellen aus der ganzen Retina gestrippt wurden, zu beginnen.
HINWEIS: Das isolierte OmmaTidia sind im TS-Drop sichtbar, und wenn der Isolationsvorgang fortschreitet, wird der TS-Tropfen weniger lichtdurchlässig. - Übertragen Sie die verbleibenden Retinae zum nächsten TS-Drop. Füllen Sie die Pipette mit dem ganzen ehemaligen TS-Tropfen (mit dem isolierten Ommatidia) und vervollständigen Sie den Tropfen in die Badkammer.
- Wiederholen Sie die Schritte 4.12-4.14, um maximal isolierte Omatidien zu erreichen. Warten Sie ca. 1 min, damit die isolierte Ommatidia sinken und an den Boden der Badkammer binden kann.
- Mit dem Perfusionssystem den Fluss von ES-0Ca 2+ mit 1,5 mM Ca 2+ in die Badkammer starten. Sicherstellen, dass die Kammer mit der Lösung vollständig von unten nach oben gefüllt ist und dass der Boden vollständig in die Lösung eingetaucht ist. Weiter zum Waschen der Badewanne 4-5x.
5. Retina Dissektion und Ommatidia Isolation: Option 2
Hinweis: Führen Sie alle folgenden Schritte unter dem stereoskopischen Zoom-Mikroskop, mit einem ampliGeeignet für die korrekte Betrachtung der Vorbereitung (siehe Abbildung 1 ).
- Bereiten Sie einen Rasierklingen-Chip und Halter vor. Abbrechen und montieren Sie einen kleinen dreieckigen Chip einer Rasierklinge mit einem Rasierklingenhalter (Abbildung 1 ).
- Bereiten Sie eine Silikon-Dissektion Schüssel / Block nach den Anweisungen des Herstellers (siehe die Tabelle der Materialien ).
- Für die Dissektion, erstellen Sie einen großen Tropfen (<0,5 mL) der ES-Lösung auf dem Silikon-Dissektion Block. Füge zwei "Reservoir" Tropfen (~ 50 μL) von TS-Lösung zu einer 60 mm Petrischale hinzu
- Immobilisieren Sie eine neu geöffnete (<2 h Post-Eclosion) Fliege in einem Glasröhrchen auf Eis und holen Sie sie durch ihre Flügel mit Pinzette auf. Nehmen Sie ab diesem Zeitpunkt alle Verfahren schnell und unter einer dunklen Rotation bei 20 ± 1 ° C durch.
- Halten Sie die Fliege mit Pinzette, schneiden Sie den Kopf der Fliege mit einem Rasierklingen-Chip in einem Halter montiert. Heben Sie einen Insektenstift (12 mm lang,0,1 mm im Durchmesser) mit der Pinzette und durchbohren den Kopf zwischen den Augen.
- Den Kopf in 70% Ethanol kurz eintauchen; Dadurch wird verhindert, dass sich Luftblasen auf der Kopf- / Augenoberfläche bilden. Pin den Kopf unter dem ES-Tropfen auf der Silikon-Dissektion Schale.
- Schneiden Sie beide Augen mit dem Rasierklingen-Chip, indem Sie eine Sägebewegung entlang der Linie des vorderen Randes des Auges verwenden.
- Fassen Sie den Rand einer Hornhaut mit der feinen Pinzette fest.
- Schaufeln Sie die Netzhaut mit dem Scoop aus.
ANMERKUNG: Nach Beendigung dieses Schrittes wird die Hornhaut leer und intakt gelassen, getrennt von einer intakten Netzhaut. - Ohne Beschädigung der Netzhaut, verwenden Sie die Pinzette und scooper, um vorsichtig anhaftende Luftsäcke und überschüssiges Hirngewebe zu entfernen.
ANMERKUNG: Die Herstellung von isolierten Retinae ist auch für Western-Blot-Analysen von unspezifischen Retinae-Proteinen 11 , Voll-Histologie und Voll-Retina-Bildgebung geeignet. Patch-Clamp-Aufnahmen können auch auf phOtorezeptoren aus der ganzen retina 12 - Nehmen Sie die Triturationspipette mit dem größten Durchmesser, verbinden Sie sie mit dem Schlauch und füllen Sie die Pipette mit einer kleinen Menge an TS aus einem der Reservoir Tropfen in der Petrischale durch sanfte Absaugung ( dh durch den Mund). Führen Sie diesen Schritt jedes Mal durch, wenn eine neue Ommatidia-Triturationspipette verwendet wird.
- Die TS über die beiden Netzhaut vorsichtig durch den Mund blasen und dann die isolierte Retinae mit sanfter Absaugung in die Pipette ziehen. Achten Sie darauf, dass keine Luftblasen in die Pipette gelangen.
- Übertragen Sie die isolierten Retinae auf die Petrischale, bilden einen kleinen Tropfen (~ 20 μL) und waschen Sie sie einmal oder zweimal mit TS von einem der Reservoir Tropfen.
- Inkubieren Sie die Netzhaut im Dunkeln für 20-25 min.
- Ersetzen Sie die ommatidia trituration pipette mit einer Pipette mit einer kleineren Durchmesseröffnung (mit frischem TS von einem der Reservoir Tropfen wie in Schritt 4.6, um die Pipette zu verfüllen).
- SchnellAspirieren und beide Retinae in einem kleinen Tropfen (~ 20 μl) ablaufen lassen, um die Trennung der isolierten Omatidien zu beginnen.
HINWEIS: Im ersten Stadium sollte das umgebende pigmentierte Glia zerfallen, wobei sichtbare kleine Trümmer in der Lösung zurückbleiben. - Nachdem sich erhebliche kleine Trümmer angesammelt haben, aber bevor sich viele Ommatidien getrennt haben, verwenden Sie frische TS aus einem der Reservoir Tropfen und übertragen die Retinae zu einem neuen kleinen Tropfen.
- Wählen Sie eine Verjüngungspipette mit kleinerem Durchmesser, backfill und weiter zu triturieren.
HINWEIS: Da sich die Ommatidien nun zu trennen beginnen, sollten ihre langgestreckten Formen unter der hohen Leistung des Stereomikroskops deutlich sichtbar sein. Gegebenenfalls die Triturationspipetten auf kleinere Durchmesser wechseln, bis eine gute Ausbeute an Ommatidien sichtbar ist - Sobald eine vernünftige Ausbeute an Ommatidien sichtbar ist und der Tropfen nicht mehr lichtdurchlässig ist, füllen Sie die Pipette mit dem ganzen Tropfen, der die isolierten Ommatidien enthält, und verlässt den Tropfen sanft in dieUnterseite der mit ES vorgefüllten Badkammer.
- Warten Sie ca. 1 min, damit die isolierte Ommatidie sinken und sich auf der Unterseite der Badkammer absetzen kann.
- Mit dem Perfusionssystem starten Sie den Fluss von ES in die Badkammer. Stellen Sie sicher, dass die Kammer voll von der Lösung ist, von unten nach oben, und dass der Boden vollständig in die Lösung eingetaucht ist. Weiter zum Waschen der Badewanne 4-5x.
HINWEIS: Danach ist eine kontinuierliche Perfusion nicht erforderlich, obwohl das Bad kurz vor dem Einbringen einer neuen Patchpipette gespült werden sollte.
6. Ganzzellen-Aufzeichnung

Abbildung 2: Überblick über die elektrophysiologische und optische Einrichtung. Das Setup enthält einen eisenfarbenen, schwarz lackierten Faraday Käfig ( F ). Die Vorderseite ist mit einem schwarzen Vorhang mit Kupfer Mesh innen bedeckt. Diese configDie Vorbereitung ermöglicht es, die Vorbereitung vollständig von jedem Streulicht abzudichten und eignet sich zur Aufnahme von dunklen spontanen Beulen. Das invertierte Fluoreszenzmikroskop ( A ) ist an einem Antivibrationstisch ( E ) befestigt. Die Photorezeptor-Aufzeichnungsvorrichtung besteht aus einer selbstgemachten Acrylglasbadkammer ( O ) mit einem Perfusionseingang ( Q ), einer Saugpipette ( S ) und einem Silber-Silberchlorid-Boden ( P ). Die Badkammer wird auf dem Mikroskopstadium ( T ) mit einem selbstgebauten Adapter montiert. Die Aufzeichnungspipette wird über Silber-Silberchlorid-Draht mit einem Acrylglashalter verbunden, der mit der Verstärker-Kopfstufe ( C ) verbunden ist. Die Kopfstufe wird dann auf einem groben Mikromanipulator montiert, der auf einem feinen mechanischen Mikromanipulator XYZ ( B ) montiert ist. Das Perfusionssystem ( D ) besteht aus einer Spritze, während der Fluß von LiquiD wird durch Quetschventile ( H ) gesteuert. Das Rack ist elektrisch mit dem gleichen Mittelpunkt verbunden, an dem alle Geräte innerhalb des Faraday-Käfigs angeschlossen sind und aus einem Patch-Clamp-Verstärker ( N ), einem Oszilloskop ( J ), einem Puls- / Funktionsgenerator ( K ), einem A bis D-Wandler ( L ), einen Perfusionsregler ( I ) und einen Filter- und Verschlusscontroller ( M ). Für bildgebende Experimente ist eine gekühlte (-110 ° C, siehe Tabelle der Materialien ) CCD-Kamera über einen Seitenanschluss ( G ) verbunden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
HINWEIS: Bei allen folgenden Schritten nur schwache Rotlichtbeleuchtung verwenden und sicherstellen, dass die Belichtung der Ommatidie mit Licht minimal ist ( dh schnell arbeiten undSchalten Sie die Sezierlichtquelle und die Kammer Rotbeleuchtung für die Betrachtung der Ommatidia bei der Durchführung von Aufgaben, die nicht die Betrachtung der Ommatidium). Führen Sie außerdem alle folgenden Schritte nach dem üblichen elektrophysiologischen Protokoll durch.
- Unter einem invertierten Mikroskop (40X Objektiv) sorgfältig alle Ommatidien im Bad kontrollieren und ein geeignetes Ommatidium für das Experiment wählen.
- Stellen Sie sicher, dass die äußere Membran des Ommatidiums glatt und intakt ist, dass die lange Achse etwa rechtwinklig zur Elektrodenansatzrichtung liegt (siehe Abbildung 3A ), und dass der distale Abschnitt des Ommatidiums nicht von irgendeinem umgeben ist Überschüssiges Gewebe Legen Sie das gewählte Ommatidium auf die optische Achse der Objektivlinse (in der Mitte des Gesichtsfeldes), um eine gleichmäßige Ausleuchtung zu gewährleisten.
- Füllen Sie eine Patchpipette mit intrazellulärer Lösung (IS1 oder IS2).
HINWEIS: Zu meaSicher die Intensitätsreaktion und Bump-Analyse, verwenden Sie IS1. Um das Umkehrpotential der lichtempfindlichen Kanäle zu messen, verwenden Sie IS2. - Montieren Sie die Patchpipette auf den Elektrodenhalter.
- Blasen Sie in die Pipette durch den Mund, durch das Rohr mit dem Elektrodenhalter verbunden, wodurch es mit positivem Druck zu füllen. Schließen Sie das Rohrventil, um den Druck aufrechtzuerhalten.
- Mit dem Mikromanipulator die Elektrode in die Badkammer einführen.
- Führen Sie die Elektrode in die Nähe des distalen Abschnitts des Ommatidiums, so dass kein Kontakt zwischen der Elektrode und dem Ommatidium besteht, bis eine kleine Grübchen (aufgrund des positiven Drucks in der Patchpipette) im Ommatidium beobachtet werden kann.
- Öffnen Sie die Aufnahmesoftware (siehe Tabelle der Materialien ). Öffnen Sie das "Membran-Testmodul", um kontinuierliche quadratische Spannungsimpulse von 2 mV mit einer Rate von 100 Hz anzuwenden.
- Setzen Sie das Sperrpotential auf "Null", indem Sie den entsprechenden Kno einstellenB im Patch-Clamp-Verstärker, um die Basis des Rechteckimpulses auf Null zu setzen
HINWEIS: Der elektrophysiologische Aufbau beinhaltet eine Kopfstufe ( dh eine Verstärkung der ersten Stufe), die mit einem Verstärker verbunden ist ( dh Verstärkung der zweiten Stufe). Das verstärkte Analogsignal wird mit dem A / D-Wandler in ein Digitalsignal umgewandelt, das von einer auf einem PC-Rechner installierten Software gesteuert wird. - Lösen Sie den positiven Druck in der Pipette, indem Sie das Ventil des Rohres öffnen, das mit dem Elektrodenhalter verbunden ist. Schon vorsichtig einen Druck in der Pipette erzeugen, indem man aus dem Rohr heraussaugt, was zur Verbindung der Pipette zur Zellmembran führt. Schließen Sie das Rohrventil, um den Druck aufrechtzuerhalten.
- Stellen Sie sicher, dass der auf dem Computerbildschirm angezeigte Elektrodenwiderstand auf 100 - 150 MΩ erhöht ist. Lösen Sie den Unterdruck in der Pipette, indem Sie das Ventil des Rohres, das mit dem Elektrodenhalter verbunden ist, manuell öffnen.
- Stellen Sie sicher, dass die elDer Ektrodenwiderstand wird auf mindestens 1-2 GΩ erhöht.
HINWEIS: Zu diesem Zeitpunkt wurde eine Dichtung zwischen der Elektrode und dem Photorezeptor gebildet. - Versetzen Sie die kapazitiven Ströme der Pipette, indem Sie den entsprechenden Regler im Patch-Clamp-Verstärker einstellen.
- Erstellen Sie schnelle, kurze und kraftvolle Anfälle von Unterdruck in der Elektrode, saugen durch den Mund aus dem Rohr, das mit dem Elektrodenhalter verbunden ist, um in die Photorezeptormembran zu "brechen" und eine Ganzzellkonfiguration zu erzeugen. Alternativ verwenden Sie die "Zap-Taste", um kurze, rechteckige elektrische Impulse anzuwenden, beginnend mit einer Dauer von "0,1 ms" oder eine Kombination beider Methoden.
HINWEIS: Die Erzeugung der Ganzzellkonfiguration zeigt sich durch einen plötzlichen Anstieg der Pipettenkapazität (typischerweise ~ 60 pF für einen Wildtyp-R1-6-Photorezeptor, eine Kapazität von nur ~ 20 pF zeigt eine Aufzeichnung von einem R7-Photorezeptor an, eine Kapazitanz oben ~ 90 pF zeigt eine Aufnahme von zwei anPhotorezeptoren). - Setzen Sie das Haltepotential des Photorezeptors auf die erforderliche Spannung (meist -70 mV), manuell mit dem entsprechenden Regler im Patch-Clamp-Verstärker.
HINWEIS: Es ist möglich, diesen Schritt durchzuführen, nachdem ein Siegel erhalten wurde (Schritt 6.11) und bevor die Ganzzellkonfiguration erreicht wurde. - Versetzen Sie die kapazitiven Ströme und den Serienwiderstand (ein gemessener Serienwiderstandswert größer als 25 MΩ zeigt an, dass die Elektrodenpipette verstopft ist) und bei Bedarf ( dh bei größeren Strömen) die Widerstandskompensation mit den entsprechenden Reglern im Patch-Clamp-Verstärker anwenden .
- Schließen Sie den schwarzen Vorhang des Faraday-Käfigs, um maximale Dunkelheit und elektrische Isolation zu erhalten.
- Beginnen Sie den Aufzeichnungsprozess mit der Software und verabreichen Sie Lichtreize und / oder pharmakologische Substanzen nach dem gewünschten experimentellen Verfahren.
7. Gleichzeitiges WhOle-Cell-Aufnahmen und Ca 2+ Imaging
- Für genetisch codierte Ca 2+ Indikatoren isolieren Sie die Ommatidien wie oben beschrieben mit D. melanogaster fliegen, die GCaMP6f 13 exprimieren. Verwenden Sie für die Fluoreszenzmessung eine CCD-Kamera (siehe Tabelle der Materialien ) und stellen Sie sicher, dass das Mikroskop mit geeigneten Anregungs- und Emissionsfiltern und einem dichroitischen Spiegel ausgestattet ist (siehe Tabelle ).
- Für die Verwendung von exogenem Ca 2+ Indikator (Abbildung 4 , siehe Tabelle der Materialien ), isolieren Sie die ommatidia wie oben beschrieben. Darüber hinaus stellen Sie sicher, dass die Pipettenlösung einen 20-100 μM Kalziumindikator enthält.
- Verwenden Sie die Imaging-Software (siehe Tabelle der Materialien ), um Bilder mit einer Rate von 40 Hz zu erfassen. Führen Sie die Bildaufnahme während einer 10 s dunklen Periode durch, gefolgt von einem intensiven 2 s Licht stiMulde
- Verwenden Sie die Imaging-Software und definieren Sie eine Region of Interest (ROI). Messen Sie die Fluoreszenzintensität im ROI. Durchschnitt der dunklen Fluoreszenz (F D ) und subtrahieren sie von den Fluoreszenzaufnahmen während der Lichtreaktion (F L ) (F L -F D ). Normalisieren Sie diese Messungen entsprechend der Fluoreszenzintensität zu Beginn der Lichtstimulation (F L 0 ).
Ergebnisse
Das beschriebene Verfahren ermöglichte die genaue Aufzeichnung der fundamentalen Einheitsströme, die spontane und licht evozierte Quantenhöcker erzeugen, die die makroskopische Antwort auf Licht unter definierten Bedingungen erzeugen. Es erlaubte auch den Vergleich zwischen Wildtyp- und Mutantenfliegen, die Defekte in kritischen Signalmolekülen aufweisen ( Fig. 3 und 5 ) 14 , 15 , 16 , 17 , 18 . Darüber hinaus zeigte die Fähigkeit, das Umkehrpotential unter bi-ionischen Bedingungen zu messen, grundlegende biophysikalische Eigenschaften der TRP- und TRP-ähnlichen (TRPL) Kanäle 18 , 19 . Es ermöglichte auch die Messung der Wirkungen von Aminosäuresubstitutionen in der Porenregion von TRP, die ihr Ca 2+ modifiziertenDurchlässigkeit 20
Die durch Patch-Clamp-Ganzzell-Aufnahmen erhaltene Lichtreaktion hängt linear von der Lichtintensität für mindestens 4 Größenordnungen ab. Dies konnte nicht durch die Verwendung von ERG- und intrazellulären Aufzeichnungsverfahren behoben werden. Dementsprechend zeigte eine Reihe von Antworten auf kurze Blitze mit zunehmender Intensität und einer Auftragung der Intensitätsantwortfunktion eine strenge Linearität der Blitzreaktion mit zunehmender Lichtintensität. Die strenge Linearität hält bis zu mindestens einigen hundert pA, aber es ist umstritten, ob es danach Linearität oder Klemmsteuerung ist, die bricht (Abbildung 6 ). Diese Ergebnisse deuten darauf hin, dass die makroskopischen Reaktionen auf Licht eine lineare Summierung der unitären Reaktionen auf Licht ( dh Quantenstöße) sind.
Es wurde gut etabliert unter Verwendung von Spannungsaufzeichnungen, die Licht Stimulation indUces diskrete Spannungsschwankungen ( dh Quantenstöße) bei den meisten wirbellosen Arten. Die M. melanogaster Quantenbumps ergeben sich aus der konzertierten Öffnung von ~ 15 TRP Kanälen und ~ 2 TRPL Kanälen am Höhepunkt der Bump 18 . Jeder Stoß wird durch die Absorption eines einzelnen Photons erzeugt, während die makroskopische Reaktion auf intensivere Lichter die Summierung dieser elementaren Reaktionen 14 , 21 ist . Die Stöße variieren in Latenzzeit, Zeitverlauf und Amplitude, auch wenn die Stimulusbedingungen identisch sind. Die Bump-Generation ist ein stochastischer Prozess, der von der Poisson-Statistik beschrieben wird, wobei jedes effektiv absorbierte Photon nur einen Bump auslöst. Die Single-Photon-Single-Bump-Beziehung erfordert, dass jeder Schritt in der Kaskade nicht nur einen effizienten "Turn-On" -Mechanismus beinhaltet, sondern auch einen ebenso effektiven "Abschalt" -Mechanismus. Der funktionale Vorteil ist die Produktion vonSehr empfindlicher Photonenzähler mit einer schnellen Transientenreaktion, die sehr gut für die Empfindlichkeit und die zeitliche Auflösung des visuellen Systems geeignet ist. Die Anforderung an einen effizienten Abschaltmechanismus zeigt sich, wenn entweder das aktive Photopigment ( dh Metarhodopsin, M) oder sein Ziel, das G q α, nicht inaktiviert und zur kontinuierlichen Produktion von Stößen führt, lange nachdem das Licht ausgeschaltet ist ( Abb 3 ) 15 , 22 , 23 , 24 .
Der Stoß stellt die kooperative Aktivität der TRP / TRPL-Kanäle in einem Mikrovillus dar. Als solche sollte jede Hypothese der Kanalaktivierung auch die Kooperationskanalaktivierung erklären. Vor kurzem haben Hardie und Kollegen gezeigt, dass Licht rasche Kontraktionen der Photorezeptoren hervorruft, was darauf hindeutet, dass das lichtempfindlicheE Kanäle (TRP / TRPL) können mechanisch gated werden 25 . Diese mechanische Aktivierung, zusammen mit den beobachteten Protonen, die durch PLC-vermittelte PIP 2- Hydrolyse freigesetzt werden, fördern die Öffnung der TRP / TRPL-Kanäle und erklären die Kooperationsart der Bump-Produktion 26 . Derzeit sind D. melanogaster Photorezeptoren eines der wenigen Systeme, in denen Phosphoinositide Signaling und TRP Kanäle in vivo untersucht werden können, so dass D. melanogaster Phototransduktion und die Methodik entwickelt, um diesen Mechanismus ein sehr wertvolles Modell-System zu studieren.
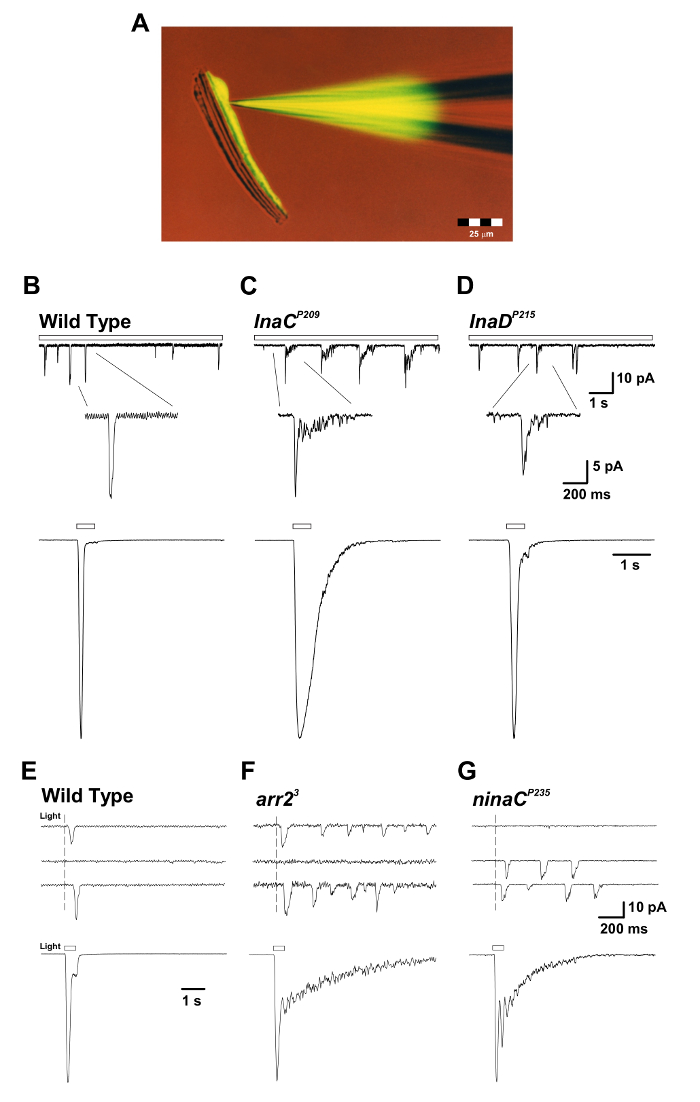
Abbildung 3: Die inaC P209 und inaD P215 Mutanten zeigen die langsame Reaktion Beenden der makroskopischen Reaktion auf Licht und der einzelnen Quantenhöcker. ( A ) Die isolierte Ommatidium prepaRation mit einer Patchpipette, gefüllt mit fluoreszierendem Lucifer Yellow CH-Farbstoff (Anregung: 430 nm, Emission: 540 nm) wird während einer Ganzzell-Aufzeichnung präsentiert. Man beachte, daß der Fluoreszenzfarbstoff diffundiert und einen einzelnen Photorezeptorzellkörper markiert ist und daß die Photorezeptorzellkörper von ihren langgestreckten Axonen abgelöst werden, aber dennoch die Lebensfähigkeit beibehalten. Diese Vorbereitung eignet sich für gleichzeitige Ganzzell-Aufnahmen und Imaging-Experimente. ( BD ) Obere Panels: Ganzzellige Spannung geklemmte Quanten-Bump-Reaktionen auf kontinuierliches Dämmerlicht (offener Stab) in WT, InaC P209 und InaD P215 Mutantenfliegen . Eine langsame Beendigung der Beulen wird bei inaC P209 und inaD P215- Mutanten relativ zu WT-Fliegen beobachtet . Die Einfügung unten zeigt die vergrößerte Form der einzelnen Stöße. Bodenpaneele: Normalisierte Ganzzell-aufgezeichnete makroskopische Reaktionen auf einen 500-ms-Lichtpuls (1,5 x 10 5 Photonen pro s) des obigen Wildtyps Und mutierte Fliegen. (EG) Obere Panels: Ganzzellige Spannung geklemmte Quanten-Bump-Reaktionen auf ein kurzes (1 ms), schwaches Licht, das Einzelphotonenantworten in Wildtyp-, arr2 3- und ninaC P235-Mutantenfliegen auslöst . Beachten Sie den Zug der in arr2 3 und ninaC P235 beobachteten Bumps in Reaktion auf eine einzelne Photonenabsorption. Bodenplatten: Ganzzellige Spannung klemmte normalisierte Reaktionen auf einen 500 ms Lichtimpuls (1,5 x 10 4 Photonen / s) in den entsprechenden Mutanten. Beachten Sie die langsame Beendigung der makroskopischen Reaktionen, die in arr2 3 beobachtet wurden Und NinaC P235 Mutante fliegt relativ zu WT. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
D / 55627 / 55627fig4.jpg "/>
Abbildung 4: Zelluläre Ca 2+ -Dynamik nach dem signalinduzierten Ca 2+ -Influx wird von Calphotin beeinflusst. Eine Zeitreihe von Photorezeptor-Bildern von Wildtyp- und Cpn- 1% -Flügen, die die Fluoreszenz des Ca 2+ -Analys während der Lichtstimulation zeigen. Rohfarbbilder werden mit Falschfarbenkodierung aufgetragen (bar = 10 μm, Pfeilspitzen geben die Pipette an). Bild nachgedruckt mit Genehmigung von Weiss et al. 4 Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
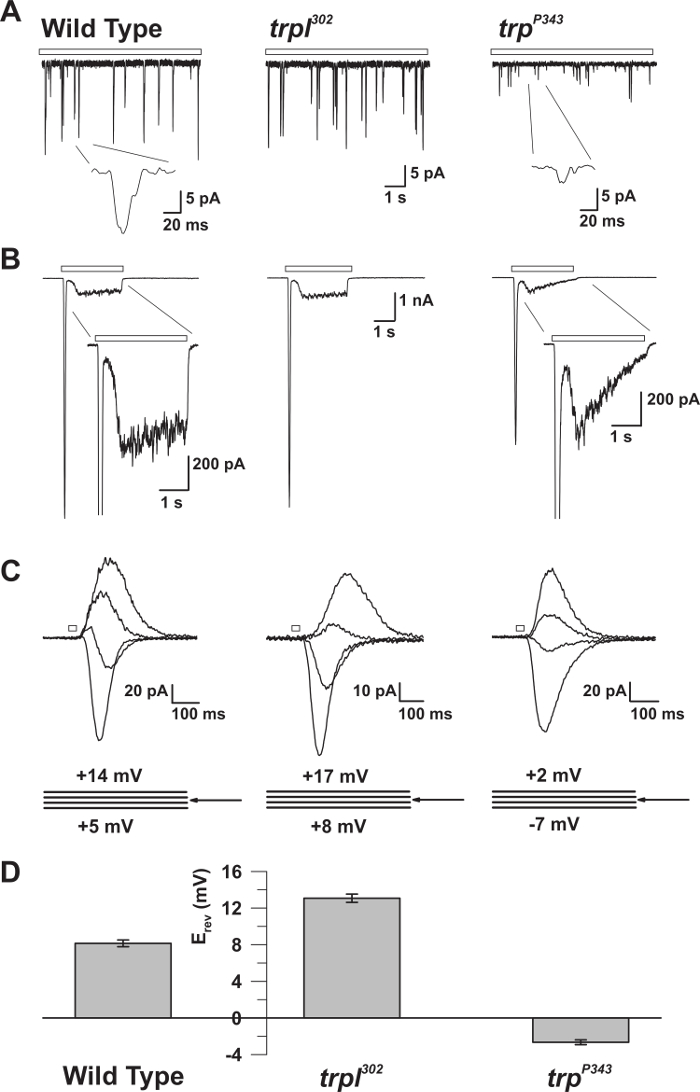
Abbildung 5: Die elektrophysiologischen Eigenschaften von WT, trp und trpl Mutanten. ( A ) Ganzzellspannungsklemme recoRings von Quantenstößen in Reaktion auf kontinuierliches schwaches Licht (offener Stab) in WT, trpl 302 und trp P343 Nullmutantenfliegen. Es werden sehr reduzierte Amplituden von trp P34 3 Beulen beobachtet. Inset: Vergrößerte Einzelquantenstöße von Wildtyp und trp P343 null Mutantenfliegen werden gezeigt. ( B ) Ganzzellige Spannungsklemmenaufnahmen in Reaktion auf einen 3 s Lichtpuls des Wildtyps und die entsprechenden Mutanten. Die transiente stationäre Reaktion der trp- P343- Mutante wird beobachtet. Inset: Vergrößerte Lichtreaktionen von WT und trp P343 Mutanten werden gezeigt. ( C ) Eine Familie von überlagerten lichtinduzierten Strömen der obigen Fliegendehnungen, die in Reaktion auf einen 20 ms-Lichtimpuls bei Spannungsschritten von 3 mV, gemessen um das Umkehrpotential (E rev ), hervorgerufen wurden. ( D ) Ein Histogramm, das die mittlere E rev des Wildtyps und die verschiedenen Mutanen darstelltTs Die Fehlerbalken sind die SEM Das Umkehrpotential (E rev ) von WT liegt zwischen dem positiven E rev von trpl 302 , das nur TRP exprimiert, und die E rev der trp P343 Nullmutante, die nur TRPL ausdrückt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
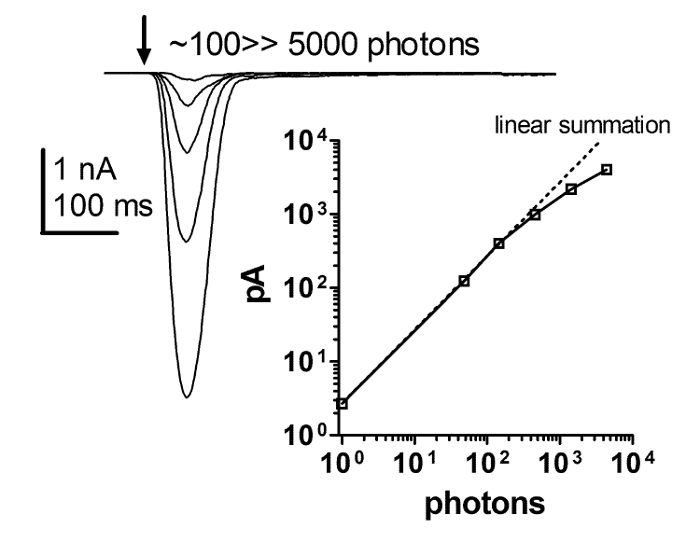
Abbildung 6: Die Flash-Antwort ist streng linear mit zunehmender Lichtintensität.
Eine Reihe von aktuellen Reaktionen auf kurze Blitze der zunehmenden Lichtintensität und eine Auftragung der Abhängigkeit der Spitzenamplitude der Lichtreaktion auf die zunehmende Intensität der kurzen Lichtblitze blinkt. Diese Beziehung zeigt eine strikte Linearität zwischen der Blitzreaktion und der zunehmenden Lichtintensität. Diese strenge LinearitätBis zu mindestens einigen hundert pA, mit Lichtintensität über 4 Größenordnungen, während es umstritten ist, ob es Linearität oder die Klemmensteuerung ist, die danach zerbricht. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| PH-Wert | 7.15 (mit NaOH einstellen) |
| Reagens | Konzentration (mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCl & sub2 ; | 4 |
| TES | 10 |
| Proline | 25 |
| Alanin | 5 |
| Bei -20 ° C aufbewahren. | |
| Hinweis: Diese Lösung ist nominell Ca 2+ frei, hat aber keine Ca 2+ Puffer und wird daher ca. 5 - 10 μM Trace Ca 2+ haben . Extrazelluläre Lösung (ES) = ES-0Ca 2+ mit 1,5 mM CaCl 2 , hergestellt durch Zugabe von CaCl 2 aus einer 0,5 oder 1 M Stammlösung zu ES-0Ca 2+ . | |
Tabelle 1: Ca + 2 -freie extrazelluläre Lösung (ES). Chemische Beschreibung und die spezifischen Mengen, die zur Herstellung von Ca +2- freie ES erforderlich sind.
| Reagens | Menge |
| FBS | 15 ml |
| Saccharose | 1,5 g |
| In 150 μl Aliquots in 1,5 mL Fläschchen teilen und bei -20 lagern 76; | |
| Triturierungslösung (TS) | Füllen Sie 1 Durchstechflasche mit 150 ml der Stammlösung mit 1.350 ml ES oder ES-0Ca 2+ , um die bei der Dissektion verwendete Lösung zu erfüllen. |
Tabelle 2: Fetales Rinderserum (FBS) + Saccharose - Lagerlösung. Chemische Beschreibung und die spezifischen Mengen, die zur Herstellung von fötalem Rinderserum (FBS) + Saccharose - Stammlösung erforderlich sind.
| PH-Wert | 7.15 (mit KOH einstellen) |
| Reagens | Konzentration (mM) |
| Kaliumglukonat (Kglu) | 140 |
| MgCl & sub2 ; | 2 |
| TES | 10 |
| ATP-Magnesiumsalz (MgATP) | 4 |
| GTP-Natriumsalz (Na 2 GTP) | 0,4 |
| Β-Nicotinamid-adenindinucleotidhydrat (NAD) | 1 |
| Bei -20 ° C aufbewahren. |
Tabelle 3: Intrazelluläre Lösung (IS1). Chemische Beschreibung und die spezifischen Mengen, die zur Herstellung von IS1 erforderlich sind, die meist für Intensitätsreaktionen und Quantenstoßmessungen verwendet werden.
| PH-Wert | 7.15 (mit CsOH einstellen) |
| Reagens | Konzentration (mM) |
| CsCl | 120 |
| MgCl & sub2 ; | 2 |
| TES | 10 |
| ATP-Magnesiumsalz (MgATP) | 4 |
| GTP-Natriumsalz (Na 2 GTP) | 0,4 |
| Β-Nicotinamid-adenindinucleotidhydrat (NAD) | 1 |
| Tetra-ethylammoniumchlorid (TAE) | 15 |
| Bei -20 ° C aufbewahren. |
Tabelle 4: Intrazelluläre Lösung (IS2). Chemische Beschreibung und die spezifischen Mengen, die zur Herstellung der intrazellulären Lösung IS2 erforderlich sind, die meistens für Umkehrpotentialmessungen des lichtinduzierten Stroms verwendet wird.
Diskussion
Die Anwendung von Ganzzell-Aufnahmen auf D. melanogaster Photorezeptoren erlaubte die Entdeckung und die funktionelle Aufklärung von neuartigen Signalproteinen wie TRP-Kanälen 27 , 28 , 29 und INAD 30 , 31 , 32 Gerüstprotein. Seit der ersten Einführung dieser Technik ermöglichte es die Auflösung von langfristigen Grundfragen bezüglich des Ionenmechanismus und der Spannungsabhängigkeit der Lichtreaktion. Dies geschah aufgrund der verliehenen Fähigkeit, die Membranspannung und die extrazelluläre und intrazelluläre ionische Zusammensetzung 19 , 28 genau zu steuern.
Ein großes Hindernis der Patch-Clamping-Technik in D. melanogaster war die Zerbrechlichkeit der isolierten ommatidia prepaRation. Detaillierte Untersuchungen haben ergeben, dass die Integrität der Phototransduktionsmaschinen kritisch von der kontinuierlichen Versorgung von ATP abhängt, insbesondere bei der Belichtung, was zu einem großen Verbrauch an ATP führt. Leider beseitigt die mechanische Streifenung der Pigment- ( dh Glia) -Zellen, die mit der Patchpipette zur Photorezeptormembran gelangen muss, die Hauptquelle der für die ATP-Produktion notwendigen Metaboliten 33 . Die Anwendung von exogenem ATP in die Aufzeichnungspipette erfüllt nur teilweise die Forderung nach großen Mengen an ATP. Eine kurze Versorgung mit ATP führt zu einer spontanen Aktivierung der TRP-Kanäle und zur Dissoziation der Phototransduktionsmaschinerie aus den lichtaktivierten Kanälen, was zu einer starken Zunahme des zellulären Ca 2+ und der Abschaffung der normalen Reaktion auf das Licht 34 , 35 führt . Diese Folge von Ereignissen ist nicht auf Schäden an derPhotorezeptoren durch das Sektionsverfahren, sondern vielmehr die zelluläre Erschöpfung von ATP. Um zu verhindern, dass diese Folge von Ereignissen auftritt und normale Lichtreaktionen aufrechterhalten wird, sollten die Photorezeptoren nicht intensiven Lichtern ausgesetzt werden, die große Mengen an ATP verbrauchen. Auch muss NAD in die Aufzeichnungspipette aufgenommen werden, vermutlich um die ATP-Produktion in den Mitochondrien 18 , 36 zu erleichtern. Für Messungen von Spontan- und Quantenstößen ist die obige Schwierigkeit minimal, da nur schwache Lichter verwendet werden. In der Praxis kann eine stabile Ganzzell-Aufzeichnung für ~ 20-25 min aufrechterhalten werden, obwohl es eine Tendenz gibt, dass die Reaktionskinetik über diesen Zeitraum verlangsamt wird. Eine einmalige Vorbereitung der dissoziierten Ommatidien kann bis zu 2 h lebensfähig bleiben.
Ein zusätzliches Manko der isolierten Ommatidienpräparation ist die Unzugänglichkeit der Mikrovilli, was auf die Unzugänglichkeit der TRP undTRPL-Kanäle zur Aufzeichnungspipette, die Einkanal-Aufnahmen verhindern. Mit einer von ihnen entwickelten Methode gelang es Bacigalupo und Kollegen, die Einkanal-Aktivität aus dem Rhabdomere direkt zu erfassen 37 . Jedoch unterscheidet sich diese Kanalaktivität von der von TRPL-Kanälen, die heterolog in den Gewebekulturzellen 38 exprimiert wurden, und von der TRP-Kanalaktivität, die aus der aus der isolierten Omatidia 34 erhaltenen Schussgeräuschanalyse abgeleitet ist. Vermutlich hat das Dissektionsverfahren die Photorezeptorzellen bei der Verwendung dieses Verfahrens stark beschädigt.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Der experimentelle Teil dieser Forschung wurde durch Stipendien der US-Israel Bi National Science Foundation (BM und IL), der Israel Science Foundation (ISF), der Deutsch-Israelischen Projektkooperation (DIP) (bis BM) und der Biotechnologie unterstützt Und Biological Sciences Research Council (BBSRC Grant Zahlen: BB / M007006 / 1 und BB / D007585 / 1) zu RCH
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
Referenzen
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten