Method Article
Flash-and-Freeze-: eine neuartige Technik Membrandynamik mit Elektronenmikroskopie zu erfassen
In diesem Artikel
Zusammenfassung
Wir entwickeln eine neue Technik in der Elektronenmikroskopie, „flash-and-freeze“, die die Visualisierung von Membrandynamik mit ms zeitlicher Auflösung ermöglicht. Diese Technik kombiniert die optogenetische Stimulation von Neuronen, die mit Hochdruck-Einfrieren. Hier haben wir die Verfahren zeigen, und die Protokolle im Detail beschreiben.
Zusammenfassung
Zellen ständig ihre Membranarchitektur und Proteinverteilung ändern, aber es ist extrem schwierig, diese Ereignisse zu einer zeitlichen und räumlichen Auflösung in der Größenordnung von ms und nm sichtbar zu machen sind. Wir haben eine zeitaufgelöste Elektronenmikroskopie Technik entwickelt, „flash-and-freeze“, die die zelluläre Ereignisse mit Optogenetik induziert und visualisiert die resultierende Membrandynamik von Zellen zu bestimmten Zeitpunkten nach der Stimulation Einfrieren. Um diese Technik zu demonstrieren, wir ausgedrückt Kanalrhodopsin, ein lichtempfindliches Kationenkanal, in Maus-Hippocampus-Neuronen. Ein Lichtblitz, stimuliert die neuronale Aktivität und induziert die Freisetzung von Neurotransmittern aus synaptischen Terminals durch die Fusion von synaptischen Vesikeln. Die optogenetische Stimulation von Neuronen gekoppelt ist, mit Hochdruck-Gefrieren zu morphologischen Veränderungen während der synaptischen Übertragung zu folgen. Mit einem kommerziellen Instrument erfasst wir die Fusion von synaptischen Vesikeln und die Erholung der synaptic Vesikelmembran. Um die Abfolge der Ereignisse zu visualisieren, wurden große Datensätze erzeugt und analysiert blind, da morphologische Veränderungen in verschiedenen Zellen im Laufe der Zeit folgten. Dennoch Blitz-und-freeze ermöglicht die Visualisierung von Membrandynamik in elektronenmikroskopischen Aufnahmen mit ms zeitlicher Auflösung.
Einleitung
Visualizing Membran und Proteindynamik innerhalb einer Zelle ist ein wichtiger Schritt, um die Zellbiologie bestimmter Prozesse zum Verständnis. Dynamische Handel Ereignisse können unter Verwendung von Licht oder Fluoreszenzmikroskopie erfasst. Fehlt jedoch wird der subzelluläre Kontext weitgehend in solchen Bildern , weil subzellulärer Strukturen nicht vollständig „gemalt“ durch Farbstoffe oder Fluoreszenzsonden und gelöst werden räumlich und spektral 1, 2 werden können. Auf der anderen Seite, während der Elektronenmikroskopie subzellulärer Architektur in kleinstem Detail beschreiben können, kann es nicht zelluläre Dynamik erfassen, weil Proben vor der Bildgebung fixiert werden müssen. So ist es in der Regel nicht ausreicht, um vollständig zelluläre Dynamik zu verstehen mit nur einer Bildgebungsmodalität.
Zur Überwindung der Grenzen von Licht- und Elektronenmikroskopie, korrelative Mikroskopie-Techniken entwickelt. Korrelat Licht- und Elektronenmikroskopie(Clem) visualisiert intrazellulärem Dynamik unter Verwendung von Lichtmikroskopie und die darunter liegende subzellulären Strukturen mit Elektronenmikroskopie. In Clem in verschiedenen Prozessen in Eingriff Zellen, wie Zytokinese und Endozytose 3, 4, 5, 6, sind Live-Bild versehen und dann für die Elektronenmikroskopie verarbeitet. Obwohl CLEM bestimmte Aspekte der intrazellulären Dynamik erfasst, gibt es vier Faktoren, die den Nutzen dieses Ansatzes begrenzen. Zuerst wird die zeitliche Auflösung begrenzt, wie schnell die Zellen immobilisiert werden, die typischerweise s dauert - min aufgrund der langsamen Diffusion und Reaktion von Fixiermitteln 7. Zweitens ist die subzelluläre Architektur beobachtet post facto 8; somit können die dynamischen morphologischen Veränderungen nicht mit diesem Ansatz erfaßt werden. Drittens können die Fluoreszenz und elektronenmikroskopische Aufnahmen nicht genau aufgrund von Geweben sh ausgerichtet werden,rinkage durch Dehydratation während der Probenvorbereitung für die Elektronenmikroskopie 9, 10 hervorgerufen. Viertens Veranstaltungen wie Zytokinese und Endozytose finden nicht zugleich in jeder Zelle 5, 11, und somit eine bestimmte Zelle, die im Fall beschäftigt ist , muss von einer großen Population von Zellen identifiziert werden. Dieser Prozess ist oft mühsam. Somit ist ein neues Verfahren notwendig bestimmte Ereignisse in jeder Zelle zu induzieren und die daraus resultierende zellulären Dynamik durch die schnelle Immobilisierung von Zellen zu bestimmten Zeitpunkt zu erfassen.
In letzter Zeit wurden mehrere Werkzeuge entwickelt besondere zelluläre Dynamik zu induzieren mit Hilfe von Licht (Optogenetik). Kanalrhodopsin ist ein lichtempfindlicher, nicht-selektiver Kationenkanal , isoliert aus Chlamydomonas reinhardtii 12, 13. Wenn Kanalrhodopsin in Neurona ausgedrücktl - Membranen, ein kurzer Lichtblitz induziert einen Einstrom von Natriumionen in Neuronen und löst ein Aktionspotential 14, 15. Das Aktionspotential breitet sich dann in den synaptischen Terminals, in denen synaptische Vesikel fusionieren innerhalb von Millisekunden 16, 17, 18 daher Kanalrhodopsin neuronaler Aktivität induziert. Um Membrandynamik an synaptischen Klemmen zu folgen, müssen Neuronen zu definierten Zeitpunkten nach der Stimulation mit Präzision ms immobilisiert werden.
Um Membrandynamik nach Induktion neuronaler Aktivität zu erfassen, wir koppelten Licht Stimulation mit Hochdruckgefrier 17, 18, 19. Hochdruck - Gefrieren ermöglicht die nahezu sofortige Immobilisierung von Zellen mit reduzierter Eiskristallbildung 20. Eiskristalle can Berstfolien und stören die subzelluläre Architektur 21. Durch Variation der Zeitintervalle zwischen Stimulation und Gefrieren, Membrantransport innerhalb synaptischen Terminals wurde nach der Induktion eines Aktionspotentials erfasst.
Hier zeigen wir, experimentelle Verfahren unter Verwendung einer kommerziell Hochdruckgefriermaschine, die Paare, die eine ms zeitliche Steuerung der Licht Stimulation mit Hochdruck-Einfrieren. Im Gegensatz zu anderen Instrumenten , die ein externes Gerät erfordern Lichtstimulation und Gefrieren zu steuern, ist Lichtstimulation vollständig in diesem System integriert und kann mit 19 ms Genauigkeit angewandt werden. Dieser Prozess umfasst mehrere Schritte. 1) Maus - Hippocampus - Neuronen , kultiviert auf Saphirscheiben und Lentivirus infiziert mit einem Expressionsvektor für Kanalrhodopsin 18 trägt. 2) Neurons stimuliert und zu definierten Zeitpunkten nach der Stimulation eingefroren. 3) Das vitrifiziert Wasser Ersatzd mit einem organischen Lösungsmittel, während Lipide und Proteine werden durch Fixative vernetzt die intrazelluläre Architektur zu erhalten. 4) Die Proben werden infiltriert und in Epoxyharz eingebettet. 5) Ultradünne Schnitte werden unter Verwendung eines Ultramikrotom gesammelt. 6) Dünne Schnitte werden auf einem Transmissionselektronenmikroskop abgebildet. 7) Bildaufnahme und Analyse blind in Bezug auf Zeitpunkt oder Genotypen durchgeführt. Zelluläre Dynamik kann durch die Rekonstruktion der zeitaufgelösten Bilder 17, 18 bestimmt werden. Probenvorbereitung (Schritte 2 bis 5 oben) eine Woche benötigt, aber die anschließende Bildanalyse erfordert Monate bis ein Jahr.
Protokoll
Alle Versuche wurden nach den Regeln und Vorschriften der Tiernutzung durch die National Institutes of Health durchgeführt. Das Protokoll wurde von der Animal Care und Use Committee (IACUC) an der Johns Hopkins School of Medicine zugelassen.
1. Isolierung und Kultur von Maus-Hippocampus-Neuronen
- Sezieren Rinden von einem postnatalen Tag 0 - Tag 2 (P0 - 2) Gehirn der Maus 18. Isolieren Sie die Astrozyten aus den Rinden.
HINWEIS: Das Gehirn der Maus wurde nach Enthauptung isoliert. Astrozyten dient als Feeder-Schicht für Hippocampus-Neuronen. - Behandelt die Rinden mit 800 & mgr; l von 0,05% Trypsin-EDTA für 15 Minuten bei 37 ° C die Astrozyten dissoziieren.
- Kultur der Astrozyten in einer T-75 - Kolben mit 13 ml DMEM , das 10% fötalen Rinderserum (FBS) und 0,2% Penicillin-Streptomycin für eine Woche bei 37 ° C und 5% CO 2.
- Legen Sie eine Säure gewaschenes und sterilisiertes 18 mm Deckglas per Vertiefung einer 12-Well-Platte.
- kohlenstoffbeschichteten Saphirplatten in 70% Ethanol und legen sie auf der jeweils Deckglas kurz waschen zwei 6 mm.
- Bereiten Poly-D-lysin (PDL) Lösung, die durch Mischen von 3 ml 17 nM Essigsäure mit 1 ml Rattenschwanz-Kollagen und 1 ml PDL (1 mg / ml). Bewerben 200 ul PDL-Lösung auf die Saphirplatten und Glasplättchen für 5 min bei RT.
- Entfernen Sie die PDL-Lösung und der Luft trocknen. Vor der Verwendung wird die Platte sterilisiert wie in den Schritten 1.4 hergestellt - 1,6 für 30 min unter UV-Licht.
- Saatgut die Astrozyten aus Schritt 1.3 in 2 ml DMEM mit einer Dichte von 5x10 4 Zellen / Napf in der Platte , wie hergestellt in Schritten von 1,4 bis 1,6. Sie wachsen bei 37 ° C und 5% CO 2 für eine Woche.
- Fügen Sie 20 ul fluoro-desoxyuridin (Endkonzentration: 80 uM) zu jeder Vertiefung für mindestens ein paar Stunden, bevor die Neuronen Kultivierung.
HINWEIS: Fluoro-desoxyuridin Astrozyten Division stoppt. - Ändern des Mediums auf 1,5 ml neuronaler basal - Medium (siehe Tabelle of Materials) , enthaltend 1% L-Alanyl-L-Glutamin (siehe Tabelle of Materials), 2% serumfreien Zuschlag für neuronale Zellen (siehe die Tabelle des Materials), und 0,2% Penicillin-Streptomycin .
- Bereiten Papain - Lösung durch Zugabe von 20 Einheiten Papain zu 5 ml Enzymlösung (1,65 mM Cystein, 1 mM CaCl 2 und 0,5 mM EDTA in DMEM). Man säuert die Lösung mit CO 2 -Gas für 20 min durchgeleitet wurde . Filter-Sterilisieren mit einem 0,22 um-Filter.
- Ernten Sie das Gehirn von einem P0 - 2 - Maus 18. Ab sofort überträgt, das Gehirn zu eiskalter Hanks'-ausgeglichener Salzlösung (HBSS). Seziert die Hippocampi unter einem Stereomikroskop, das Gewebe zu halten in HBSS getaucht.
- Platzieren Sie die beiden Hippocampi in 1 ml der Papain-Lösung, hergestellt in Schritt 1.11. Inkubieren für 1 h auf einem Thermomixer bei 37 ° C und 750 Umdrehungen pro Minute.
- Ersetzen der Papain mit 1 ml inaktivierende Lösung, enthaltend2,5 mg Trypsin-Inhibitor und 0,5 mg Albumin pro ml DMEM. Inkubieren Sie für 5 min bei 37 ° C. Absaugen der inaktivierenden Lösung.
- In 200 ul neuronalen Grundmedium (siehe Tabelle der Materialien) auf den isolierten Hippocampus. Verreibe eine 200 & mgr; l-Pipettenspitze mit Hilfe der Zellen dissoziieren. Warten, bis die nicht-dissoziierten Zellen am Boden absetzen. Entfernen Sie vorsichtig das Medium mit Zellen von oben.
- Wiederholen Sie Schritt 1,15 3x. Pool alle dissoziierten Zellen in ein neues 1,5 ml Zentrifugenröhrchen.
- Zähle die Anzahl der Zellen unter Verwendung eines Hämozytometers. Platte Neuronen bei einer Dichte von 6,5 x 10 4 Zellen / Vertiefung auf der Oberseite der Schicht in Astrozyten Schritten hergestellt 1,1-1,10.
- Infect die Neuronen mit Lentivirus Kanalrhodopsin bei DIV 3 (3 d in vitro) 18 exprimieren.
- Führen Sie Flash-und-freeze auf DIV 14, wie 2.1 in den Schritten - 2.5, unten.
2. Blitz eind-Gefrier
- Herstellung von Fixative
- Unter einer chemischen Haube, die folgenden Substanzen in ein konischen Rohr die Fixiermittel vorzubereiten: 2,5 ml Glutardialdehyd (10% Lager in Aceton), 0,25 g Osmiumtetroxid, 0,25 ml Wasser und 22.25 ml wasserfreiem Aceton.
HINWEIS: Die Endkonzentration jeder Komponente 1% in Aceton sein sollte. Glutaraldehyd wird hinzugefügt, um die Proteinstrukturen während der Gefriert Substitution zu bewahren. ACHTUNG: Die akute Toxizität von Osmiumtetroxid ist hoch. Die Exposition gegenüber Dämpfen könnte die Hornhaut des Auges schädigen. Es sollte nur in einer zertifizierten chemischen Haube behandelt werden. - Aliquot 1 ml Fixativ in nummerierte Kryoröhrchen (2 ml) zugegeben. Halten Sie das Fixiermittel in flüssigem Stickstoff bis zur Verwendung eingefroren.
HINWEIS: Osmiumtetroxid und Glutaraldehyd kreuzreagieren und auszufällen; Somit kann, sobald gemischt, Aliquot sofort die Rohre Kappe und die Kryoröhrchen in flüssigem Stickstoff versenken, um das Fixierungsmittel gefrieren. Verwenden Sie einen Bleistift die Kryo nummerierengenic Fläschchen kann, da Aceton Marker abzuwaschen.
- Unter einer chemischen Haube, die folgenden Substanzen in ein konischen Rohr die Fixiermittel vorzubereiten: 2,5 ml Glutardialdehyd (10% Lager in Aceton), 0,25 g Osmiumtetroxid, 0,25 ml Wasser und 22.25 ml wasserfreiem Aceton.
- Herstellung von Physiologische Saline
- Make physiologische Kochsalzlösung durch Mischen von Hepes (10 mM, pH 7,5), NaCl (140 mM), KCl (2,4 mM) und Glucose (10 mM).
HINWEIS: Diese Werte sind Endkonzentrationen. Cryo-Schutzmittel sind nicht für die Monolayer-Kulturen verwendet. Jedoch wird ein geeignetes Cryo-Schutzmittel für Proben erforderlich dicker als 5 um. Die Verwendung von 20% BSA wird in der Regel empfohlen. Hefe - Paste und E. coli OP50 kann auch als Kryo-Schutzmittel für Fliegenlarven oder C. elegans verwendet werden. - Hinzufügen CaCl 2 bei 4 mM MgCl 2 und 1 mM bei Endkonzentrationen.
HINWEIS: Die Konzentrationen von CaCl 2 und MgCl 2 auf Experimente variieren. Um die Erfassung von exozytischen Zwischenprodukten zu gewährleisten, 4 mM Calcium für diese speziellen Experimente verwendet 18 die Freisetzungswahrscheinlichkeit von Vesikeln zu erhöhen. - Überprüf denOsmolarität einen osmometer verwenden. Stellen Sie sicher, dass es 300 ± 5 mOsm ist.
- Hinzufügen AMPA-Rezeptor-Antagonist (NBQX) bis zu einer Endkonzentration von 3 & mgr; M und GABA-Rezeptor-Antagonisten (Bicucullin) bis zu einer Endkonzentration von 30 uM.
HINWEIS: Neurotransmitter - Rezeptor - Antagonisten rezidivierende Netzwerkaktivität nach einem neuronalen Stimulation 18 zu vermeiden , werden hinzugefügt. - Sich aufzuwärmen, die physiologische Kochsalzlösung auf 37 ° C zum Einsatz.
- Make physiologische Kochsalzlösung durch Mischen von Hepes (10 mM, pH 7,5), NaCl (140 mM), KCl (2,4 mM) und Glucose (10 mM).
- Vorbereitung des Fachhochdruckes Gefrierschrank und eine automatisierte Freeze - Substitution Einheit
- Vor dem Hochdruck-Gefrieren, abkühlen, eine automatisierte freeze Substitutionseinheit auf -90 ° C durch den Tank mit flüssigem Stickstoff gefüllt wird.
- Das Abkühlen der Aceton in einer kleinen Tasse bis -90 ° C, indem er innerhalb der Probenkammer platzieren.
- Füllen des flüssigen Stickstoffs Dewar und Lagerung Dewar des Hochdruckgefriergerät (siehe Tabelle of Materials) mit flüssigem nitrogen.
- Stellen Sie das Lichtstimulationsprotokoll mit dem Touch-Screen-Monitor auf.
- Nennen Sie das Programm, indem Sie auf „Bearbeiten“ neben „Programmname“ auf der Lichtstimulation Fenster. Ein weiteres Fenster öffnet sich.
- Gesetzt, ein Programm, indem „15.000 ms“ in „dunklen Phase“, „100 ms“ in „Zeit“, „10 ms“ in der Eingabe „pulse“ und „1“ in „Anzahl der Perioden“ für einen Einzelreiz von 10 Frau. Einfrieren der Zellen 90 ms später (1C).
HINWEIS: Die „dunkle Phase“ ermöglicht es den Zellen, die aus Lichtexposition während der Probenbeladung zu erholen. „Period“ definiert die Stimulationsfrequenz. Zum Beispiel sollte, wenn der Stimulus bei 20 Hz angelegt werden, sollten diese Spalte auf 50 ms eingestellt werden. „Pulse“ definiert die Dauer des Lichtreizes. Schließlich definiert die „Anzahl der Perioden“ die Gesamtzahl der Stimuli angewandt. eine Hochfrequenz-Stimulation für die Einrichtung finden Sie unter 1E.
- Für einen "keine Stimulation" Steuerung, Typen "15 s" in "dunklen Phase", "0 ms" in "Zeit", "1 ms" in "pulse" und "0" in "Anzahl der Perioden" im Lichte Stimulations Setup-Fenster, wie es in Schritt 2.3.4 beschrieben.
HINWEIS: Standardmäßig ist der „Impuls“ muss mindestens 1 ms betragen. - Auf dem Hauptbildschirm, stellen Sie sicher, dass das Feld für Lichtstimulation aktiviert ist.
- Stellen Sie das Speicherprotokoll, indem „Specimen Storage“ auf dem Hauptbildschirm klicken. Klicken Sie auf „Bearbeiten“. Im folgende Fenster verwenden „+“ oder „-“, „2“, um zu speichern, 2 Platten in jedem Kanal (3 Kanäle insgesamt). Überprüfen Sie "Storage LN2 aktiviert."
- Probe geladen und Einfrieren in der Hochdruck - Gefrierschrank
HINWEIS: Alle Probenanordnung und Ladeschritte unter einem Stereomikroskop mit einem 7.5-60X Vergrößerungsbereich getan. Ein TWEEZer wird in den Schritten 2.4.1 verwendet - 2.4.4, um die Proben zu manipulieren. Die Versuche müssen bei physiologischer Temperatur durchgeführt werden.- Legen Sie eine Saphirscheibe, Zellseite nach oben, in der auch der schwarzen, mittleren Platte (1B).
- Legen Sie einen 100 & mgr; m Distanzring über den Saphirscheibe (1B).
- Legen Sie eine leere Saphirscheibe über den Distanzring (1B) nach dem in der vorgewärmten Kochsalzlösung aus dem Schritt 2.2 eine Seite der Platte eingetaucht wird . Achten Sie darauf, dass keine Luftblasen zwischen den beiden Saphirscheiben eingeklemmt werden.
- Legen Sie eine anderen 100 & mgr; m und einen Distanzring 400 um Distanzring (1B). Entfernen Sie die überschüssige Flüssigkeit mit Filterpapier.
- Platzieren Sie die Anordnung aus Schritt 2.4.3 zwischen den beiden transparenten Halbzylinder (1A). Schließen Sie die obere rote Abdeckung den Gefrierprozess zu initiieren.
HINWEIS: Das voreingestellte Protokoll läuft automatisch ab, sobald der Deckel geschlossen ist. Die Probe bleibt in der gleichen Ausrichtung in der Gefrierkammer, und ein Lichtblitz von der Oberseite der Probe Anordnung aufgebracht. Die rote Abdeckung öffnet wieder automatisch, sobald der Gefriervorgang beendet ist. - Lagern Sie die Probe in dem Speicher Dewar.
HINWEIS: Nach dem Einfrieren wird die Probe automatisch gelöscht, in ein Lager Dewar mit flüssigem Stickstoff gefüllt und dort bis zum weiteren Verarbeitung gelagert. Die Lager Dewar hat drei Kammern, und jede Kammer kann bis zu 3 Proben höchstens halten. Typischerweise werden zwei Proben unter den gleichen Stimulationsbedingungen eingefroren, und die Hochdruck-Tiefkühltruhe ist so programmiert, beide in der gleichen Kammer zu speichern. - Wiederholen Sie die Schritte 2.4.1 - 2.4.6 für jede Probe.
- Gehen 2.5 zu Schritt einmal alle Kammern voll sind.
HINWEIS: Das Gerät eingestellt wurde zu einer Zeit in dem Speicher Dewar bis 6 Proben zu speichern. Deshalb nach jedem 6. Probe, Schritt 2.5 durchgeführt werden muss. Einmal entladen, wiederholen Sie die Schritte 2.4.1 - 2.4.6.
- Probensammlung und Transfer zu einer automatisierten Gefriersubstitution Einheit
- Öffnet die Tür zu dem Speicher Dewar, der unter dem Tisch der Hochdruck-Tiefkühltruhe angeordnet ist. Entfernen Sie die Speicher Dewar und legen Sie sie am Prüfplatz.
- Mit den Händen, Entfernen der Probenkammer von der Dewar und übertragen sie in der Fachprobenschale mit flüssigem Stickstoff gefüllt. Schalte den Knopf, um den Probenbecher freizugeben.
- Den transparenten Halbzylinder aus dem Probenbecher mit einer Pinzette nach Vorkühlung der Spitze der Pinzette mit flüssigem Stickstoff (-196 ° C ~). Sorgfältig überträgt die mittleren, flüssigen Stickstoff schwarze Platte auf einen kleinen Becher enthalten.
HINWEIS: Die Spitzen der Pinzette muss auf die Temperatur von flüssigem Stickstoff vorgekühlt werden. Die Probe muss unter flüssigem Stickstoff zu allen Zeiten gehalten werden, die Bildung von Eiskristallen zu verhindern.
3. Freeze-Substitution in der Automatischen Gefriersubstitution Einheit
- Verwendung von vorgekühltem Pinzette (TIPS bei ~ 196 ° C), schnell überträgt die mittlere Platte aus Schritt 2.5.3 auf das vorgekühlte Aceton (-90 ° C).
- Trennen Sie die Saphirscheibe von der mittleren Platte durch leichtes Schütteln oder Klopfen.
HINWEIS: Gelegentlich kann es schwierig sein, die Saphirscheibe von der mittleren Platte zu trennen. In einer solchen Situation, lassen Sie die mittlere Platte in vorgekühltes Aceton (-90 ° C) für ein paar Minuten. Leichtes Klopfen mit einer Pinzette hilft auch, die Saphir aus der mittleren Platte zu distanzieren. - Legen Sie eine Kryoröhrchen Fixiermitteln (Schritt 2.1) innerhalb einer Probenkammer der Substitutionseinheit enthalten. Übertragen Sie die Saphirscheibe in die kryogene Fläschchen und legen Sie eine Kappe auf dem Fläschchen.
- Stellen Sie das Gefriertsubstitutionsprogramm wie folgt: (i) -90 ° C für 5-30 h, (ii) -90 - -20 ° C in 14 h (5 ° C / h), (iii) -20 ° C für 12 h, und (iv) -20 ° C - 20 ° C in 4 h (10 ° C / h).
HINWEIS: Die duRation des ersten Schrittes bei -90 ° C variiert werden. Die Gesamtdauer der Gefriersubstitution wird so eingestellt, dass das Programm am Morgen endet (~ 1,5 d postexperiment) um 08.00 Uhr, so dass die nachfolgenden Schritte können während des Tages durchgeführt werden.
4. Infiltrations- und Kunststoff Embedding mit Epoxidharz
- Sobald das Programm endet, verwenden behandschuhte Hände die Kryoröhrchen mit den Saphir-Scheiben aus der Probenkammer der Substitutionseinheit zu einer chemischen Haube zu übertragen.
- Mit einer Pipette hinzu Aceton (Raumtemperatur) zu jedem Kryoröhrchen und waschen jede Saphirscheibe 4 - 6x für 1 - 2 Stunden.
- Optional kann für 1 h, die Proben in 0,1% Uranylacetat inkubieren, wenn zusätzlicher Kontrast benötigt wird. Waschen 4 - 6x mit Aceton über 1 - 2 Stunden.
HINWEIS: ACHTUNG: Es besteht die Gefahr mit internen Exposition nach dem Einatmen von Uranylacetat, die Reizungen der oberen Atemwege verursacht. Hohe Belichtung kann DAMAGe Blutkörperchen. Arbeit mit Uranylacetat sollte unter Entlüftung erfolgen. Schutzkleidung wird empfohlen. - Bereiten flüssiges Epoxidharz Medium durch Abwiegen von 6,2 g Glycerinpolyglycidylether, 4,4 g Bisphenol-A-Epoxidharz und 12,2 g Dodecenylbernsteinsäureanhydrid (DDSA). Gründlich mischen und fügen 800 ul Benzyldimethylamin (BDMA) während des Mischens. De-Gas für 10 min.
- Herstellung von 30, 70 und 90% Epoxidharz in Aceton aus dem 100% Epoxyharz, hergestellt in Schritt 4.4.
- Fügen Sie 30% Epoxidharz auf die Kryoröhrchen Saphirplatten enthalten, und Inkubieren für 2 - 3 h bei RT in einem Orbitalschüttler bei 120 Umdrehungen pro Minute.
- Ersetzen von 30% Epoxyharz mit 70% Epoxidharz durch Pipettieren und Inkubation für 3 bis 4 h bei RT in einem Orbitalschüttler.
- Mit einer Pinzette überträgt jede Saphirscheibe, Zell Seite nach oben, auf die Kappe eines Einbettungskapsel. Fügen Sie 90% Epoxidharz auf der Kappe. Inkubieren O / N bei 4 ° C.
- Am nächsten Tag macht frisches Medium Epoxidharz, wie in Schritt 40,4.
- Überträgt jede Saphirscheibe, Zellseite nach oben auf die Kappe eines Einbettungskapsel. Füllen der Kappe mit frisch hergestelltem 100% Epoxidharz. Ändern, um 100% frisch Epoxidharz alle 2 h, Wiederholen dreimal.
- Platzieren Sie die Proben in einem 60 ° C Ofen für 48 Stunden zu polymerisieren.
5. Montage Proben
- Die Probe wird umgedreht auf dem Stereomikroskop, so dass das Saphirscheibe an der Oberseite des Harzblockes befindet. Entfernen der dünnen Schicht aus Epoxidharz von oben, indem sie es mit einer Rasierklinge zu verkratzen.
- Unter Verwendung einer Rasierklinge geschnitten, um eine flache Linie entlang der Kante der Saphirscheibe; Diese Linie trägt in Schritt 5.3 die Saphirscheibe von dem Epoxidharz zu trennen.
- Trennt die Saphirscheibe aus dem Epoxidharz, indem sie in flüssigen Stickstoff für etwa 10 s eingetaucht wird.
HINWEIS: Die Zellen in dem Epoxidharz bleiben. - Nach dem Saphirscheibe zu entfernen, verwenden Sie ein Binokular einen Bereich mit Zellen zu finden (4-10 x Vergrößerung). Cut um den Bereich von Interesse (~ 2 x 2 mm) mit einer Rasierklinge (zweischneidiges). Um die Probe in Position zu halten, führen diesen Schritt, während die Probe auf die Oberfläche des Mikroskops abgeklebt wird.
- Montieren Sie das kleine Stück Plastik (~ 2 x 2 x 5 mm), um die Zellen unter Verwendung von Klebstoff, enthaltend Ethylcyanoacrylat auf einem zylindrischen Blindblock aus Epoxydharz enthält. Inkubieren den Block bei 60 ° C für 1 h.
6. Sectioning
- Verwenden eines Ultramikrotom Abschnitt der Probe.
- Schneiden Sie die Oberfläche der Kunststoff eingebettete Probe mit einem Glasmesser mit einer Geschwindigkeit von 3 mm / s und einer Dicke von 200 nm / Abschnitt. Cut 4 - 5 Abschnitte von der Oberfläche, wo die Astrozyten befinden.
- Schalten zu einem Diamantmesser und den Abschnitt mit einer Geschwindigkeit von 0,8 mm / s und einer Dicke von 40 nm / Abschnitt. Schneiden Sie von 20 bis 25 Abschnitte.
- Sammeln Bänder von Abschnitten auf Einzelschlitzkupfergitter bedeckt mit 0,7% Polyvinylacetat (siehedie Tabelle der Materialien).
7. Bildgebung unter Verwendung eines Transmissions-Elektronenmikroskops (TEM)
- Stand der Bildgebung TEM den Abschnitt mit 2,5% Uranylacetat in Methanol für 5 min beflecken.
- Waschen Sie das Gitter 15x in 50% Methanol. Dann wäscht in Reinstwasser 15x, mit jeder Wäsche von 30 s.
- Kurz an der Luft trocknet den Abschnitt und den Rost in einen Probenhalter des TEM.
- Bild bei 93,000X Vergrößerung.
- Erwerben Sie Bilder.
HINWEIS: Imaging erfolgt typischerweise blind für die Zeitpunkte oder Genotypen, und in der Regel ~ 200 Bilder werden gesammelt / Zeitpunkt.
8. Bildanalyse
- Analysieren Sie die Bilder mit einer Software (zB ImageJ) mit einem benutzerdefinierten Makro (Watanabe, Davis, und Jorgensen, nicht veröffentlicht).
HINWEIS: Die x / y-Koordinaten von Vesikeln aufgezeichnet sind, die Plasmamembran, die aktive Zone Membran und alle anderen membrangebundenen Organellen an den Synapsen. Der Text files , die Informationen enthalten , werden an eine andere Software exportiert (zB Matlab). Die Daten werden weiter mit benutzerdefinierten Programmen analysiert.
Ergebnisse
Unter Verwendung des oben beschriebenen Protokolls, führten wir „flash-and-freeze“ Experimente in der Maus Hippocampus-Neuronen exprimieren Kanalrhodopsin. Diese Neuronen wurden eingefroren entweder 15 ms oder 100 ms nach Beginn der Hellperiode. Wir haben zuvor gezeigt , dass die Exozytose und Endozytose synaptischer Vesikel im synaptischen Klemmen treten bei dem 15 ms und 100 ms Zeitpunkt jeweils 18. Diese Ereignisse wurden erfolgreich zu den entsprechenden Zeiten (Abbildung 2) erfaßt, was darauf hindeutet , dass Flash-und Kühlversuche erfolgreich auf der gewählte Fachdurchgeführt werden Hochdruckgefriermaschine (siehe Tabelle der Materialien).
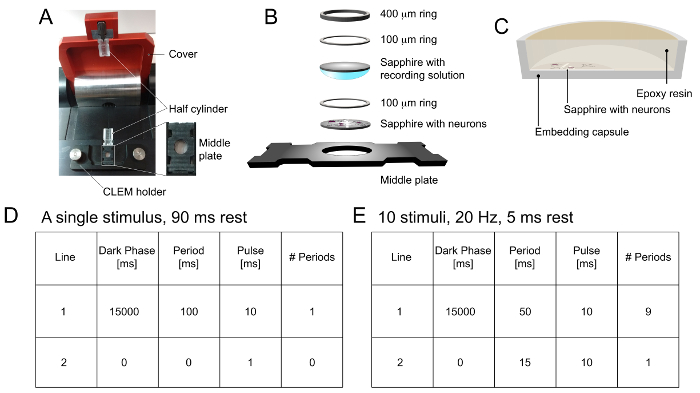
Abbildung 1. Beispiel Läden und Programmierung im Hochdruck - Gefrierschrank. A) Probenladetisch eines Hoch pruck Gefrierschrank. Die mittlere Platte, für die strukturelle Detail in der Einfügung gezeigt, wird in einem Halter für CLEM Probenbeladung platziert. Eine der Halbzylinder ist am unteren Teil des Probenladetisch platziert, und der andere mit einem Clip an der oberen Abdeckung angebracht ist. Sobald die Probe geladen wird, wird die Mittelplatte auf den unteren Halbzylinder nach vorne gedrückt und die Abdeckung geschlossen wird, um das Einfrieren zu initiieren. B) Probenanordnung. Das Saphirscheibe enthaltende Neuronen wird in der Vertiefung der Mittelplatte, mit der Zellseite nach oben gelegt. Ein 100 & mgr; m Ring ist direkt über dem Saphirscheibe innerhalb der Vertiefung gegeben. Dann wird eine leere in physiologischer Kochsalzlösung getaucht Saphirscheibe ist nach unten mit der Lösung Seite angeordnet. Luftblasen zu vermeiden. Schließlich werden 100 & mgr; m und ein Ring 400 um Ring eng anliegend darüber angeordnet. Jede zusätzliche Flüssigkeit wird mit Filterpapier entfernt. C) Ein Querschnitt eines Einbettungs Kapsel mit der Saphirscheibe in Epoxidharz eingetaucht. die sappmieten Scheibe ist am Boden der Kapsel angeordnet ist, mit der Zellseite nach oben zeigt und mit Epoxidharz für die Infiltrierung und Einbettung abgedeckt. D) Programmieren die Hochdruck - Tiefkühltruhe für einen einzelnen, 10 ms Reiz. Die Proben werden eingefroren 90 ms nach dem Lichtimpuls. E) Programmieren die Hochdruck - Tiefkühltruhe für 10 Impulse bei 20 Hz. Die Proben werden eingefroren 5 ms nach dem letzten Lichtimpuls. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
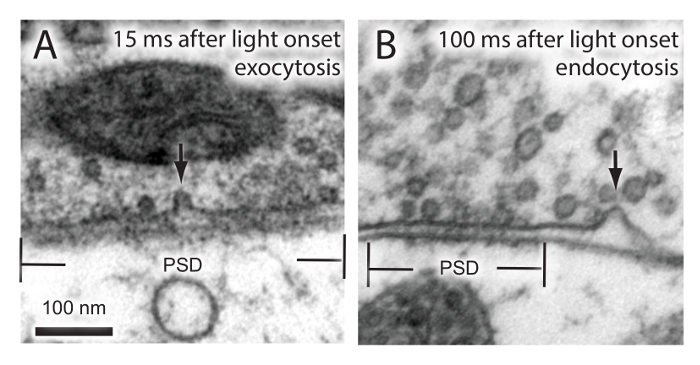
Abbildung 2. Visualisierung von Exocytosis und Endozytose in Maus - Hippocampus - Neuronen. Hippocampus-Neuronen stimuliert einmal und zu den angegebenen Zeiten eingefroren. Elektronenmikroskopische Aufnahmen zeigen die Exozytose eines synaptischen Vesikel - A) und ultraschneller endocytosis B). PSD, postsynaptischen Dichte. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Der „Flash-and-freeze“ Ansatz visualisiert Membrandynamik durch ein bestimmtes Zellereignis mit Optogenetik induzieren und durch die Zellen zu bestimmten Zeitpunkt nach der Stimulation 19 einfriert. In dieser Demonstration verwenden wir Kanalrhodopsin, um einen lichtempfindlichen Kationenkanal, Neuronen zu stimulieren und erfasst die Fusion und Rückgewinnung von synaptischen Vesikeln an dem synaptischen Terminals. In den letzten Jahren haben viele optogenetische Werkzeuge wurden 22 entwickelt, 23, die alle mit kompatiblen Flash-und Kühltruhe. Zum Beispiel kann Organell Handel 24 unter Verwendung von durch Licht induzierte Heterodimerisierung von Crypto und CIB1 induziert werden. In ähnlicher Weise kann die Lipid - Zusammensetzung der Plasmamembran durch die lichtinduzierte Translokation von Phosphoinositid Phosphatasen zur Plasmamembran 25 verändert werden. Weiterhin kleine, lichtempfindliche Verbindungen wie Azobenzol change Konformation auf den Beleuchtungswellenlängen abhängig. Diese Konformationsänderung kann verwendet werden , Liganden-gesteuerte Kanäle zu aktivieren oder Lipidzusammensetzung in der Membran 26, 27 zu ändern. Caged Verbindungen können auch zu induzieren Zellaktivität verwendet werden. Jedoch kann die LED verwendet in der aktuellen Setup nicht ausreichend Energie für Uncaging erzeugen; somit weitere Optimierungen des Systems sind wahrscheinlich notwendig. Dennoch sind die Anwendungen dieser lichtaktivierbaren Werkzeuge flexiblen viele zelluläre Ereignisse, die von einem Lichtblitz induziert werden kann. „Flash-and freeze“ können die resultierenden Membrandynamik erfassen.
Es gibt zwei Haupt Einschränkungen für die „Flash-and-freeze“ -Verfahren. Erstens, es fängt „Schnappschüsse“ eines bestimmten Ereignisses aus verschiedenen Zellen. Mit anderen Worten ist es nicht möglich Membrandynamik in einer Zelle über einen Zeitraum von Zeit zu folgen. So wird für die Rekonstruktion eines zellulären selbstt, muss man eine große Anzahl von Bildern von jeder Probe und zu jedem Zeitpunkt erwerben und analysieren. Weiterhin in Neuronen, eine noch größere Anzahl von Bildern ist notwendig, da die Fusion von synaptischen Vesikeln nur Orte nimmt in 20 - 30% der Synapsen in Maus - Hippocampus - Neuronen 18, 28. Die Analyse einer solch großen Datenmenge erfordert enorme Mengen an Zeit. In Zukunft Bildaufnahme und Analyse müssen automatisiert werden der Ansatz effizienter 29, 30 zu machen.
Die zweite Einschränkung ist durch die Natur der Hochdruckgefriertechnik auferlegt. Wenn die Zellen einzufrieren, zelluläres Wasser lagert sich Eiskristalle zu bilden , wenn die Gefriergeschwindigkeit unter 100 K / s 21 ist. Diese Eiskristalle kann Membranen eindringen oder gelöste Stoffe konzentrieren lokalen osmotischen Druck zu verändern, was zu dem Bruch von Membranen. Zur Vermeidung von Eiskristallen, high Druck (~ 2,000 atm) wird an den Proben angewendet. Aufgrund des Unterkühlungs-Effekts ist eine Gefriergeschwindigkeit von 100 K / s ausreichend Wasser , um zu verhindern , 21 bei diesem Druck Eiskristalle bilden. Theoretisch Proben so dick wie 500 & mgr; m ohne Eiskristallen gefroren werden kann, aber etwa 200 & mgr; m ist wahrscheinlich die praktische Grenze, wie quader Formen von Eis neigen dazu, in dickem Gewebe zu bilden, zu beeinträchtigen Morphologie. Bei der Bearbeitung von Proben dicker als 5 um, ist die Verwendung eines geeigneten Cryo-Schutzmittel, wie beispielsweise BSA, notwendig. BSA wird die Osmolarität der Lösung ändert jedoch und kann die physiologische Reaktion von Zellen beeinflussen. Daher sind umfangreiche Kontrollexperimente erforderlich, um die Verwendung von BSA in bestimmten Systemen zu validieren. Eiskristalle kann auch nach dem Hochdruck Einfrieren bilden, wenn die Proben aus Versehen aus dem Bad aus flüssigen Stickstoff entfernt werden. Somit ist es wichtig, die Proben in dem flüssigen Stickstoff zu allen Zeiten zu halten, und vorgekühlte Zange zu verwenden, ummanipulieren sie.
Wenn Experimente planen, sollten die folgenden drei Punkte in Betracht gezogen werden. Zuerst wird die maximale Intensität des Lichts (die 460 nm - Linie) ist 5,5 bis 8,0 mW / mm 2. Ob diese Intensität ausreicht Aktivität zu induzieren muß mit Live-Cell-Imaging auf einem Fluoreszenzmikroskop vor dem Blitz-und-freeze Experimente überprüft werden. Zweitens müssen Experimente bei physiologischer Temperatur durchgeführt werden. Die Stufe der Hochdruck - Tiefkühltruhe ist , auf 37 ° C für die Experimente mit Maus - Hippocampus - Neuronen 31 erwärmt. Schließlich müssen die Zeitpunkte sorgfältig die Membrandynamik gewählt werden, zu erfassen. Erste Untersuchungen zeigten, dass die Endozytose nach 100 ms der Stimulation abgeschlossen ist. Somit werden drei zusätzliche Zeitpunkten (15, 30, und 50 ms) wurden auch die Membrandynamik 17 zu folgen , untersucht 18. Diese Zeitpunkte waren notwendig, Membrantransport Ereignis zu visualisierens während der synaptischen Übertragung. Allerdings sind die Voraussetzung für die Anzahl von Zeitpunkten unterschiedlich in jedem Zellereignis. Daher sollte ein paar Zeitpunkten vor große Daten-Set Sammlung initiiert werden abgetastet.
Offenlegungen
Open - Access - Veröffentlichung dieses Artikels wurde von Leica Mikrosysteme GmbH gefördert.
Danksagungen
Diese Arbeit wurde durch die Finanzierung von der Johns Hopkins University (SW) unterstützt. Wir danken der Johns Hopkins School of Medicine Mikroskop Einrichtung für ihre technische Unterstützung. Wir danken Erik Jorgensen und Christian Rosenmund und die Mitglieder ihrer Labors für die Entwicklung der Technik. Wir danken M. Wayne Davis für die Gestaltung des ursprünglichen Geräts. Wir danken Paul Wurzinger, Cveta Tomova und Delgermaa Luvsanjav für ihre technische Hilfe. Wir danken auch Natalie R. Hamilton und Grant F. Kusick für die kritische Durchsicht des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Freeze-substitution and Low-temperature Embedding System for Light and Electron Microscopy -AFS II | Leica | ||
| High Pressure Freezer - EM-ICE | Leica | EM ICE is a specialized high pressure freezer that allows precise control of light stimulation and freezing. | |
| Osmometer | Gonotec | ||
| Ultramicrotome UC7 | Leica | ||
| Oven | Blue M | ||
| Razor blade | Personna | ||
| Glutaraldehyde | EMS | 16530 | |
| Osmium tetroxide | EMS | RT19132 | Toxic, open only under certified chemical hood |
| Acetone | EMS | RT10016 | |
| HEPES | Emdmillipore | 391340-250GM | |
| Glucose | Sigma | 49159-1KG | |
| KCl | Sigma | 746436-1KG | |
| NaCl | Sigma | S7653-1KG | |
| CaCl2 | Sigma | 21115-250ML | |
| MgCl2 | J.T.Baker | 2444-01 | |
| Liquid epoxy resin Eponate 12 | Ted Pella | 18028 | |
| Bisphenol A epoxy resin Araldite 502 | Ted Pella | 18028 | |
| Dodecenyl succinic anhydride (DDSA) | Ted Pella | 18028 | |
| Benzyl dimethyl amine (BDMA) | Ted Pella | 18241 | |
| Special embedding (BEEM) capsule | EMS | 70021 | |
| Copper Grid | Ted Pella | 1GC12H | |
| Polyvinyl acetate (Pioloform F) | Ted Pella | 19244 | |
| Uranyl acetate | Polysciences | 21447-25 | |
| Ethyl cyanoacrylate (Super glue) | Scotch | 170497 | |
| Trypsin-EDTA | Themo scientific | 25300-120 | |
| DMEM (Dulbecco's Modified Eagle's Medium) | Thermo scientific | 10569-044 | Should be warmed to 37 °C before use |
| FBS (Fetal Bovine Serum) | Thermo scientific | 26140-079 | |
| Pen-Strep | Thermo scientific | 15140-122 | |
| Fluoro-deoxyuridine (FUDR) | Sigma | F0503 | |
| Glass cover slip | Fisher | S175223 | Should be acid-washed |
| Sapphire disc | Technotrade | 616-100 | |
| Acetic acid | Emdmillipore | 1000631011 | |
| Poly-D-Lysine (PDL) | Sigma | P6407 | |
| Rat tail collagen | Thermo scientific | A10483-01 | |
| Neurobasal A | Fisher | 10888022 | Should be warmed to 37 °C before use |
| L-alanyl-L-glutamine (Glutamax) | Fisher | 35050-079 | |
| Seraum free supplement (B-27) | Fisher | 17504044 | |
| Hanks'-balanced Salt Solution (HBSS) | Thermo scientific | 24020117 | |
| Papain | Worthington | LS003126 | Active Unit should be calculated for each batch |
| Thermomixer | Eppendorf | Thermomixer C | |
| Trypsin inhibitor | Sigma | T9253 | |
| NBQX | Tocris | 03-731-0 | |
| Bicculine | Tocris | 01-091-0 | |
| Whatman I filter paper | GE | ||
| Transmission Electron Microscope | Philips CM20 |
Referenzen
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), aab3500 (2015).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Sjollema, K. A., Schnell, U., Kuipers, J., Kalicharan, R., Giepmans, B. N. G. Correlated light microscopy and electron microscopy. Methods Cell Biol. 111, 157-173 (2012).
- Redemann, S., Müller-Reichert, T. Correlative light and electron microscopy for the analysis of cell division. Journal Microsc. 251 (2), 109-112 (2013).
- Kukulski, W., Schorb, M., Kaksonen, M., Briggs, J. A. G. Plasma membrane reshaping during endocytosis is revealed by time-resolved electron tomography. Cell. 150 (3), 508-520 (2012).
- Kobayashi, S., Iwamoto, M., Haraguchi, T. Live correlative light-electron microscopy to observe molecular dynamics in high resolution. Microscopy (Oxford, England). 65 (4), 296-308 (2016).
- Start, R. D., Layton, C. M., Cross, S. S., Smith, J. H. Reassessment of the rate of fixative diffusion. J Clin Pathol. 45 (12), 1120-1121 (1992).
- Müller-Reichert, T., Srayko, M., Hyman, A., O'Toole, E. T., McDonald, K. Correlative Light and Electron Microscopy of Early Caenorhabditis elegans Embryos in Mitosis. Cellular Electron Microscopy. 79, 101-119 (2007).
- Bykov, Y. S., Cortese, M., Briggs, J. A. G., Bartenschlager, R. Correlative light and electron microscopy methods for the study of virus-cell interactions. FEBS Lett. 590 (13), 1877-1895 (2016).
- Casanova, G., Nolin, F., Wortham, L., Ploton, D., Banchet, V., Michel, J. Shrinkage of freeze-dried cryosections of cells: Investigations by EFTEM and cryo-CLEM. Micron. 88, 77-83 (2016).
- Kukulski, W., Schorb, M., Welsch, S., Picco, A., Kaksonen, M., Briggs, J. A. G. Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J Cell Biol. 192 (1), 111-119 (2011).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U.S.A. 100 (24), 13940-13945 (2003).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neurosci. 8 (9), 1263-1268 (2005).
- Nagel, G., Brauner, M., Liewald, J. F., Adeishvili, N., Bamberg, E., Gottschalk, A. Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol. 15 (24), 2279-2284 (2005).
- Heuser, J. E., Reese, T. S. Structural changes after transmitter release at the frog neuromuscular junction. J Cell Biol. 88 (3), 564-580 (1981).
- Watanabe, S., et al. Ultrafast endocytosis at Caenorhabditis elegans neuromuscular junctions. eLife. 2, e00723 (2013).
- Watanabe, S., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S. Flash-and-Freeze: Coordinating Optogenetic Stimulation with Rapid Freezing to Visualize Membrane Dynamics at Synapses with Millisecond Resolution. Front Synaptic Neurosci. 8, 24 (2016).
- Moor, H. . Cryotechniques in Biological Electron Microscopy. , (1987).
- Dubochet, J. The physics of rapid cooling and its implications for cryoimmobilization of cells. Methods Cell Biol. 79, 7-21 (2007).
- Weitzman, M., Hahn, K. M. Optogenetic approaches to cell migration and beyond. Curr Opin Cell Biol. 30, 112-120 (2014).
- Niu, J., Ben Johny, ., Dick, M., E, I., Inoue, T. Following Optogenetic Dimerizers and Quantitative Prospects. Biophys J. 111 (6), 1132-1140 (2016).
- van Bergeijk, P., Adrian, M., Hoogenraad, C. C., Kapitein, L. C. Optogenetic control of organelle transport and positioning. Nature. 518 (7537), 111-114 (2015).
- Idevall-Hagren, O., Dickson, E. J., Hille, B., Toomre, D. K., De Camilli, P. Optogenetic control of phosphoinositide metabolism. Proc Natl Acad of Sci U.S.A. 109 (35), E2316-E2323 (2012).
- Kramer, R. H., Fortin, D. L., Trauner, D. New photochemical tools for controlling neuronal activity. Curr Opin Neurobiol. 19 (5), 544-552 (2009).
- Frank, J. A., Franquelim, H. G., Schwille, P., Trauner, D. Optical Control of Lipid Rafts with Photoswitchable Ceramides. J Am Chem Soc. 138 (39), 12981-12986 (2016).
- Rosenmund, C., Clements, J. D., Westbrook, G. L. Nonuniform probability of glutamate release at a hippocampal synapse. Science. 262 (5134), 754-757 (1993).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), e329 (2004).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28 (12), 2959-2964 (2008).
- Watanabe, S., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten