Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Glukoseaufnahme Messung und Response auf Insulin Stimulation in
In diesem Artikel
Zusammenfassung
Bei diesem Verfahren werden menschliche primäre Muskelzellen in vitro kultiviert, um differenzierte Myotubes zu erhalten, und Glucose-Aufnahmeraten werden gemessen. Wir liefern ein detailliertes Protokoll zur Quantifizierung von Raten in basalen und insulin-stimulierten Zuständen unter Verwendung von radioaktiv markiertem [ 3 H] 2-Desoxy-D-Glucose.
Zusammenfassung
Skelettmuskel ist die größte Glukoseablagerung bei Säugetieren und trägt wesentlich zur Glukose-Homöostase bei. Die Beurteilung der Insulinsensitivität von Muskelzellen ist für alle Studien, die der Erforschung des Muskelglukosestoffwechsels und der Charakterisierung von Stoffwechselveränderungen gewidmet sind, von großer Bedeutung. In den Muskelzellen bewegen sich Glukosetransporter Typ 4 (GLUT4) -Proteine als Reaktion auf Insulin in die Plasmamembran, so dass ein massiver Eintritt von Glukose in die Zelle möglich ist. Die Fähigkeit der Muskelzellen, auf Insulin zu reagieren, indem sie die Rate der Glukoseaufnahme erhöht, ist eine der Standardauslesungen, um die Empfindlichkeit der Muskelzelle gegenüber Insulin zu quantifizieren. Menschliche primäre Myotubes sind ein geeignetes in vitro- Modell, da die Zellen viele Merkmale des Spender-Phänotyps beibehalten, einschließlich Insulinsensitivität. Dieses in vitro Modell eignet sich auch für den Test von Verbindungen, die die Insulinreaktion beeinflussen könnten. Messungen der Glukoseaufnahmerate in differenzierten Myotubes reflektierenInsulinsensitivität
Bei dieser Methode werden menschliche primäre Muskelzellen in vitro kultiviert, um differenzierte Myotubes zu erhalten, und Glukoseaufnahmeraten mit und ohne Insulinstimulation werden gemessen. Wir liefern ein detailliertes Protokoll zur quantitativen Bestimmung von passiven und aktiven Glukosetransportraten unter Verwendung von radioaktiv markiertem [ 3 H] 2-Desoxy-D-Glucose ([ 3 H] 2dG). Berechnungsmethoden werden zur Quantifizierung der aktiven basalen und insulin-stimulierten Raten sowie der Stimulationsfalte bereitgestellt.
Einleitung
Skelettmuskel ist die größte Glukoseablagerung bei Säugetieren und trägt wesentlich zur Glukose-Homöostase bei. Dieses Insulin reagierende Gewebe ist die primäre Stelle der Glukoseaufnahme, die durch Insulinstimulation ausgelöst wird 1 .
Bei Typ-2-Diabetes wird die Insulinresistenz in mehreren Geweben, einschließlich des Skelettmuskels, beobachtet und führt zu einer übermäßigen Blutglukosekonzentration. So ist es von großer Bedeutung, den Grad der Insulinsensitivität dieses Gewebes und seiner Zellen zu bestimmen, ob es darum geht, einen Defekt eines Subjekts zu charakterisieren oder die Effizienz einer Behandlung zu beurteilen, die beabsichtigt, sie zu verbessern. Bei menschlichen oder tierischen Probanden ist die Gold-Standard-Technik zur Beurteilung der Insulinsensitivität die hyperinsulinämisch-euglykämische Klammer. Eingeführt von DeFronzo im Jahr 1979 2 und seit 3 , 4 geändert , dann erlaubt die Methode, den ganzen Körper zu quantifizierenNd Gewebe Insulin-Reaktionsfähigkeit gemessen als die Rate der Glukose, um unter Insulin-Stimulation perfundiert werden, um die normale Blutglukose-Konzentration zu erhalten.
Insulin-Sensitivitäts-Exploration kann auch auf der Zellebene unter Verwendung von In-vitro- Muskelmodellen durchgeführt werden, und die Messung der Glukose-Aufnahmeraten bleibt ein effizientes und zuverlässiges Werkzeug, um die biologische Antwort der Zelle auf die Insulinstimulation 5 , 6 , 7 zu quantifizieren. In der Tat quantifiziert die Glukose-Aufnahme-Messung die zellbiologische Antwort auf Insulin-Stimulation, von der Bindung von Insulin an seinen Rezeptor an die Translokation von GLUT4 angereicherten Vesikeln und einschließlich intrazellulärer Signal- und Phosphorylierungskaskaden 8 .
Dies ist von großer Bedeutung für menschliche Proben, da differenzierte Myotubes viele Merkmale des Spender-Phänotyps beibehalten, einschließlich metabolischer EigenschaftenUnd Störungen, die bei Patienten 9 , 10 , 11 , 12 beobachtet wurden . Die Myotubes zeigen strukturelle, metabolische und phänotypische Ähnlichkeiten mit dem Skelettmuskel 13 , 14 , einschließlich der Expression von Glukosetransportern 15 und der zellulären Insulin-Signalisierungsmaschine 16 . So ist die Messung der Glukoseaufnahme in primären Myotubes für die Charakterisierung des Muskelphänotyps eines Spenders relevant oder untersucht die Wirkung einer Intervention (Arzneimittel, Ernährung oder körperliche Aktivität) auf die Insulinsensitivität in der Muskelzelle.
Die Messung der Glukoseaufnahme auf kultivierten Myotubes ist auch ein zuverlässiges Werkzeug bei der Durchführung von Experimenten, die die Insulinsensitivität modifizieren 17 , 18 . Die in vitro Modell eignet sich für den Test von beliebigen Verbindungen, die die Insulinreaktionsfähigkeit verbessern könnten oder die erworbene oder induzierte Insulinresistenz 19 , 20 , 21 , 22 , 23 verhindern oder umkehren könnten.
Hier beschreiben wir ein detailliertes Protokoll zur Kultur und differenzieren menschliche Myotubes und zur Messung der Zellglukose-Aufnahmeraten. Die Methode gilt für jede Quelle von menschlichen Muskelvorläuferzellen, ob sie aus In-Labor-Präparaten, Collaboration oder kommerziell erhältlichen Lieferanten stammen. Immortalisierte Muskelzelllinien, wie C2C12 und L6, jeweils aus Maus- und Rattenursprung, können auch für die Glukoseaufnahme mit diesem Protokoll verwendet werden 7 .
Wir liefern ein detailliertes Protokoll zur Quantifizierung von Raten in basalen und Insulin-stimulierten Zuständen unter Verwendung von radioaktiv markiertem [ 3 H] 2dG. TDie Verwendung eines markierten Glukose-Analogons ermöglicht eine genaue Bestimmung des Glukoseeintritts mit reduziertem Ausgangsmaterial, ein gemeinsamer Zustand bei der Arbeit mit Primärzellen. Das modifizierte Glukosemolekül ist nicht in der Lage, metabolische Wege einzugehen und sich somit innerhalb der Zelle zu akkumulieren, was eine zuverlässige Quantifizierung über die gesamte Zellradioaktivität ermöglicht. Die experimentellen Bedingungen umfassen die Verwendung eines Glukose-Transport-Inhibitors (Cytochalasin B), und Messungen werden mit und ohne Insulin durchgeführt. Diese Kombination ermöglicht die Bestimmung der Glukose-Eintrittsraten sowie die Berechnung der Faltungsänderung für den Insulinreaktionsindex. Die Methode wird mit einer Dosis Insulin während einer einzigen Inkubationszeit präsentiert, aber das Protokoll kann leicht für Dosisreaktionen oder Zeitverlaufsexperimente modifiziert werden 12 .
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Vorbereitung von Zellkulturmedien und -lösungen
- Vorbereitung von Kulturmedien
- Bereiten Sie das Proliferationsmedium (PM) vor, indem Sie das F-10-Medium von Ham mit Glutamin (2 mM), Penicillin / Streptomycin (5 & mgr; g / ml Finale), 2% Fetal Calf Serum (FCS) und 2% Serumersatz ergänzen.
- Bereiten Sie das Differenzierungsmedium (DM) vor, indem Sie Dulbecco's Modified Eagle Medium (DMEM) mit Glutamin (2 mM), Penicillin / Streptomycin (5 μg / ml Finale) und 2% FCS ergänzen.
- Vorbereitung von Glukose-Aufnahmelösungen
Achtung: Die Handhabung von radioaktivem Material ist nur in einem eingeschränkten und kontrollierten Bereich durch autorisiertes Personal zulässig. Material und Abfall müssen nach den entsprechenden Verfahren, Richtlinien und örtlichen Gesetzen behandelt werden.- Zur Herstellung von X-Dulbecco-Phosphat-gepufferter Kochsalzlösung (X-DPBS) eine Lösung von DPBS, enthaltend 0,2% (w / v) (Endkonzentration) RinderserumalbumUmin (BSA). Filtriere die Lösung durch einen 0,2 μm Filter. Bei 4 ° C aufbewahren.
- Zur Herstellung von kalter 2-Desoxy-D-glucose (2dG) -Lösung wiegen 16,4 mg 2dG und in 10 ml destilliertem Wasser solubilisieren, um eine 10 mM Lösung zu erhalten. Bei 4 ° C aufbewahren.
- Fügen Sie 600 μl kaltes 2dG und 6 μl radioaktiv markiertes [ 3 H] 2dG zu 5400 μl X-DPBS hinzu, um die radioaktiv markierte 2dG (2dG *) - Lösung zu erhalten.
HINWEIS: Die Endkonzentration beträgt 1 mM 2dG und die Markierung beträgt 1 μCi / mL.- Stellen Sie ein 20 μl Aliquot (TC20) der radioaktiv markierten 2dG * -Lösung auf.
- Herstellung von Inkubationsmischungen
- Für die Cytochalasin-B-Mischung werden 2 μl 20 mM Cytochalasin B zu 2 ml radioaktiv markierter 2dG * -Lösung gegeben.
HINWEIS: Die Stammlösung von Cytochalasin B liegt bei 10 mg / ml in Dimethylsulfoxid (DMSO). - Für die DMSO-Mischung werden 4 μl DMSO zu den restlichen 4 ml radioaktiv markierten 2dG * -Lösung gegeben.
- Für die Cytochalasin-B-Mischung werden 2 μl 20 mM Cytochalasin B zu 2 ml radioaktiv markierter 2dG * -Lösung gegeben.
2. Kultur der menschlichen primären Muskelzellen
- Aussaat von 6-Well-Platten mit menschlichen Muskelsatellitenzellen
HINWEIS: Im Haushalt (siehe Referenz 24 für Details) oder handelsübliche menschliche Muskelsatellitenzellen aus einer gefrorenen Durchstechflasche (mit 250.000 Zellen) verwenden. Das folgende Verfahren wird für 250.000 Zellen gegeben, um eine 6-Well-Platte zu erhalten, die für die Messung der Glukoseaufnahme in einem einzigen Zustand erforderlich ist.- Schnelles Auffrischen von gefrorenen Durchstechflaschen von hauseigenen 24 oder kommerziellen Vorbereitungen von menschlichen Muskelsatellitenzellen in vorgewärmtem Wasser (37 ° C), bis nur ein kleiner Eisblock in der Durchstechflasche verbleibt.
- Gießen Sie direkt in ein 50 ml Plastikröhrchen, das 10 ml vorgewärmtes (37 ° C) PM enthält.
- 5 min bei 500 xg zentrifugieren und den Überstand verwerfen.
- Das Zellpellet vorsichtig mit 18 ml vorgewärmtem PM (um 42.000 Zellen pro3 ml Medium). 3 ml in jeder Vertiefung einer 6-Well-Platte (9,6 cm 2 ) verteilen.
HINWEIS: Die sechs einzelnen Vertiefungen einer Platte sind erforderlich, um eine doppelte Messung der Glukoseaufnahme für die folgenden Bedingungen durchzuführen: passive Transportinhibierung (Wells 1 und 2), Basalrate (Wells 3 und 4) und Insulin stimulierte Rate (Wells 5 und 6). Wiederholen Sie so viele Sechs-Well-Platten, wie verschiedene Behandlungen erforderlich sind. - Inkubieren in Standardkulturbedingungen (37 ° C, 5% CO 2 ) bis Zellen 90% Konfluenz erreichen.
HINWEIS: Dieser Schritt dauert je nach Zellcharge zwischen 48 - 72 Stunden. Ändern Sie während dieses Schrittes kein Medium.
- Differenzierung der muskelzellen
- PM (nach 48-72 h) entfernen und mit vorgewärmtem DM (3 ml pro Vertiefung) ersetzen. Inkubieren bei 37 ° C, 5% CO 2 .
HINWEIS: Die Differenzierung dauert fünf Tage, um einen stabilen Zustand zu erreichen, in dem die Zellen ausgerichtet und polynukleiert sind. In der Regel ist die primäreMyotubes werden in einem 1 g / l Glukosemedium kultiviert. Um die Glukoseverarmung während der Kultur zu vermeiden, füllen Sie die Platte mit 3 ml Medium, um sicherzustellen, dass genügend Glukosesubstrat für die Zellen zur Verfügung steht. - Ersetzen Sie DM alle zwei Tage.
HINWEIS: Ab diesem Zeitpunkt sind Myotubes für bis zu 7 Tage ohne signifikante Veränderung stabil und die Glukoseaufnahme kann jederzeit durchgeführt werden.
- PM (nach 48-72 h) entfernen und mit vorgewärmtem DM (3 ml pro Vertiefung) ersetzen. Inkubieren bei 37 ° C, 5% CO 2 .
- Muskelzellenbehandlung (optional)
HINWEIS: Primäre Myotubes können für mehrere Tage behandelt werden, um eine Modifikation (Arzneimitteltest, Inhibitoren / Aktivatoren des Signalweges usw. ) vor Insulinstimulation und Glukoseaufnahmemessungen zu induzieren. Muskelzellen können jeder Behandlung unterworfen werden, die einen Einfluss auf die Insulinsensitivität haben kann, und die Glukose-Aufnahmemessung wird diese Wirkung quantifizieren. Zum Beispiel fördert die Inkubation von Muskelzellen mit dem gesättigten Fettsäurepalmitat die Insulinresistenz und die Zellen, die reduziert werdenNsulin stimulierte die Glukoseaufnahme.- 12 ml DM, ergänzt mit 10% BSA (fettsäurefrei) und 0,5 ml Palmitat (PALM), zubereiten. Vorbereitet 12 ml DM, ergänzt mit 10% BSA (nur fettsäurefrei).
- Bereiten Sie zwei 6-Well-Platten mit menschlichen primären Myotubes vor und kultivieren Sie sie wie in den Abschnitten 2.1 und 2.2 beschrieben (mit 5 Tagen Differenzierung).
- Am Tag 5, waschen Sie sich mit 2 ml PBS. Zu einer Platte fügen Sie 2 ml DM mit PALM hinzu. Auf die andere Platte füge 2 ml BSA nur DM hinzu.
- Inkubieren für 48 h bei 37 ° C, 5% CO 2 .
3. Insulin-Stimulation
- Waschen Sie die differenzierten Muskelzellen zweimal mit 2 ml PBS.
- PBS sorgfältig entfernen und mit 3 mL DM ohne FCS für 3 h (37 ° C, 5% CO 2 ) zur Serumverarmung inkubieren.
- Ersetzen Sie das Medium in allen Brunnen mit 3 mL DM ohne FCS. Füge 100 nM Insulin zu den Brunnen 5 und 6 hinzu.
- Inkubieren Sie menschliche Myotubes Kultur für1 h (37 ° C, 5% CO 2 ).
4. Glukoseaufnahme
- Nach 1 h Insulinstimulation, Wells zweimal mit X-DPBS (1 ml pro Waschgang) waschen.
- Füge 1 ml Cytochalasin-B-Gemisch zu den Vertiefungen 1 und 2 und 1 ml DMSO-Gemisch zu den Vertiefungen 3 - 6 hinzu. Inkubieren für 15 min (37 ° C, 5% CO 2 ). Am Ende der Inkubation sofort die Platte auf Eis legen.
5. Zell-Lyse
- Waschen Sie die Zellen zweimal mit 1 ml eiskaltem PBS.
- Lyse die Zellen in jeder Vertiefung mit 600 μl 50 mM NaOH. Inkubieren auf Eis für 5 min und mischen sanft mit langsamer orbital Rotation.
HINWEIS: Wenn das Lysat zu viskos ist, mit bis zu 1,5 ml NaOH verdünnen. - Verwenden Sie eine Pipette, resuspendieren und sammeln Sie das Zelllysat.
6. Bestimmung von radioaktiv markiertem Glukose
- Setzen Sie 400 μl jedes Zelllysats in eine Flüssigkeitsszintillationszählung ein. Bereiten Sie eine Negativkontrolle mit 400 vorΜL 50 mM NaOH und ein positives Kontrollgefäß mit 20 μl TC20 (ab Schritt 1.2.3.1).
- Füge 4 ml Flüssigkeitsszintillationslösung zu jeder Durchstechflasche hinzu. Schließen Sie die Kappe und mischen Sie jede Durchstechflasche gründlich (1-2 s).
- Setzen Sie jede Durchstechflasche in einen Flüssigkeitsszintillationszähler ein und messen Sie die Radioaktivität gemäß der Anweisungen des Herstellers. Aufzeichnungszählungen pro Minute (CPM) für jede Szintillationsröhre für 10 min.
HINWEIS: CPM = "Zerfall pro Minute" x "Zählwirkung".
7. Rate der Glukoseaufnahme
- Verwenden Sie das restliche Lysat (200 μL, ab Schritt 5.2), um die Proteinkonzentration zu messen. Bestimmen Sie die Proteinkonzentration jedes Zelllysats mit Bradford 25 oder einer äquivalenten Methode. Berechnen Sie die Gesamtproteinmenge (Q) in mg für jede Vertiefung.
- Um TC1 zu erhalten (der Wert für 1 μl radioaktiv markiertes 2dG *), teilen Sie den CPM-Wert von TC20 um 20.
- Für jede Durchstechflasche berechnen Sie tDie Rate der Glukoseaufnahme wie folgt:
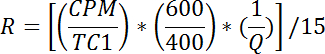
HINWEIS: R wird in pmol / mg / min gemessen. Mittler von R für Brunnen 1 - 2 gibt passive Transportrate, R p . Mittler von R für Brunnen 3-4 ergibt basale Gesamttransportrate, R bt . Mittler von R für Brunnen 5-6 gibt Insulin stimulierte Gesamttransportrate, R it .- Berechnen Sie die basale aktive Transportrate (R ba ) wie folgt:
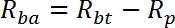
- Berechnen Sie die Insulin-stimulierte aktive Transportrate (R ia ) wie folgt:
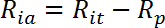
HINWEIS: In Insulin-reaktionsfähigen Zellen wie Myotubes werden die Glukose-Aufnahmeraten üblicherweise durch drei Werte dargestellt: R ba , R ia und die fache Insulinstimulation als R ia / R ba .
- Berechnen Sie die basale aktive Transportrate (R ba ) wie folgt:
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Am Tag 3 erreichen Myoblasten Zusammenfluss ( Abbildung 1A ). Die Myoblasten sind in diesem Stadium typischerweise mononukleiert. Medium wurde geändert und am Tag 8 wurde die Differenzierung abgeschlossen ( Abbildung 1B ) (Protokollabschnitt 2). Nach 5 Tagen Differenzierung werden Myotubes ausgerichtet und typischerweise polynukleiert. Menschliche primäre Myotubes wurden einer Palmitat- oder einer BSA-Behandlung unterzogen, be...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Glukoseaufnahme ist eine wichtige biologische Messung zum Testen von Aktivatoren oder Inhibitoren auf die Zellkultur und deren Auswirkungen auf die Verwendung von Glukose und die Fähigkeit der Zelle, auf Insulin zu reagieren. Die hier beschriebene Methode hat sich als schnell und zuverlässig erwiesen und wurde in vielen Studien mit primären Myotubes von gesunden Probanden und / oder metabolisch betroffenen Patienten 6 , 7 , 10...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bestätigen Anne Charrié bei der Radiobiologie (Lyon-Sud Krankenhaus) und der Fond National Suisse (FNS) für ihre finanzielle Unterstützung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
Referenzen
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657(2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home? Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556(2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104(2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203(2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693(2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten