Method Article
Verfahren und wichtige Optimierungsstrategien für eine automatisierte Kapillar elektrophoretischen basierende Immunoassay-Methode
In diesem Artikel
Zusammenfassung
Eine Kapillare-basierte Immunoassay mit einer kommerziellen Plattform zu Zielproteine von Gesamtprotein Vorbereitungen messen wird demonstriert. Darüber hinaus sind Assay Parametern Belichtungszeit, Proteinkonzentration und Antikörper-Verdünnung für ein Zellkultursystem Modell optimiert.
Zusammenfassung
Neue Technologien, die Kapillare-basierten Immunoassays nutzen Versprechen Protein schneller und mehr quantitative Bewertung im Vergleich zu traditionellen Immunoassays. Ist jedoch ähnlich wie bei anderen Antikörper-basierten Protein-Assays, Optimierung der Kapillare-basierte Immunoassay Parameter, z. B. Proteinkonzentration Antikörper Verdünnung und Belichtungszeit eine wichtige Voraussetzung für die Erzeugung von sinnvolle und zuverlässige Daten. Messungen müssen innerhalb des linearen Bereichs des Assays wo sind Veränderungen im Signal direkt proportional zur lysate Konzentrationsänderungen fallen. Der Prozess der Auswahl geeigneter lysate Konzentrationen, Antikörper-Verdünnungen und Belichtungszeiten in der menschlichen bronchialen Epithelzelle Linie, BEAS-2 b, wird hier gezeigt. Assay Linearität wird über einer Strecke der ganzen Zelle Extrakt Proteinkonzentrationen mit p53 und α-Tubulin Antikörper angezeigt. Ein Beispiel für Signal-Burnout ist in den höchsten Konzentrationen mit langen Belichtungszeiten gesehen, und eine α-Tubulin Antikörper Verdünnung Kurve zeigt Sättigung zu demonstrieren. Darüber hinaus sind Beispiel experimentelle Ergebnisse für Doxorubicin-behandelten Zellen mit optimierten Parametern ausgewiesen.
Einleitung
Kapillare elektrophoretischen Immunoassays messen Proteinexpression in Zelle Lysates mit Größe oder Ladung Trennsysteme und bieten mehrere Vorteile gegenüber der traditionellen Immunoassays. Zum Beispiel im Vergleich zu western-Blot das automatisierte Kapillar-basierte Verfahren eliminiert die Notwendigkeit für Gele, Transfer Geräte und Handbuch wäscht. Darüber hinaus ist die absolute Menge an Protein benötigt etwa 10 mal weniger, und Kapillar-basierte Systeme ideal für den Einsatz mit seltenen Zelltypen oder begrenzten Stichprobe1,2. Ergebnisse in weniger als 3 h mit automatisierten Systemen stammen und haben zuvor nachgewiesen, dass mehr quantitative und reproduzierbar als herkömmliche Western blot Verfahren3,4,5. Der Prozess für Größe basierende Assays besteht aus Proben, die Sodium Dodecyl Sulfat (SDS), Dithiothreitol (DTT), laden und Gewebekulturen beschriftet Molekulargewicht Marker in Kapillarsäulen mit Stapeln und Trennung Matrizen. Spannung an den Kapillaren trennt die Proteine in den Proben je nach Größe und UV-Licht lähmt die getrennten Proteine an der Kapillare Wand. Die Kapillare ist dann Immuno-sondiert mit zielgruppenspezifischer primären Antikörper und Meerrettich-Peroxidase (HRP)-konjugierten Sekundärantikörper. Luminol und Peroxid katalysieren chemiluminescent Lichterzeugung durch eine Ladung gekoppelten Gerät (CCD) Kamera gemessen und analysiert, um Protein quantitate.
Trotz der relativen Leichtigkeit und Geschwindigkeit einer automatisierten Kapillare basierende elektrophoretische Immunoassay-Plattform ist die Optimierung der Assay-Bedingungen wie Proteinkonzentration, Antikörper Verdünnung und Belichtungszeit wichtig für den Erhalt der genaue und reproduzierbare Ergebnisse. Im Allgemeinen sollten die folgenden Verfahren durchgeführt werden, um eine Probe für diese Systeme zu optimieren:
(1) ein Bildschirm sollte durchgeführt werden, zu bewerten und Antikörpern für Signal und Spezifität an das Protein-Ziel zu wählen. Falls verfügbar, kann gereinigtes Protein oder Ziel-Epitop zur Spezifität zu beurteilen; Allerdings ist es noch wichtig zu beurteilen, mögliches unspezifisches Signal in Gesamt-Protein aus dem Modellsystem bezogen.
(2) als nächstes muss der dynamische Bereich des Tests bestimmt werden. In einer idealen Situation ist Signal verdoppeln (mit Peakfläche gemessen) beobachtet, wie Probenkonzentration verdoppelt wird; in der Praxis ist jedoch eine proportionale Veränderung in Signal an Eingang in einer vorhersagbaren Weise (z. B.lineare passen) ausreichend Protein Quantifizierung. Darüber hinaus wird diese Optimierung Proteinkonzentration mit high-Signal, aber noch innerhalb des linearen Bereichs für den experimentellen Modell definieren.
(3) bestimmen Sie die optimale Antikörperkonzentration mit der festen Proteinkonzentration in Optimierungsschritt 2 ausgewählt. Wenn die Antikörperkonzentration zunimmt, nimmt das Signal bis es bei Sättigung Hochebenen. Eine Antikörperkonzentration in der Nähe dieser Sättigungsgrad ist erforderlich für eine genaue Messung der Proteinkonzentration.
Der Prozess zur Optimierung der Proteinkonzentrationen, Antikörper-Verdünnungen und Belichtungszeiten für eine automatisierte Kapillar-basierte Größe Assay6 zeigt sich mit ganze Zelle Extrakten von BEAS-2 b, ein SV-40 verwandelte Mensch bronchiale isoliert epithelialen Zell-Linie. Protein isoliert von Zellen oder Geweben Extrakte kann mit einer Reihe von veröffentlichten Protokolle7,8,9 durchgeführt werden und wird hier nicht behandelt werden. Ergebnisse einer Studie Experiment mit der optimierten Bedingungen sind auch für insgesamt gemeldeten und phosphoryliert (Serin 15, Serin 20) p53 in Kulturen ausgesetzt Doxorubicin (ein gemeinsames Chemotherapeutikum, die Zelle Apoptose10induziert) 1.2, 1.8, und 2,4 µg/mL Medien für 4 h vor der Ernte. Die p53 Peakflächen sind auf ɑ-Tubulin, normalisiert die als laden-Steuerelement verwendet wird.
Protokoll
Hinweis: sicherstellen, dass alle Reagenzien und Proben sind nach Angaben des Herstellers vorbereitet ' s-Protokoll, unten beschrieben. Bitte tragen Sie geeignete persönliche Schutzausrüstung während dieser Prozedur umfasst Nitril-Handschuhe, Kittel, geschlossene Schuhe und Schutzbrille. Eine Tabelle mit bestimmten Materialien, Reagenzien und Geräte erforderlich ist separat zur Verfügung gestellt. Gesamt-Protein-Konzentration der Proben sollte ermittelt werden, vorher mit etablierten Methoden, die kompatibel mit der lysate Puffer verwendet, wie z. B. Bradford assay 11.
1. Vorbereitung der Proben und Reagenzien aus dem standard Pack als vom Hersteller mitgelieferten
- , bereiten die 400 mM Arbeitslösung des Dithiothreitol (DTT), 40 µL deionisiertes Wasser hinzufügen, den Schlauch mit der Lager vom Hersteller geliefert. Es ist wichtig, zu vermeiden, Einführung von Bläschen, die Lösung durch Mischen der Lösung mit langsamen und sanften pipettieren.
- Fügen Sie 20 µL 10 X Probenpuffer und 20 µL der vorbereiteten 400 mM DVB-t-Lösung für die rosa Röhrchen mit fluoreszierenden 5 X master Mix (siehe die Tabelle der Werkstoffe).
Hinweis: Die Master-Mix (MM) wird vom Hersteller mit einer Folie versiegelt und muss von einer Pipettenspitze durchbohrt werden. Mischung sanft durch langsame Pipettieren vermeiden Spritzwasser DVB-t in der Pipette. - Fügen Sie 16 µL deionisiertes Wasser, 2 µL 10 X Probenpuffer und 2 µL der vorbereitet 400 mM DVB-t-Lösung für das weiße biotinylierte Leiter Rohr des Herstellers geliefert. Vorsichtig mischen und in eine 0,6 mL-Tube für Denaturierung übertragen.
- Vorbereiten 0,1 x Probenpuffer durch die mitgelieferten 10 X Lösung 1: 100 mit Wasser verdünnen. Bereiten Sie genügend 0,1 x Probenpuffer, alle Proben zu verwässern.
- Berechnen Sie die Menge von 0,1 X Probenpuffer, die eine Probe hinzugefügt wird, die auf die gewünschte Endkonzentration des gesamten Proteins abhängen. Mix 1 Teil 5 x fluoreszierende MM mit 4 Teilen verdünnt Probe auf die gewünschte endgültige Protein-Konzentration zu erreichen.
- Berechnen Volumen wie folgt: (i) Band 5 x fluoreszierende MM = (Desired endgültige Proteinkonzentration) / 5; (Ii) Lagervolumen Protein = (Desired endgültige Proteinkonzentration x Gesamtvolumen erforderlich) / Protein Lager Konzentration; (Iii) Volumen 0,1 x Probenpuffer = Gesamtvolumen - 5 x MM Volumen - Protein Lager Volumen.
2. Denaturierung von Proben und Leiter
- vorbereiteten Ort Proben und biotinylierte Leiter in einem Heizblock 95 ° C für 5 min. Vortex Röhrchen sofort nach der Inkubation ausführen einen Spin für ~ 5 s in einem Tabletop Zentrifuge und auf Ice
Hinweis: Einige Proteine sanftere denaturierenden Bedingungen (z. B. 70 o C für 10 min) möglicherweise zur Verhütung Proteinaggregation und Migration in der Kapillare Matrix zu verbessern. Betrachten Sie diese Option, wenn es schwere Verschmieren auf die höheren Molmassen gibt (siehe Video zum Beispiel).
3. Herstellung von Antikörpern
- durch Optimierung bestimmt (siehe Vertreter Ergebnisse und video), bereiten Sie die gewünschte Dilution(s) des primären Antikörper (z. B. 01:50, 1: 100) in der zur Verfügung gestellten Antikörper Diluent 2.
Hinweis: Antikörper sind in der Regel bei höheren Konzentrationen für Kapillar-basierte Immunoassay als für herkömmliche westliche Beflecken verwendet. Die mitgelieferten Sekundärantikörper ist einsatzbereit ohne Verdünnung.
4. Vorbereitung von Luminol-S und Peroxid
- bereiten Sie eine 1:1 Mischung von Luminol-S und Peroxid.
- Vortex mischen und speichern auf Ice
Hinweis: Es ist wichtig, dass diese Mischung für jede experimentelle Probe frisch zubereitet wird. 250ul total Mischung ist notwendig, um einen vollen Teller laufen.
5. Vorbereitung der Assay-Platte
- , wie in Abbildung 1 dargestellt, laden der Proben und Reagenzien in der Assay-Platte oben vorbereitet. Finden Sie detaillierte Anweisungen für jede Zeile. Zur Minimierung von Verdunstung aus den Brunnen sorgen dafür, dass die Platte Deckel zwischen Reagenz Ergänzungen ersetzt wird.
- In Zeile A, Pipettieren 5 µL biotinylierte Leiter in gut A1. Für die restlichen Zeile vorbereitet Pipettieren Proben (5 µL) in Vertiefungen A2-A25.
Hinweis: Es ist zwingend notwendig, dass der A1 auch immer Leiter enthält, da die ersten Kapillare in der Patrone optimiert ist für die Ausführung dieser Standard. - In Zeile B, Pipettieren 10 µL Antikörper Diluent 2 in jede Vertiefung (B1-B25).
- In Reihe C, Pipettieren 10 µL Antikörper Diluent 2 in gut C1. In der restlichen Zeile C Brunnen, Pipettieren 10 µL Primärantikörper (Brunnen C2-C25).
- In Zeile D, Pipettieren 10 µL Streptavidin-HRP in gut D1. In der übrigen Reihe D Brunnen, Pipettieren 10 µL Sekundärantikörper (Brunnen D2-D25).
- In Zeile E, Pipettieren 10 µL des frisch zubereiteten Luminol-Peroxid-Mix in jede Vertiefung (E1-E25).
- Schließlich hinzufügen 500 µL Waschpuffer pro Fach jeweils die obersten 3 Reihen Puffer Brunnen.
Hinweis: Es ist wichtig, um Blasenbildung zu minimieren, indem Sie sanft pipettieren und nicht der letzte Band von der Spitze vertreiben, da Luftblasen stören die Kapillare laden und ausführen können. - Sobald alle Brunnen geladen sind, Zentrifugieren die Platte bei ~ 1000 X g für 5 min bei Raumtemperatur um Luftblasen zu entfernen, und sicherzustellen, dass die Flüssigkeit im unteren Teil der Brunnen ist. Alle sichtbaren Bläschen mit einem kleinen Pipettenspitze oder saubere Nadel Pop (z.B., sterile 25 Gauge " Rep oben " Nadel).

Abbildung 1 . Pipettieren Vorlage für Assay Platte. Farbcodierung repräsentiert richtigen Reagenzien und Proben (bis zu 24 insgesamt) an der Assay-Platte hinzugefügt. Hinzufügen biotinylierte Leiter gut A1 (orange), Proben aus Brunnen A2 bis A25 vorbereitet (hellblau), Antikörper Diluent 2 Brunnen B1-B25 und C1 (hellgrün), Primärantikörper in Vertiefungen C2 bis C25 (blau), Streptavidin-HRP auch D1 (dunkelrosa), sekundäre Antikörper D2 bis D25 Brunnen (dunkelgrün) und Luminol-Peroxid-Mix in Vertiefungen E1 bis E25 (lila). Waschpuffer wird hinzugefügt, um die ersten drei Reihen der größeren mittleren Platte Brunnen (dunkelblau). Bitte klicken Sie hier für eine größere Version dieser Figur.
6. beginnt die Kapillare Immunoassay-Instrument
- achten Sie darauf, die das Instrument und die zugehörigen Computer eingeschaltet sind. Keine Aufwärmzeit erforderlich.
- Die Instrumentierung-Software auf dem Computer öffnen. Wählen Sie zunächst die " Assay " Registerkarte "auf der rechten Seite des Fensters und " neuen Assay " unter den " Menü" Datei "" auf der linken Seite. Wählen Sie die Größe, die Größenbereich (z. B. 12-230 kDa) und die Patrone Typ (z. B. 25 Kapillare), für die besondere Assay verwendet wurde.
Hinweis: Ein Mai auch Eingang Assay Parameter, einschließlich der Proteinkonzentration, Antikörper-Typ und Verdünnung, wenn gewünscht, aber diese sind nicht erforderlich, um den Test zu starten. - Die Tür auf das Gerät durch Drücken des Knopfes auf dem orange Panel.
- Entfernen Sie vorsichtig die Kapillare Patrone aus der Verpackung. Ohne Berührung der Glaskapillaren selbst, setzen Sie die Patrone in die Patronenhalterung. Überprüfen Sie Patrone Sitzgelegenheiten durch die Beobachtung der Innenbeleuchtung von Orange auf blau ändern.
- Halten Sie die Platte fest auf die Bank und die Verdunstung Dichtung aus dem unteren Teil der Platte vorsichtig abziehen. Pop alle Bläschen gesehen in diese Trennung Matrix Brunnen mit einem smalle Pipettieren Tipp oder saubere Nadel (z.B., sterile 25 Gauge " Rep oben " Nadel).
- Die Assay Platte auf den Kennzeichenhalter, Gewährleistung, es sitzt vollständig, und schließen Sie die Tür Instrument.
- Klicken Sie auf die " Start " Button in der Software.
Hinweis: Wenn keine Schaltfläche "Start" angezeigt wird, ist die Verbindung mit dem Instrument verloren gegangen. Instrument aus dem oberen linken Menü wählen, dann verbinden. Ein Pop-up sollte mit der Seriennummer angezeigt werden; Wählen Sie diese Option aus, klicken Sie auf Connect. Die Schaltfläche "Start" sollte nun angezeigt werden. - , Wenn die Ausführung abgeschlossen ist, entsorgen Sie die Platte. Entfernen Sie die Patrone und in Sharps Container für Entsorgung, sowie alle Nadeln, die auf pop Bubbles herangezogen. Lassen Sie die Macht auf Probleme mit der Verbindung zu vermeiden, wenn das Instrument regelmäßig verwendet wird (z. B. mindestens einmal pro Woche).
7. Experimentieren Sie Analyse
- vor der Analyse, stellen Sie sicher die folgenden Qualitätskontrollen durchgeführt.
- Verify fluoreszierende Normen durch die Auswahl der " zeigen Standards " Symbol. Prüfung, die die Standards korrekt, in identifiziert werden der " Diagrammansicht " Registerkarte ". Wenn sie nicht korrekt sind, fahren Sie mit der " Einzelansicht " Symbol, klicken Sie rechts auf den richtigen Gipfel, und wählen Sie " Kraft Standard ", oder klicken Sie rechts auf die falsche Spitze und wählen Sie " kein Standard ". Führen Sie diese Prüfung für jede neue Kapillare.
- Verify biotinylierte Leiter durch Anklicken der " Proben " und " Einzelansicht " Symbole. Wählen Sie die Leiter in der Registerkarte "Experiment". Wenn ein Peak nicht falsch erkannt wird, einen Rechtsklick darauf in " Diagrammansicht " und wählen Sie " entfernen Peak ".
Hinweis: zum Beispiel sollte die biotinylierte Leiter für das 12-230-kDa-Kit 12, 40, 66, 116, 180 und 230 kDa Dimensionierung Gipfeln zeigen. Wenn dieser Schritt nicht ausgeführt wird, die Größe der Stichprobe Gipfel wird falsch berechnet werden, falsche Ergebnisse produzieren. - Ansicht und Probe Gipfeln zu analysieren. Spitzen Tisch, einschließlich Molekulargewicht, Peakfläche, Scheitelhöhe und Signal-Rausch (S/N), je nach Bedarf für experimentelle Berechnungen Daten entstammen.
Ergebnisse
Belichtungszeit - Bestimmung Signal burnout
Signal-Burnout kann auftreten, wenn das Luminol und Wasserstoffperoxid Substrat zu schnell erschöpft ist. Dies kann durch Prüfung der Daten bei verschiedenen Chemilumineszenz Belichtungszeiten bestimmt werden. Gehen Sie in der Analysesoftware zu "Bearbeiten – > Analyse – > Bilder". Belichtungszeiten reichen von 5 bis 480 s. Die y-Achse in einem Electropherogram meldet Signal/Uhrzeit, so dass die Daten aus jeder Aufnahme ein ähnliches Signal/Zeit-Koeffizient haben sollte. Dieser Koeffizient nimmt mit sequenziell längere Belichtungszeiten wenn Luminol aufgebraucht wird, wie mit dem p53--1-Antikörper (Abbildung 2) zu sehen. Wegen Erschöpfung Substrat kann dieser Assay messbar bis zu 0,2 µg/µL-Konzentration nur bei 5-30 s Forderungen betrachtet werden. Also, in diesem Beispiel 15 s war entschlossen, die optimale Daten-Analyse-Belichtungszeit für p53.
Lysate titration - Bestimmung der linearen Dynamikbereich
Es ist wichtig, dass die Messungen innerhalb der linearen Dynamikbereich jedes Assay wo sind Veränderungen im Signal gemessen an Peakfläche proportional zu Änderungen in der Höhe von Protein in der Probe. Mit der optimalen Belichtungszeit von 15 s gewählt im vorherigen Abschnitt zeigt Assay Linearität für p53 und ɑ-Tubulin über mehr als eine 15-fold Reihe von Konzentration (Abbildung 3). Nach unserer Erfahrung eine R-2 -Wert von > 0,9 einer linearen Regression passen ist annehmbar für vielfältige Verdünnung gereinigtes Protein von bekannten Menge (wenn Assay eine absolute quantitative Messung ist) oder Probe lysate unbekannt Zielprotein (wenn Assay ist eine relative quantitative Messung).
Optimierung der Antikörper-Verdünnung
Mit Antikörpern bei Sättigung Konzentrationen wird sichergestellt, dass Signaländerungen gemessen nur auf Änderungen im Protein Betrag fällig sind. Als Demonstration zwei BEAS-2 b-Zell-Linie, die ganze Zelle (0,2 µg/µL Gesamt-Protein in den Assay geladen) extrahiert wurden sondiert mit seriell verdünnten ɑ-Tubulin Antikörper-Konzentrationen von 01:25 - 1:800 (Abbildung 4). Chemilumineszenz-Signal (hier als Peakfläche gemessen) gegen Antikörper Verdünnung aufgetragen wurde. Sättigung wurde beobachtet, in der Nähe der 01:50 Verdünnung, wo die Kurve eine spürbare Plateau beginnt.
Experimentelle Studie - Doxorubicin Behandlung in BEAS-2 b-Zellen
Mit optimierten Assay-Bedingungen, BEAS-2 b Zellkultur wurde mit drei verschiedenen Konzentrationen von Doxorubicin behandelt (1.2, 1,8 und 2,4 µg/mL) für 4 h (Abbildung 5, Tabelle 1). Aktivierung von p53 durch post-translationalen Modifikationen vermittelt mehrere zelluläre Reaktionen, einschließlich der Zellzyklus-Arrest, Seneszenz und Apoptose12. Insbesondere hat der Phosphorylierung von Serin 15 transkriptionelle Aktivierung von p53, was bei der Apoptose nach Doxorubicin Behandlung13zugeschrieben worden. In dieser Demo normalisiert ɑ-Tubulin Spitze, die als Falte der Kontrolle vorgestellt. Interessanterweise, 3.5 zu einem 4-fold Anstieg p53 Phosphorylierung an Serin 15 und 2-fold in der Ebene von p53 phosphoryliert an Serin 20 waren Anstiege nach 4 h Exposition mit Doxorubicin. Diese Ergebnisse deuten auf Aktivierung von p53. Allerdings sieht man keine Dosis-Wirkungs-für die Konzentrationen gewählt (umgekehrt, die niedrigste Dosis getestet löste die höchste Resonanz). Insgesamt p53 hat nicht nachgewiesen, eine klare Behandlungserfolg in diesem Modellsystem. Wir haben zuvor Aktivierung der Phosphorylierung von p53 in Ermangelung der erhöhte Spiegel von insgesamt p53 unter ähnlichen Bedingungen in Zink behandelt BEAS-2 b Zellen14beobachtet.

Abbildung 2 . Exposition Bildvergleich Signal Burnout zu erkennen. Lane Ansichten zeigen abnehmende Proteinkonzentrationen für BEAS-2 b Lysates sondiert mit p53-1 Antikörper bei einer Verdünnung von 1: 500. Chemilumineszenz Signal Koeffizienten als Peak-Höhen in der Gerätesoftware gemeldet werden überlagert. Im Gegensatz zu den Peak-Höhen sind die visuellen Band Intensitäten automatisch generiert und bereinigt um das Instrument zur Betrachtung der Bänder und sind nicht vergleichbar von einer Platte zur anderen zu helfen. Beachten Sie die Abnahme der Chemilumineszenz-Signal als Belichtung Zeit erhöht, mit dem Signal beginnen zu verschwinden (Split Peak) auf die zwei längsten Ausstellungen, Substrat Erschöpfung anzeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 . Lysate Titration mit der Spur-Ansichten. Lysate Titration zeigt die Fahrspur anzeigt (A) der BEAS-2 b lysate wenn mit 1: 500 p53-1 oder 01:50 ɑ-Tubulin sondiert. Im Gegensatz zu den Spitzenwerten Bereich sind die visuellen Band Intensitäten automatisch generiert und durch das Instrument zur Betrachtung der Bänder und sind nicht vergleichbar, von einem Panel zum anderen Unterstützung eingestellt. Lineare Regressionsanalyse (B) bestätigt, dass die Assays über den gesamten Bereich getestet, von 0,01 bis 0,20 µg/µL und 0,025 bis 0,40 µg/µL, mit R-2 -Werte von 0,999 und 0.985, bzw. linear sind. Gesamt-Protein-Konzentrationen in der Mitte des linearen Bereichs wurden ausgewählt, um potenzielle Zielvariation Protein in beide Richtungen (z.B. 0,2 µg/µL für α-Tubulin) unterzubringen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 . Α-Tubulin Antikörper Verdünnung Kurven für zwei separate BEAS-2 b Protein-Lysaten mit und ohne Basis Normalisierung. Eine definitive Haftdauertur von Linearität bei der 01:50 (0,02) gesehen ist Verdünnung, Sättigung angibt. 01:50 wurde deshalb als die optimale Verdünnung für dieses Antikörpers gewählt. Bitte klicken Sie hier für eine größere Version dieser Figur.
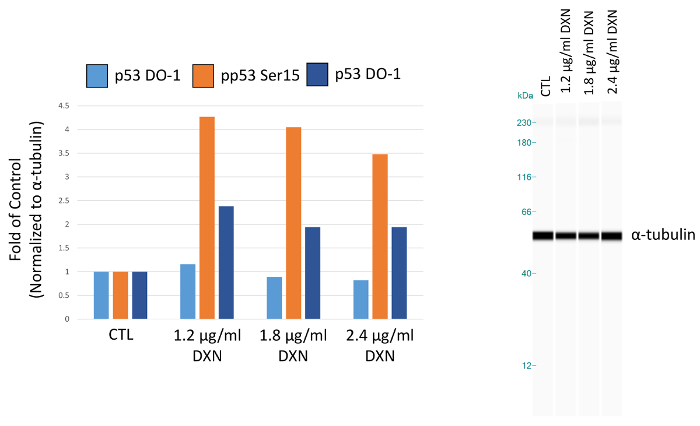
Abbildung 5. Wirkung von 4 h Doxorubicin (DXN) Behandlung auf insgesamt und Serin phosphoryliert p53-Protein-Expression von BEAS-2 b Zellen. Peakflächen sind normiert auf α-Tubulin und als Falte des Steuerelements (CTL) dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
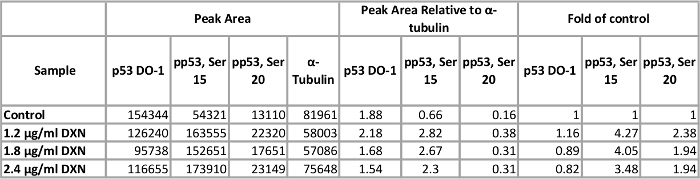
Tabelle 1. Wirkung von 4 h Doxorubicin (DXN) Behandlung auf insgesamt und Serin phosphoryliert p53-Protein-Expression von BEAS-2 b Zellen. Klicken Sie bitte hier, um eine größere Version dieser Tabelle zu sehen.
Diskussion
Es hat seit Jahrzehnten nachhaltiges Interesse an der Entwicklung der Kapillare elektrophoretischen basierende Immunoassay Methoden wegen niedrigem Probe und Reagenz Ausgaben, verringerte Verarbeitung Zeit im Vergleich zu traditionellen Methoden und hohe Kompatibilität zu automatisieren Sie die Prozedur4,15. Es gibt eine Reihe verschiedener Protokolle für die Trennung von Proteinen, die Kapillaren, einschließlich der elektrophoretischen, elektrokinetischen, Polymer Siebung und isoelektrischen Methoden, die Proteine (bzw. durch unterschiedliche Eigenschaften zu isolieren, genutzt haben elektrostatische Aufladung, Partition Gleichgewicht, Siebung Eigenschaften der trennenden Matrix und pH-Wert)16. Hier beschreiben wir ein Antikörper-basierte (oder Immunoassay) Kapillarelektrophorese-Methode, bei der ein Polymer, Siebung, Trennung, die automatisiert worden und kommerziell angenommenen3. Vorteile dieses Systems sind einfache Bedienung und Betrieb, standardisierte und im Handel erhältlichen Reagenzien und zuverlässige, empfindliche Messungen, die weniger Reagenzien und Proben im Vergleich zu traditionellen Protein Assays wie western-Blot erfordern, Enzym-linked Immunoassay und andere Formate3,4,5. Es wurde in vorherigen Bewertungen dieser Technologie festgestellt, dass die Größe des Proteins, die beurteilt werden kann begrenzt wurde durch die verfügbaren Trennung Matrix4, aber den letzten Angebote der messbaren Bereich von 2 bis 440 kDa17 erweitert haben . Darüber hinaus muss einige lysate Puffer für unvereinbar mit dem Assay18bekannt sind, daher Auswahl des experimentellen Reagenzien vorher berücksichtigt werden.
Ein großer Vorteil eines automatisierten Verfahrens mit handelsüblichen Bauteilen ist die Konsistenz der Ergebnisse durch standardisierte Methoden und Reagenzien. Dies minimiert die Chancen der Assay-Ausfall durch die Automatisierung wichtige Schritte im Rahmen des Verfahrens. Es ist jedoch wichtig zu beachten, dass bestimmte Praktiken während des Protokolls, Probleme mit der Kapillare elektrophoretischen basierende Immunoassay zu minimieren eingehalten werden müssen. Erstens ist es wichtig, dass die Luminol-S/Peroxid-Mischung vor Platte laden frisch und sofort bereit ist. Konsequente Timing führt konsequent Lumineszenz nach Oxidationsmittels hinzugefügt wird, das konsequente Messungen für einen bestimmten Antikörper-Assay nach Assay ergibt. Darüber hinaus ist es wichtig, dass nicht abgelaufen Reagenzien verwendet werden, das betrifft vor allem der Potenz des Oxidationsmittels. Darüber hinaus ist es wichtig, dass die Ladereihenfolge der Proben, Antikörper und andere Reagenzien strikt eingehalten werden (siehe Abbildung 1). Jede Reagenz pipettiert fehl am Platz führt Assay scheitern und eine vergeudete laufen.
Neben diese kritischen Schritte können primäre Probleme mit der Technik in der Regel durch Optimierung überwunden werden. In der Tat, diese Bedingungen sind spezifisch für jedes Modell-System/Antikörper-Kombination und sollte daher für jeden neuen Assay empirisch ermittelt werden. In diesem Artikel konzentrieren wir uns auf drei gemeinsame Optimierungsverfahren: Belichtungszeit, lysate Titration und Primärantikörper Verdünnung. Messbare Ergebnisse zu generieren, hängt Analyse eine Belichtungszeit als die Luminol-Substrat nicht rasch, als Substrat Erschöpfung führt zum Verlust des Signals zur Neige gehen wird. Lysate Titration bestimmt den linearen Dynamikbereich jedes Assays, die mit verschiedenen Modellsysteme sowie verschiedene Antikörper, auch für das gleiche Protein-Ziel abweichen können. Antikörper-Verdünnungen gewählt an oder nahe der Sättigung Konzentrationen sorgen für Veränderungen im Signal nicht durch einen Mangel an freien Antikörper, sondern nur durch unterschiedliche Menge an verfügbaren Protein-Ziel-Epitop betroffen sein werden. Andere Überlegungen bei den Optimierungsprozess können Antikörper Inkubationszeit und Stapeln/Probe Ladezeit gehören. In den meisten Fällen bieten die Standardeinstellungen für das Instrument das beste Verhältnis von Auflösung und Empfindlichkeit. Jedoch kann in einigen Fällen schlechte Auflösung und Empfindlichkeit verbessert werden durch diese Parameter anpassen.
Kapillare elektrophoretischen basierende Immunoassay Methoden liefern schnelle, effiziente und reproduzierbare Protein Messungen. Während diese Methoden vor allem in Forschung und Entwicklung Einstellungen verwendet worden sein, hat die Konsistenz dieser Technologien potenzielle Nutzen in regulatorischen und klinische Anwendungen. Beispielsweise kann die Identifizierung von anfälligen Subpopulationen, Umweltgifte oder Patienten mit Fortschreiten der Krankheit auf Protein-Biomarkern gemessen in zugänglichen Matrizen, wie Blut, Urin und Speichel beruhen. Als Reagens und Betrieb Kosten Drop und die Anzahl der Proben und Ziele, die gleichzeitig bewerteten erhöht werden können, sehen wir wahrscheinlich Kapillare elektrophoretischen basierende Immunoassay Methoden für diese Arten von Anwendungen verwendet.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte. Dieses Manuskript wurde von der National Health and Environmental Effects Research Laboratory überprüft und zur Veröffentlichung freigegeben. Der Inhalt gibt nicht notwendigerweise die Ansichten der US-EPA noch stellt die Erwähnung von Handelsnamen oder kommerzielle Produkte Billigung oder Empfehlung für den Einsatz.
Danksagungen
Die Autoren möchten Keith Tarpley von uns EPA Büro von Forschung und Entwicklung-Research Triangle Park (ORD-RTP) Grafik und Media Team für Entwicklung, Aufzeichnung und Bearbeitung von das Anleitungsvideo zu danken. Wir würden auch gerne Deborah Pritchett aus ProteinSimple Danke für hilfreiche Gespräche zur Optimierung unserer Daten. JM Guynn wurde vom Oak Ridge Institut für Wissenschaft und Forschung/Teilnahme Education Program der US Environmental Protection Agency unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
Referenzen
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten