Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese und Test von unterstützten Pt-Cu-Feststofflösungen Nanopartikelkatalysatoren für die Propan-Dehydrierung
In diesem Artikel
Zusammenfassung
Ein zweckmäßiges Verfahren zur Synthese von 2 nm unterstützten Bimetall-Nanopartikel-Pt-Cu-Katalysatoren für die Propan-Dehydrierung wird hier beschrieben. In situ- Synchrotron-Röntgentechniken erlauben die Bestimmung der Katalysatorstruktur, die typischerweise mit Laborinstrumenten nicht erreichbar ist.
Zusammenfassung
Ein zweckmäßiges Verfahren zur Synthese von bimetallischen Pt-Cu-Katalysatoren und Leistungsprüfungen zur Propan-Dehydrierung und -charakterisierung wird hier gezeigt. Der Katalysator bildet eine substituierte feste Lösungsstruktur mit einer kleinen und gleichmäßigen Teilchengröße von etwa 2 nm. Dies wird durch eine sorgfältige Kontrolle über die Imprägnierungs-, Kalzinierungs- und Reduktionsschritte während der Katalysatorherstellung realisiert und durch fortgeschrittene in situ- Synchrotrontechniken identifiziert. Die Katalysator-Propan-Dehydrierungsleistung verbessert sich kontinuierlich mit zunehmendem Cu: Pt-Atomverhältnis.
Einleitung
Propan-Dehydrierung (PDH) ist ein wichtiger Verarbeitungsschritt bei der Herstellung von Propylen, unter Ausnutzung von Schiefergas, der am schnellsten wachsenden Gasquelle im Land 1 . Diese Reaktion bricht zwei CH-Bindungen in einem Propanmolekül, um ein Propylen und molekularen Wasserstoff zu bilden. Edelmetallkatalysatoren, einschließlich Pd-Nanopartikel, weisen eine schlechte Selektivität für PDH auf, brechen die CC-Bindung zur Herstellung von Methan mit hoher Ausbeute mit der gleichzeitigen Herstellung von Koks, was zu einer Katalysatordeaktivierung führt. Jüngste Berichte zeigten, dass selektive PDH-Katalysatoren durch Zugabe von Promotoren wie Zn oder In zu Pd 2 , 3 , 4 erhalten werden konnten . Die geförderten Katalysatoren sind nahezu 100% selektiv für PDH, im Gegensatz zu weniger als 50% für monometallische Pd-Nanopartikel der gleichen Größe. Die große Verbesserung der Selektivität wurde der Bildung von PdZn oder PdIn intermetallischen Verbindungen zugeschrieben(IMC) Strukturen auf der Katalysatoroberfläche. Die geordnete Anordnung von zwei verschiedenen Atomtypen in den IMCs isolierte die Pd-aktiven Stellen geometrisch mit nichtkatalytischen Zn- oder In-Atomen, die die von einem Ensemble (Gruppe) benachbarten Pd-aktiven Stellen katalysierten Nebenreaktionen ausschalteten.
Platin hat die höchste intrinsische Selektivität unter Edelmetallen für die Propan-Dehydrierung, ist aber für den kommerziellen Gebrauch noch nicht zufriedenstellend 1 . Typischerweise wird Sn, Zn, In oder Ga als Promotor für Pt 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 zugegeben. Basierend auf der Idee, dass die geometrische aktive Standortisolation zu hoher Selektivität beiträgt, kann jedes nichtkatalytische Element, das eine Legierung bildet,Struktur mit Pt, wie Cu, sollte auch potentiell die Katalysatorleistung fördern 14 . Mehrere frühere Studien deuten darauf hin, dass die Zugabe von Cu tatsächlich die PDH-Selektivität der Pt-Katalysatoren 15 , 16 , 17 , 18 verbesserte. Trotzdem wurde kein direkter Beweis vorgelegt, um festzustellen, ob Pt und Cu bimetallische Nanopartikel oder geordnete Strukturen bilden, was für das Verständnis der Werbewirkung von Cu entscheidend ist. Im Binärphasendiagramm von Pt-Cu sind zwei verschiedene Strukturtypen über einen breiten Zusammensetzungsbereich möglich 16 , 18 : intermetallische Verbindung, bei der Pt und Cu jeweils spezifische Kristallstellen einnehmen und eine feste Lösung, in der Cu zufällig in der Pt Gitter. IMCs bilden sich bei niedriger Temperatur und verwandeln sich in feste Lösung bei etwa 600 - 800 ° C für Schüttgüter 14 Diese Umwandlungstemperatur kann bei Nanopartikeln nahe der Reaktionstemperatur von PDH ( dh 550 ° C) niedriger sein. Daher ist es wichtig, die Atomordnung von Pt-Cu unter Reaktionsbedingungen zu untersuchen. Für gestützte Nanopartikel mit kleinen Partikelgrößen ist es sehr schwierig, mit Laborinstrumenten sinnvolle Strukturinformationen zu erhalten 19 . Die begrenzte Wiederholung von Einheitszellen führt zu sehr breiten Beugungspeaks mit sehr geringen Intensitäten. Wegen des hohen Anteils an Oberflächenatomen in Nanopartikeln von 1 - 3 nm, die in Luft oxidiert werden, muss die Beugung in situ unter Verwendung eines Hochfluss-Röntgenstrahls gesammelt werden, der typischerweise mit Synchrotrontechniken erhältlich ist.
Die zuvor berichteten Pt-Cu-PDH-Katalysatoren waren alle größer als 5 nm in den Größen 15 , 16 , 17 , 18 Jedoch für Edelmetall - Nanopartikel - Katalysatoren, gibt es immer einen starken Wunsch katalytische Aktivität pro Einheitskosten zu maximieren , indem Katalysatoren mit hohen Dispersionen (typischerweise um oder weniger als 2 nm in der Größe) 19 zu synthetisieren. Obwohl die Herstellung von Bimetall-Nanopartikeln dieser Größe durch Standardimprägnierungsverfahren möglich ist, ist eine rationale Kontrolle über die Verfahren notwendig. Die Metallvorstufen, der pH-Wert der Imprägnierlösung und der Trägertyp müssen gesteuert werden, um die Verankerung der Metallspezies auf hochflächige Träger zu optimieren. Die nachfolgenden Kalzinierungs- und Reduktionswärmebehandlungen sollten auch sorgfältig kontrolliert werden, um das Wachstum der metallischen Nanopartikel zu unterdrücken.
Dieser Artikel umfasst das Protokoll für die Synthese von unterstützten 2 nm Pt-Cu-Bimetall-Nanopartikel-Katalysatoren und für die Prüfung ihrer Propan-Dehydrierungsleistung. Die Struktur der Katalysatoren wird durch Scannen T untersuchtRangeing-Electron-Mikroskopie (STEM), In-situ- Synchrotron-Röntgen-Absorptionsspektroskopie (XAS) und In-situ- Synchrotron-Röntgenbeugung (XRD), die die verbesserte Katalysatorleistung bei der Einführung von Cu erleichtern.
Protokoll
1. Synthese von unterstützten 2 nm Pt-Cu-Bimetall-Nanopartikel-Katalysatoren
- Herstellung der Metallvorläuferlösung
- 0,125 g Kupfernitrat-Trihydrat (Cu (NO 3 ) 2 · 3H 2 O) in 1 ml Wasser auflösen, um eine himmelblaue Lösung zu erhalten.
Achtung: Beim Umgang mit Chemikalien Schutzhandschuhe verwenden. - Ammoniak tropfenweise der Kupfernitratlösung zugeben, wobei dunkelblaue Präzipitate von Kupferhydroxid entstehen.
Achtung: Verwenden Sie eine Dunstabzugshaube für die Handhabung von Basen und flüchtigen Chemikalien. - Halten Sie das Ammoniak zu, bis sich die dunkelblauen Präzipitate auflösen, um eine dunkelblaue Lösung und den pH> 10 zu bilden.
- Füge 0,198 g Tetraamminplatinnitrat ((NH 3 ) 4 Pt (NO 3 ) 2 ) zu der Lösung und zusätzlichem Wasser hinzu, so daß das Gesamtvolumen der Lösung 3,5 ml beträgt. Fügen Sie gegebenenfalls zusätzlichen Ammoniak hinzu, um den pH-Wert der Lösung größer als 10 zu halten.
- Die Lösung auf 70 ° C erhitzen, bis alle Tetraaminplatinnitrat-Salze in der Lösung gelöst sind. Lassen Sie die Lösung auf RT abkühlen.
- 0,125 g Kupfernitrat-Trihydrat (Cu (NO 3 ) 2 · 3H 2 O) in 1 ml Wasser auflösen, um eine himmelblaue Lösung zu erhalten.
- Co-Imprägnierung der Metallvorläuferlösung
- Vor der Katalysatorherstellung das imprägnierende Porenvolumen des Siliciumdioxidträgers bestimmen. Ziehen Sie sorgfältig etwa 5 g trockenes Siliciumdioxid in eine Gewichtungsschale. Beim Mischen wird H 2 O tropfenweise zugegeben, bis das Siliciumdioxid vollständig nass ist, aber ohne überschüssige Lösung. Die Nasskieselsäure wieder aufwärmen. Teilen Sie das Gramm des hinzugefügten Wassers mit dem Gramm der Probe, um das Porenvolumen zu berechnen.
- Füge der gelösten Metallvorläuferlösung einige Tropfen zu einer Zeit zu 5 g hochporösem Siliciumdioxid (SiO 2 ) in einer keramischen Verdampfungsschale hinzu und rühre sanft auf, um die Partikel aufzubrechen, die zusammenhalten, um eine homogene Verteilung der Lösung zu erreichen.
HINWEIS: Das weiße Siliciumdioxid wird dunkelblau, sobald es alle 3,5 ml Metallvorläuferlöslösung adsorbiertN.- Stellen Sie sicher, dass die Textur der Siliciumdioxid-Partikel wie die von trockenem Sand bleibt. Vermeiden Sie die Akkumulation von überschüssiger Lösung während der Imprägnierung.
- Den imprägnierten Pt-0,7Cu / SiO 2 -Katalysatorvorläufer in einen Trockenofen geben und bei 125 ° C / N trocknen.
- Kalzinierung und Reduktion
- Calcinieren Sie den Katalysator in einem Ofen bei 250 ° C mit einer 5 ° C / min Rampenzahl in Luft für 3 h.
HINWEIS: Die Kalzinierung bei höheren Temperaturen führt in der Regel zu größeren Pt-Nanopartikeln. - Legen Sie eine 2-cm-Schicht Quarzwolle in die Mitte eines 1 "Quarzrohrreaktors und laden Sie den kalzinierten Pt-0,7Cu / SiO 2 -Katalysator in den Schlauch durch einen Plastik-Trichter. Legen Sie den Schlauch in einen kolbenhochtemperaturprogrammierten Ofen.
- Nach dem Spülen des Röhrchens mit N 2 für 5 min bei RT beginnen wir, H 2 (bei RT) mit der gleichen Strömungsrate wie N 2 (100 ccm) zu fließen, um die Pt-0,7Cu /SiO 2 -Katalysator.
- Erhöhen Sie die Temperatur auf 150 ° C mit einer 5 ° C / min Rampenzahl und halten Sie für 5 min.
- Starten Sie das langsame Hochfahren der Temperatur mit einer Geschwindigkeit von 2,5 ° C / min auf 250 ° C. Halten Sie die Temperatur für 15 min bei 25 ° C.
HINWEIS: Andere Metalle können niedrigere oder höhere Reduktionsgrade erfordern. Die genaue Temperatur kann im allgemeinen durch Untersuchung von Farbveränderungen des Katalysators ( z. B. von blau nach schwarz) für Pt-Cu bestimmt werden. - Ramp auf 550 ° C (oder die Reaktionstemperatur, falls höher) bei 10 ° C / min und für 30 min aufbewahren, um die Reduktion zu vervollständigen. Mit N 2 abspülen und auf Raumtemperatur abkühlen lassen.
- Entleeren Sie die Pt-0,7Cu / SiO2-Katalysatoren und lagern Sie sie in einer Durchstechflasche für zukünftige Verwendung.
HINWEIS: Wiederholen Sie ähnliche Syntheseverfahren mit unterschiedlicher Menge an Cu (NO 3 ) 2 · 3H 2 O und (NH 3 ) 4 Pt (NO 3 ) 2 , um das andere Pt-X Cu / SiO 2 herzustellen Katalysatoren (X = 0,7, 2,3 und 7,3 und steht für Cu: Pt-Atomverhältnisse) und Pt / SiO2-Katalysatoren.
- Calcinieren Sie den Katalysator in einem Ofen bei 250 ° C mit einer 5 ° C / min Rampenzahl in Luft für 3 h.
2. Propan-Dehydrierung Leistungstest
- Katalysatorbeladung
- Nehmen Sie einen 3/8 "Quarzrohrreaktor und legen Sie eine 1 cm Schicht Quarzwolle gegen die Grübchen in der Mitte.
Achtung: Bei der Handhabung von Quarzwolle Schutzhandschuhe verwenden, da die feinen Nadeln in die Haut eingebettet werden können. - 40 mg Pt-0,7Cu / SiO 2 -Katalysator und 960 mg des Siliciumdioxids zur Verdünnung wiegen. Mischen Sie die Partikel (1 g Gesamtgewicht) in einer leeren Durchstechflasche.
- Verwenden Sie einen Kunststoff-Trichter, um die gesamte Katalysatormischung in das Reaktionsrohr zu laden. Wischen Sie die Außenwand der beiden Rohrenden mit fusselfreien Tüchern ab, um Schmutz zu entfernen, um eine gute Abdichtung mit dem O-Ring zu erhalten.
- Setzen Sie die Schlauchverschraubungen auf beide Enden des Quarzreaktorrohres und befestigen Sie sie an dem mit einem Schalenofen ausgestatteten Reaktorsystem.
- Nehmen Sie einen 3/8 "Quarzrohrreaktor und legen Sie eine 1 cm Schicht Quarzwolle gegen die Grübchen in der Mitte.
- Dichtheitsprüfung und Katalysatorvorbehandlung
- 50 cm 3 / min N 2 durch den Rohrreaktor einschalten. Nach 1 min schließen Sie den Kugelhahn am Reaktorausgang. Warten Sie, bis der Systemdruck auf 5 psig ansteigt. Schließen Sie den Kugelhahn am Einlass N 2 , um den N 2 -Anschlag zu stoppen und das Reaktorsystem abzudichten.
- Warten Sie 1 Minute und notieren Sie den vom Messgerät gelesenen Druck. Wenn der Druck sinkt, öffnen Sie den Kugelhahn am Reaktorausgang, um den Druck zu lösen und die Beschläge wieder zu befestigen. Wenn nicht, öffnen Sie zuerst den Kugelhahn am Reaktorausgang, um den Druck zu lösen, bevor Sie den N 2 -Strom wieder einschalten, indem Sie den Kugelhahn an der Einlass-N 2- Leitung einschalten, um das System für 1 min zu spülen.
- Fließende 50 cm 3 / min von 5% H 2 / N 2 für die Katalysatorreduktion vor dem Laufen einer Reaktion und stoppen den N 2 -Fluss. Starten Sie das Röhren auf die Reaktionstemperatur von 550 ° C, mit arAß von 10 ° C / min. Warten Sie 30 Minuten, nachdem der Ofen den Sollwert erreicht hat und lassen Sie die Systemtemperatur bei der Zieltemperatur stabilisieren.
- Propan-Dehydrierungsreaktionstest
- Starten Sie den Gaschromatographen (GC) im Reaktorsystem und wählen Sie die richtige Methode zur Gaskomponentenanalyse aus.
- Schalten Sie den Reaktor-Gasstrom zu einer Bypass-Leitung. Durchfluss 100 cm 3 / min 5% Propan / N 2 und 100 cm 3 / min 5% H 2 / N 2 . Warten Sie 1 min, damit der Propanfluss die Bypassströmung in GC als Referenzprobe stabilisiert und injiziert.
- Schalten Sie den Gasfluss zurück in die Reaktorrohrleitung, um die Reaktion zu starten und die Zeit aufzuzeichnen.
- Nachdem die Reaktion 4 min lang durchgeführt wurde, injizieren Sie den Reaktorauslassgasstrom (eine GC-Probe) in den GC, um die Auslassgaskomponenteninformationen zu erhalten. Injizieren Sie alle 4 Minuten Probe und führen Sie den Test durch, bis die Umwandlung stabil ist Te oder die Umwandlung ist sehr gering.
- Verwenden Sie die entsprechende Peak-Analyse-Software, um jeden Peak zu analysieren.
- Klicken Sie auf die Start- und Endpunkte des Peaks. Verwenden Sie die integrierte Funktion, um den Peak-Bereich zu erhalten. Notieren Sie die Peakfläche für den Propan (C 3 H 8 ) -Reaktanten; das Propylen (C 3 H 6) Produkt; Und die Nebenprodukte Methan (CH 4 ), Ethan (C 2 H 4 ) und Ethylen (C 2 H 6 ).
ANMERKUNG: Für jede Injektion wird ein GC-Muster mit mehreren Peaks erhalten, dessen Fläche sich auf die Anzahl der Mole verschiedener Gasarten bezieht.
- Klicken Sie auf die Start- und Endpunkte des Peaks. Verwenden Sie die integrierte Funktion, um den Peak-Bereich zu erhalten. Notieren Sie die Peakfläche für den Propan (C 3 H 8 ) -Reaktanten; das Propylen (C 3 H 6) Produkt; Und die Nebenprodukte Methan (CH 4 ), Ethan (C 2 H 4 ) und Ethylen (C 2 H 6 ).
- Umwandlung der Peak-Fläche auf die Anzahl der Mole für jede Spezies mit dem Response-Faktor. Bestimmen Sie die Propanumwandlung und die Propylenselektivität zu dem Zeitpunkt für jede Probe gemäß den folgenden Formeln:
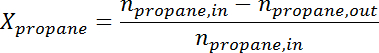
Ad / 56040 / 56040eq2.jpg "/>
woher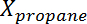 Ist die Umwandlung von Propan,
Ist die Umwandlung von Propan, 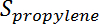 Ist die Propylenselektivität,
Ist die Propylenselektivität, 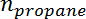 Ist die Anzahl der Mole von Propan, und
Ist die Anzahl der Mole von Propan, und 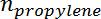 Ist die Anzahl der Mole von Propylen.
Ist die Anzahl der Mole von Propylen. - Erhalten Sie den anfänglichen Umwandlungs- und Selektivitätswert bei t = 0, indem Sie die gemessene Umwandlung und die Selektivität über die Zeit im Strom mit einer exponentiellen Anpassung extrapolieren.
- Starten Sie den Gaschromatographen (GC) im Reaktorsystem und wählen Sie die richtige Methode zur Gaskomponentenanalyse aus.
- Nachreaktion
- Stoppen Sie, den Reaktor zu heizen, indem Sie das Temperaturprogramm ausschalten. Schalten Sie den Gasstrom auf 10 cm 3 / min N 2 .
- Schalten Sie den Gaschromatographen wieder in die Standby-Methode, um die Durchflussmenge des Trägergases zu reduzieren.
- Entladen Sie den gebrauchten Katalysator aus dem Quarz-Fix-Bett-Reaktor nach dem Abkühlen aufZimmertemperatur. Sammeln Sie das Katalysatorgewicht in einem bestimmten Abfallbereich.
3. Charakterisierung von Katalysatorproben
- Scanning Transmission Electron Microscopy 4 , 20
- Legen Sie den Katalysator in einen Mörser und schleifen Sie ihn in weniger als 100 Mesh-Pulver mit einer Pistille.
- 30 mg Katalysatorpulver in etwa 5 ml Isopropylalkohol in einer kleinen Durchstechflasche verteilen. Schütteln Sie die Durchstechflasche für das volle Mischen und lassen Sie dann die Durchstechflasche für 5 min sitzen, um die Ablagerung der relativ großen Teilchen zu ermöglichen.
HINWEIS: Die erhaltene Suspension sollte sehr kleine Partikel von Trägerkatalysatoren enthalten. - Legen Sie ein Au TEM-Raster auf eine Verdampfungsschale. Die Schale auf 80 ° C auf einer heißen Platte erhitzen. Füge drei Tropfen der Katalysatorsuspension zum Gitter hinzu.
HINWEIS: Der Isopropylalkohol verdampft schnell und hinterlässt die Katalysatorpartikel auf thE grid - Legen Sie das Gitter auf den Probenhalter für die Elektronenmikroskopie Probe Bildgebung.
- In-situ -Röntgenabsorptionsspektroskopie 3 , 4 , 19 , 20
- Legen Sie den Katalysator in einen Mörser und schleifen Sie ihn in weniger als 100 Mesh-Pulver mit einer Pistille. Legen Sie die feinen Pulver in einen Würfelsatz und drücken Sie ihn mit den Fingern, um einen selbsttragenden Wafer zu bilden.
- Legen Sie eine ~ 100 mg Probe in den Probenhalter.
- Stellen Sie den Probenhalter in einen Quarzrohrreaktor und stellen Sie die Probe vor, indem Sie ihn in 50 cm 3 / min 3% H 2 / He reduzieren.
- Nach dem Abkühlen auf RT das Röhrchen abdichten und auf die Synchrotron-Strahllinie übertragen, um die XAS-Daten zu sammeln.
- In-situ -Röntgenbeugung 19 , 20
- LoDen Katalysator in einen Mörser geben und in weniger als 100 Mesh-Pulver unter Verwendung einer Pistille schleifen.
- Drücken Sie einen dünnen Wafer mit einem üblichen 7 mm Durchmesser.
HINWEIS: Der Würfelsatz enthält ein weibliches Stück und obere und untere männliche Stücke.- Befestigen Sie das untere männliche Stück an der weiblichen Teil. Legen Sie die Probe auf die polierte Oberfläche des Unterteils. Bringen Sie das obere männliche Stück an und übertragen Sie den Matrizensatz in die Probenstufe der Presse. Mit entsprechender Stärke drücken.
- Entleeren Sie den Wafer und übergeben Sie ihn auf den keramischen Becher der spezialisierten Probenstufe (siehe Tabelle der Materialien ). Dichtung der Bühne und fixiere sie auf dem Probentisch auf der Strahllinie.
- Reduzieren Sie die Probe durch Fließen und Rampen der Temperatur auf 550 ° C. Sammeln Sie die In-situ -Röntgenbeugungsdaten unter 3% H 2 / He-Gasstrom bei 550 ° C und nach Abkühlen auf RT 20 .
Ergebnisse
Die Propylenselektivität gegenüber der Zeit für Pt- und Pt-Cu-Katalysatoren, gemessen bei einer anfänglichen Propanumwandlung von etwa 20%, ist in 1A dargestellt . Pt-Katalysator hat eine anfängliche Selektivität von 61%, die mit der Zeit im Strom auf etwa 82% ansteigt, wenn der Katalysator für 1h deaktiviert wird. Der Pt-0,7Cu-Katalysator zeigt eine bessere anfängliche Propylenselektivität von 72%. Bei Pt-2.3Cu- und Pt-7.3Cu-Katalysatoren erreichen...
Diskussion
Die in dieser Arbeit hergestellten Pt-Cu-Katalysatoren enthalten einheitliche Nanopartikel mit einer Größe von etwa 2 nm, ähnlich den für die industrielle Anwendung qualifizierten heterogenen Katalysatoren. Alle Pt- und Cu-Vorläufer bilden bimetallische Strukturen, im Gegensatz zu separaten monometallischen Partikeln. Diese Bimetall-Wechselwirkung und die kleine Teilchengröße werden durch sorgfältige Kontrolle über die Syntheseverfahren realisiert. Das Imprägnierungsverfahren nutzt die starke Elektrostatische ...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der School of Chemical Engineering, Purdue University unterstützt. Die Nutzung der Advanced Photon Source wurde vom US Department of Energy, Office of Basic Energy Sciences, unter Vertrag Nr. DE-AC02-06CH11357. MRCAT-Operationen, Strahllinie 10-BM werden vom Department of Energy und den MRCAT-Mitgliedsinstituten unterstützt. Die Autoren bestätigen auch die Verwendung von Strahllinie 11-ID-C. Wir danken Evan Wegener für die experimentelle Unterstützung beim XAS.
Materialien
| Name | Company | Catalog Number | Comments |
| 1" quartz tube reactor | Quartz Scientific | Processed by glass blower | |
| drying oven | Fisher Scientific | ||
| calcination Furnace | Thermo Sciencfic | ||
| clam-shell temperature programmed furnace | Applied Test System | Custom made | |
| propane dehydorgenation performance evaluation system | Homemade | ||
| gas chromatography | Hewlett-Packard | Model 7890 | |
| TEM grid | TedPella | 01824G | |
| pellet press | International Crystal Lab | 0012-8211 | |
| die set | International Crystal Lab | 0012-189 | |
| Linkam Sample Stage | Linkam Scientific | Model TS1500 | |
| copper nitrate trihydrgate | Sigma Aldrich | 61197 | |
| tetraammineplatinum nitrate | Sigma Aldrich | 278726 | |
| ammonia | Sigma Aldrich | 294993 | |
| silica | Sigma Aldrich | 236802 | |
| isopropyl alcohol | Sigma Aldrich | ||
| balance | Denver Instrument Company | A-160 | |
| spatulas | VWR | ||
| ceramic and glass evaporating dishes, beakers | VWR | ||
| heating plate | |||
| kimwipe papers | |||
| mortar and pestle | |||
| quartz wool | |||
| Swagelok tube fittings |
Referenzen
- Sattler, J. J., Ruiz-Martinez, J., Santillan-Jimenez, E., Weckhuysen, B. M. Catalytic dehydrogenation of light alkanes on metals and metal oxides. Chem. Rev. 114 (20), 10613-10653 (2014).
- Childers, D. J., et al. Modifying structure-sensitive reactions by addition of Zn to Pd. J Catal. 318, 75-84 (2014).
- Gallagher, J. R., et al. Structural evolution of an intermetallic Pd-Zn catalyst selective for propane dehydrogenation. Phys. Chem. Chem. Phys. 17, 28144-28153 (2015).
- Wu, Z., et al. Pd-In intermetallic alloy nanoparticles: highly selective ethane dehydrogenation catalysts. Catal Sci Technol. 6 (18), 6965-6976 (2016).
- Siddiqi, G., Sun, P., Galvita, V., Bell, A. T. Catalyst performance of novel Pt/Mg (Ga)(Al) O catalysts for alkane dehydrogenation. J Catal. 274 (2), 200-206 (2010).
- Passos, F. B., Aranda, D. A., Schmal, M. Characterization and catalytic activity of bimetallic Pt-In/Al 2 O 3 and Pt-Sn/Al 2 O 3 catalysts. J Catal. 178 (2), 478-488 (1998).
- Virnovskaia, A., Morandi, S., Rytter, E., Ghiotti, G., Olsbye, U. Characterization of Pt, Sn/Mg (Al) O catalysts for light alkane dehydrogenation by FT-IR spectroscopy and catalytic measurements. J Phys Chem C. 111 (40), 14732-14742 (2007).
- Jablonski, E., Castro, A., Scelza, O., De Miguel, S. Effect of Ga addition to Pt/Al 2 O 3 on the activity, selectivity and deactivation in the propane dehydrogenation. Appl Catal A. 183 (1), 189-198 (1999).
- Galvita, V., Siddiqi, G., Sun, P., Bell, A. T. Ethane dehydrogenation on Pt/Mg (Al) O and PtSn/Mg (Al) O catalysts. J Catal. 271 (2), 209-219 (2010).
- Shen, J., Hill, J. M., Watwe, R. M., Spiewak, B. E., Dumesic, J. A. Microcalorimetric, infrared spectroscopic, and DFT studies of ethylene adsorption on Pt/SiO2 and Pt-Sn/SiO2 catalysts. J Phys Chem B. 103 (19), 3923-3934 (1999).
- Silvestre-Albero, J., et al. Microcalorimetric, reaction kinetics and DFT studies of Pt–Zn/X-zeolite for isobutane dehydrogenation. Catal Lett. 74 (1-2), 17-25 (2001).
- Sun, P., Siddiqi, G., Vining, W. C., Chi, M., Bell, A. T. Novel Pt/Mg (In)(Al) O catalysts for ethane and propane dehydrogenation. J Catal. 282 (1), 165-174 (2011).
- Sun, P., Siddiqi, G., Chi, M., Bell, A. T. Synthesis and characterization of a new catalyst Pt/Mg (Ga)(Al) O for alkane dehydrogenation. J Catal. 274 (2), 192-199 (2010).
- Okamoto, H. . Phase diagrams for binary alloys. Desk handbook. , (2000).
- Hamid, S. B. D. -. A., Lambert, D., Derouane, E. G. Dehydroisomerisation of n-butane over (Pt, Cu)/H-TON catalysts. Catal Today. 63 (2), 237-247 (2000).
- Veldurthi, S., Shin, C. -. H., Joo, O. -. S., Jung, K. -. D. Promotional effects of Cu on Pt/Al 2 O 3 and Pd/Al 2 O 3 catalysts during n-butane dehydrogenation. Catal Today. 185 (1), 88-93 (2012).
- Han, Z., et al. Propane dehydrogenation over Pt-Cu bimetallic catalysts: the nature of coke deposition and the role of copper. Nanoscale. 6 (17), 10000-10008 (2014).
- Komatsu, T., Tamura, A. Pt 3 Co and PtCu intermetallic compounds: promising catalysts for preferential oxidation of CO in excess hydrogen. J Catal. 258 (2), 306-314 (2008).
- Gallagher, J. R., et al. In situ diffraction of highly dispersed supported platinum nanoparticles. Catal Sci Technol. 4 (9), 3053-3063 (2014).
- Ma, Z., Wu, Z., Miller, J. T. Effect of Cu content on the bimetallic Pt-Cu catalysts for propane dehydrogenation. Catal Struct React. 3 (1-2), 43-53 (2017).
- Richards, R. . Surface and nanomolecular catalysis. , (2006).
- Jiao, L., Regalbuto, J. R. The synthesis of highly dispersed noble and base metals on silica via strong electrostatic adsorption: I. Amorphous silica. J Catal. 260 (2), 329-341 (2008).
- Miller, J. T., Schreier, M., Kropf, A. J., Regalbuto, J. R. A fundamental study of platinum tetraammine impregnation of silica: 2. The effect of method of preparation, loading, and calcination temperature on (reduced) particle size. J Catal. 225 (1), 203-212 (2004).
- Wei, H., et al. Selective hydrogenation of acrolein on supported silver catalysts: A kinetics study of particle size effects. J Catal. 298, 18-26 (2013).
- Ertl, G., Knözinger, H., Schüth, F., Weitkamp, J. . Handbook of heterogeneous catalysis: 8 volumes. , (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten